Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Avances en Periodoncia e Implantología Oral
versión On-line ISSN 2340-3209versión impresa ISSN 1699-6585
Avances en Periodoncia vol.18 no.1 Madrid abr. 2006
Uso de proteínas derivadas de la matriz del esmalte en defectos infraóseos periodontales. Presentación de casos clínicos
ALONSO A*, ARACIL L**, BLANCO J***, RODRIGO D****, BASCONES A*****
* Profesor asociado Periodoncia Universidad Salamanca.
** Profesor asociado Periodoncia UCM.
*** Profesor asociado Universida Santiago Compostela.
**** Master en Periodoncia UCM. Board of the Europea Federation of Periodontology.
***** Catedrático de Medicina Bucal y Periodoncia. Facultad de Odontología. Universidad Complutense de Madrid.
Dirección para correspondencia
RESUMEN
La periodontitis es una infección crónica causada por las bacterias de la placa dental. Esta condición induce la perdida de soporte del aparato de inserción. La cirugía está indicada para detener la progresión de la enfermedad y regenerar el tejido perdido. Se han utilizado diferentes técnicas quirúrgicas para regenerar los tejidos periodontales incluyendo la regeneración tisular guiada (RTG), y el uso de proteínas derivadas de la matriz del esmalte (EMD). Las EMD contienen amelogenina. Se sabe que la amelogenina está relacionada con la formación del esmalte, y también con la formación de la inserción periodontal durante la formación dentaria. A través de esta presentación de dos casos clínicos tratados con Proteínas derivadas de matriz de esmalte EMDOGAIN®, se pretende , por un lado describir paso a paso el procedimiento clínico de su uso y a la vez hacer una revisión de la literatura de la regeneración periodontal y de la regeneración utilizando Emdogain® en particular.
Palabras clave: Regeneración periodontal, Emdogain, Proteínas derivadas de la matriz del esmalte, EMD.
ABSTRACT
Periodontitis is a chronic infective disease of the gums caused by bacteria present in dental plaque. This condition induces the breakdown of the tooth supporting apparatus until teeth are lost. Surgery may be indicated to arrest disease progression and regenerate lost tissues. Several surgical techniques have been developed to regenerate periodontal tissues including guided tissue regeneration (GTR), and the use of proteins enamel matrix derivative (EMD). EMD is an extract of enamel matrix and contains amelogenins. There is evidence to show that amelogenins are involved not only in enamel formation, but also in the formation of the periodontal attachment during tooth formation. Accordly to two clinicals cases treated with Endogain, the aim of this presentation is, first to describe the clinical procedure,and second to make a literature review of the differents materials to periodontal regeneration.
Key words: Periodontal regeneration, Emdogain, proteins enamel matrix, EMD.
Introducción
La periodontitis se define como aquella inflamación que afecta y destruye el hueso alveolar de soporte y el ligamento periodontal (American Academy of Periodontology 1986). La causa de la periodontitis es la placa bacteriana y la lesión de periodontitis se caracteriza por inflamación, placa y cálculo subgingival, pérdida de hueso alveolar y ligamento periodontal, con migración del epitelio de unión hacia el ápice. Clínicamente la periodontitis se reconoce por sangrado y/o enrojecimiento gingival e inflamación o recesión. Las bolsas periodontales profundizan apicalmente a la unión amelocementaria, y la pérdida ósea alveolar, puede observarse en radiografías periapicales (Caton 1989).
El tratamiento de la periodontitis incluye la eliminación de la placa bacteriana. Cuando la periodontitis se controla, pueden quedar defectos en la anatomía periodontal, en los que son característicos la neoformación de fibras gingivales, la inflamación se reduce, y persiste la pérdida de hueso y ligamento, formándose un epitelio de unión largo. (Caton 1989, Listgarten 1979).
Sin embargo el tratamiento periodontal ideal debería de actuar no solo sobre el control de la inflación sino sobre la eliminación de los defectos de la anatomía periodontal que favorecen la infección. Para eliminar estos defectos anatómicos que la infección produce sobre el periodonto, se utilizan técnicas quirúrgicas tanto resectivas como regenerativas. La cirugía resectiva elimina el defecto periodontal, eliminando la encía y las paredes óseas, para lo cual se realiza gingivectomía, cirugía ósea resectiva y reposición apical de los colgajos. (Ochsenbein 1960). Sin embargo la cirugía regenerativa (Regeneración periodontal) trata de eliminar los defectos, pero formando nuevo cemento, ligamento periodontal, y hueso perdido por la infección.
Actualmente entendemos por regeneración periodontal el fenómeno que después de la cirugía periodontal da como resultado la formación de una nueva inserción (cemento, ligamento periodontal, y hueso alveolar). Las características histológicas de un periodonto regenerado incluyen la formación de hueso nuevo, cemento y ligamiento periodontal para reconstituir un nuevo aparato de inserción. (Melloning 1999).
Los diferentes estudios de histología llevados a cabo sobre regeneración periodontal ponen de manifiesto que lejos de producirse la regeneración periodontal después de la cirugía, lo que se produce con mayor frecuencia es el fenómeno de reparación periodontal (fenómeno que se consigue después de la cirugía periodontal sin restauración de un aparato de inserción normal Caton 1989, Listgarten 1979), a pesar de que en la mayoría de los casos existe aumento del volumen y densidad ósea-radiográfica. Este fenómeno de reparación periodontal se caracteriza por la migración apical del epitelio gingival entre el conectivo y la raíz, y por tanto esta interposición del epitelio, es la que impide que las células del ligamento periodontal repueblen la superficie radicular, y por tanto impidan la regeneración periodontal.
Aunque las observaciones y datos de estudios histológicos y ensayos clínicos controlados han demostrado que algunos de los procedimientos regenerativos disponibles son capaces de obtener resultados que podemos denominar regeneración periodontal (Cortellini y col. 1993; Melloning 1999; Bowers y col. 1989, Nyman y col. 1982, 1986, Gotlow y col. 1994, Cortellini y col. 1993) conseguir una verdadera regeneración, completa y predecible es aún difícil de obtener (Trombelli y col. 2002) Por tanto el objetivo de la cirugía de regeneración periodontal, consiste no sólo en detener el proceso destructivo de la periodontitis, sino que busca regenerar el tejido destruido y para que ocurra, es necesaria la neoformación de cemento radicular, hueso alveolar y fibras del ligamento periodontal, con orientación funcional e insertados en el cemento radicular y hueso alveolar.
La regeneración completa se caracteriza por la "restitutio ad integrum". La inserción de las fibras de ligamento periodontal en el cemento radicular nuevo en las áreas radiculares patológicamente expuestas se denomina nueva inserción (Gottlow 1993).
Para la cirugía de reconstrucción periodontal se utilizan materiales autógenos, alógenos y aloplásticos. Además se aplican membranas de barrera y técnicas quirúrgicas que excluyen el epitelio y el tejido conectivo del colgajo mucoperióstico de la superficie radicular durante la cicatrización y protegen el coágulo de fibrina que aparece. Así, desde comienzos de los años 80 se introdujo por primera vez el concepto de regeneración tisular guiada (RTG). En esas fechas Gottlow y col. (1984) realizaron una serie de estudios experimentales encaminados a regenerar el aparato de inserción perdido. El procedimiento consistió en la colocación de una membrana situada entre el defecto infraóseo y el colgajo para evitar la proliferación y migración apical del epitelio y conectivo, con mayor capacidad y velocidad de proliferación, creando así un ambiente y un espacio necesarios para la regeneración de los tejidos responsables de una nueva inserción periodontal (hueso, cemento y ligamento periodontal). Su eficacia fue demostrada en diferentes publicaciones. (Gottlow y col. 1984; Nyman y col. 1987). Inicialmente se utilizaron membranas no reabsorbibles que debían eliminarse en una segunda intervención, esto suponía mayor morbilidad para los pacientes además de un traumatismo potencial para los tejidos periodontales inmaduros que se estaban regenerando. En un intento por resolver estos problemas, en los años 90 se desarrollaron procedimientos de una sola fase en los que se empleaban membranas reabsorbibles sobre los que se han comunicado resultados favorables (Hugoson y col. 1997). Y actualmente también se utilizan una serie de modificadores de la respuesta biológica que regularía la proliferación, la movilidad y la inserción celular (factores de crecimiento, proteínas morfogenéticas óseas, y proteínas derivadas del esmalte) (García de la Fuente 1999).
Las razones para utilizar este tipo de materiales, viene avalada. Por su capacidad para inducir a células formadoras de hueso (osteogénesis), servir como andamio para la formación ósea (osteoconducción), o estimular la formación de nuevo hueso o ligamento periodontal (osteoinducción). Esto implicaría que las células que provienen del hueso también tendrían capacidad para formar ligamento periodontal. (Melcher 1976, Caton y Greenstein 1993, Karring y col. 1993).
Debido a la variabilidad biológica inherente en el proceso de cicatrización periodontal y el deseo de mejorar el grado de predictibilidad clínica, la industria de los productos periodontales investiga continuamente nuevos materiales de injerto sustitutivo y uno de estos materiales es el EMDOGAIN® que es una matriz derivada del esmalte (MDE). Las matrices derivadas están compuestas principalmente de amelogenina y proteínas relacionadas derivadas de los gérmenes dentarios porcinos (Hammarstrom 1997, Gestrelius 1997) y estas proteínas derivadas de la matriz el esmalte son fundamentales para el desarrollo del cemento acelular, del ligamento periodontal y del hueso alveolar (Hammarstrom 1997, Heijl 1997).
Durante su evolución, las proteínas del esmalte han permanecido intactas (Gestrelius 1997) y se sabe que existe una gran semejanza entre las proteínas del esmalte humanas y las porcinas, además se tiene evidencia histológica de su potencial para la regeneración periodontal, habiéndose también demostrado que su empleo en seres humanos es seguro y eficaz (Heijl 1997). Se han llevado acabo estudios en animales ratas y monos (Hammarströn 1997, Sculean y cols. 2000) y perros (Araujo y col. 1998) que demuestran histológicamente la regeneración periodontal conseguida, aunque las informaciones obtenidas en modelos animales no pueden ser extrapoladas directamente a humanos, diferentes estudios en humanos (Heijl y col. 1997, Froum y col. 1994; Zuchelli y col. 2002, Sanz y col. 2004) demuestran que el tratamiento de defectos infraóseos con Emdogain© obtiene mejores resultados respecto al tratamiento convencional a colgajo.
Independientemente de la habilidad de MDE para inducir los procesos que conllevan a la regeneración del aparato de inserción se han observado otras cualidades o características que pueden ayudar o facilitar dicho proceso. Estudios in vitro (Sphar y col. 2002) y en vivo (Sculean y col. 2001) indican que la MDE puede tener influencia tanto cuantitativa como cualitativa en la flora bacteriana: inmediatamente tras su aplicación debido a su bajo pH y, una vez precipitado sobre la superficie radicular debido a sus propiedades hidrofóbicas. Por tanto su influencia sobre la flora bacteriana podría ser otro de los factores que contribuyen a mejorar la cicatrización temprana de las zonas tratadas (Sculean y col. 2001). Esta aceleración en la cicatrización inicial de los tejidos blandos ha sido confirmada por otros trabajos (Wennström y Lindhe 2002) (Zuchelli y col. 2002).
La técnica MDE (proteínas derivadas de la matriz del esmalte) son unas proteínas hidrofóbicas extraídas del esmalte embrionario de origen porcino que se presentan en jeringuilla estéril y liofilizado en forma de gel.
Es muy importante realizar una buena hemostasia de la zona a tratar, pues un sangrado excesivo, impediría, al igual que la contaminación por saliva obtener buenos resultados.
Después de elevar el colgajo mucoperióstico de espesor total, se alisa la raíz y se procede a la biomodificación de la superficie radicular, para lo que se realiza la desmineralización de la superficie de la raíz con ácido ortofosfórico, ácido cítrico pH1 o con ácido etilenodiaminotetraacético al 24% (EDTA-Biora) con un pH de 6,7 durante 15 segundos (Blomlöf 1996) para eliminar el polvillo dentinario (swear layer) y facilitar la adherencia de las MDE a la raíz, lo que permite que las MDE precipiten encima de una raíz exenta de restos (Polson 1995). Posteriormente se lava la raíz con suero fisiológico y se aplica el gel MDE que cubrirá toda la superficie expuesta de la raíz procurando que desborden los límites del defecto. A continuación se cierra la herida con sutura monofilamento de colchonero verticales, y se aplica presión con una gasa humedecida en suero fisiológico durante 3 minutos, lo que facilita la cicatrización permitiendo que sólo se forme un delgado coágulo sanguíneo entre el diente y el colgajo (Kon 1969).
Las suturas se retiran a los 12 ó 15 días y el paciente sigue un régimen de clorexhidina en enjuague bucal al 012 durante las siguientes 3-6 semanas, procurando una higiene bucal cuidadosa de la zona quirúrgica. Las visitas del paciente son bimensuales durante los 6 primeros meses y posteriormente realizará visitas de mantenimiento cada 3 meses, pues los resultados terapéuticos dependen de un buen programa de mantenimiento (Becker 1992, Axelsson 1981).
Casos clínicos
CASO 1
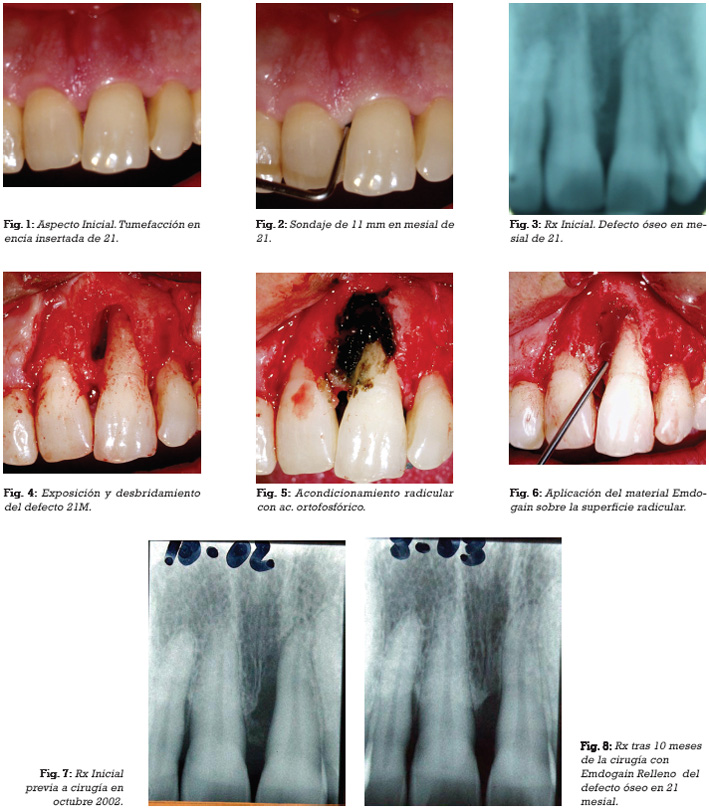
CASO 2

Discusión
Muchos estudios han mostrado que el tratamiento de defectos infraóseos con técnicas de RTG con membranas reabsorbibles y no reabsorbibles tienen un alto porcentaje de éxito (Pontoriero y col. 1988; Caffesse y col. 1990; Cortellini y col. 1995; Caton y col. 1994). Sin embargo los procedimientos de RTG tienen algunas desventajas. La aplicación de membranas conlleva tiempo y es un procedimiento sensible a la técnica, además la sutura y adaptación de estos materiales es difícil, especialmente en sectores posteriores. Cuando se usa una membrana reabsorbible es necesaria una segunda intervención quirúrgica para retirarla. La exposición de membranas y la consecuente colonización bacteriana es probablemente la mayor complicación o riesgo con este tipo de procedimientos (De Sanctis y col. 1996. Nowzari y col. 1996). La prevalencia de exposición de membranas varía entre el 70- 80% (Cortellini y col. 2000). Aunque esta exposición se ha visto fuertemente reducida con el uso de colgajos especialmente diseñados para preservar los tejidos interdentales 30-50% (Zuchelli y col. 2002; Cortellini y col. 1999).
La profundidad inicial del defecto infraóseo parece ser una factor importante en la predictibilidad de procedimientos regenerativos con EMD (Pontoriero y col. 1999; Sculean y col. 1999; Tonetti y col. 1996; Daniel Rodrigo (Revista Perio) Rodrigo Daniel 2004) habiéndose demostrado mayor ganancia a partir de 4 mm de componente infraóseo con técnicas de RTG (Cortellini y col. 1998), no obstante, otras publicaciones ponen en duda esta cuestión (Heden y col. 1999; Zuchelli G y col. 2002). De hecho es muy probable que la significación del componente infraóseo del defecto en baseline en las ganancias de CAL se deba probablemente al impacto de la PS en esas localizaciones (Heden y col. 1999; Zuchelli G y col. 2002; Bratthall y col. 2001) ya que la profundidad de sondaje y el mayor o menor componente infraóseo del defecto están íntimamente relacionados (Tonetti y col. 1993). En muchos estudios con Emdogain® se ha seguido un protocolo de administración de antibióticos sistémicos en los que se incluían amoxicilina, metronidazol o una combinación de ambos. Sin embargo Sculean y col. 2001 en un ensayo clínico controlado no observaron diferencias estadísticamente significativas entre el grupo test (antibiótico) y el control (Placebo) datos estos que confirman los obtenidos en otras publicaciones (Bratthall y col. 2001; Heden y col. 1999). De hecho, estos estudios muestran que la cuidada selección del paciente y la técnica quirúrgica, así como un meticuloso control postoperatorio tienen más importancia en los resultados de los procedimientos regenerativos.
Conclusiones
Parece que el uso de EMDOGAIN® es técnicamente más simple con menor riesgo (no exposición) y menos invasivo que la membranas, además se produce menos recesión postoperatoria. Se debe tener en cuenta que una cuidada selección del paciente y una técnica quirúrgica muy sensible así como un meticuloso control posoperatorio son de gran importancia en los resultados de los procedimientos regenerativos periodontales.
Bibliografía
1. American Academy of Periodontology. Glossary of periodontic terms. J. Periodontol 1986; 57. [ Links ] 2. Caton JG. Periodontal diagnosis and diagnostic aids. In: Nevins R, Becker W, Kornman K, eds. Prodeedings of the World Workshop in Clinical Periodontics. Chicago: American Academy of Periodontology, 1989:1-32. [ Links ]
3. Listgarten MA, Ronsenberg MM. Histological study of repair following new attachment procedures in human periodontal lesions. J Periodontol 1979;50:333-44. [ Links ]
4. Ochsenbein C. Rationale for periodontal osseous surgery. Dent Clin North Am 1960; March: 27-32. [ Links ]
5. Cortellini P, Pini Prato G, Tonetti MS. Periodontal regeneration of human intrabony defects with titanium reinforced membranes. A controlled clinical trial. J Periodontol. 1995 Sep;66(9):797-803. [ Links ]
6. Mellonig JT. Enamel matrix derivative for periodontal reconstructive surgery: technique and clinical and histologic case report. Int J Periodontics Restorative Dent 1999 Feb;19(1):8-19 [ Links ]
7. Bowers GM, Chadroff B, Carnevale R, Mellonig JT, Corio R, Emerson J, et al. Histologic evaluation of new attachment apparatus formation in humans. Part III. J Periodontol 60:683-693, 1989. [ Links ]
8. Gottlow J, Nyman S, Lindhe J, KarringT,Wennstrom J. New attachment formation in the human periodontium by guided tissue regeneration. Case Reports. J Clin Periodontol 1986;13: 604-616. [ Links ]
9. Nyman S, Lindhe J, Karring T, Rylander H. New attachment following surgical treatment of human periodontal disease. J Clin Periodontol 1982; Jul;9(4):290-6. [ Links ]
10. Gottlow J, Laurell L, Lundgren D, Mathisen T, Nyman S, Rylander H, et al. Periodontal tissue response to a new bioresorbable guided tissue regeneration device: A longitudinal study in monkeys. Int J Periodont Rest Dent 1993;14:437-49. [ Links ]
11. Cortellini P, Clauser C, Pini Prato GP. Histologic assessment of new attachment following the treatment of a human bucal recession by means of a guided tissue regeneration procedure. J Periodontal 1993;64: 387- 91. [ Links ]
12. Trombelli L, Heitz-Mayfield LJ, Needleman I, Moles D, Scabbia A.: A systematic review of graft materials and biological agents for periodontal intraosseous defects. J Clin Periodontol 2002;29 Suppl 3:117-35. [ Links ]
13. Gottlow J, Nyman S, Karring T, Lindhe J.: New attachment formation as the result of controlled tissue regeneration. J Clin Periodontol 1984;Sep;11(8):494-503. [ Links ]
14. Nyman S, Gottlow J, Lindhe J, Karring T,Wennstrom J.New attachment formation by guided tissue regeneration. J Periodontal Res 1987;May;22(3):252-4. [ Links ]
15. Hugoson A, Ravald N, Fornell J, Johard G, Teiwik A, Gottlow J.: Treatment of class II furcation involvements in humans with bioresorbable and nonresorbable guided tissue regeneration barriers. A randomized multi-center study. J Periodontol 1995; Jul;66(7):624-34. [ Links ]
16. García de la Fuente y cols.: Actualización sobre el uso de los factores de crecimiento y proteinas en el tratamiento regenerativo periodontal. Periodoncia 1999;Vol. 9, 5. [ Links ]
17. Melcher AH. On the repair potential of periodontal tissues. J. Periodontol 1976;47:250-60. [ Links ]
18. Caton JG, Greenstein G. Factors related to periodontal regeneration. Periodontol 2000. 1993 Feb;1: 9-15. [ Links ]
19. Karring T,Nyman S, Gottlow J,Laurell L.:Development of the biological concept of guided tissue regenerationanimal and human studies. Periodontol 2000. 1993 Feb;1: 26-35. [ Links ]
20. Hammarstrom L, Heijl L, Gestrelius S.: Periodontal regeneration in a buccal dehiscence model in monkeys after application of enamel matrix proteins. J Clin Periodontol 1997 Sep;24(9 Pt 2):669-77. [ Links ]
21. Gestrelius S, Andersson C, Johansson AC, Persson E, Brodin A, Rydhag L, Hammarstrom L.: Formulation of enamel matrix derivative for surface coating. Kinetics and cell colonization. J Clin Periodontol 1997 Sep;24(9 Pt 2):678-84. [ Links ]
22. Heijl L.: Periodontal regeneration with enamel matrix derivative in one human experimental defect. A case report. J Clin Periodontol. 1997 Sep; 24 (9 Pt 2): 693-6. [ Links ]
23. Sculean A, Chiantella GC, Windisch P, Donos N.: Clinical and histologic evaluation of human intrabony defects treated with an enamel matrix protein derivative (Emdogain). Int J Periodontics Restorative Dent 2000 Aug;20(4):374-81. [ Links ]
24. Araujo MG, Lindhe J.: GTR treatment of degree III furcation defects following application of enamel matrix proteins. An experimental study in dogs. J Clin Periodontol 1998 Jun; 25 (6): 524-30. [ Links ]
25. Froum SJ, Gomez C. Periodontal regeneration. Curr Opin Periodontol 1993;111-28. [ Links ]
26. Zucchelli G, Brini C, De Sanctis M.: GTR treatment of intrabony defects in patients with early-onset and chronic adult periodontitis. Int J Periodontics Restorative Dent 2002 Aug;22(4):323-33. [ Links ]
27. Sanz M,Tonetti MS, Zabalegui I, Sicilia A, Blanco J, Rebelo H, Rasperini G, Merli M, Cortellini P, Suvan JE.: Treatment of intrabony defects with enamel matrix proteins or barrier membranes: results from a multicenter practicebased clinical trial. J Periodontol 2004 May;75(5):726-33. [ Links ]
28. Blomlöf J, Blomlöf L, Lindskog S. Smear layer removal and collagen exposure after non surgical root planing followed by etching with an EDTA gel preparation. J Periodontol 1996;67:841-5. [ Links ]
29. Polson AM, Southard GL, Dunn RL, Polson AP, Billen JR, Laster LL. Initial study of guided tissue regeneration in Class II furcation defects after use of a biodegradable barrier. Int J Periodont Rest Dent 1995;15:43-55. [ Links ]
30. Kon S, Novaes A, Ruben M, Goldmen H. Visualization of the microvasularization of the healing periodontal wound. IV. Mucogigival sugery: Fullthickness flap. J Periodontol 1969;40:441-456. [ Links ]
31. Becker y cols. A comparative of e-PTFE membranes alone or in combination with platelet derived growth factors and insuline like growth factor-I or demineralized freeze-dried bone in promoting bone formation around immediate extraction socket implants. J Periodontol 1992;63:929-40. [ Links ]
32. Axelsson P, Lindhe J. The significance of maintenance care in the treatment of periodontal disease. J Clin Periodontol 8: 282-294, 1981. [ Links ]
33. Spahr A, Lyngstadaas SP, Slaby I, Haller B, Boeckh C, Tsoulfidou F, Hammarstrom L. :Expression of amelin and trauma-induced dentin formation. Clin Oral Investig. 2002 Mar;6 (1):51-7. [ Links ]
34. Sculean A, Donos N, Miliauskaite A,Arweiler N, Brecx M.: Treatment of intrabony defects with enamel matrix proteins or bioabsorbable membranes. A 4-year followup split-mouth study. J Periodontol. 2001 Dec;72(12): 1695- 701. [ Links ]
35. Wennstrom JL, Lindhe J.: Some effects of enamel matrix proteins on wound healing in the dento-gingival region. J Clin Periodontol. 2002 Jan;29(1):9-14. [ Links ]
36. Pontoriero R, Lindhe J, Nyman S, Karring T, Rosenberg E, Sanavi F.: Guided tissue regeneration in degree II furcation- involved mandibular molars. A clinical study. J Clin Periodontol. 1988 Apr;15(4):247-54. [ Links ]
37. Caffesse RG, SMith BA, Duff B, Morrison EC, Merrill D, Becker W.: Class II furcations treated by guided tissue regeneration in humans: case reports. J Periodontol. 1990 Aug;61(8):510-4. [ Links ]
38. Cortellini P, Pini Prato GP, Tonetti MS.: No detrimental effect of fibrin glue on the regeneration of intrabony defects. A controlled clinical trial. J Clin Periodontol. 1995 Sep;22(9):697-702. [ Links ]
39. Caton J,Greenstein G, Zappa U.: Synthetic bioabsorbable barrier for regeneration in human periodontal defects. J Periodontol. 1994 Nov; 65 (11): 1037- 45. [ Links ]
40. De Sanctis M, Zucchelli G, Clauser C.: Bacterial colonization of bioabsorbable barrier material and periodontal regeneration. J Periodontol. 1996 Nov; 67(11):1193- 200. [ Links ]
41. Nowzari H, MacDonald ES, Flynn J, London RM, Morrison JL, Slots J.: The dynamics of microbial colonization of barrier membranes for guided tissue regeneration. J Periodontol. 1996 Jul;67(7):694-702. [ Links ]
42. Cortellini P, Tonetti MS.: Focus on intrabony defects: guided tissue regeneration. Periodontol 2000. 2000 Feb; 22:104-32. [ Links ]
43. Zucchelli G, Bernardi F, Montebugnoli L, De SM.: Enamel matrix proteins and guided tissue regeneration with titanium- reinforced expanded polytetrafluoroethylene membranes in the treatment of infrabony defects: a comparative controlled clinical trial. J Periodontol. 2002 Jan;73(1):3-12. [ Links ]
44. Pontoriero R,Wennstrom J, Lindhe J.: The use of barrier membranes and enamel matrix proteins in the treatment of angular bone defects. A prospective controlled clinical study. J Clin Periodontol. 1999 Dec;26(12):833-40. [ Links ]
45. Sculean A, Donos N, Blaes A, Lauermann M, Reich E, Brecx M.: Comparison of enamel matrix proteins and bioabsorbable membranes in the treatment of intrabony periodontal defects. A split-mouth study. J Periodontol. 1999 Mar;70(3):255-62. [ Links ]
46. Tonetti MS, Prato GP, Cortellini P.: Factors affecting the healing response of intrabony defects following guided tissue regeneration and access flap surgery. J Clin Periodontol. 1996 Jun;23(6):548-56. [ Links ]
47. Cortellini P, Carnevale G, Sanz M, Tonetti MS.: Treatment of deep and shallow intrabony defects. A multicenter randomized controlled clinical trial. Clin Periodontol. 1998 Dec;25(12):981-7. [ Links ]
48. Heden G,Wennstrom J, Lindhe J.: Periodontal tissue alterations following Emdogain treatment of periodontal sites with angular bone defects. A series of case reports. J Clin Periodontol. 1999 Dec; 26(12):855-60. [ Links ]
49. Bratthall G, Lindberg P, Havemose-Poulsen A, Holmstrup P, Bay L, Soderholm G, Norderyd O, Andersson B, Rickardsson B, Hallstrom H, Kullendorff B, Skold Bell H.: Comparison of ready-to-use EMDOGAIN-gel and EMDOGAIN in patients with chronic adult periodontitis. J Clin Periodontol. 2001 Oct;28(10):923-9. [ Links ]
50. Cortellini P, Prato GP, Tonetti MS.: The simplified papilla preservation flap. A novel surgical approach for the management of soft tissues in regenerative procedures. Int J Periodontics Restorative Dent. 1999 Dec;19(6):589-99. [ Links ]
51. Tonetti MS, Pini-Prato G, Cortellini P.: Periodontal regeneration of human intrabony defects. IV. Determinants of healing response. J Periodontol. 1993 Oct;64(10):934-40. [ Links ]
52. Sculean A, Blaes A, Arweiler N, Reich E, Donos N, Brecx M.: The effect of postsurgical antibiotics on the healing of intrabony defects following treatment with enamel matrix proteins. J Periodontol. 2001 Feb;72(2):190-5. [ Links ]
Aceptado para publicación: Abril 2005
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Angel Alonso Rosado
Paseo de la Estación 11-13, 7ºA
37004. SALAMANCA
Arosado1955@mixmail.com














