Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Avances en Periodoncia e Implantología Oral
versión On-line ISSN 2340-3209versión impresa ISSN 1699-6585
Avances en Periodoncia vol.18 no.3 Madrid dic. 2006
Papel de los linfocitos T CD4+ en la destrucción ósea observada durante la periodontitis crónica
Role of CD4+ T cells in bone destruction during chronic periodontitis
Vernal R.*, Dutzan N.**, León R.***, Gamonal J.****
* Profesor Asistente. Departamento de Odontología Conservadora. Facultad de Odontología. Universidad de Chile.
** Ayudante. Departamento de Odontología Conservadora. Facultad de Odontología. Universidad de Chile.
*** Profesor Asistente. Departamento de Ciencias Físicas y Químicas. Facultad de Odontología. Universidad de Chile.
**** Profesor Asociado. Departamento de Odontología Conservadora. Facultad de Odontología. Universidad de Chile.
Dirección para correspondencia
RESUMEN
Propósito: La periodontitis crónica es una enfermedad de naturaleza inflamatoria y etiología infecciosa, caracterizada por la destrucción del aparato de inserción del diente, cemento radicular, ligamento periodontal y hueso alveolar, y que causa la pérdida de los dientes. Durante su desarrollo se establece un denso infiltrado inflamatorio celular, constituido principalmente por linfocitos T, con la capacidad de secretar una serie de citoquinas que participan en los eventos patogénicos de la enfermedad, regulando la inflamación de los tejidos periodontales y la destrucción del hueso alveolar. En la artritis reumatoide, la citoquina recientemente identificada RANKL (Ligando del receptor activador del factor nuclear kB) es expresada por los linfocitos T CD4+, participando directamente en los procesos de estimulación de la diferenciación osteoclástica y en la activación de osteoclastos maduros, y por lo tanto, en la destrucción ósea articular. El objetivo del presente estudio es determinar si mayores niveles de RANKL se encuentran asociados a la periodontitis crónica y si estos son sintetizados por los linfocitos T CD4+ reclutados en los sitios con periodontitis crónica.
Material y métodos: En 33 pacientes mayores de 35 años de edad afectados de periodontitis crónica y 20 individuos controles sanos, se determinaron los niveles de mensajero de ácido desoxiribonucleico (mARN) de RANKL en biopsias de encía mediante transcriptasa reversareacción en cadena de la polimerasa (RT-PCR) en tiempo real. A partir de las mismas biopsias, células gingivales totales fueron aisladas para inmunotipificar y cuantificar los leucocitos infiltrantes gingivales e identificar las células responsables de la expresión de RANKL mediante doble tinción por citometría de flujo.
Resultados: Los pacientes con periodontitis mostraron mayores niveles de mARN de RANKL en comparación a individuos sanos, observándose que la expresión de RANKL se incrementó en 238,3 veces con relación a los sujetos controles. Los individuos con periodontitis mostraron mayores porcentajes de linfocitos T CD4+ y CD8+. Además, una asociación entre RANKL y los linfocitos T CD4+ fue determinada mediante doble tinción por citometría de flujo.
Conclusión: Estos datos demuestran que mayores niveles de RANKL se encuentran asociados a la periodontitis y que estos mayores niveles se pueden explicar en parte a la actividad de los linfocitos T CD4+ en el sitio de la infección. La determinación de la asociación entre la periodontitis crónica y la síntesis de RANKL constituye un interesante mecanismo molecular que contribuye a explicar en parte la destrucción tisular asociada y permite proyectar posibles nuevas estrategias inmunoterapéuticas que ayudarían a controlar la pérdida de tejido característica de la enfermedad periodontal.
Palabras clave: Periodontitis, RANKL, Linfocitos, CD4.
ABSTRACT
Background: Chronic periodontitis is an infectious disease, characterized by alveolar bone destruction and teeth loss. Receptor activator of nuclear factor kB- ligand (RANKL) is an osteoclastogenic cytokine, central regulatory factor in the osteoclasts life-span and physiological and pathological bone resorption. Gingival T cells synthesize RANKL contributing to molecular local unbalance that entail to the alveolar bone resorption seen in periodontitis. Our study was aimed at associating the levels of RANKL with the CD4+ T cell activity present in gingival tissues of chronic periodontitis patients.
Methods: Gingival biopsies were obtained from 33 chronic periodontitis patients and 20 healthy controls. Specimens were either formalin fixed and paraffin embedded for real-time reverse transcriptionpolymerase chain reaction (RT-PCR) and histological analysis, or tissue digestion processed for cell culture and flow cytometry analysis. RANKL mRNA and protein levels were determined by quantitative RT-PCR and enzyme-linked immunosorbent assay (ELISA) in gingival cells culture supernatants. Gingival leukocytes were quantified by flow cytometry. RANKL and CD4 immunoreactivity was analyzed by flow cytometry and confocal microscopy.
Results: RANKL mRNA levels were higher in periodontitis than in healthy subjects and spontaneous and LPSand PHA-stimulated RANKL synthesis were higher also in patients than controls. CD4+ T lymphocytes were the predominant infiltrate cell subset present in gingival tissues of periodontitis patients. Furthermore, an association between RANKL and CD4+ T cells was determined by double-staining flow cytometry and confocal microscopy.
Conclusion: Taken together, these data demonstrate that gingival CD4+ T cells are the main cells responsible for the higher levels of RANKL observed in chronic periodontitis human patients.
Key words: Periodontitis, RANKL, lymphocytes, CD4.
RÉSUMÉ
But: La parodontite chronique est une maladie de nature inflammatoire et étiologie infectieuse, caractérisée par la destruction de lappareil dinsertion de la dent, ciment radiculaire, ligaments parodontaux et os alvéolaire, et qui cause la perte des dents. Pendant son développement, un dense infiltré inflammatoire cellulaire est établie, constitué principalement par des lymphocytes T, avec la capacité de sécréter une série de cytokines impliquées dans les événements pathogéniques de la maladie, en régulant linflammation des tissus parodontaux et la destruction de los alvéolaire. La cytokine récemment identifiée dans larthrite rhumatoïde RANKL (ligand du récepteur activeur du facteur de transcription nucléaire kB) est exprimé par les lymphocytes T CD4+, et est directement impliqué dans les processus de stimulation de la différenciation des ostéoclastes, leur activation, et la destruction osseuse de larticulation. Lobjectif de la présente étude est de déterminer une possible association entre des niveaux élevés de RANKL et la parodontite chronique, et établir si les lymphocytes T CD4+ recrutés dans les emplacements avec parodontite chronique son les cellules qui sécrètent cette cytokine.
Matériel et méthodes: Dans 33 patients ages de 35 années diagnostiqués de parodontite chronique et 20 individus contrôles sains, les niveaux de dacide ribonucléique messager (ARNm) spécifique pour RANKL ont été déterminés sûr des biopsies de gencive par RT-PCR en temps réel. À partir de les mêmes biopsies, des cellules gingivales totales ont été isolées pour typifier et quantifier les leucocytes infiltrant de la gencive et identifier les cellules responsables de lexpression de RANKL par cytométrie de flux de double couleur.
Résultats: Les patients diagnostiqués de parodontite ont des niveaux plus élevés de ARNm de RANKL en comparaison à des individus sains (238 fois), et des pourcentages de lymphocytes T CD4+ (7 fois) et CD8+ (5 fois) supérieurs à des individus sains. Une association entre les taux dexpression de RANKL et le pourcentage de lymphocytes T CD4+ a été déterminée par cytométrie de flux.
Conclusion: Ces données démontrent que de plus grands niveaux de RANKL, que peuvent être expliqués en partie à lactivité des lymphocytes T CD4+ dans lemplacement de linfection, sont associés à la parodontite. La détermination de lassociation entre la parodontite chronique et la synthèse de RANKL constitue un mécanisme moléculaire intéressant qui contribue à expliquer en partie la destruction tissulaire associée et permet de projeter de nouvelles stratégies immunotherapéutiques qui aideraient à contrôler la perte de tissu caractéristique de la parodontite chronique
Introducción
En el individuo adulto normal, el tejido óseo maduro se encuentra en un constante, balanceado, celularmente acoplado, y local y molecularmente controlado proceso de remodelación ósea1. En la mayoría de las patologías óseas existe un desbalance en los niveles fisiológicos de los factores osteomoduladores locales que provoca una mayor tasa de reabsorción ósea y la consecutiva pérdida de hueso2,3. En la periodontitis ha sido propuesto un desbalance local en los niveles de RANKL inducido por la actividad de las células residentes locales, tal como osteoblastos, y los linfocitos T CD4+ predominantes en el infiltrado inflamatorio en los tejidos afectados4,5.
Aunque los reguladores moleculares de las distintas fases de vida y actividad de los osteoclastos no han sido completamente dilucidados, por décadas varios sistemas de citoquinas han sido sugeridos como importantes reguladores de la reabsorción ósea. En la actualidad un nuevo sistema de citoquinas recientemente identificado como nuevos miembros de la superfamilia TNF (factor de necrosis tumoral) y TNFR (TNF-receptor), han sido propuestos como esenciales para la biología osteoclástica4,5.
Los componentes de este sistema de citoquinas consisten de un ligando RANKL (ligando de RANK), un receptor unido a membrana RANK (receptor activador del factor nuclear kB) y un receptor soluble denominado OPG (osteoprotegerina)4,5. Se ha demostrado que RANKL estimula directamente la diferenciación y activación de osteoclastos a través de la interacción con su receptor específico RANK en la superficie de las células progenitoras del linaje osteoclástico y en los osteoclastos maduros6,7. RANK, también denominado TRANCE-R (Receptor de TRANCE) y ODAR (Receptor de diferenciación y activación de osteoclastos), es el miembro TNFRSF11A de la superfamilia TNF5. El ligando RANKL, también denominado TRANCE (Citoquina inductora de activación relacionada a TNF), OPGL (Ligando de OPG) y ODF (Factor de diferenciación de osteoclastos), miembro TNFSF11 de la superfamilia TNF, es expresado en la superficie de células estromales, osteoblastos, células T, y/o liberado por acción de la enzima TACE (Metaloproteinasa desintegrina TNFa convertasa)5,8,9. La identificación del nuevo receptor OPG, también denominado OCIF (Factor inhibidor de la osteoclastogénesis), miembro TNFRSF11B de la superfamilia TNF, ha revelado un mecanismo regulador clave en la diferenciación y actividad de los osteoclastos5.
La mayoría de las patologías óseas corresponden a un desbalance en los procesos celulares acoplados de la remodelación ósea provocados por la pérdida de los niveles fisiológicos de los factores regulatorios locales, que provoca una alteración en el número y actividad de los osteoclastos y resulta en una inapropiada alta tasa de reabsorción ósea que excede la capacidad compensatoria de los osteoblastos2,3,10.
Se ha demostrado la participación del complejo de citoquinas RANKL-RANK-OPG en diversas patologías que comprometen el tejido óseo4,5. La evidencia del rol esencial de RANKL en la patología ósea se basa fundamentalmente en estudios in vitro, sistemas transgénicos y knock-out y modelos animales de enfermedades óseas metabólicas4-9. Así mismo, la información respecto de su participación en enfermedades humanas in vivo es aún limitada.
En enfermedades de carácter crónico, tal como la artritis reumatoide, y en modelos experimentales animales se ha demostrado que los linfocitos T CD4+ participan directamente, mediante la expresión y liberación de RANKL, e indirectamente, mediante la liberación de citoquinas específicas, IL-1 y TNFa que inducen la producción de RANKL por las células del linaje osteoblástico, en los procesos de destrucción ósea11-14. Ha sido recientemente demostrado que RANKL es suficiente para la completa diferenciación de células precursoras osteoclásticas y para la activación de los osteoclastos maduros15,16. La expresión de RANKL, de su receptor específico RANK en estos tipos celulares, y la actividad de OPG, competidor natural de RANK, conformarían el eje RANKL-RANK-OPG que regularía la destrucción en la artritis reumatoide, así como en otras enfermedades caracterizadas por la destrucción de tejido óseo11-14.
Las periodontitis constituyen un grupo heterogéneo de enfermedades periodontales que se manifiestan en respuesta a la infección bacteriana por patógenos específicos que colonizan el área del surco gingivodentario17. Se caracterizan por presentar una variada historia natural, progresión y respuesta a la terapia, y por provocar la destrucción del aparato de inserción dentario, compuesto por ligamento periodontal, cemento radicular y hueso alveolar, que lleva finalmente a la pérdida del diente17,18.
Aunque la patogénesis de la enfermedad periodontal no está completamente dilucidada se sabe que la interacción de los mecanismos defensivos del hospedero y los agentes bacterianos etiológicos son importantes en el inicio y progresión de la periodontitis17. Existe evidencia bien documentada que bacterias Gram (-), tales como Actinobacilus actinomicetencomitans (Aa) y Porphyromonas gingivalis (Pg), que forman parte de la placa bacteriana patogénica, son los agentes etiológicos primarios responsables de la enfermedad19,20. Estos son capaces de producir una variedad de moléculas bioactivas, tal como lipopolisacáridos (LPS), enzimas y factores citotóxicos moleculares, que directamente afectan al individuo19,20. La interacción de estas moléculas y la respuesta inmunitaria de hospedero determinará el resultado patológico de la infección21.
En los tejidos periodontales enfermos, en respuesta a la infección se constituye un denso infiltrado inflamatorio mononuclear caracterizado por la presencia de leucocitos polimorfonucleares neutrófilos, macrófagos, plasmocitos y linfocitos de la serie B y T21. En las lesiones periodontales activas, en los sitios que evidencian progresión de la enfermedad periodontal, el 70% de las células mononucleares lo constituyen linfocitos del tipo T, con la capacidad de secretar una serie de citoquinas que participan en los eventos etiopatogénicos de la enfermedad22-24.
La acumulación de linfocitos T CD4+, atraídos al sitio de la infección por factores quimiotácticos específicos y activados durante los periodos de destrucción tisular, regularía la inflamación de los tejidos periodontales inducida por la infección bacteriana subgingival, a través de la liberación de citoquinas proinflamatorias, y podría estar asociada a la destrucción del hueso alveolar y la consecuente pérdida de nivel de inserción clínico, a través de la expresión y secreción de RANKL13.
En la actualidad no existen estudios in vivo que hayan evaluado el rol de las células T y de RANKL en la enfermedad periodontal. Por otro lado, numerosas revisiones bibliográficas que analizan el rol de RANKL en la destrucción ósea asociada a trastornos metabólicos óseos, como por ejemplo artritis reumatoide y destrucción ósea asociada a metástasis de lesiones cancerosas, proponen una participación de RANKL en la destrucción ósea y la pérdida de inserción clínica asociada a la enfermedad periodontal4,7,13. El objetivo del presente trabajo es estudiar el real rol de los linfocitos T CD4+ en la periodontitis en humanos, y dilucidar si sintetizan RANKL, que desencadenaría la diferenciación y activación de osteoclastos, la pérdida de hueso alveolar y la consecutiva pérdida de inserción clínica durante la periodontitis.
Material y métodos
Selección de los sujetos
Se estudió a 33 individuos mayores de 35 años de edad con diagnóstico clínico de periodontitis crónica con niveles de severidad de enfermedad moderada a avanzada, los que fueron seleccionados mediante el método no probabilístico de casos consecutivos en el Centro de Diagnóstico y Tratamiento Dra. Eloisa Díaz del Servicio de Salud Metropolitano Norte.
La selección de los pacientes se realizó de acuerdo a los siguientes criterios de inclusión: Tener al menos 14 dientes, sin contabilizar los terceros molares, de los cuales al menos 10 tenían que ser dientes posteriores. Para el diagnóstico de periodontitis crónica al menos 5 a 6 dientes debían tener bolsas periodontales de profundidad de sondaje ≥ 5 mm, pérdida de inserción clínica ≥ 3 mm y evidencia radiográfica de destrucción ósea alveolar. Los individuos no sufrían de enfermedades sistémicas, ni tenían antecedentes de terapia periodontal, no habían recibido terapia de antibióticos, antiinflamatorios esteroidales o no esteroidales en el período de 3 meses previos al examen clínico inicial y su incorporación al estudio, y si era de género femenino no estar embarazada. Como grupo control se estudió a 20 individuos voluntarios con periodonto sano, determinado por la ausencia de bolsas periodontales y de pérdida de inserción clínica asociada a infección. Todos los sujetos recibieron una clara explicación del protocolo de investigación y firmaron un consentimiento informado aprobado por el Comité de Ética de la Facultad de Odontología de la Universidad de Chile.
Evaluación clínica
Todos los pacientes recibieron previo al examen clínico una profilaxis para remover el cálculo supragingival y permitir una correcta evaluación clínica. Los parámetros clínicos fueron medidos en todos los dientes por un investigador entrenado y calibrado, excluyendo los terceros molares. Se realizaron mediciones replicadas de la profundidad de las bolsas periodontales y del nivel de inserción clínica, y mediciones dicotómicas respecto de la presencia de placa bacteriana supragingival, sangramiento y supuración al sondaje, en 6 sitios por diente (mesiobucal, bucal, distobucal, distolingual, lingual, mesiolingual). Se utilizó una sonda periodontal de tercera generación (Florida Probe Corporation, Gainesville, FL, USA), de fuerza de sondaje controlada y registro automatizado, para reducir los errores asociados a la presión de sondaje y la subjetividad en el registro de los datos inherente a la técnica de sondaje manual.
Para la toma de biopsias de encía, de cada individuo del grupo con periodontitis se seleccionaron 2 sitios periodontales afectados en dientes posteriores, caracterizados por presentar una profundidad de sondaje ≥ 5 mm y una pérdida de inserción clínica asociada a la infección ≥ 3 mm, y de acuerdo a las necesidades quirúrgicas del tratamiento establecido. En los individuos controles sanos, los sitios seleccionados fueron aquellos con indicación de cirugía periodontal para procedimientos de elongación coronaria por indicación protésica o de encía sana asociada a terceros molares con indicación de exodoncia.
Procesamiento de las biopsias
Con hoja de bisturí número 15 se obtuvo una biopsia del margen gingival de acuerdo a las necesidades quirúrgicas particulares de cada paciente. Previo lavado con PBS (Sigma Chemical Co., St. Louis, MO, USA.), para la eliminación de detritus y restos de sangre, la biopsia fue hemiseccionada. Una hemisección fue inmediatamente sumergida en 1 mL de ARN-later (Ambion Inc., Austin, TX, USA) y almacenada a 4ºC, para posterior cuantificación de mARN de RANKL mediante RT-PCR cuantitativa. La otra hemisección fue sumergida en 5 mL de medio de cultivo RPMI 1640 estéril, suplementado con 50 UI/mL de penicilina, 50 µg/mL de estreptomicina y L-glutamina 200 mM (SIGMA Chemical Co., St. Louis, MO, USA.) y almacenada a 4°C hasta el momento de su procesamiento, para posterior cuantificación de la población celular infiltrante gingival y determinación del tipo celular responsable de la síntesis de RANKL mediante doble tinción por citometría de flujo.
Extracción de ARN total
El procesamiento de las biopsias a ser analizadas mediante RT-PCR cuantitativa fue realizado como ha sido previamente publicado25. Brevemente, las biopsias fueron seccionadas en fragmentos de aproximadamente 1 mm3 y homogeneizadas en TRIzol (Invitrogen Corp., Barcelona, España), para posteriormente ser incubadas en 0,2 mL de cloroformo durante 3 minutos. Luego, a partir de la fase acuosa, el ARN total fue precipitado mediante incubación en 0,5 mL de alcohol isopropílico durante 10 minutos. El ARN fue lavado en 1 mL de alcohol 75% y resuspendido en 50 µL de agua libre de ARNasas tratada con dietilpirocarbonato (DEPC) 0,1% (Sigma Chemical Co.) durante 10 minutos a 60ºC. Previa cuantificación en espectrofotómetro, las muestras de ARN total fueron almacenadas a –80ºC en una concentración de 250 ng/µL hasta posterior análisis.
Transcripción Reversa
La primera cadena de ácido desoxirribonucleico complementario (cADN) fue sintetizada usando 500 ng de ARN total utilizando el kit TaqMan® Reverse Transcription Reagents (Roche Molecular Systems Inc., NJ, USA). 30 µL de reacción que contenía: 3 µL de amortiguador RT 10x, 6,6 µL de MgCl2 25 mM, 6 µL de mezcla de dNTP, 1,5 µL de Oligo d(T), 0,6 µL de inhibidor de ARNasas, 0,75 µL de enzima transcriptasa reversa Multi ScribeTM, 9,55 µL de agua libre de ARNasas DEPC 0,1% y 2 µL de ARN total, fueron retrotranscritas en termociclador Primus 96 plus Termal Cycler (MWG AG Biotech, Germany) bajo las siguientes condiciones: 10 min. a 25ºC, 30 min. a 48ºC y 5 min. a 95ºC.
RT-PCR en tiempo real
Para examinar la expresión de mARN de RANKL, 83,3 ng de cADN, en diluciones de 1x y 0,1x y en duplicado, fueron amplificadas por PCR en tiempo real utilizando en ensayo específico Assay-on-DemandTM Gene Expression Products (Applied Biosystems, CA, USA), que contiene partidores forward y reverse en concentraciones no limitantes y una sonda TaqMan® MGB 6- FAM fluorescentemente marcada, específicamente diseñada para detectar y cuantificar secuencias de cADN del gen RANKL multiexónico sin amplificar ADN genómico. 25 µL de volumen de reacción que contenía: 12,5 µL de TaqMan® Universal PCR Master Mix (Applied Biosystems), 1,25 µL de Assay-on-Demmand 20x, 6,23 µL de agua libre de ARNasas DEPC 0,1% y 5 µL de cADN, fueron analizadas bajo las siguientes condiciones: Un primer paso de 2 min. a 50ºC, un segundo paso de 10 min. a 95ºC y 40 ciclos de 15 seg. a 95ºC y 1 min. a 60ºC, en un detector de PCR tiempo real ABI PRISMTM 7700 Sequence Detector System (Applied Biosystems). Como control interno del ensayo 33,3 ng de cADN fueron amplificados para determinar la expresión de mARN de gliceraldehido-3-fosfato deshidrogenasa (GAPDH) utilizando un kit TaqMan® Pre- Developed Assay Reagent Human GAPDH (Applied Biosystems) en las mismas diluciones y condiciones que RANKL.
Obtención de leucocitos infiltrantes gingivales
La obtención de los leucocitos infiltrantes gingivales totales y su inmunotificación y cuantificación mediante citometría de flujo fue realizado como ha sido previamente publicado26. Brevemente, La biopsia gingival fue pesada en balanza analítica y seccionada en fragmentos de aproximadamente 1 mm3. Los fragmentos se incubaron durante 90 min. en baño termorregulado a 37°C sometido a agitación constante, en medio de digestión que contenía: RPMI 1640 suplementado con 50 UI/mL de penicilina, 50 µg/mL de estreptomicina, L-glutamina 200 mM y 200 UI/mL de colagenasa clostridial tipo IV (Gibco Invitrogen Corp., Grand Island, NY, USA.), en una relación de 1 mL de solución de digestión por cada 50 mg de tejido. La reacción se inactivó suspendiendo la población celular obtenida en medio de cultivo completo suplementado con 10% de suero bovino fetal (SBF) (Gibco Invitrogen Corp.). Se realizó contabilización celular en cámara de Neubahuer mediante microscopio de contraste de fase (Axiovert 100, Zeiss Co., Germany). La viabilidad celular se evaluó por exclusión del colorante azul de Trypan y fue igual o superior a 90%.
Análisis mediante citometría de flujo
Para la inmunotipificación y cuantificación de los leucocitos infiltrantes gingivales, suspensiones de 200.000 células totales gingivales en 50 µL de PBS fueron incubadas separadamente con 10 µL de anticuerpos monoclonales (mAc) de ratón antihumano (Becton Dickinson Immunocytometry Systems, San José, CA, USA.) anti-CD4 (linfocitos T CD4+), anti-CD8 (linfocitos T CD8+), anti-CD14 (monocitos), anti-CD19 (linfocitos B), anti-CD16 y anti-CD56 (células natural killer), anti-62L (neutrófilos) y anti-CD83 (células dendríticas), conjugados con ficoeritrina (PE) y/o fluoresceína isotiociarato (FITC), durante 30 min. a 4ºC en la oscuridad. Para determinar las células infiltrantes gingivales responsables de la síntesis de RANKL, un análisis de doble marcaje mediante citometría de flujo fue realizado como ha sido previamente publicado27. Brevemente, posterior al marcaje específico para cada tipo celular, un mAc de conejo anti-RANKL humano fue incubado en una concentración de 20 µg/mL a 4ºC durante toda la noche en cámara de humedad (R&D Systems Inc., MI, USA). Luego, un mAc de hámster anticonejo FITC-conjugado fue incubado en una dilución 1:64 durante 1 hora a temperatura ambiente (R&D Systems Inc.). Previo lavado en PBS, las células resuspendidas en 300 µL de PBS fueron analizadas en citómetro de flujo FACSort (Becton Dickinson Immunocytometry System). LeucoGATE (CD45 FITC/ CD14 PE) fue utilizado para determinar la población leucocitaria total, y TriTEST CD4 FITC/CD8 PE/CD3 PerCP, para la cuantificación de la razón CD4/CD8 (Becton Dickinson Immunocytometry Systems). Controles de isotipo para FITC y PE fueron utilizados con control.
Análisis de los datos
Los datos se analizaron utilizando el software estadístico Stata® versión 7.0 (Statistics/Data Analysis Stata, Stata Co., Tx, USA). El test Shapiro-Wilk fue utilizado para determinar distribución normal de lo datos. Los parámetros clínicos edad, profundidad de sondaje y nivel de inserción clínico, y los datos experimentales Ct, DCt y porcentaje de leucocitos infiltrantes gingivales entre grupo control y experimental se analizaron utilizando la prueba estadística t de Student no pareada de 2 colas. El test ANOVA no pareado de 2 colas se utilizó para analizar los parámetros clínicos género, placa bacteriana y sangramiento al sondaje, y las diferencias en porcentaje de las poblaciones leucocitarias dentro del grupo control y el experimental. El tipo celular predominante en cada grupo se determinó con el test de Tukey. Un p<0,05 fue considerado como diferencia significativa.
Los datos obtenidos por citometría de flujo fueron graficados como LeucoGATE dotplot y TriTEST CD4/CD8/ CD3 contourplot e histogramas para cada tipo celular, utilizando en software WinMDI versión 2.8.
Los datos obtenidos de la técnica de detección de mARN de RANKL y GAPDH mediante PCR en tiempo real fueron analizadas mediante el software ABI PRISMTM Sequence Detector Systems versión 1.7a (Applied Biosystems). Los datos fueron graficados como la señal de fluorescencia ∆Rn versus el número de ciclo de amplificación, utilizando la ecuación ∆Rn = Rn+ – Rn–, donde Rn+ es la señal de fluorescencia del producto en un momento dado y Rn– es la señal de fluorescencia durante la emisión background durante los ciclos 3 a 15. Un límite umbral arbitrario fue establecido mediante el método de los replicados. El valor Ct fue definido como el número de ciclo en el cual ∆Rn cruza el límite umbral establecido. La relación entre RANKL y GAPDH en cada individuo fue definida como ∆Ct, donde ∆Ct = CtRANKL – CtGAPDH. Los valores Ct y ∆Ct de RANKL y GAPDH son expresados como promedio ± desviación estándar y rango de datos, la prueba estadística t-test de Student no pareada fue utilizada para analizar las diferencias. La eficiencia de amplificación entre GAPDH y RANKL fue evaluada analizando la variación de ∆Ct en diluciones seriadas en un rango de 1000 en 3 pacientes con periodontitis. Un gráfico de ∆Ct versus el logaritmo en base 10 de la dilución de cADN fue realizado y los datos fueron fijados utilizando análisis de regresión lineal. El número de veces de expresión de mARN de RANKL relativas al control interno mARN de GAPDH fue determinado utilizando el método 2-∆∆ct28.
Resultados
Características clínicas
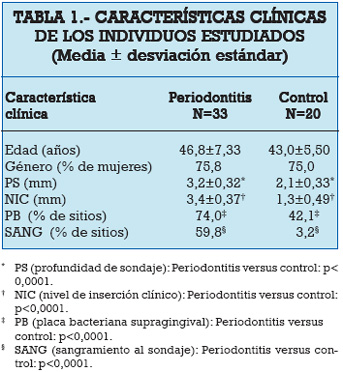
Las características clínicas de los pacientes con periodontitis y de los individuos control sano incluidos en este estudio se muestran en la Tabla 1. En el grupo con periodontitis fueron estudiados 8 hombres y 25 mujeres, con un rango de edad de 35–65 años (46,8±7,33), y 5 hombres y 15 mujeres, con un rango de edad de 35–57 (43,0±5,50), fueron estudiados en el grupo control. No se observaron diferencias significativas en la edad y el género, expresado como porcentaje de mujeres, entre ambos grupos en estudio. Los pacientes con periodontitis mostraron significativamente mayor porcentaje de sitios con presencia de placa bacteriana (74,0 vs. 42,1) y de sitios con sangramiento al sondaje periodontal (59,8 vs. 3,2), y mayor profundidad de sondaje y nivel de inserción clínico perdido (3,2±0,32 vs. 2,1±0,33 y 3,4±0,37 vs. 1,3±0,49, respectivamente) en comparación a los sujetos controles sanos.
Identificación de mARN de RANKL mediante RTPCR tiempo real en biopsias de encía
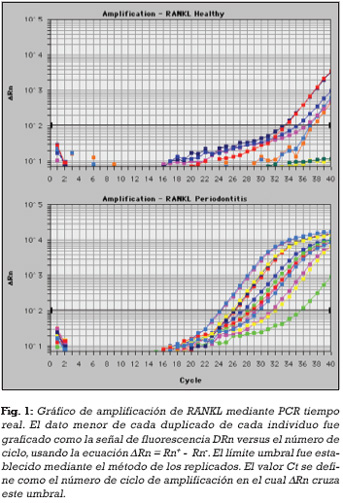
Todos los pacientes con periodontitis mostraron niveles detectables de mARN de RANKL, mientras un 75% tenían niveles detectables en el grupo de individuos controles sanos. Los valores medios y el rango de los datos Ct para RANKL y GAPDH se muestran en la Tabla 2. Los gráficos de amplificación de RANKL del menor de cada duplicado para ambos grupos se muestran en la Figura 1. El Ct de GAPDH fue similar entre ambos grupos (21,678±1,62 vs. 21,505±0,86), pero el Ct de RANKL fue significativamente más bajo en el grupo de individuos con periodontitis en comparación a los sujetos sanos (28,791±3,27 vs. 36,514±2,67). El ∆Ct de RANKL y GAPDH se muestra en la Tabla 3. El ∆Ct fue significativamente más bajo en el grupo de individuos con periodontitis en comparación a los sujetos sanos (7,113±3,00 vs. 15,009±2,80). La gráfica de eficiencia de amplificación de GAPDH y RANKL muestra una pendiente de 0,0752 (Figura 2), así, la eficiencia de amplificación de ambos amplicones es similar y la cuantificación relativa de RANKL con relación a GAPDH puede ser determinada por el método 2-∆∆C. Utilizando este método se determinó que, en individuos con periodontitis, la expresión de RANKL se incrementó en 238,3 veces con relación a los sujetos control sanos, con un rango de error estimado de 29,8– 1.903,4 (Tabla 3).
Inmunotipificación y cuantificación de los leucocitos infiltrantes obtenidos de biopsias gingivales
Las células totales obtenidas por digestión enzimática de biopsias gingivales de pacientes con periodontitis e individuos controles sanos fueron inmunotipificadas mediante citometría de flujo (Tabla 4). Se observa significativamente mayor porcentaje de linfocitos T CD4+ y CD8+ (28,1±7,09 vs. 4,4±1,46 y 15,4±3,80 vs. 3,2±0,95, respectivamente) en pacientes con periodontitis en comparación a individuos sanos. Por otro lado, se observa mayor porcentaje de neutrófilos en individuos controles sanos (44,8±7,29 vs. 26,9±7,29). El tipo celular predominante en el grupo de pacientes con periodontitis son los linfocitos T CD4+ y en el grupo control los polimorfonucleares neutrófilos. No se observa diferencia en el porcentaje de monocitos, natural killer, células dendríticas, linfocitos B, ni en la razón linfocitos T CD4/CD8.
Doble marcaje mediante citometría de flujo
Un porcentaje de 19,4±2,81 del total de leucocitos infiltrantes gingivales aislados expresaron RANKL en las muestras de pacientes con periodontitis crónica. De estas células totales un 17,1±2,54 correspondían a linfocitos T CD4+, 1,7±1,05 a células dendríticas y 0,6±0,63 a monocitos (Tabla 5).
Discusión
Aunque la periodontitis es una de las enfermedades humanas asociadas a la pérdida de hueso más prevalentes, el mecanismo de formación de osteoclastos y la destrucción de hueso durante esta enfermedad aún son escasamente comprendidos. Mientras, es ampliamente aceptado y corroborado en la literatura científica que citoquinas proinflamatorias que estimulan la reabsorción de hueso, tal como IL-1b, TNFa , PGE2, INFn presenteejidos periodontala periodontitis29-31, el rol de los mediadores claves de la diferenciación y activación de osteoclastos, RANKL, RANK y OPG, aún no ha sido completamente determinado.
La citoquina RANKL estimula directamente la diferenciación y activación de osteoclastos, a través de la interacción con su receptor específico RANK en la superficie de las células progenitoras del linaje osteoclástico y en los osteoclastos maduros5-7. La unión de RANKL a OPG bloquea su acción en el receptor RANK5, provocando efectos opuestos a los de RANKL en el metabolismo óseo4,5.
En el presente estudio demostramos que significativamente mayores niveles de RANKL son expresados en pacientes adultos afectados por periodontitis crónica en comparación con individuos controles sanos. Dado que, RANKL es la señal molecular final común requerida para la completa diferenciación de los precursores celulares hematopoyéticos totipotenciales en osteoclastos multinucleados y la activación de ellos como células osteodestructivas15,16,32, y a que ha sido demostrado que TNFa, IL-1b, IL-6 y PGE2 aumentan los niveles de RANKL a nivel proteína y mARN33, podría correlacionarse la presencia de mayores niveles de esta citoquina osteoclastogénica en los tejidos afectados por periodontitis con la destrucción ósea alveolar, y así dar una explicación biológica comprensible a la pérdida de dientes consecutiva a la periodontitis.
Nuestros actuales resultados son concordantes con hallazgos previos de nuestro grupo de investigación y con resultados descritos por Mogi y colaboradores, que establecen mayores niveles de RANKL en el fluido gingival crevicular (FGC) de individuos con periodontitis, con niveles de severidad de enfermedad leve, moderada y avanzada, en comparación con sujetos sin enfermedad periodontal34,35. En nuestros datos, no encontramos asociación significativa entre los niveles de RANKL y los parámetros clínicos de diagnóstico y severidad de la enfermedad. Aunque en una periodontitis de mayor severidad los parámetros clínicos de profundidad de sondaje y nivel de inserción clínico son más elevados, esto asociado a una mayor historia de pérdida de hueso alveolar acumulada, no necesariamente significa que un individuo con periodontitis severa este siendo afectado por un proceso de destrucción ósea más activa, en comparación a uno con severidad de enfermedad menor, y en un momento determinado. Uno de los modelos clínicos actualmente más aceptado que explica la historia natural de la periodontitis la define como una enfermedad sitio-específica de progresión episódica. Esto es, la pérdida de hueso alveolar asociada a la infección no sigue un curso lineal de destrucción, sino que responde a un proceso cíclico de episodios cortos, únicos o múltiples, de activa destrucción del tejido periodontal, seguido de largos períodos de latencia en los que no hay evidencia de destrucción e incluso puede existir regeneración de los tejidos perdidos18,36-38. Así, habría que definir longitudinalmente la actividad de la periodontitis, en el individuo en general y en el sitio periodontal en estudio en particular, para definir que la muestra analizada corresponde a un sitio periodontal con activa destrucción de tejido periodontal. Por otro lado, ha sido probado que la edad del individuo no es un factor de riesgo de la enfermedad y que la mayor prevalencia de periodontitis y de destrucción ósea alveolar en individuos adultos y adultos mayores no se asocia a la edad per se, sino que a una acumulación del daño a través del tiempo39,40. Debido a estas razones era de esperar no encontrar asociación entre los parámetros clínicos de la enfermedad y los niveles de RANKL.
En este estudio examinamos los niveles de mARN de RANKL en los tejidos gingivales mediante RT-PCR en tiempo real. Nuestros datos demuestran que todos los pacientes con periodontitis mostraron niveles detectables de mARN de RANKL y estos fueron significativamente mayores que los encontrados en sujetos controles sanos.
Nosotros demostramos que el Ct y el DCt de RANKL fueron menores en pacientes con periodontitis en comparación a individuos controles sanos. Dado que el Ct es inversamente proporcional a la cantidad de mARN presente41, los niveles de mARN de RANKL fueron mayores en el grupo de individuos con periodontitis en relación al grupo control. Al igual que en los hallazgos mediante análisis por RT-PCR semicuantitativo realizados por Liu y colaboradores42, todos los pacientes con periodontitis estudiados mostraron niveles detectables de mARN de RANKL mediante RT-PCR en tiempo real. En nuestro estudio por RT-PCR cuantitativo, todos los sujetos con periodontitis mostraron un Ct de mARN de RANKL más bajo que la Ct media del grupo control (36,514 ± 2,67), excepto un caso, con un Ct de 35,644 (Tabla 2). Nuevamente esto puede ser explicado porque nuestro estudio definió el grupo experimental con sólo una evaluación clínica, sin determinar progresión longitudinal de la destrucción periodontal.
Nosotros estudiamos los niveles de mARN de RANKL en los tejidos periodontales mediante RT-PCR en tiempo real porque esta técnica ha sido calificada como el método de elección para cuantificar citoquinas que expresan bajos niveles de mARN41. Además, la expresión de mARN de RANKL normalizado a GAPDH permite la cuantificación relativa de la expresión de RANKL en los tejidos periodontales28,41. GAPDH fue seleccionado como control interno de la técnica debido a que es un gen housekeeping, sintetizado en niveles muy poco fluctuantes en todos los tipos celulares nucleados del organismo, dado que codifica para una enzima de la vía metabólica glicolítica, indispensable para la sobrevivencia celular43. Numerosos estudios han mostrado que los genes housekeeping podrían expresarse en niveles variables en determinados estados metabólicos de las células. Nuestros resultados indican que no existen diferencias significativas en el nivel de expresión del gen GAPDH entre los individuos del grupo experimental y control, y de esta forma en este estudio GAPDH puede ser utilizado como estándar interno sin problemas metodológicos.
Utilizando el método 2 -∆∆Ct, que permite normalizar la expresión del gen blanco a la del housekeeping, dándole un valor uno en el grupo control, y posibilita la cuantificación en forma relativa a este referente, esto es las veces que este gen blanco está sobreexpresado en el grupo experimental28, nuestros datos muestran que en los individuos con periodontitis crónica la expresión de RANKL se encuentra incrementada en 238,3 veces en comparación a los sujetos sanos, indicando una sobreexpresión del gen RANKL en los tejidos periodontales asociados con destrucción ósea alveolar.
Biopsias de tejidos gingivales fueron sometidas a digestión enzimática tisular para el aislamiento de leucocitos infiltrantes gingivales totales. Mediante citometría de flujo se determinó que los pacientes con periodontitis crónica mostraron un infiltrado de linfocitos T CD4+ y CD8+ significativamente mayor que en individuos controles sanos. Estudios clásicos han establecido un predominio de infiltrado linfocitario en espécimenes gingivales humanos sometidos a lesión periodontal experimental a partir de una a dos semanas de interrumpida la higiene oral44,45. Seymour y colaboradores establecieron mediante inmunohistoquímica de muestras gingivales de estudiantes de odontología sometidos a lesiones periodontales experimentales que un predominio de linfocitos en el infiltrado inflamatorio se establecía al día 21 del período experimental22, observando que en todas las lesiones estudiadas alrededor del 70% correspondía al subtipo T23. En concordancia con esos trabajos, nuestro estudio estableció que en los individuos con periodontitis crónica los linfocitos son el tipo celular predominante del foco inflamatorio establecido, con un predominio de los linfocitos T CD4+ sobre los CD8+ 22-24. Los individuos controles sanos mostraron niveles más bajos de células de naturaleza inflamatoria, con significativamente menores niveles de linfocitos y un predominio de neutrófilos. Los individuos controles se establecieron sobre la base de los parámetros clínicos establecidos en los criterios de inclusión del estudio. La presencia de células de naturaleza inflamatoria, como los polimorfonucleares neutrófilos, se consideran normales en tejidos gingivales clínicamente sanos, ya que participan en la homeostasis de los tejidos, infiltrando el tejido conectivo gingival desde los plexos capilares fenestrados subepiteliales y migrando al surco gingivodentario a través del epitelio de unión, en donde conforman la primera barrera defensiva del organismo ante la injuria bacteriana20,46,47. Por otro lado, signos histológicos de inflamación pueden aparecer en respuesta a acumulación de placa bacteriana clínicamente no visible, sin manifestar signos clínicos de inflamación45,48.
Para evaluar el tipo celular infiltrante gingival responsable de la síntesis de RANKL en los tejidos periodontales afectados, se realizó una evaluación de los distintos tipos celulares y la expresión de RANKL mediante doble tinción usando la técnica de citometría de flujo. Nuestros datos demostraron que los linfocitos T CD4+ fueron el principal tipo celular que sintetizaba RANKL en los tejidos gingivales de pacientes afectados por periodontitis crónica. En un significativamente menor nivel, la expresión de RANKL fue también detectada en macrófagos y células dendríticas. Datos similares de expresión de RANKL en superficie celular han sido descritos por nuestro grupo de investigación en granulomas periapicales consecutivos a lesiones pulpares irreversibles25, en donde fue establecido que el tipo celular principal responsable de la síntesis de RANKL fueron del linaje monocito/macrófago.
Sobre la base de nuestros resultados, claramente concluimos que los linfocitos T CD4+ infiltrantes de los tejidos periodontales de pacientes con periodontitis crónica expresan en superficie RANKL unido a membrana, y como ha sido anteriormente propuesto, contribuirían al desbalance en los procesos celulares acoplados de la remodelación ósea a través de una pérdida de los niveles fisiológicos locales de RANKL, lo que provocaría una alteración en el número y actividad de los osteoclastos y resultaría en una inapropiada alta tasa de reabsorción ósea que excede la capacidad compensatoria de los osteoblastos4,10,13.
Un rol fundamental de los linfocitos T CD4+ en la patogenia de la enfermedad periodontal ha sido recientemente establecida por Baker y colaboradores49. En un modelo de ratas knockout para la actividad de células T CD4+ mediante la deleción del complejo mayor de histocompatibilidad MHC tipo II, estableció en un 70% menos pérdida de hueso alveolar en respuesta a la infección oral por P. gingivalis, en comparación a ratas inmunocompetentes. Las células T no son requeridas para la normal homeostasis ósea, dado que ratas deficientes en células T tienen estructura ósea normal y normal proceso de erupción dentaria12, pero en estados patológicos como la periodontitis crónica la actividad de los linfocitos T puede promover la reabsorción de hueso.
Tomados en conjunto nuestros datos nos permiten establecer que mayores niveles de RANKL se encuentran asociados a individuos afectados por periodontitis crónica en comparación a sujetos control sanos, y que en ellos los linfocitos T CD4+ juegan un rol fundamental en el desbalance del eje RANKL-RANK-OPG. Aunque algunos estudios no descartan que otros tipos celulares, tal como osteoblastos, macrófagos, fibroblastos y células tumorales, expresen RANKL en condiciones patológicas50-53, estudios adicionales son necesarios para resolver la real participación de ellos en la enfermedad. El mayor predominio de los linfocitos T CD4+ en los sitios periodontales afectados por destrucción ósea y su actividad mediante la secreción de citoquinas proinflamatorias y proosteodestructivas, tal como RANKL, nos permite explicar, al menos en parte, los fenómenos etiopatogénicos que llevan a la destrucción de hueso alveolar y la consecutiva perdida de dientes observada en la periodontitis.
Bibliografía
1. Hill PA, Orth M. Bone remodeling. Brit J Orthod 1998; 25:101-7. [ Links ]
2. Boyce BF, Hughes DE, Wright KR, Xing L, Dai A. Recent advances in bone biology provide insight into the pathogenesis of bone diseases. Lab Invest 1999;79: 83-94. [ Links ]
3. Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation. Nature2003;423:337-42. [ Links ]
4. Hofbauer LC, Heufelder AE. Role of receptor activator of nuclear factor-kB ligand and osteoprotegerin in bone cell biology. J Mol Med 2001;79:243-53. [ Links ]
5. Blaque S, James I. RANKL (Receptor Activator of NFkB Ligand). En:Thomson AW, Lotze MT. The Cytokine Handbook. Academic Press. 2003. [ Links ]
6. Takahashi N, Udagawa N, Suda T. A new member of Tumor Necrosis Factor Ligand Family, ODF/OPGL/ TRANCE/RANKL, regulates osteoclast differentiation and function. Biochem Biophys Res Commun 1999;256: 449-55. [ Links ]
7. Kong YY, Boyle WJ, Penninger JM. Osteoprotegerin ligand:a regulator of immune responses and bone physiology. ImmunolToday2000;21:495-502. [ Links ]
8. Yasuda H, Shima N, Nakagawa N, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/ osteoclastogenesis inhibitory factor and is identical to TRANCE/RANKL. Proc Natl AcaSci USA1998;95:3597- 602. [ Links ]
9. Kwon B, Youn BS, Kwon BS. Functions of newly identified members of the tumor necrosis factor receptor/ligand superfamilies in lymphocytes. Curr Opin Immunol 1999;11:340-5. [ Links ]
10. Schwartz Z, Goultschin J, Dean DD, Boyan, BD. Mechanisms of alveolar bone destruction in periodontitis. Periodontol 2000 1997;14:158-72. [ Links ]
11. Kong YY, Feige U, Sarosi I, et al. Activated T cells regulate bone loss and joint destruction in adjuvant arthritis through osteoprotegerin ligand. Nature1999;402:304- 9. [ Links ]
12. Kong YY, Yoshida H, Sarosi I, et al. OPGL is a key regulator of osteoclastogenesis, lymphocyte development and lymph-node organogenesis. Nature1999;397:315-23. [ Links ]
13. Taubman MA, Kawai T. Involvement of T-lymphocytes in periodontal disease and in direct and indirect induction of bone resorption. Crit Rev Oral Biol Med 2001;12:125-35. [ Links ]
14. Teng Y-T, Nguyen H, Cao X, et al. Functional human Tcell immunity and osteoprotegerin ligand control alveolar bone destruction in periodontal infection. J Clin Invest 2000;106:59-67. [ Links ]
15. Lacey DL, Timms E, Tan H-L, et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell1998;93:165-76. [ Links ]
16. Burgess TL, Quian Y-X, Kaufman S, et al. The ligand for osteoprotegerin (OPGL) directly activates mature osteoclasts. J Cell Biol 1999;145:527-38. [ Links ]
17. Offenbacher S. Periodontal Diseases:Pathogenesis. Ann Periodontol 1996;1:821-872. [ Links ]
18. Lindhe J, Haffajee AD, Socransky SS. Progression of periodontal disease in adult subjects in the absence of periodontal therapy. J Clin Periodontol 1983;10:433-42. [ Links ]
19. Zambon JJ. Periodontal Diseases: Microbial factors. Ann Periodontol 1996;1:879-925. [ Links ]
20. Darveau RP, Tanner A, Page RC. The microbial challenge in periodontitis. Periodontol 2000 1997;14:12-32. [ Links ]
21. Van Dyke TE, Lester MA, Shapira L.The role of host response in periodontal disease progression: implications for future treatment strategies. J Periodontol 1993; 64:792-806. [ Links ]
22. Seymour GJ, Powell RN, Aitken JF. Experimental gingivitis in humans. A clinical and histologic investigation. J Periodontol 1983;54:522-8. [ Links ]
23. Seymour GJ, Powell RN, Cole KL, et al. Experimental gingivitis in humans. A histochemical and immunological characterization of the lymphoid cell subpopulations. J Periodont Res 1983;18:375-85. [ Links ]
24. Johannessen AC, Nilsen R, Kristoffersen T, Knudsen GE. Variation in the composition of gingival inflammatory cell infiltrates. J Clin Periodontol 1990;17:298-305. [ Links ]
25. Vernal R, Dezerega A, Dutzan N, et al. RANKL in human periapical granuloma:possible involvement in periapical bone destruction. Oral Dis 2006;12:283-9. [ Links ]
26. Vernal R, Dutzan N, Chaparro A, Puente J, Valenzuela MA, Gamonal J. Levels of interleukin-17 in gingival crevicular fluid and in supernatants of cellular cultures of gingival tissue patients with chronic periodontitis. J Clin Periodontol 2005;32:383-9. [ Links ]
27. Vernal R, Dutzan N, Hernández M, et al. The high expression levels of receptor activator of nuclear factor kB ligand associated to human chronic periodontitis are mainly secreted by CD4+T lymphocytes. J Periodontol (en prensa). [ Links ]
28. Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-DCtmethod. Methods2001;25:402-8. [ Links ]
29. Ishihara Y, Nishihara T, Kuroyanagi T, et al. Gingival crevicular interleukin-1 and interleukin-1 receptor antagonist levels in periodontally healthy and diseased sites. J Periodont Res 1997;32:524-9. [ Links ]
30. Rasmussen L, Hanstrom L, Lerner U. Characterization of bone resorbing activity in gingival crevicular fluid from patients with periodontitis. J Clin Periodontol 2000; 27:41-52. [ Links ]
31. Bickel M, Axtelius B, Solioz C, Attstrom R. Cytokine gene expression in chronic periodontitis. J Clin Periodontol 2001;28:840-7. [ Links ]
32. Nakagawa N, Kinosaki M, Yamaguchi K, et al.RANK is the essential signaling receptor for osteoclast differentiation factor in osteoclastogenesis. Biochem Biophy Res Commun 1998;253:395-400. [ Links ]
33. Nakashima T, Kobayashi Y, Yamasaki S, et al. Protein expression and functional difference of membranebound and soluble receptor activator of NF-kappaB ligand:modulation of the expression by osteotropic factors and cytokines. Biochem Biophys Res Commun 2000;275:768-75. [ Links ]
34. Vernal R, Chaparro A, Graumann R, Puente J, Valenzuela MA, Gamonal J. Levels of cytokine receptor activator of nuclear factor kB ligand in gingival crevicular fluid in untreated chronic periodontitis patients.J Periodontol 2004;75:1592-7. [ Links ]
35. Mogi M, Otogoto J, Ota N, Togari A. Differential expression of RANKL and osteoprotegerin in gingival crevicular fluid of patients with periodontitis. J Dent Res 2004;83:166-9. [ Links ]
36. Becker W, Berg L, Becker BE. Untreated periodontal disease. J Periodontol 1979;67:1123-37. [ Links ]
37. Goodson JM, Tanner AC, Haffajee AD, Sornbenger GC, Socransky SS. Patterns of progression and regression of advanced destructive periodontal disease. J Clin Periodontol 1982;9:72-81. [ Links ]
38. Haffajee AD, Socransky SS, Goodson JM. Comparison of different data analyses for detecting changes in attachment level. J Clin Periodontol 1983;10:298-310. [ Links ]
39. Kiyak HA, Persson RE, Persson GR. Influences on the perceptions of and responses to periodontal disease among older adults. Periodontol 2000 1998;16:34-43. [ Links ]
40. Locker D, Slade GD, Murray H. Epidemiology of periodontal disease among older adults:a review. Periodontol 2000 1998;16:16-33. [ Links ]
41. Giulietti A, Overbergh L, Valckx D, Decallonne B, Bouillon R, Mathieu Ch. An overview of real-time quantitative PCR:applications to quantify cytokine gene expression. Methods2001;25:386-401. [ Links ]
42. Liu D, Xu JK, Figliomeni L, et al. Expression of RANKL and OPG mRNA in periodontal disease: Possible involvement in bone destruction. Int J Molec Med 2003;11:17-21. [ Links ]
43. Thellin O, Zorzi W, Lakaye B, et al. Housekeeping genes as internal standards:use and limits. J Biotechnol 1999;75:291-5. [ Links ]
44. Zachrisson BU. A histologic study of experimental gingivitis in man. J Periodont Res 1968;3:293-302. [ Links ]
45. Payne WA, Page RC, Ogilvie AI, Hall WB. Histopathologic features of the initial and early stages of experimental gingivitis in man. J Periodontal Res 1975;10:51-64. [ Links ]
46. Dennison DK, Van Dyke TE. The acute inflammatory response and the role of phagocytic cells in periodontal health and disease. Periodontol 2000 1997;14:54-78. [ Links ]
47. Kornman KS, Page RC, Tonetti MS. The host response to the microbial challenge in periodontitis:assembling the players. Periodontol 2000 1997;14:33-53. [ Links ]
48. Schroeder HE, Lindhe J. Conversion of established gingivitis in the dog into destructive periodontitis. Arch Oral Biol 1975;10:775-82. [ Links ]
49. Baker PJ, Garneau J, Howe L, Roopenian DC. T-cell contributions to alveolar bone loss in response to oral infection with Porphyromonas gingivalis. Acta Odontol Scand 2001;59:222-5. [ Links ]
50. Huang L, Xu J, Wood DJ, Zheng MH. Gene expression of osteoprotegerin ligand, osteoprotegerin, and receptor activator of NF-kB in giant cell tumor of bone. Possible involvement in tumor cell-induced osteoclast-like cell formation. Am J Pathol 2000;156:761-7. [ Links ]
51. Hasegawa T, Yoshimura Y, Kikuiri T, et al. Expression of receptor activator of NF-kappa B ligand and osteoprotegerin in culture of human periodontal ligament cells. J Periodont Res 2002;37:405-11. [ Links ]
52. Crotti T, Smith MD, Hirsch R, et al. Receptor activator NF kB ligand (RANKL) and osteoprotegerin (OPG) protein expression in periodontitis. J Periodont Res 2003;38: 380-7. [ Links ]
53. Tay JYY, Bay BH, Yeo JF, Harris M, Meghji S, Dheen ST. Identification of RANKL in osteolytic lesions of the facial skeleton. J Dent Res 2004;83:349-53. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rolando Vernal Astudillo
Facultad de Odontología
Universidad de Chile
Departamento de Odontología Conservadora
Olivos 943 Independencia
Santiago- Chile
Telf.: +56 2 978 18 33 Fax: +56 2 978 18 15
E-mail: rvernal@uchile.cl
Aceptado: Enero 2006.