Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Avances en Periodoncia e Implantología Oral
versión On-line ISSN 2340-3209versión impresa ISSN 1699-6585
Avances en Periodoncia vol.19 no.3 Madrid dic. 2007
La utilización del beta-fosfato tricálcico como biomaterial en implantología oral
Implant treatment by fixed prostheses in completely edentulous mandible patients
Velasco Ortega E*, Pato Mourelo J**, Segura Egea J J***, Pérez Pérez O****, Medel Soteras R***
* Profesor Titular de Odontología Integrada de Adultos. Facultad de Odontología.
Director del Postgrado de Implantología Oral. Universidad de Sevilla.
** Profesor Colaborador Honorario de Odontología Integrada de Adultos. Facultad de Odontología.
Profesor del Postgrado de Implantología Oral. Universidad de Sevilla.
*** Profesor Asociado de Odontología Integrada de Adultos. Facultad de Odontología.
Profesor del Postgrado de Implantología Oral. Universidad de Sevilla.
**** Profesor de Cirugía Oral y MáxiloFacial. Facultad de Estomatología de La Habana (Cuba).
Dirección para correspondencia
RESUMEN
Introducción. El objetivo del presente estudio era mostrar los resultados del tratamiento con implantes dentales insertados en diversas situaciones clínicas utilizando un biomaterial de relleno óseo.
Métodos.43 pacientes con pérdidas dentales fueron tratados con 171 implantes Microdent®. En todos los casos, como biomaterial para regeneración ósea se utilizó el beta-fosfato tricálcico KeraOs®. Los implantes fueron cargados después de un periodo de cicatrización de 6 meses.
Resultados. Los hallazgos clínicos indican una supervivencia y éxito de los implantes del 98,8%. 2 implantes se perdieron durante el periodo de cicatrización. En el 67,4% de los pacientes se realizó técnica de elevación sinusal, en el 18,6% de los pacientes se realizaron implantes postextracción y en el 14%, los implantes fueron insertados en rebordes alveolares atróficos. Después de un periodo de carga funcional de 12 meses, no ha habido complicaciones tardías. El 54% de las prótesis realizadas fueron puentes fijos; el 28% coronas unitarias; el 14% rehabilitaciones completas fijas y el 4% sobredentaduras.
Conclusiones. Este estudio indica que el beta-fosfato tricálcico puede ser utilizado con éxito como material de regeneración ósea en el tratamiento con implantes dentales.
Palabras clave. Implantes orales, biomateriales, injertos, betafosfato tricálcico, implantología oral.
ABSTRACT
Introduction. The aim of this study was to report the outcome of treatment with dental implants inserted in different clinical situations with use of biomaterial of bone regeneration.
Methods. 43 patients with tooth loss were treated with 171 Microdent®. In all cases, beta-tricalcium phosphate KeraOs® were used. Implants were loaded after a healing free-loading period of 6 months.
Results. Clinical results indicate a survival and success rate of implants of 98,8%. 2 implants were lost during the healing period. After a functioning period of 12 months, no late complications were reported. 54% of implant-supported prostheses were fixed bridges; 28% were single crowns; 14% were fixed rehabilitations and 4% were overdentures.
Conclusions.This study indicate that beta-tricalcium phosphate can be used with success as biomaterial of bone regeneration in treatment with dental implants.
Key words. Dental implants, biomaterials, grafts, beta-tricalcium phosphate, implant dentistry.
Introducción
Los defectos óseos maxilares pueden dificultar la fase quirúrgica del tratamiento implantológico al presentar un insuficiente volumen óseo para la adecuada inserción de los implantes dentales. En este sentido, durante las últimas décadas diversas técnicas quirúrgicas han sido desarrolladas para mejorar estas situaciones clínicas mediante la utilización de injertos de hueso autólogo, de origen animal (ej.: hueso bovino, porcino o equino) o sintéticos (ej.: fosfato tricálcico) que han sido preconizados en el tratamiento con implantes oseointegrados 1-5.
El hueso autólogo está considerado el mejor material para las técnicas de injertos ya que tiene propiedades osteoconductoras (crecimiento óseo por aposición sobre una superficie), osteoinductoras (estimulación de células pluripotenciales indiferenciadas que estimulan el desarrollo de células formadoras de estirpe ósea), y osteogénicas (crecimiento óseo por células procedentes del injerto) 6-7. Sin embargo, la morbilidad de la zona dadora no puede ser ignorada y además frecuentemente existen limitaciones para conseguir una buena cantidad de hueso, siendo estas desventajas las que han obligado a los clínicos e investigadores a desarrollar diversos sustitutos óseos que puedan ser utilizados con éxito en el tratamiento implantológico con compromiso óseo 8-12.
Los injertos heterólogos de origen animal (ej. hueso bovino mineralizado) constituyen un buen biomaterial cuando el autoinjerto no representa un opción realista. Estos sustitutos óseos poseen propiedades osteoconductoras. Sin embargo, este material ofrece resultados clínicos más variables que el autoinjerto, puede presentar algún riesgo de contaminación microbiana o inmunogenicidad, así como su tratamiento intensivo para su comercialización contribuye a disminuir sus propiedades biológicas y mecánicas y a incrementar su costo económico 13-15.
Entre los materiales sintéticos, el betafosfato tricálcico es un material altamente biocompatible, reabsorbible y osteoconductor que ha sido utilizado ampliamente para la reparación de defectos óseos, ya que permite por sus características fisicoquímicas mantener extremadamente bien el espacio rellenado con un éxito elevado en diversas áreas de la biología, medicina y odontología 13,16-20.
El betafosfato tricálcico ha sido testado en diversos estudios animales para demostrar su capacidad como biomaterial en la regeneración ósea 21-25. Un estudio valora la aplicabilidad clínica y el comportamiento biológico después de 12 semanas de un cemento de fosfato cálcico como relleno óseo para los espacios resultantes (entre 1-2 mm) alrededor de los implantes insertados en el hueso trabecular de los fémures de cabras. La inyección del cemento de fosfato cálcico resultó en un casi completo relleno de los espacios con hueso neoformado 21. La eficacia para preservar la integridad del reborde alveolar postextracción con un sustituto óseo realizado mediante la combinación de gránulos de fosfato cálcico y un polímero en solución ha sido demostrado en perros beagle mediante un estudio histomorfométrico a los 3 meses de cicatrización 22.
La utilización del betafosfato tricálcico ha demostrado buenos resultados clínicos en cirugía e implantología oral 5,12,26-28. Un compuesto de hidroxiapatita (50%) y beta fosfato tricálcico (50%) fue utilizado con éxito para rellenar los defectos óseos producidos por la enucleación de quistes maxilares que a los 6 meses fueron tratados con la inserción de implantes dentales en el nuevo tejido regenerado 26.
Un estudio valora los resultados de la carga inmediata de 1065 implantes insertados en 338 pacientes edéntulos parciales donde se utilizó el beta fosfato tricálcico como biomaterial en rebordes alveolares atróficos, postextracción y elevación sinusal. Después de una medía de 19,2 meses (rango: 12-48), la supervivencia de los implantes fue del 97,6% 12.
Diversos estudios han demostrado las ventajas de utilizar el beta fosfato tricálcico como biomaterial en aquellos pacientes que necesitaban la elevación del seno maxilar para la inserción posterior de implantes dentales 5,27-28. Aunque el hueso del propio paciente es el material ideal en la técnica del sinus lift, sin embargo un estudio reciente no muestra diferencias en el éxito entre los implantes insertados a los 6 meses de cicatrización en elevaciones sinusales uni y bilaterales comparando el hueso autólogo y el beta fosfato tricálcico (100% con ambos tipos de injertos) después de 12 meses de seguimiento 5. Además se ha demostrado mediante histología e histomorfometría que ambos tipos de injertos (hueso autólogo y aloinjerto con beta fosfato tricálcico) no presentan diferencias significativas en la regeneración ósea del suelo maxilar y en su adecuación en altura para la inserción posterior de los implantes dentales 27-28.
El objetivo del presente estudio era valorar la capacidad del betafosfato tricálcico para facilitar la formación de hueso en el tratamiento con implantes oseointegrados.
Pacientes y métodos
El presente estudio fue realizado por profesores de la unidad docente de Odontología Integrada de Adultos de la Facultad de Odontología y del Postgrado de Implantología Oral de la Universidad de Sevilla y del Departamento de Cirugía Oral de la Facultad de Estomatología de La Habana (Cuba).
Previamente a la realización del estudio, aquellos pacientes que padecían trastornos sistémicos graves que podían comprometer la oseointegración fueron excluidos del estudio29. Los pacientes seleccionados eran adultos, de ambos sexos.
Todos los pacientes seleccionados en el estudio fueron informados de la técnica quirúrgica de inserción de implantes con utilización de biomateriales así como del protocolo posterior del tratamiento incluyendo los aspectos prostodóncicos, temporalización y seguimiento, y de la posibilidad de la existencia de complicaciones y pérdida de implantes.
Los pacientes autorizaron el tratamiento implantológico mediante un consentimiento informado. Antes y después (a los 6 meses) del tratamiento, todos los pacientes fueron evaluados radiológicamente, con una ortopantomografía.
Los criterios de éxito y supervivencia de los implantes fueron los recomendados por van Steenberghe et al 30. En este sentido, la supervivencia fue definida como la proporción de implantes permanentes en su localización original aunque no tengan valor clínico o cause efectos adversos. Los criterios de éxito de los implantes se expresan en la tabla 1.
Cirugía
Una hora antes de la cirugía, los pacientes comenzaron un régimen antibiótico preventivo (amoxicilina + clavulánico) durante una semana. En casos de molestias, dolor o inflamación a todos los pacientes se les recomendó ibuprofeno. Todos los pacientes recibieron anestesia local. A todos los pacientes se les recomendó el enjuague diario con clorhexidina durante los primeros 30 días.
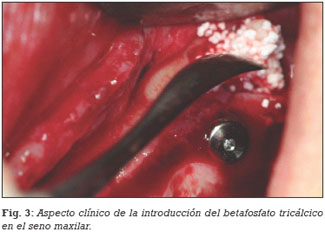
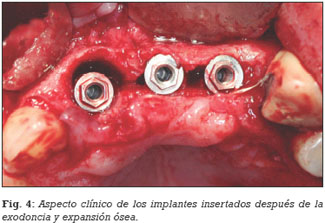
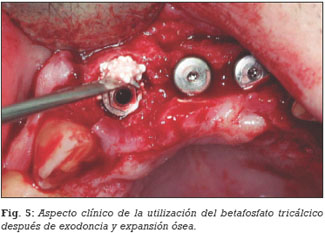
En todas las situaciones clínicas (ej. elevación del seno maxilar, implantes postextracción, relleno de defectos óseos) se utilizó como biomaterial de relleno, el betafosfato tricálcico KeraOs® (Keramat, Coruña, España) (Figuras 1, 2, 3, 4, 5).
Los implantes utilizados de conexión externa fueron Microdent® (Microdent, Barcelona, España).
Prostodoncia
A los 6 meses después de la inserción de los implantes se realizó una ortopantomografía de control, y posteriormente la carga funcional mediante la colocación de las correspondientes prótesis implantosoportadas. El tiempo transcurrido de seguimiento clínico desde la carga funcional de los implantes ha sido al menos de 12 meses.
Análisis estadístico
Se realizó una estadística descriptiva de los hallazgos clínicos del estudio, con referencia a las variables demográficas de los pacientes, los implantes y prótesis realizadas.
Resultados
Pacientes
Cuareta y tres pacientes (15 hombres y 28 mujeres) fueron tratados con implantes insertados, con una edad media de 45,8 años (rango: 22-71 años). 11 pacientes eran fumadores (25,6%).
Implantes
Se insertaron un total de 171 implantes con utilización del material sintético betafosfato tricálcico, en los correspondientes 43 pacientes, lo que representa una media de 3,9 implantes por paciente. Todos los implantes utilizados, eran de diámetro universal o estándar (3,8-4,2 mm). Con respecto a la longitud, el 100% de los implantes era 12 mm. 159 implantes (93%) fueron insertados en el maxilar superior mientras que 12 implantes (7%) en la mandíbula.
En 2 implantes (1,2%) hubo complicaciones, al presentar movilidad a la exploración clínica durante la fase de cicatrización libre de carga funcional y fueron extraídos. Ningún implante se ha perdido después de la carga funcional prostodóncica durante el periodo de seguimiento clínico.
Cirugía
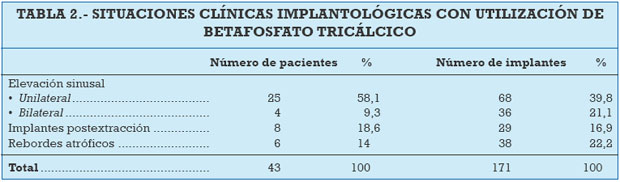
Todos los pacientes necesitaron la utilización del material sintético betafosfato tricálcico. En 29 pacientes (67,4%) se utilizó como material de relleno en la elevación del seno maxilar. En 25 pacientes (58,1%) la elevación sinusal fue unilateral, mientras que en 4 pacientes fue bilateral (9,3%) (Figuras 2 y 3).
En 8 pacientes (18,6%) se utilizó el betafosfato tricálcico como material de relleno durante la inserción de implantes postextracción y en 6 pacientes (14%) como biomaterial en defectos óseos o rebordes alveolares atróficos (Figuras 4 y 5). La distribución de pacientes e implantes insertados según las diferentes situaciones clínicas se expresa en la Tabla 2.
Prótesis implantosoportadas
Los 169 implantes restantes fueron cargados funcionalmente, a los 6 meses, con sus correspondientes prótesis implantosoportadas. Se realizaron un total de 50 prótesis (100%), 27 puentes fijos (54%), 14 coronas unitarias (28%), 7 rehabilitaciones fijas (14%) y 2 sobredentaduras (4%). El seguimiento clínico ha sido de 12 meses. No se ha perdido ningún implante en este periodo.
Discusión
En implantología oral, el objetivo de las técnicas de regeneración ósea es aumentar o mantener el volumen óseo para la inserción de implantes.La regeneración ósea puede ser modificada, además de por factores sistémicos, por la utilización de biomateriales o sustitutos óseos. Clásicamente, el material ideal para la regeneración ósea ha sido el hueso autólogo del paciente. Sin embargo, en las últimas décadas se han ido incorporando nuevos materiales de origen humano, animal o sintético que han revolucionado las técnicas quirúrgicas implantológicas 25,28.
Los hallazgos clínicos del presente estudio demuestran que un protocolo diagnóstico, quirúrgico y prostodóncico cuidadoso de los pacientes permite con un elevado éxito (98,8%), la combinación del tratamiento implantológico con la utilización de biomateriales para la solución de aquellas situaciones orales donde la disponibilidad del hueso en los maxilares está comprometida como consecuencia de las pérdidas dentales y la existencia de estructuras anatómicas (ej. seno maxilar).
En este sentido, este estudio valora los resultados clínicos del tratamiento implantológico oral en diferentes situaciones clínicas como son la elevación del seno maxilar, inserción inmediata de implantes después de la exodoncia y la inserción de implantes en rebordes alveolares atróficos. En todas estas situaciones como material de relleno con capacidad osteoconductora se utilizó un material sintético, el betafosfato tricálcico.
La elevación del seno maxilar constituye una alternativa terapéutica con un éxito elevado en el tratamiento con implantes del maxilar superior 32-33. En los casos de tratamiento implantológico con elevación sinusal, que representa el 67,4% de los pacientes y el 60,9% de los implantes del presente estudio, el betafosfato tricálcico ha demostrado ser un excelente biomaterial con un éxito elevado en la regeneración ósea necesaria para el mantenimiento del espacio adecuado para la inserción de los implantes 31. De hecho, la densidad ósea conseguida en la elevación sinusal con el betafosfato tricálcico parece ser similar a la conseguida con el hueso autólogo del paciente lo que permite tras un periodo de 6 meses obtener un tejido duro y adecuado para la inserción de los implantes 28. Este grado de regeneración ósea es debido a que el betafosfato tricálcico actúa como un sustituto óseo temporal ya que suele ser reabsorbido completamente con la nueva formación de hueso, aunque en ocasiones puedan quedar restos que pueden ser demostrados clínica y radiológicamente después de los 6 meses 28.
En el presente estudio, todos los pacientes fueron revisados a los 6 meses mediante una ortopantomografía que puede representar un excelente método diagnóstico por la imagen para demostrar el incremento en el volumen óseo con un adecuada altura en el área injertada del seno maxilar como consecuencia de la utilización del betafosfato tricálcico 5.
Los estudios histológicos e histomorfométricos realizados en los tratamientos implantológicos con elevación sinusal demuestran que el betafosfato tricálcico es un buen material para injertos cuando se le compara con el hueso autólogo aunque evidentemente su capacidad regenerativa ósea está limitada a la osteoconducción (crecimiento óseo por aposición sobre una superficie) por lo que presenta un menor índice de formación ósea que el hueso del propio paciente ya que no posee propiedades osteoinductoras y osteogénicas, sin embargo causa una menor morbilidad que la utilización de injertos óseos y su origen sintético asegura su procedencia no biológica (animal o humana) 28,34.
La inserción de implantes inmediatamente después de la exodoncia se ha convertido en una opción terapéutica con éxito en la práctica odontológica cotidiana 35. En los casos de tratamiento implantológico después de la extracción, que representa el 18,6% de los pacientes y el 16,9% de los implantes del presente estudio, el betafosfato tricálcico permite cubrir o rellenar perfectamente el espacio entre el implante y el hueso proporcionando una estabilidad tridimensional necesaria para la conservación del volumen, además el betafosfato tricálcico con su gran poder osteoconductor y su lenta degradación consigue su sustitución por hueso neoformado lo que se traduce por buen sellado óseo en contacto con la superficie cervical del implante 21,24. La unión de este biomaterial a la superficie rugosa del implante permite una respuesta del 100% del tejido óseo que ha sido demostrado en estudios de experimentación animal lo que incrementa la fijación posterior del implante y un elevado grado de oseointegración 21. Desde un aspecto clínico, los resultados de estas investigaciones parece demostrar que el betafosfato tricálcico incrementa significativamente la regeneración ósea alrededor de los implantes insertados inmediatamente después de la extracción dental 12, 21-22,24.
En los casos de tratamiento implantológico en rebordes alveolares residuales, que representa el 14% de los pacientes y el 22,2% de los implantes del presente estudio, el betafosfato tricálcico ha demostrado unos excelentes resultados, como confirma un estudio realizado en 267 pacientes donde se trataron 1.000 defectos óseos con este material sintético, donde el tejido óseo fue regenerado después de un periodo de 6 a 12 meses. 245 defectos alveolares fueron tratados, 45 casos con elevación sinusal y en 156 pacientes se insertaron 492 implantes 36.
Otra situación clínica implantológica donde el betafosfato tricálcico ha sido utilizado con éxito en el relleno de los espacios óseos originados como consecuencia de la técnica de expansión ósea, 37-38. Las diversas técnicas quirúrgicas implantológicas con expansores u osteótomos que se utilizan para la inserción de implantes en áreas con una menor anchura o altura ósea necesitan frecuentemente la utilización de biomateriales para conseguir un buen sellado entre la superficie del implante y la superficie del hueso alveolar 37. En este sentido, el betafosfato tricálcico puede ser un buen material como demuestra un estudio reciente donde se insertaron implantes en la zona posterior mandibular mediante expansión ósea con un éxito del 100%, y un periodo de cicatrización de entre 3-9 meses 38.
El grado de regeneración ósea del fosfato tricálcico varia dependiendo de su formulación, porosidad y el tamaño de las partículas 32. La fase beta es más recomendable porque es menos soluble que la fase alfa. La pureza del material debe ser al menos del 99% para evitar una respuesta biológica desfavorable. La velocidad de disolución del material está relacionada con su porosidad, es decir una mayor porosidad favorece su reabsorción. Además la porosidad es esencial para la perfusión ya que los vasos sanguíneos y el tejido óseo neoformado para crecer necesitan poros mínimos de 60 micras. El tamaño de las partículas también es importante ya que se ha demostrado que un menor tamaño provoca una menor reacción inflamatoria a cuerpo extraño, lo que permite una interconexión mecánica estable y previene la desintegración fagocítica 31.
El betafosfato tricálcico cuando es reabsorbido es reemplazado por hueso similar anatómica y funcionalmente al hueso original, obteniéndose un tejido óseo vital regenerado, lo que significa que este proceso de remodelación y maduración ósea necesario para la carga funcional de los implantes no se ve alterado por el material 39-40. Sin embargo desde un punto de vista clínico, los diversos estudios que utilizan el betafosfato tricálcico en implantología oral demuestran que se puede consideran como un buen periodo de cicatrización ósea el de 6 meses. Es decir después de este periodo de tiempo, el tejido injertado puede ser suficientemente estable para la carga funcional de los implantes 5,26-27-28,32-34,40.
Los resultados globales del estudio demuestran que después de 1 año de seguimiento clínico desde la carga funcional de los implantes (a los 6 meses de la cirugía), no han existido fracasos con los implantes o con las diferentes opciones prostodoncias implantosoportadas (puentes fijos, coronas unitarias, rehabilitaciones fijas y sobredentaduras).
Conclusiones
El desarrollo de nuevos biomateriales ha hecho posible que diversas situaciones clínicas implantológicas con compromiso óseo puedan ser tratadas con éxito. En este sentido, el betafosfato tricálcico ha demostrado ser un excelente material con capacidad osteoconductora para regenerar el hueso alveolar y poder ser utilizado en aquellos casos implantológicos como son la elevación sinusal, alveolos postextracción y rebordes atróficos consiguiendo una buena unión entere los implantes y el tejido injertado que asegure el mantenimiento de la oseointegración a largo plazo.
Bibliografía
1. Tripplet RG, Schow SR, Laskin DM. Oral and maxillofacial surgery advances in implant dentistry. Int J Oral Maxillofac Implants 2000; 15: 47-55. [ Links ]
2. Becker W. Treatment of small defects adjacent to oral implants with various biomaterials. Periodontology 2000 2003; 33: 26-35. [ Links ]
3. Lekovic V, Kenney EB, Weinlander M, Han T, Klokkevold P, Nedic M, Orsini M. A bone regenerative approach to alveolar ridge maintenance following tooth extraction. J Periodontol 1997; 68: 563-70. [ Links ]
4. Sethi A, Kaus T. Maxillary ridge expansion with simultaneous implant placement: 5-year results of an ongoing clinical study. Int J Oral Maxillofac Implants 2000; 15: 491-9. [ Links ]
5. Zijderveld SA, Zerbo IR, van der Bergh JPA, Schulten EAJM, ten Bruggenkate CM. Maxillary sinus floor augmentation using a beta-tricalcium phosphate (Cerasorb) alone compared to autogenous bone grafts. Int J Oral Maxillofac Implants 2005; 20: 432-40. [ Links ]
6. Misch CE. Bone augmentation for implant placement: keys to bone grafting. En: Misch CE (Ed.). Contemporary Implant Dentistry. 2ª ed. Mosby: San Luis. 1999. pag: 451-67. [ Links ]
7. Albrektsson T, Johansson C. Osteoinduction, osteoconduction and osseointegration. Eur Spine J 2001; 10 (suppl): 96-101. [ Links ]
8. Misch CM. Maxillofacial donor sites for sinus floor and alveolar reconstruction. En: Jensen OT. The sinus bone graft (2ª ed). Quintessence: Chicago 2006. pag: 129-45. [ Links ]
9. Kalk VW, Raghoebar GM, Jansma J, Boering G. Morbidity from iliac crest bone harvesting. J Oral Maxillofac Surgery 1996; 54: 1424-9. [ Links ]
10. Jensen SS, Aaboe M, Pinholt EM, Hjorting-Hansen E, Melsen F, Ruyter IE. Tissue reaction and material characteristics of four bone substitutes. Int J Oral Maxillofac Implants 1996; 11: 55-66. [ Links ]
11. Norton MR, Wilson J. Dental implants placed in extraction sites implanted with bioactive glass: human histology and clinical outcome. Int J Oral Maxillofac Implants 2002; 17: 249-57. [ Links ]
12. Ormianer Z, Palti A, Shifman A. Survival of immediately loaded dental implants in deficient alveolar bone sites augmented with beta-tricalcium phosphate. Implant Dent 2006; 15: 395-403. [ Links ]
13. Vaccaro AR. The role of the osteoconductive scaffold in synthetic bone graft. Orthopedics 2002; 25 (suppl): 571-8. [ Links ]
14. Hämmerle CHF. Membranes and bone substitutes in guided bone regeneration. En: Lang NP, Karring T, Lindhe J (Eds.). Proceedings of the 3rd European Workshop on Periodontology. Implant Dentistry Quintessence: Berlin 1999. pag: 468-99. [ Links ]
15. Chiapasco M, Rossi A. Cirugía preimplantar en las atrofias de los maxilares. En: Chiapasco M, Romeo E (Eds.). Rehabilitación implanto- soportada en casos complejos. Amolca: Caracas. 2006. pag: 131-62. [ Links ]
16. Ellingsen JE, Thomsen P, Lyngstadaas P. Advances in dental implant materials and tissue regeneration. Periodontology 2000 2006; 41: 136-56. [ Links ]
17. Ogose A, Hotta T, Kawashima H, Kondo N, Gu W, Kamura T, Endo N. Comparison of hydroxyapatite and beta tricalcium phosphates as bone substitutes after excision of bone tumors. J Biomed Mater Res 2005; 72B: 94-101. [ Links ]
18. Linovitz RJ, Peppers TA. Use of an advanced formulation of beta-tricalcium phosphate as a bone extender in interbody lumbar fusion. Orthopedics 2002; 25 (suppl): 585-589. [ Links ]
19. Franch J, Diaz-Bertrana C, Lafuente P, Fontecha P, Durall I. Beta-tricalcium phosphate as a syntehetic cancellous bone graft in veterinary orthopaedics. Vet Comp Orthop Traumatol 2006; 4: 1-9. [ Links ]
20. Xu HH, Takagi S, Sun L, Hussain L, Chow LC, Guthrie WF, Yen JH. Development of a nonrigid, durable calcium phosphate cement for use in periodontal bone repair. J Am Dent Assoc 2006; 137: 1131-8. [ Links ]
21. Comuzzi L, Ooms E, Jansen JA. Injectable calcium phosphate cement as a filler for bone defects around oral implants: an experimental study in goats. Clin Oral Impl Res 2002; 13: 304-311. [ Links ]
22. Boix D, Weiss P, Gauthier O, Guicheux J, Bouler JM, Pilet P, Daculsi G, Grimandi G. Injectable bone substitute to preserve alveolar ridge resorption after tooth extraction: a study in dog. J Mater Sci Mater Med 2006; 17: 1145-52. [ Links ]
23. Artzi Z, Weinreb M, Givol N, Rohrer MD, Nemcovsky CE, Prasad HS, Tal H. Biomaterial resorption rate and healing site morphology of inorganic bovine bone and beta-tricalcium phosphate in the canine: a 24-month longitudinal histologic study and morphometric analysis. Int J Oral Maxillofac Implants 2004; 19: 357-68. [ Links ]
24. Suba Z, Takács D, Gyulai-Gaäl S, Kovács K. Facilitation of beta-tricalcium phosphate-induced alveolar bone regeneration by platelet-rich plasma in beagle dogs: a histologic and histomorphometric study. Int J Oral Maxillofac Implants 2004; 19: 832-8. [ Links ]
25. Jensen SS, Broggini N, Horting-hansen E, Schenk R, Buser D. Bone healing and graft resorption of autograft, anorganic bovine bone and beta-tricalcium phosphate. A histologic and histomorphometric study in the mandibles of minipigs. Clin Oral Impl Res 2006; 17: 237-43. [ Links ]
26. Piatelli A, Scarano A, Mangano C. Clinical and histologic aspects of biphasic calcium phosphate ceramic (BCP) used in connection with implant placement. Biomaterials 1996; 17: 1767-70. [ Links ]
27. Szabo G, Huys L, Coulthard P, Maiorana C, Garagiola U, Barabas J, Néemth Z, et al. A prospective multicenter randomized clinical trial of autogenous bone versus beta-tricalcium phosphate graft alone for bilateral sinus elevation: histologic and histomorphometric evaluation. Int J Oral Maxillofac Implants 2005; 20: 371-81. [ Links ]
28. Suba Z, Takács D, Matusovits D, Barabás J, Fazekas A, Szabó G. Maxillary sinus floor grafting with beta-tricalcium phosphate in humans: desnity and microarchitecture of the newly formed bone. Clin Oral Impl Res 2006; 17: 102-108. [ Links ]
29. Buser D, von Arx T, ten Bruggenkate C, Weingart D. Basic surgical principles with ITI implants. Clin Oral Impl Res 2000; 11(suppl 1):59-68. [ Links ]
30. van Steenberghe D, Quirynen, Naert I. Survival and success rates with oral endosseous implants. En: Lang NP, Karring T, Lindhe J (eds.). Proceedings of the 3rd European Workshop on Periodontology. Implant Dentistry. Berlin: Quintessence. 1999. pag: 242-52. [ Links ]
31. Jensen OT, Garlini G, Bilk D, Peters F. Use of alloplasts for sinus floor grafting. En: Jensen OT. The sinus bone graft (2ª ed). Quintessence: Chicago 2006. pag: 201-9. [ Links ]
32. Pérez O, Velasco E, García A, López J, Medel R. La elevación del seno maxilar en el tratamiento con implantes oseointegrados. Arch Odontoestomatol 2005; 8: 463-70. [ Links ]
33. Pérez O, Velasco E, González L, García A, Rodríguez O. Técnicas quirúrgicas complejas en el tratamiento con implantes oseointegrados del maxilar superior. Av Perio Impl Oral 2006; 18: 10-9. [ Links ]
34. Zerbo IR, Zijderveld SA, de Boer A, Bronckers ALJJ, de Lange G, ten Bruggenkate CM, Burger EH. Histomorphometric of human sinus floor augmentation using a porous beta-tricalcium phosphate: a prospective study. Clin Oral Impl Res 2004; 15: 724-32. [ Links ]
35. Velasco E, Pato J, Lorrio JM, Cruz JM, Poyato M. El tratamiento con implantes dentales postextracción. Av Perio Impl Oral 2007; 19 (Supl.): 35-42. [ Links ]
36. Palti A, Hoch T. A concept for the treatment of various dental bone defects. Implant Dent 2002; 11: 73-78. [ Links ]
37. Velasco E, Pérez O, Pato J, Lorrio JM, Cruz JM. La expansión ósea en la implantología oral. Av Perio Impl Oral 2007; 19: 163-9. [ Links ]
38. Basa S, Varol A, Turker N. Alternative bone expansion tecnique for immediate placement of implants in the edentulous posterior mandibular ridge: a clinical report. Int J Oral Maxillofac Implants 2004; 19: 554-8. [ Links ]
39. Szabó G, Suba Z, Hrabák K, Barabás J, Németh Z. Autogenous bone versus beta-triclcium phosphate graft alone for bilateral sinus elevations (2- and 3-dimensional computed tomographic, histologic and histomorphometric evaluations): preliminary results. Int J Oral Maxillofac Implants 2001; 16: 681-92. [ Links ]
40. Trisi P, Rao W, Rebaudi A, Fiore P. Histologic effect of pure-phase beta-tricalcium phosphate on bone regeneration in huamn artificial jaw bone defects. Int J Perio Rest Dent 2003; 23: 69-77. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Prof. Eugenio Velasco Ortega
Facultad de Odontología de Sevilla.
C/ Avicena, s/n
41009 Sevilla
Tfno: 954 481132
e-mail: evelasco@us.es
Recepción: Octubre 2007.
Aceptado: Octubre 2007.