INTRODUCCIÓN
La IASP (International Association for the Study of Pain) define el dolor como “una experiencia sensorial o emocional desagradable, asociada a daño tisular real o potencial, o bien descrita en términos de tal daño”1.
Es un síntoma subjetivo, único para cada persona y momento, que depende del aprendizaje, modula o puede ser modulado por distintas emociones, comportamientos o fenómenos externos, y afecta a una o varias esferas personales (física, psicológica, social o espiritual).
La prevalencia del dolor oncológico varía en función del estadio de la enfermedad, estimándose una prevalencia del 24-30 % en estadios iniciales, y hasta un 60-90 % en enfermedad avanzada2.
ORIGEN DEL DOLOR
Dolor producido por la enfermedad: infiltración del tumor en órganos y estructuras nerviosas. El más frecuente (40-80 %).
Dolor asociado a la enfermedad: por aumento del catabolismo, pérdida muscular, encamamiento...
Dolor asociado al tratamiento: cirugía, efectos secundarios de tratamientos como quimioterapia, hormonoterapia y radioterapia. Supone un 15-20 %.
Dolor independiente de la enfermedad: relacionado con comorbilidades previas o de nueva aparición en el paciente. Baja prevalencia (3-15 %), pero a tener en cuenta.
CLASIFICACIÓN Y EVALUACIÓN
Existen diferentes clasificaciones del dolor en función de su localización, cronología, curso y tipo de dolor3:
Localización: región anatómica donde se localiza del dolor.
Cronología: Agudo (menos de 6 meses), crónico (más de 6 meses), episódico.
-
Curso:
-
Tipo:
DIAGNÓSTICO
Un 40 % de los pacientes oncológicos no tiene correctamente tratado el dolor. La infraevaluación e infratratamiento es recogida desde 2003 por organizaciones internacionales. La OMS insta a mejorar la asistencia sanitaria que se realiza en este problema. La IASP realizó una declaración en 2010 en Montreal, y las Federaciones Europeas de la IASP desarrollaron en Bruselas, en 2011, una hoja de ruta para marcar a los países europeos el camino a recorrer para reconocer y abordar el problema de forma adecuada4.
Es la severidad del dolor, y no el pronóstico, lo que debe indicar el grado de analgesia a alcanzar en cada etapa de la enfermedad.
La evaluación del dolor incluye:
Anamnesis: antecedentes, comorbilidades, tratamientos actuales, síntomas que acompañan al dolor (desencadenantes, agravantes y atenuantes). Dolor total: explorar no solo síntomas físicos, también psicológicos, sociales y espirituales.
Exploración física completa.
Pruebas complementarias diagnósticas (si fueran necesarias).
ESCALAS PARA LA EVALUACIÓN DEL DOLOR5
Son los métodos más usados en la evaluación del dolor. Es un informe subjetivo que el paciente realiza, generalmente de la intensidad del dolor, y pueden ser de diferentes tipos:
-
Unidimensionales:
Escala descriptiva simple: escala verbal; clasifica el dolor en cuatro, cinco o más categorías (insoportable, intenso, moderado, leve o ausente). Permite confrontar el alivio producido por el tratamiento. Fácil de usar y de comprender por los pacientes.
Escala analógica visual (EVA): El paciente anota en la línea el grado de dolor. Uso universal, simple, rápido, aun cuando requiere cierto grado de comprensión y colaboración por el paciente. Buena correlación con escalas descriptivas, buena sensibilidad y fácilmente reproducible.
Expresiones faciales.
Escala de grises de Luesher.
Escala luminosa analógica (Nayman).
Termómetro de dolor de Iowa.
-
Multidimensionales4:
Edmonton Symptom Assessment System (ESAS)5: explora dolor, astenia, anorexia, ansiedad, depresión, nauseas, bienestar global, somnolencia y disnea.
Support Team Assessment Schedule (STAS): explora síntomas físicos, psicológicos, espirituales y sociales.
Palliative Outcome Scale: buena correlación con escalas de evaluación funcional y calidad de vida. Validada en castellano.
Cuestionario de dolor de McGill: mide la capacidad afectiva, sensitiva y cognitiva.
Brief Pain Inventory: mide parámetros de dolor que interfieren con la capacidad funcional.
TRATAMIENTO DEL DOLOR
La OMS publicó en 1986 en Ginebra una estrategia terapéutica para el control del dolor oncológico, documento denominado "Alivio del dolor en el cáncer" (Cancer Pain Relief), conocido como Escalera analgésica de la OMS4,5. Se han producido modificaciones, aunque la estructura básica no ha variado, llevándose a cabo su segunda edición en 1996. Con motivo del 20º aniversario, en 2006 se evaluó (debatiendo su origen, su vigencia, sus éxitos y limitaciones), reconociéndose que su difusión ha mejorado de forma sustancial el tratamiento del dolor.
Los aspectos a tener en cuenta en su uso son los siguientes:
Es necesario cuantificar la intensidad del dolor. Normalmente utilizamos escalas unidimensionales (EVA): 1-4 primer escalón; 5-6 segundo escalón; 7-10 tercer escalón.
La subida de escalón es debida a fallo terapéutico con dosis plenas de un fármaco6.
No implica que, ante un dolor difícil, no se pueda subir directamente al tercer escalón.
No asociar analgésicos del mismo escalón, excepto cuando asociamos fármacos de tercer escalón para dolor irruptivo. No utilizar analgésicos de segundo escalón en combinación con otros del tercer escalón.
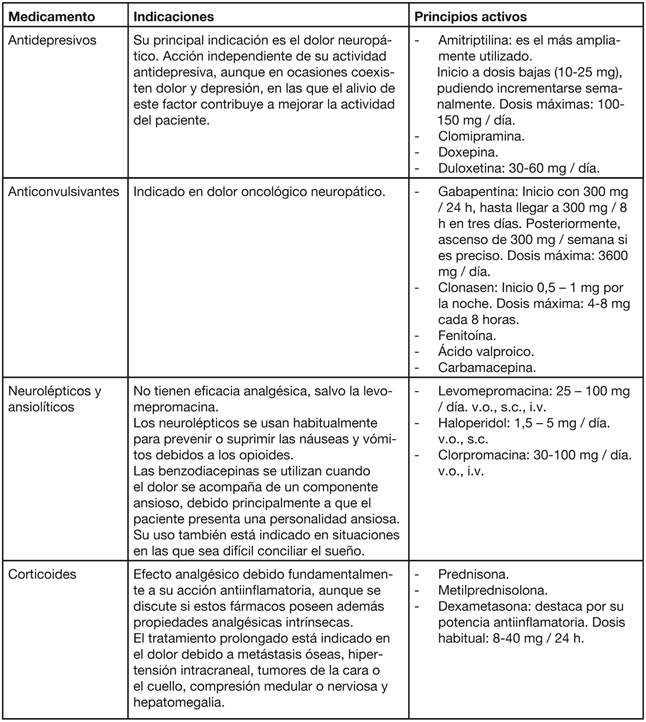
Los coadyuvantes se prescriben según la causa del dolor, siendo independientes de los posibles cambios de escalón terapéutico.
Los pacientes con buen control analgésico con opioides pueden necesitar dosis de rescate, que se estima entre 1/10 y 1/6 parte de la dosis total diaria.
Si se producen efectos secundarios severos o intolerables, se deberá cambiar el opioide. Es lo que se conoce como rotación de opioides.
Fármacos del primer escalón
Son analgésicos no opioides. Constituyen un grupo de medicamentos químicamente heterogéneos. Existe una dosis máxima diaria por encima de la cual no aportan mayor efecto analgésico (techo terapéutico).
| Medicamento | Dosis | Dosis máxima / día | Vías de administración |
|---|---|---|---|
| Paracetamol | 500-1000 mg / 4-6 h | 4000 mg | v.o., i.v., rectal |
| Ácido acetilsalicílico | 500-1000 mg / 4-6 h | 4000 mg | v.o. |
| Metamizol | 575-2000 mg / 6-8 h | 6000 mg | v.o., i.v., i.m. |
| Ibuprofeno | 400-600 mg / 6-8 h | 2400 mg | v.o. |
| Dexketoprofeno | 25-50 mg / 8-12 h | 150 mg | v.o., i.v., i.m. |
| Naproxeno | 250-500 mg / 8-12 h | 1500 mg | v.o. |
| Diclofenaco | 50 mg / 8-12 h | 150 mg | v.o., i.m., rectal |
| Meloxicam | 7,5 mg / 12 h | 15 mg | v.o., i.m., rectal |
| Lornoxicam | 8 mg / 12 h | 16 mg | v.o. |
| Celecoxib | 200 mg / 12 h | 400 mg | v.o. |
| Etoricoxib | 60 mg / 24 h | 120 mg | v.o. |
v.o.: Vía oral. i.v.: Intravenosa. i.m.: Intramuscular.
No existe evidencia que demuestre superioridad de un antiinflamatorio no esteroideo (AINE) respecto a otro. Están indicados en el dolor leve-moderado nociceptivo. Potencian la acción analgésica de los opioides en el dolor moderado-intenso7.
Los efectos adversos de los AINEs incluyen manifestaciones gastrointestinales (dispepsia, pirosis, ulcus gastroduodenal, hemorragia), renales (insuficiencia renal, nefritis intersticial, síndrome nefrótico y necrosis papilar), pulmonares (broncoespasmo), hematológicas (interfieren en la agregación plaquetaria) y reacciones de hipersensibilidad (shock anafiláctico, urticaria).
Fármacos del segundo escalón
Son los opioides débiles: codeína, dihidrocodeína, dextropropoxifeno y tramadol. Existen preparados de formulación única y simple, o en combinación fija con analgésicos antipiréticos o antiinflamatorios, y preparados de liberación retardada.
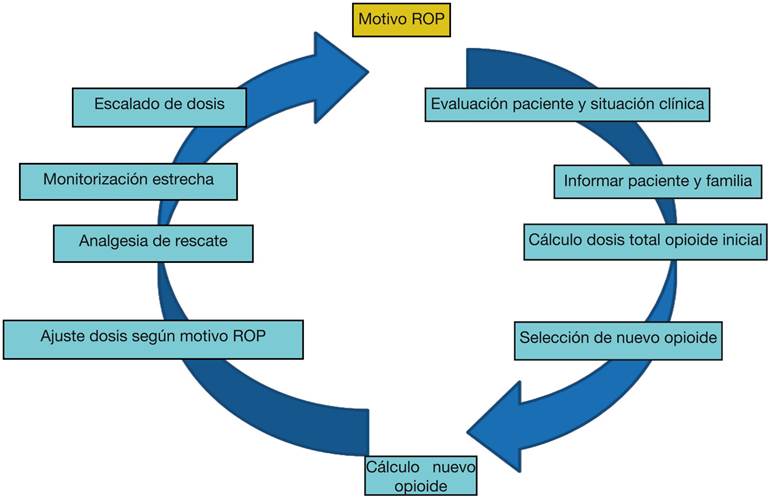
Rotación de opioides
Se puede definir como la sustitución del opioide previo por otro, con el objetivo de obtener un equilibrio entre la eficacia analgésica y la aparición de efectos secundarios. La rotación de opiáceos está indicada en los siguientes casos:
Mal control del dolor, a pesar de la titulación adecuada de un opioide mayor.
Tolerancia e hiperalgesia.
Toxicidad secundaria a opioides9.
Efectos adversos
Siempre debemos prever los efectos secundarios10:
Estreñimiento: reacción adversa más frecuente, considerada y prevenida sistemáticamente, utilizando laxantes de acción osmótica como primera medida. Si a pesar de ello persiste, se utilizarán laxantes estimulantes. Si existe impactación fecal, se administrará un enema rectal o se procederá a la desimpactación manual. Este efecto adverso aumenta en personas encamadas, que realizan poco ejercicio, ancianos y pacientes con patología gastrointestinal.
-
Náuseas y vómitos: su incidencia oscila entre el 10 y el 40 %, especialmente tras administrar las primeras dosis de opioides, aunque, se crea tolerancia con relativa facilidad. Se producen por estimulación de la zona gatillo quimioreceptora situada en el suelo del cuarto ventrículo y por sensibilización del aparato vestibular.
Si las náuseas y vómitos son postprandiales utilizaremos antieméticos procinéticos, y si ocurren con el movimiento el fármaco de elección es la cinarizina. Si no se cumple ninguna de las dos condiciones anteriores, puede usarse haloperidol, corticoides o antagonistas de la serotonina.
-
Sedación y deterioro cognitivo: es obligatorio evaluar posibles alteraciones metabólicas o patológicas del sistema nervioso central.
Hay personas que se crean tolerancia con relativa rapidez y, pasadas las primeras dosis se recuperan; en otras, por el contrario, existe una gran susceptibilidad y persiste la sedación.
Depresión respiratoria: su riesgo es mínimo. Aparece cuando hay sobredosificación o cuando existen problemas respiratorios, ya que los opioides deprimen directamente el centro respiratorio y su sensibilidad al dióxido de carbono.
Neurotoxicidad por opioides (NIO)11: se debe a la acumulación de metabolitos tóxicos, que provocan hiperexcitabilidad neuronal, produciendo alteraciones cognitivas, delirium, alucinaciones, mioclonías, convulsiones, alodinia e hiperalgesia. Especialmente vulnerables a estos efectos son los pacientes ancianos o con factores de riesgo como insuficiencia renal o deshidratación.
Retención urinaria: es infrecuente.
Prurito: si aparece, se trata con antihistamínicos.
Sudoración: efecto secundario que puede tratarse con corticoides o anticolinérgicos.
Síndrome serotoninérgico: clonus, diaforesis, temblor, mioclonías...
-
Dependencia física y adicción: ambos efectos han contribuido a que los opioides se infrautilicen en numerosas ocasiones.
La dependencia física es la aparición de un síndrome de abstinencia con sus manifestaciones físicas cuando se interrumpe el opioide administrado de forma crónica, se reduce bruscamente la dosis, o se administra un antagonista en el curso de la administración crónica de un agonista puro.
La adicción implica un cuadro conductual y psicológico en el cual el sujeto se esfuerza por conseguir nuevas dosis de opioide que le permitan seguir notando sus efectos.
Es posible que en el transcurso de un tratamiento prolongado aparezca dependencia física; ésta no tiene por qué representar un problema médico si se tienen en cuenta las siguientes puntualizaciones:
Advertir al paciente que no suspenda ni reduzca la dosis con brusquedad.
Reducir lentamente la dosis.
Cuando sea conveniente suprimir el tratamiento, evitar los opioides antagonistas e incluso los agonistas/antagonistas mixtos.
En el contexto de un tratamiento con fines médicos, es muy raro que se produzca.
CONCLUSIÓN
Ante la elevada prevalencia del dolor como síntoma oncológico y las connotaciones que presenta, es preciso un adecuado diagnóstico y tratamiento; disponemos de herramientas validadas para ello.
Es preciso el conocimiento y manejo de los fármacos disponibles, así como de sus posibles efectos secundarios, para lograr el objetivo de control del dolor.