DELIRIUM
El delirium es un estado confusional agudo que se produce por una disfunción orgánica cerebral difusa. En la actualidad se prefiere el término delirium a otros utilizados hace años, como síndrome confusional agudo, encefalopatía o fallo cerebral1.
La importancia del delirium en pacientes con enfermedad avanzada o terminal es muy grande: no solo se trata del síntoma neuropsiquiátrico más frecuente, sino que causa un considerable distrés al paciente, su familia y el equipo terapéutico y se asocia a mayor mortalidad, mayor deterioro funcional y mayor porcentaje de institucionalización y reingresos2. Además, el delirium impide la toma de decisiones al paciente y es la primera de causa de sedación en pacientes paliativos3.
FRECUENCIA Y SUBTIPOS
El delirium es un síntoma muy frecuente en cuidados paliativos. Una revisión sistemática reciente indica que un 35% de los pacientes que ingresan en unidades de paliativos presentan delirium en el momento del ingreso4. Además, los estudios demostraban una mediana del 60% de desarrollo de delirium durante la hospitalización. En pacientes no ingresados, la incidencia era menor, en torno al 4-12%. Sin embargo, si hablamos de delirium en situación de últimos de días (lo que previamente se denominaba delirium terminal), la incidencia alcanzaba una mediana del 75%, con rango entre 58 y 88%.
Existen tres subtipos psicomotores de delirium: hiperactivo (con predominio de agitación), hipoactivo (con predominio de somnolencia) y mixto5. Los estudios que han evaluado la frecuencia de estos subtipos indican que el más frecuente es el hipoactivo (39%), seguido del mixto y el hiperactivo4. Esto tiene gran importancia, pues el delirium hipoactivo es el más difícil de detectar, y muchas veces se confunde con depresión6.
FISIOPATOGENIA Y CAUSAS
Aunque los mecanismos no están perfectamente definidos, el delirium parece estar mediado por un déficit colinérgico y un exceso dopaminérgico. Junto a ello, se han implicado citocinas inflamatorias producidas como respuesta a la enfermedad y otros neurotransmisores como el GABA y la serotonina7.
Las causas suelen ser múltiples en un mismo enfermo. Es especialmente frecuente cuando hay factores predisponentes (deterioro cognitivo, déficit sensorial, edad avanzada o episodios de delirium previos), y se producen uno o más factores precipitantes, como infecciones, deshidratación, trastornos hidroelectrolíticos, insuficiencia de órganos, afectación intracraneal o toxicidad por fármacos8.
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO
El diagnóstico del delirium es exclusivamente clínico. Se basa en la presencia de un cuadro de inicio brusco (horas o días) y curso fluctuante de alteraciones en la atención (dificultad para centrarse, fácil distracción, discurso errático, etc.) y en el nivel de alerta5. Junto a ello, pueden aparecer alteraciones perceptivas, como alucinaciones visuales o táctiles, y afectación de la memoria, de la orientación o del lenguaje. Es típico que todas estas alteraciones empeoren por la noche9.
Los criterios diagnósticos actualmente más aceptados son los del DSM-510 (tabla 1), pero existen otros instrumentos que facilitan el diagnóstico y en algunos casos miden la gravedad. Los más conocidos son Confusion Assessment Method (CAM), Memorial Delirium Assessment Scale (MDAS) y Delirium Rating Scale (DRS), aunque no hay evidencia suficiente para recomendar el uso sistemático de estos instrumentos como cribado en todos los pacientes. El CAM se creó basándose en los criterios DSM-III-R y es el instrumento más usado por su sencillez11 (tabla 2).
TRATAMIENTO NO FARMACOLÓGICO
El tratamiento del delirium debe individualizarse en función de la situación clínica y funcional del paciente, sus deseos y los de su familia. En situación de últimos días, el tratamiento será exclusivamente sintomático. En otras situaciones intentaremos un tratamiento etiológico, buscando factores precipitantes, ya que hasta un 30-50% de los casos de delirium en cuidados paliativos son potencialmente reversibles12. Buscaremos sobre todo causas que puedan tratarse: retención urinaria, impactación fecal, fármacos (opioides, psicofármacos, anticolinérgicos), alteraciones metabólicas (hiponatremia, hipercalcemia o hipocalcemia), hipoxemia, insuficiencias de órgano, infecciones, metástasis cerebrales y síndromes de abstinencia (benzodiacepinas, alcohol, tabaco).
Se han descrito protocolos multimodales con intervenciones dirigidas a mejorar la cognición, el ciclo sueño-vigilia y la orientación13,14. Entre estas intervenciones estarían las siguientes:
Determinar la disponibilidad y calidad de recursos (psicológicos, económicos, familiares) e identificar y controlar riesgos, según cuál sea el estado físico del paciente y su historial de conducta5,15.
Valorar el nivel de cognición (si atiende, si se concentra, si procesa la información, si su nivel de delirio es con desorientación temporal, espacial o personal; si verbaliza sin sentido, si hay agitación y alucinaciones), para así poder realizar orientación cognitiva, haciendo autoidentificación, identificación de los seres queridos y del lugar donde está, así como el día, mes, año y estación actual16.
Deben controlarse los factores ambientales: eliminar alfombras, objetos y muebles pequeños, prevenir caídas, disminuir los estímulos sensoriales (televisión, radio, luces, teléfonos, visitas, alarmas, etc.), hacer distinción entre el día y la noche, evitar en lo posible restricciones físicas, tener a la vista objetos familiares, calendario y reloj, no olvidar nunca las prótesis auditivas o visuales y proporcionar información sobre un ambiente tranquilo para paciente y familia17.
Ayudar en el autocontrol del pensamiento distorsionado y respetar el mundo subjetivo del paciente. Si hay agitación, utilizar la distracción en lugar de la confrontación para manejar el comportamiento18.
Manejo de las alucinaciones: proporcionar el nivel de vigilancia y supervisión adecuado para controlar al paciente, intentando establecer una relación interpersonal de confianza con él. Si el paciente no es capaz de controlar su conducta, se debe favorecer el descanso de los cuidadores, alternando y planificando el cuidado.
Junto a lo anterior, se pueden usar terapias de relajación táctiles, mantener rutinas diarias constantes y transmitir confianza, seguridad y disponibilidad por parte del equipo terapéutico, bien de forma presencial o telefónica para resolver dudas5.
TRATAMIENTO FARMACOLÓGICO
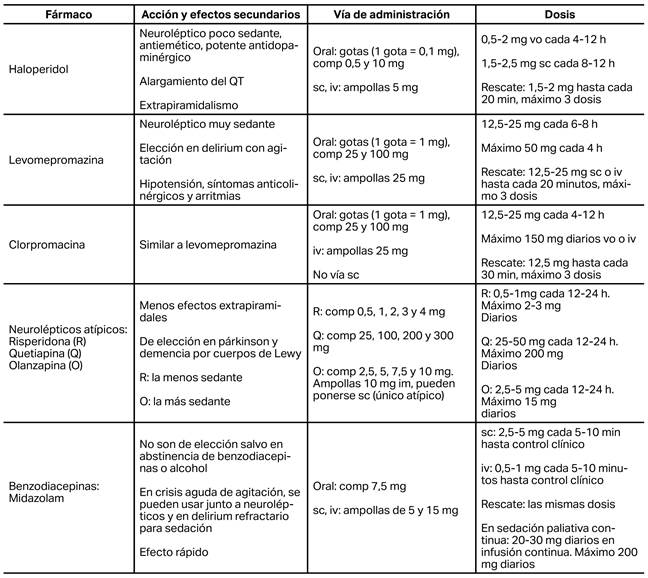
Los neurolépticos son los fármacos de elección, aunque existe evidencia clínica limitada sobre su uso en cuidados paliativos19. Debe tratarse solo el delirium hiperactivo: no existen datos que avalen el tratamiento sintomático del delirium hipoactivo con neurolépticos ni tampoco con psicoestimulantes como metilfenidato o modafinilo20.
Los fármacos más utilizados y sus características se recogen en la tabla 3.
INTRODUCCIÓN
Un 50-70% de los enfermos paliativos van a precisar el uso de la vía subcutánea a lo largo de la evolución de su enfermedad, y este porcentaje aumenta en situación de agonía23.
Pero pensar que la vía subcutánea queda relegada exclusivamente al tratamiento de pacientes en situación de final de vida es limitar una herramienta que puede ser muy resolutiva para la práctica diaria en las consultas y urgencias de Atención Primaria. Es una posibilidad a tener en cuenta en múltiples situaciones24.
La técnica consiste en la administración de medicación o fluidos a través de un catéter o aguja (palomilla) en la hipodermis, capa más profunda de la piel. Esta capa presenta pocos receptores del dolor, tiene gran capacidad de distensión y está muy vascularizada, lo que facilita la absorción de la medicación25.
VENTAJAS
Se trata de una técnica segura, poco agresiva y poco dolorosa. Sencilla, de mantenimiento fácil, ya que no precisa ser heparinizada ni ser manejada por personal sanitario, lo que permite su uso en el domicilio, dando mayor autonomía al paciente y favoreciendo la disminución del número de ingresos y del coste sanitario.
Presenta una biodisponibilidad similar a la vía intravenosa, cercana al 100%. Permite la mezcla de ciertos medicamentos que se pueden administrar juntos (en caso del uso de infusores)23,24,26-28
COMPLICACIONES
Muy baja incidencia, en torno al 2-3%. Las más frecuentes son de tipo local: enrojecimiento, edema, induración, dolor local, salida accidental del catéter, reacción alérgica al material, hematomas o abscesos en zona de inserción. En ese último caso, se recomienda cambiar la zona de inserción, evitar fármacos irritantes, reducir el volumen de administración o la velocidad de infusión. De forma menos frecuente, se puede producir necrosis cutánea (sobre todo por el uso de algunos antibióticos)23,27,29.
En caso de reacciones locales repetidas, se puede administrar, junto con la medicación, 25-100 mg de hidrocortisona.
LOCALIZACIONES
La localización habitual para su colocación es la zona infraclavicular, muy útil en infusión continua. La zona deltoidea suele usarse para medicación en bolos; la zona abdominal es de elección en hipodermoclisis por su gran superficie de absorción; la zona escapular es útil en pacientes agitados por no ser fácilmente accesible por el paciente. La cara anterolateral del muslo resulta algo más dolorosa23-27,29,30.
A la hora de elegir la zona de inserción, habrá que tener en cuenta las preferencias del paciente (por la movilidad, no colocarla en el lado sobre el que se acueste, etc.) y del cuidador, así como los fluidos que se van a administrar.
Se debe evitar su colocación en región umbilical, zonas con pliegues o con vello excesivo, sobre prominencias óseas, áreas edematosas o infiltradas por el tumor23-27,29-31.
Se recomiendan cambios en el lugar de punción en el sentido de las agujas del reloj. En cuanto a la duración, las palomillas de teflón duran una media de 12 días, y las metálicas, 5-6 días, dependiendo también de la medicación administrada, el volumen y le frecuencia de uso27.
MÉTODOS DE ADMINISTRACIÓN
Se puede administrar la medicación en forma de bolos o en infusión continua.
La administración en bolos se utiliza para dosis puntuales, «rescates». No es necesario diluir previamente el fármaco, pero a veces, y para dejar la vía limpia, se recomienda «lavarla» con suero fisiológico 0,5 ml para evitar el espacio muerto. Se deben administrar volúmenes pequeños de 1-2 ml para evitar la sobrecarga de la zona. Se entrenará a la familia en el uso de la vía y se dejará la medicación bien etiquetada con nombre y dosis para evitar errores.
La administración en perfusión continua disminuye el número de manipulaciones, se pueden administrar volúmenes más altos (sin superar los 3 ml/hora), permite concentraciones constantes del fármaco y la administración de sueros (hipodermoclisis). Se usa habitualmente con bombas de infusión, que pueden ser: mecánicas o electrónicas, reutilizables, usadas en ámbito hospitalario y en las que se puede programar la velocidad; elastoméricos, de uso exclusivo para el mismo paciente (recargable, aunque recomiendan las casas comerciales que sean de un solo uso), ligeros, fáciles de llevar. Existen de diferentes volúmenes, una vez cargada la medicación ya no puede ser modificada y se va distribuyendo de forma continua y constante gracias a la presión positiva que ejerce el globo23-27,29,30,32.
El cálculo del volumen del infusor se realiza siguiendo la fórmula:
Vt (ml) = flujo (ml/h) x 24 h x n.º días
El volumen de líquido calculado se conseguirá añadiendo suero fisiológico a la suma de la medicación pautada, para el conjunto de los días de duración del infusor32.
HIPODERMOCLISIS
Es la técnica mediante la cual se administra sueroterapia por vía subcutánea. Entre sus ventajas, cabe mencionar que disminuye la incidencia de delirium y previene úlceras por presión, aunque su uso sigue siendo un tema controvertido.
No es eficaz para la sequedad de boca o la sensación de sed, puede aumentar las secreciones respiratorias y causar más tos, aparte de las reacciones locales ya comentadas. En muchas ocasiones, es la familia la que propone la hidratación del paciente, ya que considera que así el cuidado es mayor27,29,33-39.
Dado que no existe evidencia clara a favor o en contra, la decisión de iniciar o no esta técnica, ha de ser individualizada, y se ha de tomar la decisión de forma consensuada entre sanitarios y paciente/familia25,27,29,37-39.
Está contraindicada en casos de shock, alteraciones del equilibrio hidroelectrolítico, anasarca, alteraciones de la coagulación y caquexia extrema29.
Se administra 500-1.500 ml en infusión continua, por gravedad o en bomba de infusión, de suero fisiológico 0,9%, glucosalino al 33% o glucosado al 5%.
La infusión nocturna durante 12 horas es mejor tolerada27,29.
FÁRMACOS DE USO MÁS COMÚN POR VÍA SUBCUTÁNEA
En la tabla 4 se recogen los fármacos más usados por esta vía.
Algunos de estos fármacos pueden mezclarse, según su compatibilidad, la cual está recogida en la tabla 5. Cuantos más fármacos se añadan a una mezcla, más probabilidades de precipitación hay. Se aconseja no mezclar más de tres, aunque hay mezclas de cuatro o cinco fármacos compatibles y estables27,29:
Tabla 5. Compatibilidad de fármacos más usados en mezclas29.

C*: dosis de 15 mg de haloperidol y 30 mg de butilescopolamina máximo al día; C: compatible. I: incompatible.
Morfina + midazolam + butilescopolamina
Morfina + midazolam + levomepromazina
Morfina + midazolam + metoclopramida
Morfina + haloperidol + butilescopolamina
Morfina + haloperidol + midazolam
Morfina + haloperidol + midazolam + metoclopramida
Morfina + haloperidol + midazolam + butilescopolamina
Morfina + midazolam + butilescopolamina + metoclopramida
Morfina + butilescopolamina + metoclopramida + haloperidol
Morfina + haloperidol + midazolam + metoclopramida + butilescoplamina
CONCLUSIONES
La vía subcutánea es de fácil manejo, sobre todo en el ámbito domiciliario, muy útil en el control de síntomas en pacientes paliativos, e incluso en patologías agudas o crónicas que se puedan beneficiar de esta técnica, con un amplio arsenal terapéutico, que requiere pocos cuidados y no precisa un manejo por parte del personal sanitario tras un correcto adiestramiento de pacientes y/o familiares y presenta pocas complicaciones.
Tras la revisión bibliográfica, hemos comprobado que la gran mayoría de fármacos no tiene indicación en ficha técnica para su utilización por vía subcutánea, siendo su uso off label. Se hace patente la necesidad de más estudios sobre los fármacos en su utilización por vía subcutánea y quizá su actualización en ficha técnica23,26,28.