INTRODUCCIÓN
Las hemorragias maculares son una acumulación de sangre que se produce en el espacio situado por debajo de la retina y suponen un desprendimiento hemorrágico de la retina neurosensorial o del epitelio pigmentario de la retina1. Las hemorragias maculares pueden ser secundarias a diversas enfermedades oculares, siendo la causa más frecuente la neovascularización coroidea (NVC). A su vez, la causa más frecuente de NVC es la degeneración macular asociada a la edad (DMAE)1-3 También pueden ser consecuencia de estrías angioideas así como de histoplasmosis. En algunos casos, pueden deberse a complicaciones de otras alteraciones oculares como macroaneurismas arteriales retiniales4, vasculopatías coroideas polipoidales idiopáticas5,6, complicaciones de una cirugía de retina convencional y de la realización de tratamientos de láser en la miopía7.
La presencia de sangre dentro de la retina es tóxica para el epitelio pigmentario y los fotorreceptores, produciendo degradación de los mismos. Esto se debe principalmente a que la sangre actúa como barrera que impide el flujo de nutrientes a la retina. Además, la contracción de la malla de fibrina produce tracción sobre los fotoreceptores y la presencia de hierro de la propia sangre produce toxicidad por los radicales libres formados de la reacción de Fenton. Los principales síntomas resultantes son la pérdida visual, que depende del grosor y espesor de la hemorragia, la aparición de un escotoma central y la metamorfopsia1.
Los estudios clínicos y experimentales respaldan el tratamiento inmediato, ya que puede ocurrir daño tisular en 24 horas por la escasa probabilidad de resolución espontánea. Sin tratamiento, el resultado habitual es la formación de una cicatriz macular que aumenta la pérdida de la agudeza visual1.
El tratamiento utilizado para esta patología es muy diverso pero se basa fundamentalmente en la utilización de fármacos antiangiogénicos como el bevacizumab o ranibizumab, agentes fibrinolíticos como la alteplasa, gas para el desplazamiento mecánico de la hemorragia o cirugía mediante vitrectomía1. La utilización de compuestos como bevacizumab, alteplasa, ranibizumab u otros se asocia a una mayor recuperación visual que cuando se intenta desplazar el coágulo únicamente con la inyección de gas. Esto se debe principalmente a que el gas solo desplaza el coágulo pero no consigue la lisis de éste, con lo que se produce un daño irreversible en la capa de fotorreceptores8,9. El uso de la preparación combinada de bevacizumab y alteplasa se ha utilizado con buenos resultados pues no solo induce a la regresión del proceso de NVC sino que también induce la reabsorción del coágulo1.
Las inyecciones intraoculares no son inocuas y se han relacionado con aparición de pseudoendoftalmitis, desprendimiento de retina, hemorragia intraocular, cataratas, uveítis, hipertensión ocular e incluso obstrucción vascular retiniana10,11. De ahí la conveniencia del uso de la preparación combinada que evita una inyección adicional disminuyendo los riesgos.
El estudio de Klettner12 referido a la compatibilidad del bevacizumab con la alteplasa en un modelo in vitro para el tratamiento de las hemorragias submaculares asociadas a DMAE comprobó que la estructura molecular de bevacizumab permanecía intacta y funcional. Además también confirmaron que el bevacizumab no se inactivaba ni con la alteplasa ni con la sangre. Este descubrimiento es clínicamente relevante ya que el bevacizumab podría haberse inactivado tanto con la aplicación combinada con la alteplasa como con las enzimas proteolíticas liberadas del coágulo.
Por otro lado, únicamente Treumer13,14 ha comprobado la utilidad clínica de la co-aplicación de estos dos fármacos a nivel subretiniano en dos estudios con series de 12 y 132 ojos respectivamente, en pacientes que padecían hemorragia submacular .
El objetivo del presente estudio es confirmar la efectividad y la seguridad de la preparación combinada de bevacizumab y alteplasa in vivo para el tratamiento de las hemorragias submaculares e intrarretinianas en pacientes con DMAE y determinar si supone una alternativa de tratamiento válida.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional retrospectivo en el que se incluyeron todos los pacientes con DMAE para los que se prescribió la terapia combinada de 1’25 mg de bevacizumab con 10 mcg de alteplasa para el tratamiento de las hemorragias submaculares o intrarretinianas desarrolladas. El período de evaluación fue desde febrero de 2017 a febrero de 2018.
El control y seguimiento se realizó a través de la historia clínica electrónica del paciente. Se revisó la situación clínica pre-intervención y a los 3 meses del tratamiento.
Las variables que se tuvieron en cuenta para determinar la efectividad del tratamiento fueron:
El tamaño de superficie de la hemorragia y su desplazamiento. Se determinó mediante el estudio de retinografías pre y post-intervención, considerando un 100% de ocupación si la hemorragia estaba presente en toda la superficie de la retinografía y de un 0% sino se apreciaba hemorragia.
El grosor retiniano obtenido por la tomografía de coherencia óptica (OCT).
La agudeza visual (AV). Se midió con una escala de menor a mayor agudeza determinada por la posibilidad de los pacientes de percibir luz (L) (nivel 0), movimientos de mano (MM) (nivel 1), contar dedos a un metro de distancia (CD) (nivel 2) o si presentaban visión de 0,05 (Snellen) (nivel 3). Se considera el nivel 0 con peor AV y el 3 con mejor AV.
La seguridad. Se determinó revisando los efectos adversos o sintomatología referida por el paciente, así como la aparición de signos de toxicidad retiniana tales como zonas pigmentadas o áreas de atrofia geográfica.
RESULTADOS
En el estudio se incluyeron cinco pacientes, 60% hombres, con una mediana de edad de 78 años (68-89). El número de ojos evaluados fue seis.
De forma objetiva, en todos los casos se consiguió el desplazamiento de la hemorragia con reducción de su volumen. El porcentaje mediano de ocupación de la hemorragia pre-intervención fue del 70% (50-90), siendo 100% si se observase ocupación completa en la retinografía estándar. Tras tres meses post-intervención se redujo hasta una mediana del 6% (0-10).
El grosor retiniano pre-intervención en 4 de los 5 pacientes fue de 1.531 micras (1.891-1.195) mientras que tras 3 meses post-intervención se redujo a una media de 516,8 micras (324-667). Podemos observar un ejemplo de esta disminución del grosor retiniano en la Figura 1 y 2, que muestra la OCT pre-intervención y post-intervención de un varón de 86 años.
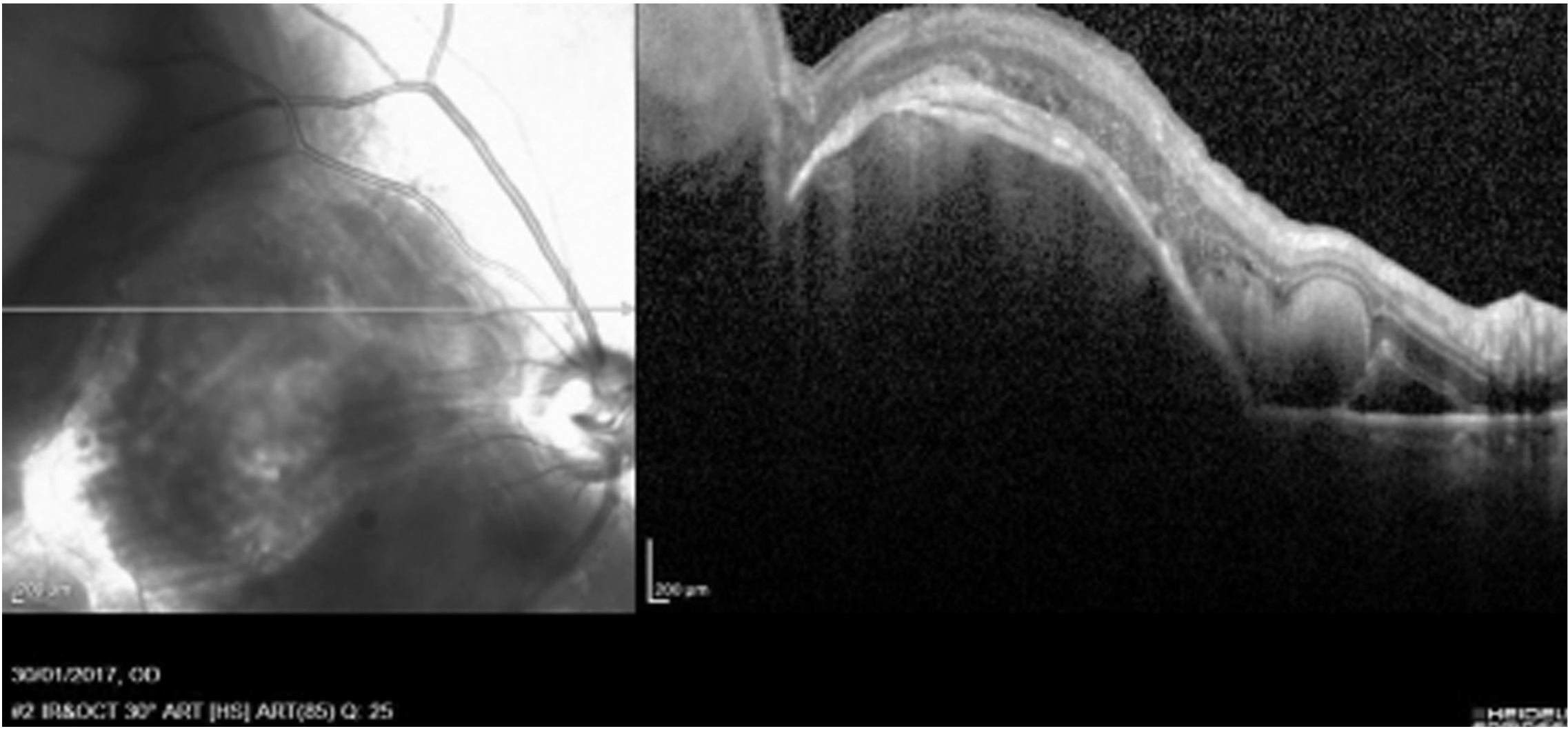
Figura 1. Epitelio retinal antes del tratamiento en varón de 86 años con antecedentes de DMAE en ojo derecho

Figura 2. Epitelio retinal menos engrosado tres meses después del tratamiento en varón de 86 años con antecedentes de DMAE en ojo derecho
En cuanto a la AV, se evaluó en 4 de los 5 pacientes. 3 de los pacientes observaban movimiento de manos (nivel 1) antes de la intervención y aunque 2 de los cuales no mejoraron la AV tras la intervención, el tercero mejoró llegando a contar dedos (nivel 2). En el cuarto paciente, su AV mejoró sustancialmente ya que pasó de observar luz (nivel 0) a contar dedos (nivel 2). En las Figuras 3, 4, 5 y 6 podemos observar las retinografías pre-intervención y post-intervención en dos pacientes, respectivamente, así como la hemorragia se ha desplazado y disminuido, y como ha variado la AV.
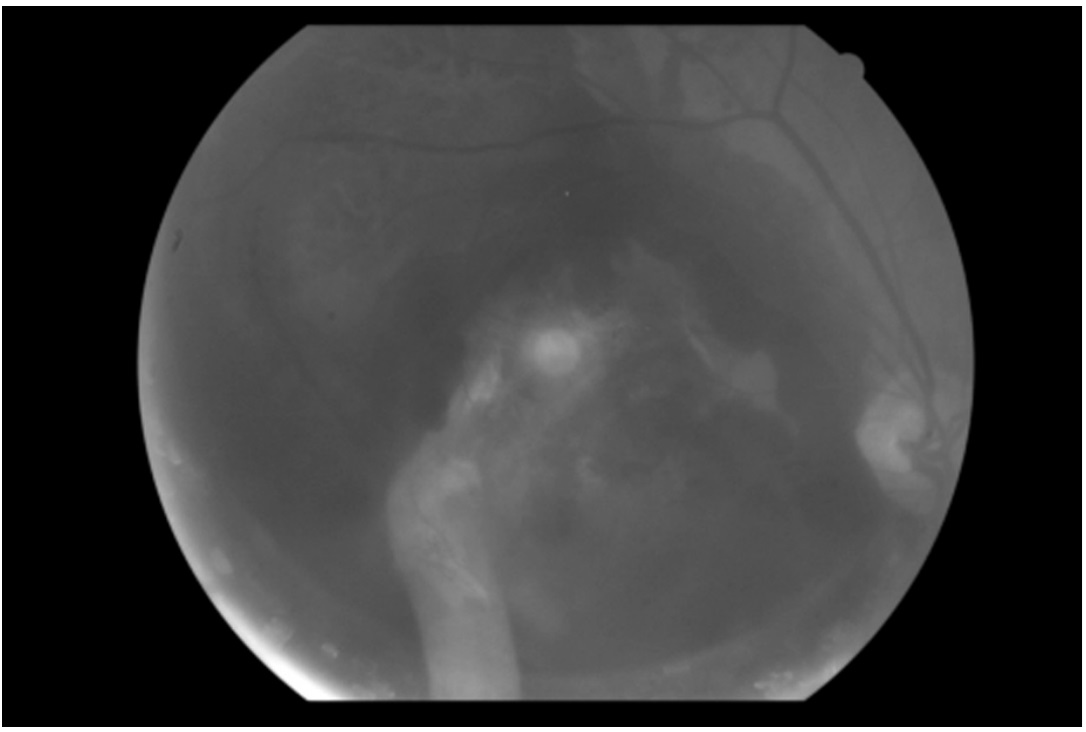
Figura 3. Ocupación de la hemorragia en fondo del ojo antes del tratamiento en varón de 86 años con antecedentes de DMAE en ojo derecho

Figura 4. Disminución de la ocupación de la hemorragia en fondo del ojo tres meses después del tratamiento en varón de 86 años con antecedentes de DMAE en ojo derecho
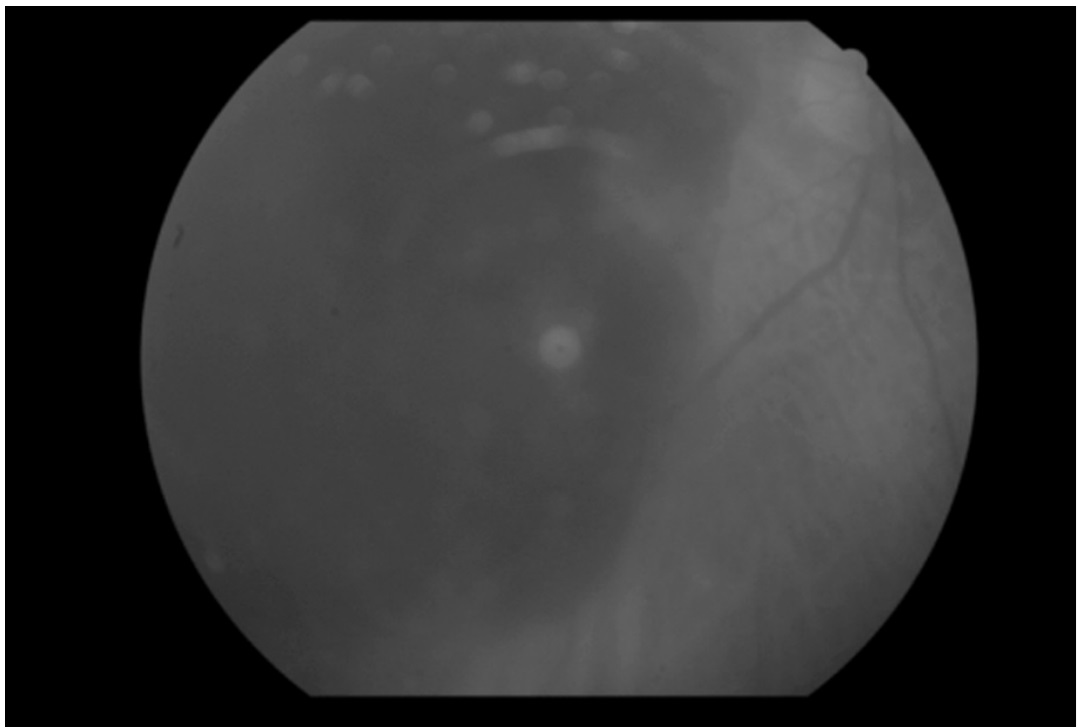
Figura 5. Ocupación de la hemorragia en fondo del ojo antes del tratamiento en varón de 68 años con antecedentes de DMAE en ojo derecho

Figura 6. Disminución de la ocupación de la hemorragia en fondo del ojo tres meses después del tratamiento en varón de 68 años con antecedentes de DMAE en ojo derecho
De forma objetiva, se consiguió en todos los casos desplazamiento de la hemorragia con reducción de su tamaño. A su vez, de forma subjetiva, todos los pacientes han referido apreciar una mejoría tras la intervención, con una reducción evidente del tamaño del escotoma. En la Tabla 1 podemos ver la evolución de la agudeza visual pre-intervención y post-intervención y la mejoría subjetiva apreciada por 4 de los 5 pacientes evaluados.
Tabla 1. Evolución de la agudeza visual pre y post-intervención y mejoría subjetiva apreciada
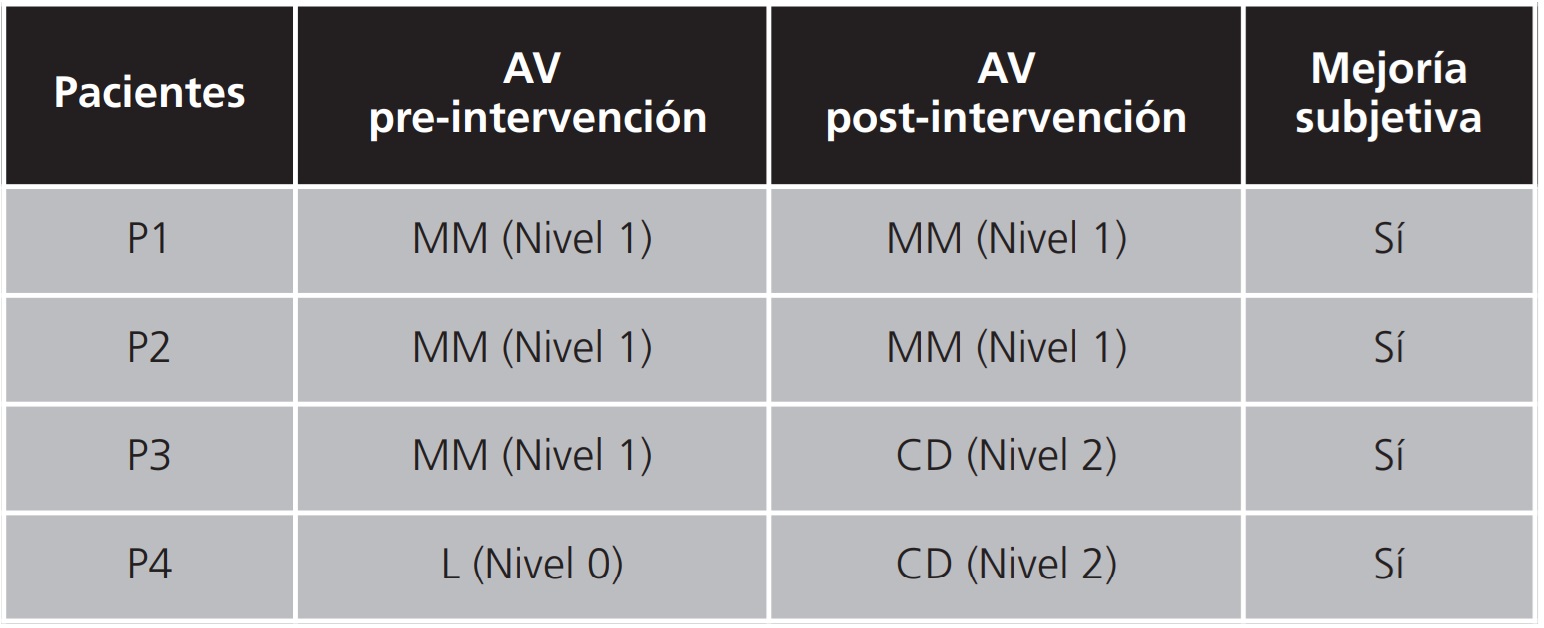
AV: agudeza visual.
La seguridad se evaluó con la no aparición de sintomatología y reacciones adversas. En ninguno de los 5 pacientes se observó aparición de alteraciones tras la intervención y seguimiento. Ninguno presentó lesiones retinianas sugerentes de toxicidad medicamentosa.
DISCUSIÓN
El pronóstico de los pacientes que presentan hemorragia subconjuntival o subretiniana es bastante comprometido por lo que el tratamiento ideal busca evitar el riesgo de complicaciones serias eliminando el coágulo con el menor daño posible a los fotorreceptores.
La alteplasa es un agente fibrinolítico eficaz en la lisis de coágulos sanguíneos. La administración dentro del polo posterior le permite alcanzar el espacio subretiniano, desplazando la hemorragia y minimizando la formación de la cicatriz, por lo que reduce la pérdida de agudeza visual del paciente8,9. Por otro lado, el bevacizumab es un anticuerpo monoclonal humanizado que tras unirse al factor de crecimiento del endotelio vascular, produce una regresión de la vascularización de la zona e inhibe la neovascularización, impidiendo así el crecimiento del coágulo15.
Es necesario la realización de estudios adicionales que permitan determinar la dosis y el régimen terapéutico óptimos, así como la estabilidad de la preparación, pues no existen estudios in vivo que lo corroboren y la cantidad de casos descritos son muy escasos1,12. Aun así, Klettner12 y su equipo estudiaron de forma in vitro el uso de la preparación combinada a dosis de 2 µg de alteplasa en 10 µl de solución salina con 250 µg de bevacizumab disuelto en 10 µl de solución salina, con un volumen total de 20 µl e incubados por 2 horas a 37ºC, demostrando su estabilidad. En nuestra experiencia hemos utilizado una dosis de 1,25 mg de bevacizumab 10 mcg de alteplasa tal y como describe Dinu Stanescu-Segall y colaboradores1. Además, el estudio de Klettner12 comprobó que ambos fármacos permanecían estables, al menos durante dos horas, cuando se unían en una misma jeringa y que su mecanismo de acción no se veía afectado.
Un estudio más reciente también ha demostrado la compatibilidad de alteplasa con otros fármacos como aflibercept o ranibizumab que, tras una electroforesis, se observó que no habían sufrido fragmentación molecular tras su unión con alteplasa y que además su acción anti-VEGF permanecía intacta16.
Así pues, una de las principales limitaciones de esta combinación de fármacos fue la estabilidad de la preparación. Pese a que hay una amplia bibliografía acerca de la estabilidad fisicoquímica y microbiológica de bevacizumab y alteplasa por separado, no se ha descrito como varían las condiciones al combinarlos y los datos proporcionados sobre su preparación y elaboración son muy limitados. Por ello, debemos asumir que se trataba de una preparación extemporánea de uso inmediato.
El resultado final es difícil de determinar pues las posibilidades de una mejoría pueden reducirse por la DMAE subyacente determinante de un pronóstico visual comprometido17,18. Pese a todo, tras nuestra experiencia, podemos demostrar in vivo la validez de este tratamiento, corroborando los hallazgos de Treumer13,14. Esto se puede demostrar por la disminución del tamaño, volumen y superficie de la hemorragia observada en todos los pacientes, función de la alteplasa y la ausencia de actividad neovascular, evidenciando la correcta actividad del bevacizumab. Además, la administración de la preparación combinada de forma intrarretiniana con buen resultado demuestra que es una alternativa válida a la vía intravítrea y pese a que es más invasiva, permite una administración de los fármacos más directa. Una de las ventajas de este tratamiento respecto a otros es que se evita una intervención con dos pinchazos intrarretinianos al paciente. Por todo ello se espera que este tratamiento se siga utilizando en el futuro ya que presenta una alternativa segura y efectiva.
CONCLUSIÓN
El uso de la preparación combinada de bevacizumab y alteplasa in vivo ha demostrado ser un tratamiento efectivo y seguro para los pacientes evaluados.
Ante la falta de bibliografía sobre la estabilidad de esta combinación de fármacos, el uso de la preparación debe ser inmediato. Aun así, su uso implica una única inyección para el paciente con la consecuente reducción de complicaciones inherentes a dichas inyecciones, por lo que ha supuesto una mejoría para su calidad de vida con rápida mejoría.
Conflicto de intereses:
Los autores declaran no tener conflicto de intereses.














