INTRODUCCIÓN
El tenofovir disoproxil fumarato (TDF) es un profármaco inhibidor de la transcriptasa inversa, análogo de nucleótido, potente antirretroviral indicado en el tratamiento del VIH-1 y de la hepatitis B. Generalmente, bien tolerado comparado con otros análogos de nucleótidos inhibidores de la transcriptasa inversa, sin embargo, su uso a largo plazo se asocia a nefrotoxicidad y reducciones de la densidad ósea atribuibles especialmente a los elevados niveles de fármaco en sangre1.
La cronicidad de la enfermedad VIH requiere como objetivos prioritarios mejorar la adherencia y la seguridad a largo plazo sin menoscabo de la efectividad del tratamiento antirretroviral (TAR).
En este contexto sale al mercado tenofovir alafenamida (TAF), un nuevo profármaco de tenofovir (TFV) cuya principal ventaja es la mejora del perfil de seguridad a nivel óseo y renal2-4, manteniendo la efectividad antirretroviral5. Esta mejora parece asociarse a la biotransformación de TAF donde existe un incremento de concentración de TFV intracelular y una reducción del 90% de niveles de TFV en plasma en comparación con TDF6. Este hecho permite la reducción de la dosis efectiva en la nueva sal de TFV pasando de 245 mg para TDF a 25 o 10 mg en TAF.
La última actualización de las guías elaboradas por el grupo de estudio del SIDA (GESIDA)7,8, proporciona recomendaciones para reemplazar por TAF los regímenes antirretrovirales que incluyen TDF. Esta recomendación es válida tanto para las coformulaciones que contienen solo la pareja emtricitabina/tenofovir disoproxil (FTC/TDF) como para las que, además de ella, incluyen como terceros fármacos a elvitegravir/cobicistat (EVG/c/TDF/FTC) o a rilpivirina (RPV/TDF/FTC)7.
No obstante en algunos casos no está recomendado este reemplazo por TAF: profilaxis postexposición donde permanece recomendado el uso de TDF/FTC y raltegravir (RAL)8 y en el caso de utilizar EFV en pacientes con tuberculosis que reciban rifampicina, donde la combinación recomendada continua siendo EFV/FTC/TDF, ya que TAF está contraindicado con rifampicina8.
Así, el intercambio paulatino de los tratamientos con TDF a la nueva formulación con TAF, se inicia con la disponibilidad de las presentaciones que incluyen TAF combinado con elvitegravir, cobicistat y emtricitabina (EVG/c/TAF/FTC), y TAF combinado con emtricitabina (FTC/TAF).
En este contexto, se realizó el presente estudio cuyo objetivo principal fue evaluar la seguridad, a nivel renal en vida real, del intercambio en el TAR de tenofovir disoproxilo a tenofovir alafenamida en pacientes VIH. Como objetivo secundario, se evaluó la efectividad del tratamiento antirretroviral tras dicho intercambio.
MATERIAL Y MÉTODOS
Estudio observacional restrospectivo que incluyó a todos los pacientes adultos diagnosticados de VIH pertenecientes al departamento de salud de Castellón tratados con TAF a los que se realizó previamente el intercambio de TDF a la nueva formulación con TAF. Se excluyeron del estudio aquellos pacientes sin, al menos, una analítica previa y una posterior al intercambio.
El intercambio se protocolizó y consensuó por el Servicio de Medicina de Enfermedades Infecciosas y el Servicio de Farmacia Hospitalaria, y fue aprobado por la Comisión de Farmacia del hospital. Este consenso interdisciplinar tuvo por objetivo que aquellos pacientes en tratamiento con EVG/c/TFD/FTC o FTC/TDF que acudieran a recoger la medicación se les pudiera realizar el intercambio desde el Servicio de Farmacia Hospitalaria, pudiendo así beneficiarse del tratamiento con TAF lo más pronto posible, y sin tener que generar una nueva visita médica para realizar el intercambio terapéutico.
Las opciones de sustitución para pacientes VIH o VHB podían ser de EVG/c/TDF/FTC a EVG/c/TAF/FTC, o bien de FTC/TDF a FTC/TAF.
En el primer caso el intercambio fue directo, sin embargo, en el segundo existen dos opciones según el tercer fármaco que completa el TAR: se realizó intercambio terapéutico de FTC/TDF 200/245 mg por FTC/TAF 200/25 mg si el tercer fármaco del TAR era no potenciador (dolutegravir, efavirenz, maraviroc, nevirapina, rilpivirina, raltegravir); si por el contrario el tercer fármaco estaba formulado con potenciador (atazanavir con ritonavir o cobicistat, darunavir con ritonavir o cobicistat o lopinavir con ritonavir) el intercambio se realizaba a FTC/TAF 200/10mg.
Se recogieron los datos analíticos de creatinina (Cr), urea y velocidad de filtración glomerular (VFG), calculada mediante la fórmula CKD-EPI9, para realizar el análisis de la seguridad a nivel renal antes y después del intercambio. Para evaluar la efectividad se recogieron de la misma manera las variables carga viral (CV) y linfocitos CD4 en sangre.
Las variables utilizadas en el estudio procedieron estrictamente de las analíticas rutinarias de seguimiento realizadas a los pacientes VIH dentro de la práctica clínica asistencial.
Además de estudiar de modo global a la población ya descrita, esta se dividió en dos subgrupos no comparativos en función del régimen de tratamiento con TAF utilizado por el paciente, cuyas medidas se realizaron en paralelo:
Grupo 1. Pacientes en tratamiento previo con EVG/c/TFD/FTC a los que se realizó el intercambio a EVG/c/TAF/FTC.
Grupo 2. Pacientes en tratamiento previo con TFD/FTC a los que se realizó el intercambio a TAF/FTC.
Se llevaron a cabo pruebas estadísticas no paramétricas ya que uno de los subgrupos tenía un tamaño muestral inferior a 30. Para medir si hubo diferencia estadísticamente significativa en variables cuantitativas tras el intercambio se llevó a cabo la prueba W de Wilcoxon para datos apareados con un intervalo de confianza del 95%.
La CV se midió de manera cualitativa binaria, considerando respondedores aquellos pacientes con un valor de CV <20 copias de ARN viral/mL y no respondedores, aquellos con CV ≥20 copias/mL. Para medir estas diferencias se utilizó la prueba estadística chi cuadrado.
Se calculó la mediana de linfocitos CD4 para pacientes respondedores y se realizó la prueba W de Wilcoxon con el fin de evaluar si había una variación en el número de linfocitos estadísticamente significativa.
Las variables numéricas se expresaron en medianas (Md), y la dispersión en rango intercuartílico (IQR). Las variables cualitativas se expresaron en porcentaje (%). El análisis estadístico se realizó mediante el software SPSS® para Windows versión 19.
RESULTADOS
Se obtuvo una muestra de 55 pacientes adultos con VIH en tratamiento con TAF. Con una Md de edad=49,5 (IQR= 44,7-52,9), donde el 58% fueron varones.
Los resultados de la población estudiada se resumen en las Tablas 1 y 2.
Tabla 1. Resultados de las variables de función renal obtenidos previos y posteriores al intercambio de toda la muestra, expresados en mediana, cuartil 1 y 3
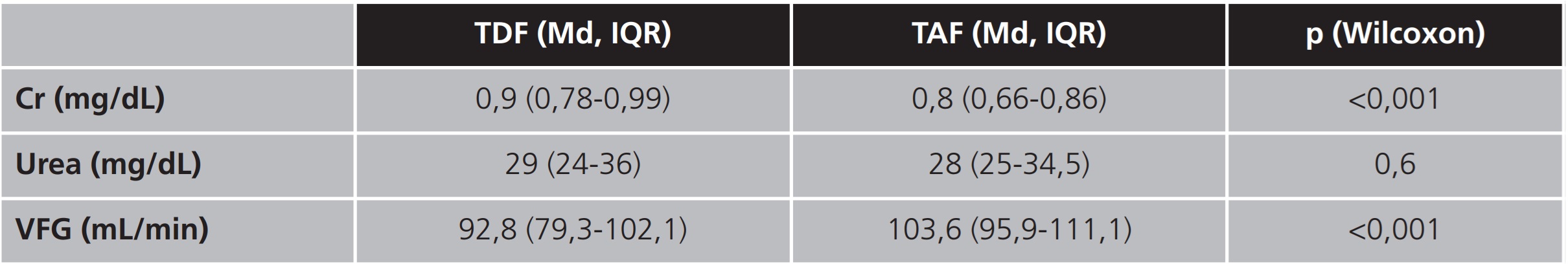
Cr: creatinina; IQR: intervalo intercuartílico; Md: mediana; TAF: tenofovir alafenamida; TDF: tenofovir disoproxilo; VFG: velocidad de filtrado glomerular
Tabla 2. Porcentaje de pacientes respondedores (carga viral inferior a 20 copias/mL) y mediana de linfocitos CD4/mcL de los pacientes de toda la muestra, antes y después del intercambio

CD4: línfocitos CD4; CV: carga viral; IQR: intervalo intercuartílico; mcL: microlitro; Md: mediana; TAF: tenofovir alafenamida; TDF: tenofovir disoproxilo; VFG: velocidad de filtrado glomerular; %: porcentaje.
El subrupo 1 incluyó a 23 pacientes en tratamiento previo con EVG/c/TFD/FTC a los que se realizó el intercambio a EVG/c/TAF/FTC, con una mediana de edad igual a 49,7 años (IQR=43,7-53,7). El tiempo transcurrido desde el inicio con TAF hasta la analítica posterior fue de Md=350 días (IQR=212-426), lo que equivale a 50 semanas.
Los resultados analíticos y de las pruebas estadísticas se presentan en las Tablas 3 y 4.
Tabla 3. Resultados de las variables de función renal obtenidos previos y posteriores al intercambio incluidos en el grupo 1, expresados en mediana, cuartil 1 y 3
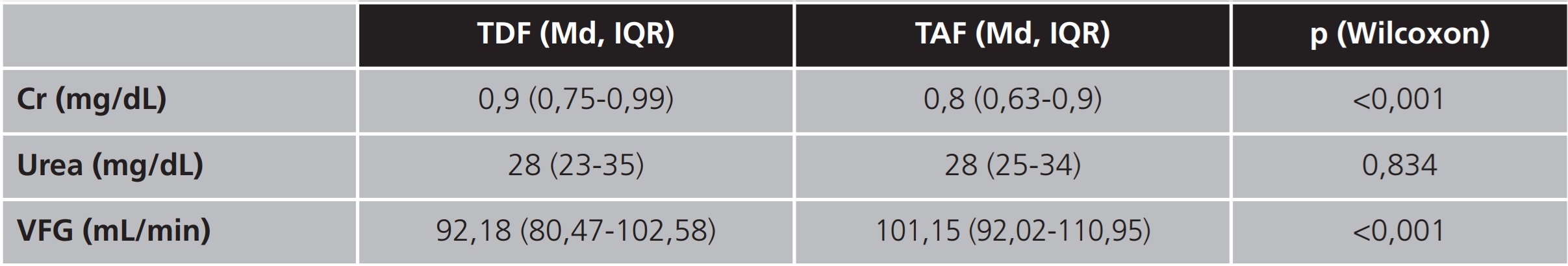
Cr: creatinina; IQR: intervalo intercuartílico; Md: mediana; TAF: tenofovir alafenamida; TDF: tenofovir disoproxilo; VFG: velocidad de filtrado glomerular.
Tabla 4. Porcentaje de pacientes respondedores (carga viral inferior a 20 copias/mL) y mediana (Md) de linfocitos CD4/mcL de los pacientes incluidos en el grupo 1, antes y después del intercambio

CD4: línfocitos CD4; CV: carga viral; IQR: intervalo intercuartílico; Md: mediana; TAF: tenofovir alafenamida; TDF: tenofovir disoproxilo; VFG: velocidad de filtrado glomerular; %: porcentaje
El subgrupo 2 incluyó a 32 pacientes en tratamiento previo con TFD/FTC a los que se realizó el intercambio a TAF/FTC, con una mediana de edad igual a 48,2 años (IQR=45,2-52,9). El tiempo transcurrido desde el inicio con TAF hasta la analítica posterior fue de Md=106 días (IQR=68 -140), lo que equivale a 15 semanas.
Los resultados del subgrupo 2 se encuentran en las Tablas 5 y 6.
Tabla 5. Resultados de las variables de función renal obtenidos previos y posteriores al intercambio con FTC/TAF
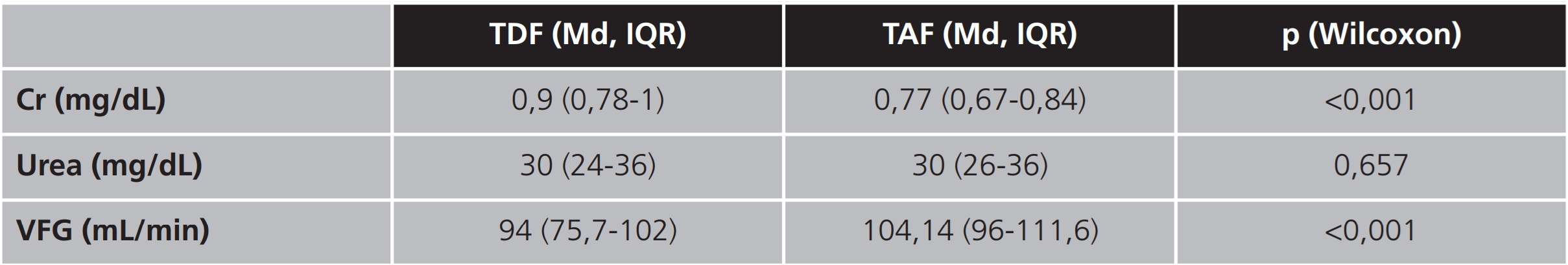
Cr: creatinina; IQR: intervalo intercuartílico; Md: mediana; TAF: tenofovir alafenamida; TDF: tenofovir disoproxilo; VFG: velocidad de filtrado glomerular.
Tabla 6. Porcentaje de respondedores y mediana de linfocitos CD4/mcL de los pacientes incluidos en el grupo 2 antes y después del intercambio

CD4: línfocitos CD4; CV: carga viral; IQR: intervalo intercuartílico; Md: mediana; TAF: tenofovir alafenamida; TDF: tenofovir disoproxilo; VFG: velocidad de filtrado glomerular.
DISCUSIÓN
La mejora en el perfil de seguridad renal del TAF frente a TDF se ha demostrado en estudios previos2-4 realizados en pacientes naive. En ellos, los pacientes se aleatorizan en dos brazos de tratamiento, TAF y TDF. La medida de la función renal se realizó en estos estudios mediante la ecuación del aclaramiento de creatinina de Cockroft-Gault. Se estableció que existía un mejor perfil de función renal estadísticamente significativo en aquellos pacientes tratados con TAF frente al brazo control, manteniéndose efectividad en cuanto a la respuesta.
Empiezan ya a aparecer los primeros ensayos clínicos tras intercambio de régimenes con TDF a TAF midiendo efectividad y seguridad5. El presente estudio trata de confirmar estos datos obtenidos en los estudios referenciados en cuanto a la función renal en una misma población de pacientes VIH a los que se cambia la sal de TFV de su tratamiento antirretroviral en vida real.
Por otra parte, esta población no ha sido estratificada por comorbilidades, ni por tratamientos anteriores o concomitantes, ni por sexo o edad. Se obtienen, por tanto, resultados para pacientes no seleccionados, pacientes en vida real.
En la evaluación de la seguridad se analizaron las variables de Cr, urea y VFG.
La VFG se ha estimado mediante la fórmula CDK-EPI, que aunque no es la utilizada en la bibliografía es la habitualmente empleada en la práctica clínica. En la mayoría de los estudios se ha utilizado como variable subrogada de la función renal el aclaramiento de creatinina calculado mediante Cockcroft Gault2-5. No existen comparaciones directas entre estas dos ecuaciones. En este estudio se utilizó CKD-EPI que, aunque tiene en cuenta menos factores que Cockroft-Gault ya que no contempla el peso, permite calcular la función renal con datos analíticos rutinarios (Cr, edad, sexo y raza).
Pese a que se evaluó la población total se consideró adecuado realizar el mismo análisis de la población por subrupos (subgrupo 1 y subgrupo 2) no comparativos debido a la diferencia temporal de dos años en la comercialización de EVG/c/TAF/FTC respecto a TAF/FTC. Teniendo en cuenta que el medicamento que contenía FTC/TAF (subrupo 2) estuvo disponible para su dispensación en el hospital en mayo de 2017, este grupo de pacientes dispuso de un menor tiempo de tratamiento con la nueva sal de TNF, respecto a los pacientes del subgrupo 1. Por este motivo, los datos analíticos del subgrupo 2 se obtuvieron a las pocas semanas del intercambio, nunca más de 24, frente a las 96 semanas evaluadas en el estudio con esta formulación3,4.
En la evaluación de la seguridad se encontró significación estadística en las variables de función renal: Cr y VFG, analizadas en el presente estudio. En ambos grupos, a pesar de la diferencia de tiempo entre ellos desde el intercambio hasta la analítica, se obtuvieron resultados similares, ya que se observó una reducción de los valores de Cr y, por tanto, un incremento en la VFG. Sin embargo, no sucede así en la variación de la urea, donde no se encontraron diferencias estadísticamente significativas en ninguno de los dos subgrupos.
Esto puede explicarse por el proceso de excreción de la urea, ya que el 90% es eliminada por el riñón por filtración, el 40-70% difunde pasivamente del túbulo al intersticio, y esta difusión se incrementa cuando menor es el flujo tubular. Por eso, la disminución del volumen urinario comporta un aumento de la reabsorción pasiva de la urea y una disminución en su eliminación. Estos datos y la variabilidad de urea en sangre dependiente de la ingesta y catabolismo proteico hacen que el cálculo del aclaramiento de urea no se utilice en la práctica clínica para calcular el filtrado glomerular. Parece ser que la urea tiene un papel más relevante en la enfermedad renal crónica (ERC) donde existe un aumento de la reabsorción tubular de urea (hasta un 40-50%) que determina que se infraestime el FG, ya que está compensado por la secreción tubular de Cr, la cual lo sobreestima. Por ello ambos parámetros adquieren más relevancia en pacientes con ERC10. Dado que la población de estudio no corresponde a este perfil de pacientes, sería conveniente tener en cuenta esta consideración.
Además, tal y como se ha observado de una manera similar en ambos grupos, hay una mejora de la función renal aun teniendo la variable tiempo en contra, ya que esta juega un papel inverso en la fórmula de CKD-EPI (a mayor edad del paciente menor VFG).
Aunque existe mejoría de los parámetros analíticos de la función renal cabe preguntarse si el estudio tiene una relevancia clínica significativa. En primer lugar, todos los pacientes incluidos en el estudio presentan una función renal dentro de la normalidad (mediana de VFG previas >90 mL/min), lo que se puede considerar como una limitación en cuanto a la evaluación de la función renal. Esta selección de población se debe a que la utilización de TFD no se recomienda en pacientes con insuficiencia renal moderada o grave. En este sentido y como posible aportación tras observar que los resultados sugieren una mejoría en los parámetros analíticos de seguridad de la función renal de una misma población, se podría empezar a valorar la utilización de TAF en pacientes con insuficiencia renal moderada sin requerir ajuste de dosis, ampliando el número de pacientes candidatos que se podrían beneficiar de este potente antirretroviral. Se requerirían efectuar estudios que afianzaran los parámetros analíticos de seguridad de la función renal en esta población en tratamiento con TAF.
Con estos datos, el TAF también podría valorarse como opción terapéutica ante un paciente con buena función renal y en tratamiento concomitante potencialmente nefrotóxico donde el TDF no se contemplaría.
Por otra parte, cabe mencionar que la evaluación de la efectividad también difirió de los ensayos clínicos citados en la bibliografía donde se definió paciente respondedor aquel con ARN viral <50 copias/mL en sangre. También se utiliza este mismo dato en las guías GESIDA para establecer el objetivo terapéutico7. En este estudio se consideró respondedor paciente con carga viral indetectable o menor 20 copias de ARN viral/mL plasma. Tras evaluar la efectividad parece que TAF no presenta peores resultados tras el intercambio que TDF, sino que parece haber una tendencia al aumento de pacientes respondedores. Sin embargo, cuando se evalúa la muestra completa no existen diferencias estadísticamente significativas.
En cuanto al recuento de linfocitos CD4 en pacientes respondedores se encontró que en el subgrupo 1 hay un ligero incremento que no se aprecia en el subgrupo 2. Si bien habrá que tener en cuenta que en el primero hay una mediana de 50 semanas de tratamiento mientras que en el segundo solo 15, pudiendo ser la persistencia un factor a tener en cuenta.
Entre otros factores que limitan los resultados de la efectividad se puede encontrar el hecho de no haberse evaluado la adherencia al tratamiento, y este es sin duda un sesgo relevante, ya que la adherencia tiene una repercusión directa sobre la efectividad.
Este estudio puede y debería ir ampliándose con la introducción en el mercado de nuevos combos con la nueva sal de tenofovir, como el recién comercializado: darunavir, cobicistat, emtricitabina y TAF.
CONCLUSIÓN
Este estudio, en vida real, sugiere que pacientes sin deterioro de la función renal previo tras el intercambio de TDF a TAF mantienen un buen perfil de seguridad con mejora de parámetros analíticos (Cr y VFG) sin perjuicio de la efectividad de su régimen antirretroviral, hecho relevante debido a la cronicidad de la enfermedad VIH y la necesidad de que los fármacos antirretrovirales sean lo más seguros posible a largo plazo.
Por supuesto, esto es un estudio limitado en el que convendría tener más datos sobre adherencia, polifarmacia y comorbilidades no contempladas aquí. De manera que para confirmar estos datos, sería recomendable la realización de estudios a más largo plazo e incluir un mayor tamaño muestral.














