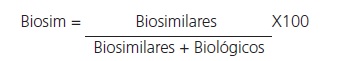Señor Director:
Los medicamentos biosimilares son más eficientes en comparación con los fármacos biológicos de referencia. Permiten reducir el coste global de las enfermedades que tratan al promover la competencia de precios entre especialidades. Su utilización es de suma importancia ya que garantiza la sostenibilidad del sistema sanitario, pudiendo destinarse el ahorro económico derivado de su uso, a la incorporación de nuevas terapias innovadoras.
En este sentido, la Consejería de Sanidad Universal y Salud Pública de la Comunidad Valenciana, en su “Estrategia para la reorientación y transformación de la política farmacéutica y productos sanitarios de la Comunidad Valenciana” destaca como una de sus líneas de actuación el fomento de los medicamentos biosimilares y genéricos cuyo papel resulta fundamental en la sostenibilidad del sistema sanitario, siendo las Comisiones de Farmacia y Terapéutica las que deberán adoptar las medidas necesarias para fomentar su uso eficiente dentro de los hospitales.
Así mismo, en los acuerdos de gestión de la Dirección General de Farmacia y Productos Sanitarios, se establece como uno de los indicadores, la penetración de biosimilares, definida como el porcentaje que representan los medicamentos biosimilares de uso hospitalario sobre el total de medicamentos biológicos de referencia y sus biosimilares adquiridos.
En este sentido, el presente trabajo tiene como objetivo analizar la penetración de biosimilares en un hospital universitario durante el período enero-junio 2018. Para ello se calculará la utilización de biosimilares aplicando la siguiente fórmula:
Donde, Biosim es el importe de las adquisiciones de medicamentos biosimilares de uso hospitalario. Biológicos es el importe de las adquisiciones de los medicamentos biológicos de referencia para los biosimilares incluidos en el numerador.
Los datos de adquisiciones se corresponden con el importe de las recepciones en Orion Logis®.
Los principios activos considerados han sido: eritropoyetina, etanercept, folitropina alfa, somatropina, filgrastim e infliximab.
También se registrará el porcentaje de prescripción de los fármacos estudiados por Servicios médicos.
Los resultados obtenidos en cuanto a porcentaje de utilización de biosimilares fueron los siguientes: eritropoyetina 34,10%, etanercept 5,06%, folitropina alfa 8%, somatropina 41,89%, filgrastim 100%, infliximab 100%.
El porcentaje de prescripción de los fármacos estudiados por Servicios se muestran en la Tabla 1.
A la vista de los resultados y comparando nuestros datos con los del resto de hospitales públicos de la Comunidad Valenciana1 para el mismo periodo observamos notables diferencias entre centros y medicamentos. Los fármacos biosimilares que mayor porcentaje medio de uso consiguen en la Comunidad Valenciana son filgrastim (91%), seguido por eritropoyetina (69%) e infliximab (67%). Los fármacos biosimilares que no consiguen superar un 15% de utilización son somatotropina (14%) y etanercept (9%).
En nuestro hospital, y gracias a los acuerdos tomados por la Comisión de Farmacia y Terapéutica se consigue una utilización total de biosimilares como, filgrastim o infliximab, en concordancia con las tendencias en el resto de hospitales.
Resulta interesante mencionar que el fármaco con menor penetración tanto en nuestro centro como en el resto de hospitales, es etanercept. En nuestro caso, únicamente se utiliza en pacientes de nuevo inicio, manteniendo el fármaco de referencia en aquellos pacientes que ya lo hubieran iniciado.
En los informes de resultados en salud en la Comunidad Valenciana todavía no se tienen resultados en salud comparables entre enbrel y los biosimilares. Como se comenta anteriormente, 90% de las prescripciones de etanerceptlas realiza el Servicio de Reumatología que se muestra reticente al cambio entre biosimilares. Ello podría estar relacionado con el posicionamiento de La Sociedad Española de Reumatología2 en cuanto a biosimilares. En el punto quinto del mismo se hace referencia a que “Actualmente no hay evidencias científicas sobre la eficacia y la seguridad del intercambio entre distintos biosimilares de un mismo fármaco de referencia”. Esta afirmación parece que no tiene en cuenta el proceso de autorización de biosimilares de la EMA en el cual se solicitan análisis de la inmunogenicidad del biosimilar frente al fármaco de referencia. Por ello, con la aprobación de un biosimilar, se garantiza que este no desencadena una inmunogenicidad mayor que la que se daría con un cambio en el proceso de fabricación del fármaco de referencia. Tanto es así que de esta regulación surgen las propuestas de países de la UE que se posicionan a favor del intercambio a biosimilares. Desconocemos si estos resultados pudieran estar influenciados por políticas comerciales. De hecho, en 2015 saltaron a la luz pública los despidos que se realizaron a directivos de Pfizer España por “conductas prohibidas en su código de buenas prácticas”3 e incumplimiento de la normativa de compliance del laboratorio por “intentar captar voluntades y fomentar el uso de este medicamento con argumentos más allá de los estrictamente científicos”4.
Ante la aprobación de un mayor número de fármacos biosimilares, la Comisiones de Farmacia deberán tomar las decisiones necesarias para que, basándose en la evidencia disponible y en las recomendaciones de la Consejeria de Salud, se garantice el uso eficiente de los fármacos biológicos.