INTRODUCCIÓN
Un pólipo intestinal es un tumor circunscrito a la pared del intestino que sobresale hacia la luz del tracto digestivo, independientemente de sus características histológicas.
La mayoría de los pólipos cursan de manera asintomática y se descubren en exploraciones endoscópicas rutinarias o hechas por otro motivo. Aun así, a veces, pueden manifestarse con síntomas como anemia, pérdida de sangre, moco en heces, hipopotasemia o alcalosis metabólica1. El cáncer colorrectal (CCR) se desarrolla a partir de una lesión premaligna (pólipo adenomatoso) en más del 70% de casos. La probabilidad de que un pólipo progrese a cáncer depende de diversos factores tales como la edad, el tamaño del pólipo y el porcentaje de componente velloso de este2. El cáncer colorrectal (CCR) es el cáncer más común en Europa y el segundo que más muertes por cáncer causa3. En España, es el segundo cáncer más frecuente, aproximadamente cada año se diagnostican 40.000 nuevos casos de CCR, de los cuales el 39% fallece por esta causa4. Las pruebas de cribado tienen el objetivo de detectar y resecar lesiones precursoras para lograr reducir la incidencia y la mortalidad por CCR. Como cribado del CCR se recomienda hacer el test de sangre oculta en heces (Test de SOHi) cada dos años a todas las personas mayores de 50 años sin síntomas que sugieran CCR. En personas con signos subjetivos de CCR (masa abdominal sospechosa palpable o visible por imagen radiológica, rectorragia con sangre oscura, pérdida de peso, cambios en el ritmo intestinal y/o ausencia de síntomas perianales) debe hacerse colonoscopia en un tiempo inferior a dos semanas. En aquellos pacientes con síntomas digestivos bajos de reciente aparición y que no cumplan criterios para la realización de una colonoscopia preferente se recomienda la realización de un Test SOHi. En caso de ser positivo se debe realizar una colonoscopia, en el caso contrario, se recomienda la derivación a especialista para valoración de pruebas complementarias4.
El método de diagnóstico de elección es la endoscopia digestiva, la cual permite la observación visual de los pólipos y su resección5. Varios estudios destacan la importancia de realizar la endoscopia en condiciones óptimas, utilizando los recursos necesarios para conseguir una visualización objetiva de los pólipos y reducir al máximo la subjetividad del endoscopista6. Para ello, se recomienda la utilización de endoscopios de alta definición7 así como el empleo de técnicas de cromoendoscopia, las cuales consisten en la aplicación tópica de colorantes para mejorar la visualización, identificación y caracterización de las lesiones8. Uno de los principales problemas a la hora de llevar a cabo la polipectomía es el conseguir mantener la elevación del pólipo hacia la luz intestinal durante el tiempo necesario para llevar a cabo su extirpación9. Para ello, las guías recomiendan la utilización de soluciones de inyección en submucosa, indicadas especialmente en la extracción de pólipos grandes (>20 mm) en los que dichas guías recomiendan la extirpación en bloque mediante disección submucosa endoscópica (DSE) o resección mucosa endoscópica mucosa (RME)10. La inyección de sustancias en la submucosa permite crear un habón debajo de la lesión que separa la mucosa de la capa muscular propia, lo que permite una mejor delimitación de la lesión y facilita su resección o disección. Por otra parte, al separar la mucosa de la capa muscular reduce la lesión térmica y el riesgo de perforación. Además, la adición de colorantes permite delimitar mejor los límites de la lesión.
Actualmente, este es un tema poco explorado tanto en el ámbito galénico como clínico, ya que las soluciones de inyección utilizadas no están caracterizadas ni protocolizadas y se basan en la práctica habitual del endoscopista o del centro hospitalario. Los productos utilizados se emplean sin indicación en inyección submucosa y se emplean mezclas de fármacos sin controles fisicoquímicos ni microbiológicos, lo que genera una alta probabilidad de variaciones en la técnica, así como un potencial riesgo para el paciente.
La actual revisión bibliográfica tiene como objetivo aportar una visión actualizada sobre las características de las soluciones de inyección utilizadas hoy en día en las polipectomías, así como visibilizar el papel de la formulación magistral hospitalaria en su desarrollo y optimización.
MÉTODOS
Este artículo presenta una revisión comprensiva de las diferentes soluciones de inyección submucosa empleadas en polipectomía endoscópica, sus principales características y sus aspectos galénicos. Para ello, se ha realizado una exhaustiva búsqueda de la literatura disponible en las bases de datos Medline, Scopus, Embase y Web of Science orientada a encontrar todos aquellos artículos científicos originales y revisiones que abarquen dicha temática. Por otra parte, se han localizado las principales patentes publicadas hasta la fecha, las cuales pueden ser abarcadas desde la farmacotecnia hospitalaria en futuras investigaciones.
Características idóneas de las soluciones de inyección
Las soluciones de inyección en submucosa son soluciones inyectables por lo que, consecuentemente, deben cumplir todos los requisitos inherentes a estas (esterilidad, limpidez, neutralidad, isotonicidad y apirogenicidad). Además, debido a que son mezclas de varios componentes, algunos de los cuales pueden no ser estériles, ya que su elaboración se haría en lotes para garantizar su disponibilidad en el hospital, pueden ser consideradas como preparaciones de alto riesgo según la “Guía de Buenas Prácticas de preparación de medicamentos en Servicios de Farmacia Hospitalaria” por lo que deben prepararse en salas blancas en los Servicios de Farmacia Hospitalaria y requieren de validación galénica obligatoria11, 12, 13.
Asimismo, este tipo de soluciones deben tener unas características especiales que las hagan idóneas para su función. La principal característica que deben cumplir estas soluciones es tener la consistencia y viscosidad adecuada para producir una elevación adecuada de la mucosa y que esta se mantenga el tiempo necesario para llevar a cabo la extirpación de los pólipos sin necesidad de inyectar la solución más de una vez. Al mismo tiempo, al introducirse a través de un catéter, es necesario que la solución tenga una reología que permita el flujo a través de este sin dificultad. Por ello, la solución idónea debe encontrarse en un punto de equilibrio entre buenas propiedades de flujo y buena consistencia9. Además, debe ser una solución que se adapte a su uso en una sala de endoscopias, por lo que debe ser una solución con una disponibilidad adecuada, una estabilidad fisicoquímica y microbiológica lo suficientemente elevada como para disponer de ella en stock14,15. Es importante también que la solución utilizada no produzca daño en la mucosa ni interferencias a la hora del análisis anatomopatológico de las biopsias10,16. Esto ocurre, por ejemplo, con las sustancias hiperosmolares, las cuales aportan viscosidad adecuada para este fin pero suelen producir daño tisular, retraso en la cicatrización de las úlceras de resección y reducción de la calidad de las muestras resecadas17. Los estudios demostraron relación entre la duración de la elevación y la viscosidad, pero no con la osmolaridad.
Por último, lo óptimo sería que la solución permitiese reducir al máximo las principales complicaciones de la polipectomía (sangrado y perforaciones) por lo que sería muy útil que la solución ideal estuviese dotada de algún componente que favoreciese la cicatrización y limitase los sangrados, como agentes vasoconstrictores o hemostáticos, así como de algún colorante que facilitase la visualización de la zona a extirpar10,17.
Propiedades de flujo de la solución y tiempo de elevación de la mucosa
La reología es la ciencia que estudia cómo se deforma y fluye la materia cuando se somete a una presión por lo que, consecuentemente, las propiedades reológicas de una sustancia están estrechamente ligadas con las fuerzas de unión de las partículas de dicha sustancia. De este modo, las propiedades de flujo de un líquido dependerán fundamentalmente de la viscosidad del medio de dispersión, la concentración de la fase dispersa, la forma y el tamaño de las partículas. Dado que dichas propiedades van a condicionar el comportamiento del líquido, en el diseño de una nueva solución de inyección es muy importante caracterizarlas.
Concretamente en el caso de las soluciones de inyección en submucosa, las características reológicas cobran vital importancia dado que se debe llegar a un punto de equilibrio entre unas buenas propiedades de flujo que permitan la administración de la solución a través de la aguja de inyección y su esterilización por filtración a través de filtro de 0,22 µm, así como una viscosidad adecuada que permita producir una elevación mantenida de la submucosa18.
Muchas veces este equilibrio es complicado de conseguir, por lo que podría ser de interés el uso de hidrogeles inteligentes. Los hidrogeles inteligentes son geles capaces de responder a determinados estímulos cambiando su forma, tamaño, volumen u otras características fisicoquímicas como conductividad, permeabilidad o viscosidad. Los estímulos que se pueden utilizar para provocar estos cambios pueden ser cambios de concentración de determinados iones (hidrogeles ión-sensibles), temperatura (hidrogeles termosensibles), pH o estímulos luminosos19,20.
Los endoscopios utilizados en las polipectomías son dispositivos que pueden tener hasta 230 cm de largo. Los más comunes contienen un canal de trabajo que varía entre los 3,2 mm hasta los 3,8 mm. A través de dicho canal de trabajo es posible la introducción del material necesario para la resección de pólipos como agujas de inyección o asas. Las agujas para la inyección de substancias presentan un calibre entorno a los 1,8 mm. Este espacio tan limitado genera una alta resistencia dinámica al flujo de la solución, por ello, las soluciones muy viscosas necesitan ser diluidas previamente para poder pasar sin complicaciones a través del catéter o bien se deben utilizar dispositivos de inyección que permitan ejercer una presión mayor para poder mejorar el flujo de la solución15.
Parámetros utilizados para la evaluación de las soluciones de inyección
Los parámetros más utilizados a la hora de evaluar la eficacia de las soluciones de inyección en los ensayos realizados en este ámbito son la resección en bloque, la altura de elevación del pólipo (mm), el tiempo de elevación (min), el número de inyecciones por lesión, el volumen de inyección total (ml) y la duración total del procedimiento (min). Para evaluar la seguridad, los parámetros más utilizados fueron la aparición de sangrados y otras complicaciones durante el procedimiento y durante los 3 meses posteriores, como visitas a urgencias, ingresos hospitalarios o necesidad de repetición de colonoscopia por sangrado.
Soluciones de inyección utilizadas
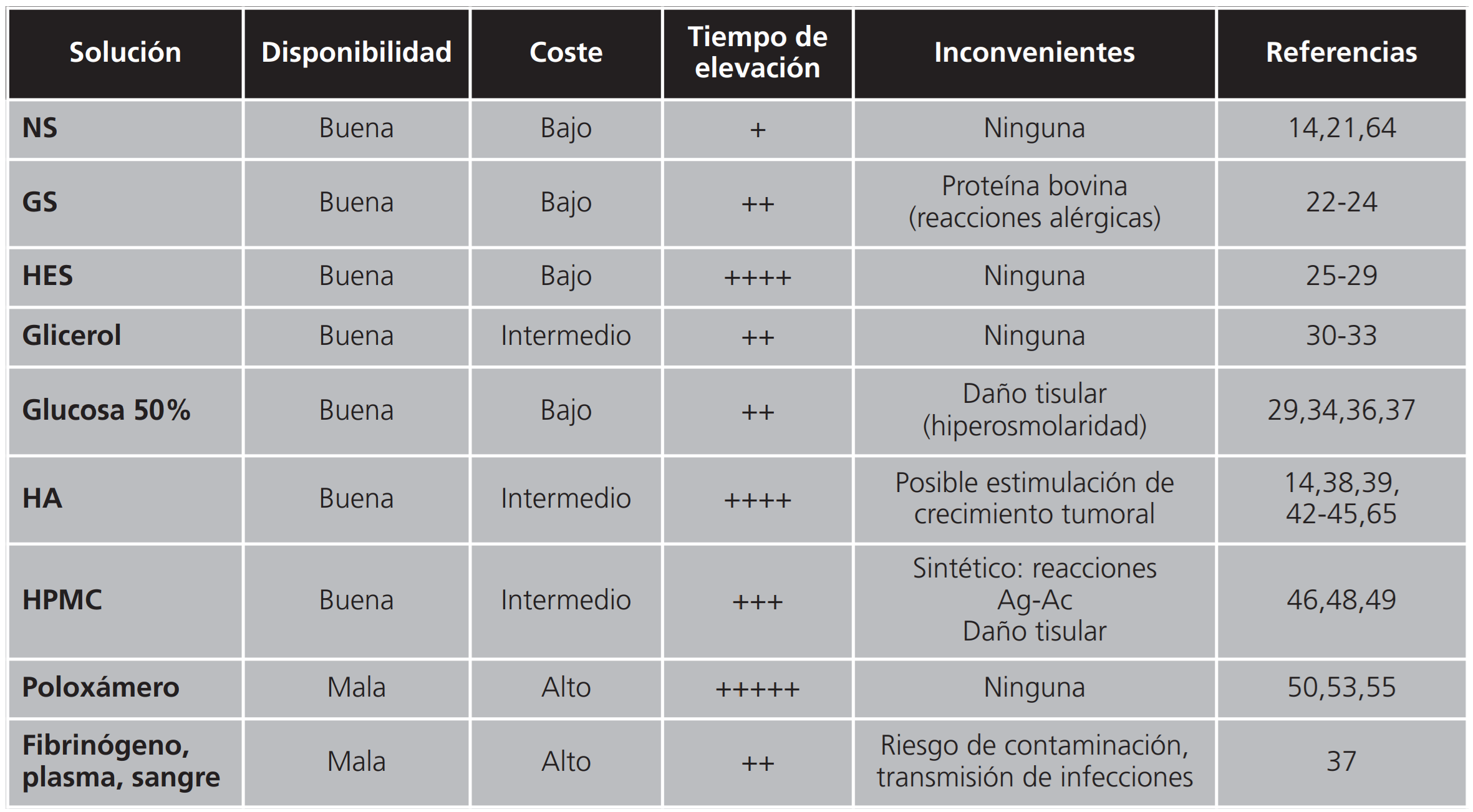
En la actualidad existen diferentes desarrollos, teniendo cada una de ellas sus ventajas y desventajas, tal como se puede apreciar en la tabla 1.
Solución salina 0,9% (SN)
Es la solución de inyección más comúnmente usada en RME. Se trata de una solución isotónica de osmolaridad aproximada de 308 mOsm/l y pH de 4,5-7 utilizada como disolvente y vehículo para la administración de medicamentos compatibles por vía parenteral, así como para el tratamiento de hiponatremia y alcalosis metabólicas hipoclorémicas. Está comercializado en envases de polietileno de diferentes tamaños y su administración por una vía diferente a la parenteral no está recogida en su ficha técnica21. La principal ventaja del uso de la solución salina como solución de inyección submucosa en polipectomías es la inocuidad, el bajo coste y la disponibilidad. Como principal inconveniente está el reducido tiempo de elevación de la mucosa, lo cual afecta especialmente en los procedimientos largos y no importa tanto en la resección de pólipos pequeños (<20 mm) ya que no es necesaria la elevación durante largos periodos de tiempo9,14.
Gelatina succinilada (GS)
Se trata de una solución coloidal de proteína modificada, usada comúnmente en clínica y disponible en España como Gelaspan® 40 mg/ml, comercializado en envases de polietileno de 500 ml. Este medicamento contiene gelatina succinilada (peso molecular de 26.500 daltons), cloruro de sodio, acetato de sodio, cloruro potásico, cloruro de calcio y cloruro de magnesio. La solución tiene una osmolaridad de 284 mOsmol/l y un pH de 7,4±0,3. Se trata de una solución clara y de color ligeramente amarillo indicada en el tratamiento de la hipovolemia y el shock que solamente está permitida su administración por vía intravenosa22. El uso de esta sustancia como solución de inyección submucosa para polipectomías se debe a que presenta mayor viscosidad y mayor peso molecular que SN, lo que limita la dispersión y reduce la reabsorción vascular, permitiendo un efecto más localizado y una mayor duración de la elevación. Existe el riesgo teórico de alergia a proteína bovina pero experimentalmente se ha usado sin presentar ninguna complicación23.
En un estudio comparativo frente a SN realizado a doble ciego en RME para lesiones ≥20 mm se vio que se reducía el número de resecciones por lesión (GS 3,0 (1,0-6,0) vs. SN 5,5 (3,0-10,0)), el número de inyecciones por lesión (GS 2,0 (1,0-3,0) vs. SN 3,0 (2,0-11,0)), el volumen de inyección (GS 14,5 ml (8,5-23,0) vs. SN 20,0 ml (16,0-46,0)) y la duración del procedimiento (GS 12,0 min (8,0-28,0) vs. SN 24,5 min (15,0-36,0)23,24. No se observó ningún efecto adverso relacionado con el uso de gelatina succinilada como inyección submucosa. En otro estudio realizado en cerdos también se comparó GS frente a SN observándose un aumento en la mediana del tiempo de elevación (GS 60 min vs. SN 15 min), una reducción de la duración media del procedimiento (GS 2,6 min vs. SN 2,5 min) y una mejoría en la puntuación de la facilidad de resección, resultando de 8 puntos con GS y 7 puntos con SN24.
Hidroxietil almidón (HEA)
El hidroxietil almidón es un coloide sintético no iónico derivado del almidón25. Está comercializado en España al 6% como Isohes® y Volulyte®, ambos contienen hidroxietil almidón de 130.000 Dalton y varios iones; cloruro sódico, cloruro potásico, cloruro magnésico y acetato sódico en el caso de Volulyte® y cloruro cálcico y ácido málico en el caso de Isohes®. Ambas soluciones comerciales están indicadas en el tratamiento de la hipovolemia como perfusiones intravenosas Pero no está recogido su uso por otra vía de administración26,27. En un estudio aleatorizado frente a SN, demostró aumentar el tiempo de elevación del pólipo (HES media 18.5 min vs. SN media 11.6 min) y reducir el tiempo total del procedimiento (HES 20.15 min vs. SN 22,8 min)28.
Por otra parte, en un estudio ex vivo en estómago porcino se observó superioridad de la solución de HES al 6%, ácido hialurónico al 0,4% y la solución Eleview® frente a otras siete sustancias en cuanto a tiempo de elevación y a la duración de la elevación. Además, presentó superioridad frente a hidroxipropilmetil celulosa (HPMC) en cuanto a área total resecada y tiempo total de procedimiento. No se vieron diferencias en cuanto a área de resección, volumen o número de inyecciones requeridas y tiempo en relación con Eleview®. Además, no se evidenciaron reacciones adversas ni complicaciones asociadas al uso de HES al 6%29.
Glicerol
El glicerol o glicerina es un triol con estructura de propano sustituido en las posiciones 1,2 y 3 por grupos hidroxil y peso molecular de 92,09 g/mol30. Es comúnmente utilizado como disolvente o detergente. En España solamente está comercializado como laxante en solución rectal.
Su uso como solución de inyección submucosa en polipectomías está descrito en algunos estudios como fórmula magistral, mezclando un 10% de glicerina y un 5% de fructosa en solución salina18,31. Presenta como principales ventajas la disponibilidad, el bajo coste y la no interferencia en el análisis anatomo-patológico. En un estudio comparativo de glicerol frente a SN se observó el aumento en el tiempo de elevación del pólipo de 3 min con SN a 7 min con glicerol in vitro. Se compararon también ambas sustancias en un estudio clínico y no se observaron diferencias estadísticamente significativas en cuanto a resección en bloque, aunque esta era ligeramente mayor en el grupo tratado con glicerol. No se observaron efectos adversos ni complicaciones32. En otro estudio clínico realizado, sí se vio una mejoría de la tasa de resección frente a SN, siendo del 63,6% en el grupo del glicerol y del 48,9% en el grupo de SN33.
Glucosa 50%
Es una solución hipertónica, de osmolaridad aproximada de 2770 mOsmol/l y pH de 3,5-5,5. Está comercializada en España en envases de polietileno de 20 ml, indicados en el tratamiento de la hipoglucemia34, o de vidrio de 500 ml y 1000 ml, utilizados principalmente como fuente de hidratos de carbono en la preparación de nutriciones parenterales35.
El hecho de que se trate de una solución más viscosa que SN, hizo pensar que resultaría más útil que este en su uso como solución de inyección submucosa para polipectomías.
En un estudio doble ciego en el que se comparó glucosa al 50% frente a SN no se observó diferencia en cuanto a porcentaje de resección completa en pólipos <30 mm pero sí se observó una mejoría en la tasa de resección de pólipos de mayor tamaño, en los cuales importa más el tiempo de permanencia de la elevación36.
En otro estudio se observó reducción en el volumen total de inyección y en el número de inyecciones de glucosa al 50% frente a SN, así como una mayor duración de la elevación (11 min con glucosa al 50% vs. 8 min con SN) y una reducción del tiempo total de procedimiento37.
Tiene como ventajas la disponibilidad y el bajo coste. El principal inconveniente reside en el potencial daño tisular debido a su alta osmolaridad29.
Ácido hialurónico (HA)
El ácido hialurónico es el glucosaminoglicano mayoritario del humor vitreo y un compuesto fisiológico de la matriz extracelular. Es un excipiente ampliamente usado en formas farmacéuticas tópicas, parenterales y oftálmicas. En solución acuosa presenta un pH de entre 5-8,5. No se han visto casos de toxicidad asociada a su uso hasta el momento38.
En España se encuentra comercializado como jeringas de 2 ml de administración intraarticular en dolor asociado a artrosis de rodilla y es un compuesto habitual en la composición de las lágrimas artificiales39. En Japón se encuentra comercializado como solución de inyección submucosa como MucoUp® (Seikagaku Corporation, Tokyo, Japan) compuesta por hialuronato sódico al 0,4%, cloruro sódico y agua18,40, que mostró eficacia y seguridad en varios estudios41.
Su eficacia como solución de inyección en técnicas de polipectomía se demostró en varios estudios, aumentado el tiempo de elevación y reduciendo el número de perforaciones14,42.
En un estudio doble ciego comparando HA al 0,13% con SN, se observó un aumento en el porcentaje de resección completa (79,5% con HA vs. 65,9% con SN) y un aumento en el número de procedimientos en los que se mantuvo la elevación durante periodos largos de tiempo (83,9% con HA vs. 54,1% con SN)43.
También se ha probado la asociación de ácido hialurónico con otros agentes. Concretamente, en un estudio en animales se observó la eficacia de un nuevo compuesto (Ziverel®) formado por ácido hialurónico, condroitin sulfato y poloxamero 407 de osmolaridad total de 20000 mOsm/l. En este estudio, se comparó el nuevo compuesto frente a gelatina succinilada (GS) y se observaron muestras de polipectomía más grandes y profundas y a una mejor elevación de lesión con el nuevo compuesto. No se evidenciaron daños tisulares a pesar de la elevada osmolaridad ni aumento en las complicaciones asociadas a la polipectomía44.
Los principales inconvenientes del uso de ácido hialurónico para este fin son el elevado coste y la disponibilidad18, así como la posibilidad de que estimule el crecimiento tumoral, ya que el HA es ligando del receptor CD44. Existe controversia sobre esto, en un estudio in vivo en ratones en el que se compararon animales tratados con HA y GS se observó un aumento de la expresión de CD44 y un aumento del crecimiento tumoral en el grupo en el que se utilizó HA. Sin embargo, estos efectos no fueron observados in vivo, según un estudio prospectivo realizado en 18 pacientes, en los que no se observó aumento de la expresión de receptores tumorales en el grupo tratado con HA45.
Hidroxipropilmetil celulosa (HPMC)
Es un derivado de la celulosa con propiedades viscoelásticas ampliamente utilizado como excipiente en fórmulas farmacéuticas tópicas y orales, cosméticos y productos alimentarios. Su peso molecular es aproximadamente 10.000-1.500.000 y en solución acuosa presenta un pH entre 5,5-846.
En un estudio realizado en cerdos en el que se comparó carboximetilcelulosa al 0,5%, hidroxipropilmetilcelulosa al 0,25 % y SN se observó un claro aumento de la duración de la elevación (12-60 min con HPMC y 10-43 min con carboximetilcelulosa vs. 8-37 min con NS)47.
Su eficacia en cuanto a la elevación de la lesión fue demostrada en varios estudios, en humanos se observó una duración de la elevación de 27 min de media con hidroxipropilmetil celulosa al 0,4%48, en cerdos se consiguió el mantenimiento de la elevación durante unos 36 min utilizando HPMC al 0,83%49.
En los estudios realizados también se demostró su seguridad, no produciendo efectos adversos ni complicaciones asociadas a su uso. Aun así, el hecho de que sea un producto sintético hace posible que genere reacciones antígeno-anticuerpo29 y se observó daño tisular con soluciones de HPMC a concentraciones >20%49.
Poloxameros (Eleview®, ORISE®)
Los poloxámeros son copolímeros no iónicos de polioxietileno-polioxipropileno utilizados en formulaciones farmacéuticas como agentes emulsionantes, solubilizantes, lubricantes o humectantes. Existen varios tipos en función de las cantidades relativas de etileno y propileno y sus propiedades físicas varían de unos a otros50,51. Los poloxameros más utilizados en las soluciones de inyección submucosa son el 188 (7.680-9.510 g/mol) y el 407 (9.840-14.600 g/mol). Ambos son sustancias sólidas, con un punto de fusión de 52-57ºC y solubles tanto en alcohol como en agua.
En 2017 se aprobó por la FDA y se comercializó una solución de inyección submucosa para utilización en polipectomías, patentada como SIC-8000 y comercializada como Eleview®52. Se trata de una microemulsión inyectable compuesta por agua, cloruro sódico, polaxamer 188, polyoxyl-15-hydroxystearate, ácidos grasos de cadena media y azul de metileno. Comparada con SN, demostró superioridad en cuando a tiempo de elevación, manteniéndose durante 45 minutos con Eleview®14. En un estudio realizado a doble ciego, se observó una disminución del volumen utilizado frente a SN (16,1±9,8 ml con Eleview® vs. 31,6±32,0 ml con SN), una disminución en el tiempo total de procedimiento (19,±16,8 min con Eleview® vs. 29,7±68,9 min con SN), un mayor porcentaje de resecciones en bloque (18,6% con Eleview® vs. 11% con SN) y no inferioridad en cuanto a seguridad y tasa de efectos adversos9,53. Eleview® mostró superioridad también frente a hidroxietilalmidón en cuanto a resección en bloque (9,3 vs. 8,1) y volumen total inyectado (14,8 mL con Eleview® vs. 20,6 mL con hidroxietilalmidón), aunque las diferencias no fueron estadísticamente significativas54.
En 2019 se publicó un artículo sobre la elaboración de un hidrogel binario que combina poloxamer 188 y 407 disueltos en SN y con un 0,2% de índigo carmín. En este artículo se destaca la capacidad de gelificación con modificaciones de temperatura del polaxamer y su aprovechamiento para este fin. Se elaboraron diferentes fórmulas con proporciones distintas de ambos poloxamer y se seleccionaron aquellas en las que la temperatura de gelificación estuviese entre 25-30ºC, resultando seleccionadas las soluciones de proporciones: P407/P188 17%/0,5% y P407/P188 18%/2%. Estas se probaron in vitro en estómagos de cerdo e in vivo en cerdos. Se obtuvo un tiempo de elevación del pólipo de 45 y 60 min, respectivamente. No hubo diferencias respecto a porcentaje de resección en bloque entre los dos grupos pero ambos mejoraron la técnica reduciendo el volumen utilizado y el tiempo total del procedimiento55. El principal inconveniente es el alto coste.
Eleview® mostró superioridad frente a SN, Eleview® sin poloxámero y MucoUP® en cuanto a bioadhesión en contacto con una matriz extracelular y capacidad para producir elevación ex vivo40.
ORISE® gel es una solución similar a Eleview® pero de otro fabricante (Boston Scientific) aprobado por la FDA en el 2018, con indicación como solución inyectable para polipectomías. Se comparó con Eleview® en cuanto a viscosidad, color, pH, osmolalidad y facilidad de inyección, resultando equivalente a este. Se comparó in vivo frente a Eleview® y SN comparando la elevación de la submucosa a diferentes tiempos, así como su seguridad y eficacia56,57. Hay descritos varios casos en los que la aplicación del gel provocó una reacción de tipo cuerpo extraño a los 2 meses de la polipectomía, denominado como “granuloma de elevación” que puede ser confundido con un granuloma de pulso o un amiloide58,59, la diferencia está en la ausencia de reacción tras tinción con rojo Congo60.
La mejora que aportan estos geles a la polipectomía todavía sigue siendo estudiado en ensayos clínicos61.
Fibrinógeno, plasma, sangre
Algunos hemoderivados se encuentran comercializados como medicamentos cuyo principio activo se obtiene a partir del plasma de donantes humanos sanos tras un proceso de fraccionamiento y purificación adecuado.
En España el fibrinógeno se encuentra comercializado como Riastap®62 en viales de 1g, indicados únicamente para su administración en perfusión intravenosa en el tratamiento de las hemorragias masivas con niveles bajos de fibrinógeno.
El plasma y la sangre no están comercializados, se obtienen a través de los Bancos de Sangre adheridos a cada centro sanitario.
El uso de hemoderivados en estos casos presenta la ventaja de que aportan un notable efecto hemostático y que presentan la viscosidad adecuada para facilitar el mantenimiento de la elevación del pólipo.
En un estudio ex vivo en estómago de cerdo se mostraron como buenas alternativas para elevar la mucosa. Los principales inconvenientes son la disponibilidad, el coste el riesgo de contaminación y transmisión de infecciones63.
Patentes publicadas
Las soluciones utilizadas hasta el momento en este ámbito dejan todavía un amplio campo de innovación, tal y como se ha expuesto. En consecuencia, son muchas las patentes publicadas sobre este tema, las más importantes de las cuales se recogen en la tabla 2.
Optimización de las soluciones mediante la adición de colorantes y agentes hemostáticos
La adición de determinadas sustancias adyuvantes a la solución de inyección puede contribuir a la prevención de las complicaciones más frecuentes de las técnicas de disección y resección endoscópicas: el sangrado y la perforación de la capa muscular10.
Excipientes utilizados en la reducción de sangrado
El sangrado puede ocurrir durante el procedimiento o después de este (normalmente en los 30 días siguientes a la intervención). En el caso de hemorragias posteriores, puede ser necesaria una segunda intervención para colocación de clips para frenar el sangrado.
Una forma de reducir el riesgo de sangrado es la adición de sustancias hemostáticas a la solución de inyección, técnica ampliamente recomendada por las guías de práctica clínica82. En una revisión sobre la eficacia de la utilización de adrenalina al 0,01% en la reducción del sangrado post-polipectomía se demostró la reducción de sangrados (OR=0,38, IC 95%: 0,21, 0,66; p=0,0006) y de hemorragias tempranas (OR=0,38, IC 95%: 0,20, 0,69; p=0,002) pero no se encontró beneficio frente a SN en sangrados tardíos. Además, en pólipos de más de 20 mm, se vio que los dispositivos de hemostasia mecánica (lazos o clips) son más efectivos que la adrenalina en la prevención del sangrado general (OR=0,33, IC 95%: 0,13, 0,87; p=0,03) y el sangrado temprano (OR=0,29, IC 95%: 0,08, 1,02; p=0,05)83. En otro estudió se vio que la combinación de clips y adrenalina resultaba más efectiva que la utilización de adrenalina en monoterapia84.
Otras sustancias como polidocanol o lauromacrogol 400 también se compararon con SN con adrenalina, observándose superioridad no significativa de polidocanol frente a adrenalina en la reducción de sangrados tempranos85.
Excipientes usados para mejorar la visualización pólipo
El segundo efecto adverso más importante es la perforación de la capa muscular. Esto puede prevenirse utilizando en la solución de inyección un colorante que permita delimitar mejor las lesiones mucosas y tras la resección de la lesión realizar una mejor valoración de la escara para descartar microperforaciones. Además, el colorante permite diferenciar la zona de resección (mucosa) de la muscular, que no se abomba al inyectar y se tiñe con mayor dificultad86. En algunos estudios se vio que el riesgo de perforación disminuía cuando se usaba el colorante87,88.
A lo largo de la historia, ha variado el tipo de colorantes utilizados y, según el tipo de técnica, se utilizarán uno u otro. Lo más habitual es su uso en técnicas de tinción de la superficie mucosa (cromoendoscopia) con el fin de mejorar la visualización de la topografía intestinal, realzar o delimitar las lesiones. Algunos colorantes también se utilizan con el objetivo de marcar la lesión previa a la cirugía89.
Existen diferentes tipos de colorantes. Entre los más destacados están:
- Tintes vitales o de absorción (lugol, azul de metileno, azul de toluidina o violeta cristal): permiten diferenciar distintos tipos de células epiteliales al penetrar en estas mediante absorción o difusión preferencial a través de la membrana celular.
- No vitales o de contraste (índigo carmín): no se absorben, se filtran entre las irregularidades de la mucosa ejerciendo un efecto topográfico.
- Reactivos (rojo congo, rojo fenol): reaccionan químicamente con componentes celulares específicos, dando lugar a cambios visibles.
- De tatuaje (tinta china o tinta india): se inyectan en la submucosa dando lugar a una marca permanente89.
Uno de los primeros colorantes utilizados en cromoendoscopia fue la tinta India, formada por etilenglicol, fenol, gomas y productos animales como gelatina. Se documentaron muchas reacciones inflamatorias y alérgicas a este producto. Se usó principalmente en el marcaje de lesiones esofágicas, por ejemplo, esófago de Barrett. Posteriormente, se usó otro colorante (Spot) basado en partículas de carbón muy finas y de alta pureza, agua, glicerol, polisorbato 80, alcohol bencílico y simeticona; este fue aprobado por la FDA para su uso como tinte de marcaje en endoscopias. Otros colorantes utilizados en este ámbito fueron azul de metileno, índigo carmín, azul de toluidina, azul de isosulfán, hematoxilina, eosina y verde de indocianina. En varios estudios de observó cómo todos estos colorantes eran reabsorbidos en menos de 48 horas, a excepción de la tinta india y el verde de indocianina90.
Hoy en día, el colorante con mayor evidencia en su utilización en cromoendoscopia para la visualización de pólipos es el índigo carmín, colorante de contraste que permite diferenciar pólipos hiperplásicos, con una superficie similar a la de la mucosa, de pólipos adenomatosos que tienen numerosos surcos o pliegues que se realzan con dicho contraste91. Se prepara a partir de la materia prima en polvo como fórmula magistral en los Servicios de Farmacia Hospitalaria. La concentración más habitual es al 0,4% y debe conservarse a temperatura ambiente y protegida de la luz. Suele aplicarse en forma de aerosol sobre la superficie intestinal en el momento de la endoscopia89.
El azul de metileno es el colorante más utilizado en el diagnóstico y seguimiento del esófago de Barett, aunque también se usa para la identificación de zonas de displasia y diagnóstico de metaplasias gástricas o intestinales. Se utiliza al 0,5% como solución acuosa para pulverización a través del catéter del endoscopio89. Se puede elaborar como fórmula magistral o se pueden utilizar las ampollas comerciales, indicadas exclusivamente en el tratamiento de la metahemoglobinemia92.
La tinta china se utiliza como colorante permanente para marcar las zonas de extirpación de pólipo, de forma que sea fácil reconocerlas en controles, nuevas extirpaciones o durante una cirugía de colon. Se realiza una inyección submucosa de la mínima cantidad de tinta posible, manteniéndose el tatuaje durante más de 10 años según los estudios89.
La concentración de colorante varía de unos estudios a otros. En cromoendoscopia suelen utilizarse concentraciones de entre 0,1-10% dependiendo del colorante utilizado. Sin embargo, cuando se incluye el colorante en la solución de inyección, es suficiente con concentraciones más bajas. Los más utilizados son índigo carmín y azul de metileno a concentraciones del orden de 0,001-0,01%16,87.
CONCLUSIÓN
Actualmente, la gran mayoría de las soluciones utilizadas para inyección submucosa en polipectomía se usan fuera de indicación en ficha técnica, ya que son fluidos destinados a su administración parenteral y comercializados para otras indicaciones. Además, estas soluciones son comúnmente manipuladas para adecuarlas a este uso, por lo que es importante destacar que la adición de excipientes o reconstitución de los mismos debería realizarse en condiciones asépticas en Servicios de Farmacia Hospitalaria11,12.
Es importante también destacar la necesidad de caracterización de las mezclas empleadas, tanto desde el punto de vista de la estabilidad fisicoquímica y microbiológica entre los diferentes componentes como por el estudio y la vigilancia de las posibles toxicidades inherentes a su uso.