INTRODUCCIÓN
Las reacciones adversas cutáneas graves como la necrosis epidérmica tóxica (NET), el síndrome de Stevens-Johnson (SSJ), la pustulosis aguda exantemática generalizada y las reacciones a fármacos con eosinofilia y sintomatología sistémica, presentan una alta mortalidad1.
El SJS y la TEN se caracterizan por una piel eritematosa, un extenso desprendimiento de la epidermis y erosiones en las membranas mucosas2. Ambas patologías podrían ser variantes de la misma enfermedad, que difieren en la gravedad de la superficie corporal afectada, aunque algunos expertos piensan que son enfermedades etiológicamente y patológicamente distintas3,4.
La incidencia (SJS y NET) global se estima de 2 a 7 casos por millón de personas5; siendo la mortalidad del 9%, 29% y 48%, respectivamente, para el SJS, SJS/NET solapados y NET1.
La identificación del agente etiológico puede ser difícil, aunque la biopsia de piel suele ser decisiva para el diagnóstico, no ayuda a establecer si la enfermedad está causada por medicamentos6.
Más de 220 medicamentos han sido relacionados con estas reacciones, siendo los principales causantes las sulfonamidas, anticonvulsivantes aromáticos, antibióticos betalactámicos, nevirapina; abacavir; antiinflamatorios no esteroideos, alopurinol, lamotrigina, tetraciclinas y quinolonas7.
A pesar de que los medicamentos son los factores etiológicos para la mayoría de los casos, también se han relacionado como causantes algunas infecciones respiratorias debidas a micoplasma pneumoniae e infecciones causadas por virus del tipo influenza2.
CASO CLÍNICO
Paciente mujer de 45 años de edad, sin antecedentes familiares de importancia y sin alergias medicamentosas conocidas, con los siguientes antecedentes médicos: hipertiroidismo, síndrome ansioso-depresivo, cefalea vasculo-tensional y con tiroidectomía practicada hace siete años.
La paciente ingresa en el Servicio de Neurología de su hospital de referencia diagnosticada de posible orbitopatía hipertiroidea vs. miositis orbitaria, siendo tratada con deflazacort y dada de alta por evolución favorable a los siete días.
Tras 28 días en su domicilio acude a Urgencias por reacción generalizada pruriginosa de 3-4 días de evolución sin indicar posible hecho desencadenante y sin responder a dexclorfeniramina vía oral. Presenta lesiones pápulo-eritematosas confluentes y pruriginosas diseminadas por tronco, extremidades y cuero cabelludo. No refiere uso de nueva medicación, alimentos ó productos dermato-cosméticos.
Se administran metilprednisolona y dexclorfeniramina intramusculares. El tratamiento en este momento consistía en deflazacort, levotiroxina, bromazepam, omeprazol, paracetamol y gluconato calcio/calcio carbonato/colecalciferol.
Se indica la sustitución en el tratamiento del deflazacort por prednisona y se deriva al Servicio de Dermatología, que tras valorar las lesiones cataloga el cuadro de posible NET solapada y decide ingreso. La biopsia cutánea determina la existencia de un eritema polimorfo que se trata con prednisona, hidroxicina y ácido fusídico.
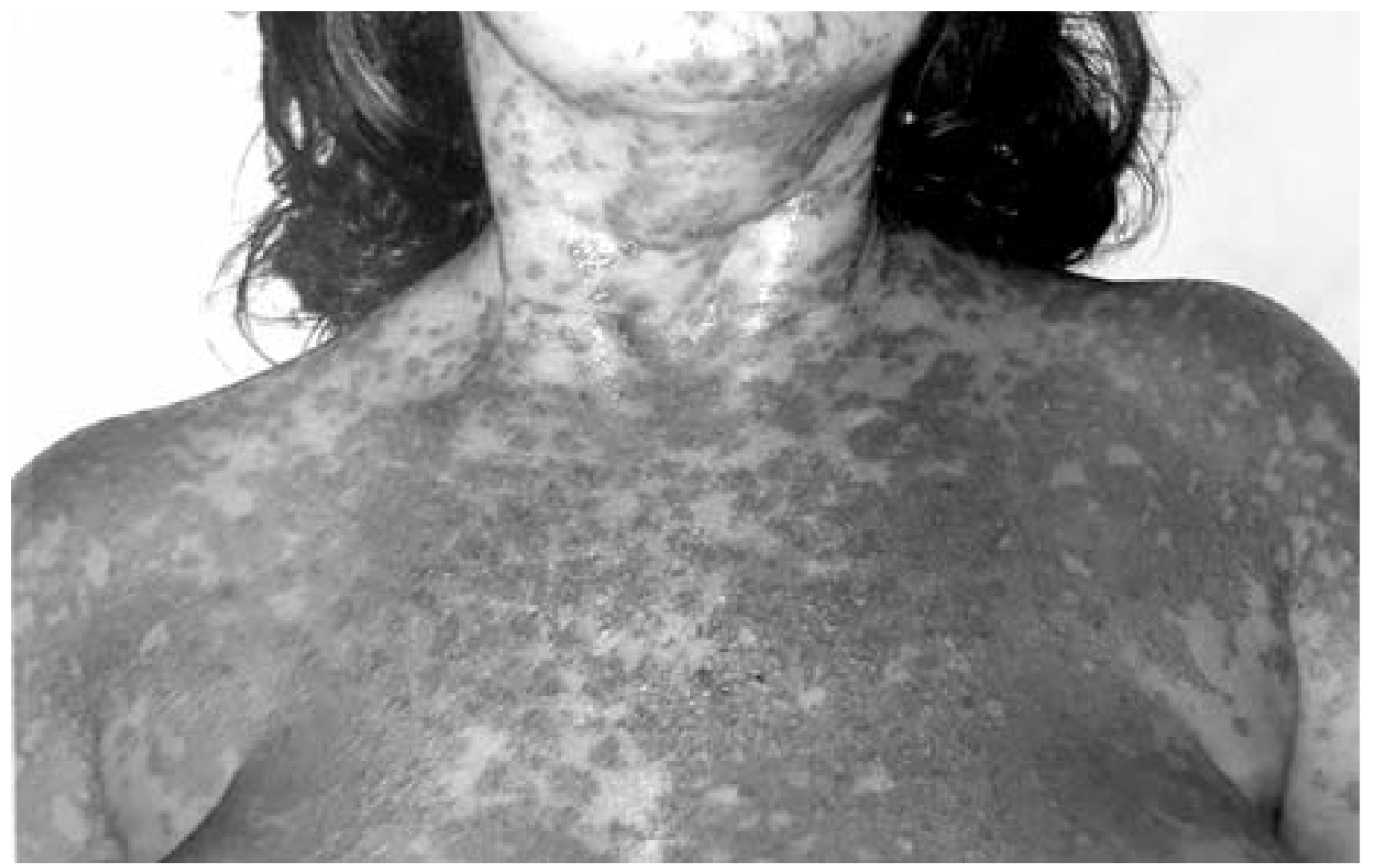
A pesar de tratamiento instaurado, la evolución no fue favorable, apareciendo flictenas que afectaban al 20% de la superficie corporal (SC), motivo por el cual se realiza después de diez días traslado a la Unidad de Quemados.
A su llegada la paciente se encuentra consciente, orientada y colaboradora; presenta la mayoría de las lesiones ya epitelizadas, objetivándose solo una afectación del 6% de la SC con flictenas en cara anterior de muslos y abdomen. Tras valoración por parte del Servicio de Dermatología, se inicia tratamiento con ciclosporina.
Durante su estancia la paciente presenta una evolución favorable, hemodinámicamente estable en todo momento, sin necesidad de aminas vasoactivas. Eupneica y con buena dinámica respiratoria sin necesidad de soporte respiratorio.
El cuadro cutáneo presentó evolución favorable, lo que permitió disminuir la dosis de ciclosporina y suspenderse tras cinco días de tratamiento.
Como complicación evolutiva, cabe destacar la presencia de aislamiento de Streptococo en hemocultivo para lo que se instauró tratamiento empírico con vancomicina, con normalización de curva térmica tras 48 horas de antibioterapia.
El juicio clínico principal al alta es un SJS/NET solapado que ya presenta una epitelización de todas las lesiones dérmicas y el tratamiento prescrito es paracetamol oral, crema hidratante a demanda y se le aconseja evitar la exposición solar, no recomendándose la toma de los fármacos que se relacionaron con el cuadro.
La paciente decide firmar el consentimiento informado para la publicación de dicho caso.
DISCUSIÓN
En Europa se dispone del EuroSCAR-Study, estudio multicéntrico internacional con miras a vigilar continuamente los riesgos de la medicación para el SJS y la TEN que tiene como base una metodología de casos y controles2. La última versión no encuentra asociación entre la administración de omeprazol y clortalidona con un riesgo detectable de SJS o TEN. Asimismo, para gluconato cálcico, vitamina D, bromazepam, levotiroxina no existen referencias2,6.
Este EuroSCAR-Study indica que muchos de los pacientes que sufrieron una reacción habían estado expuestos a esteroides cuando se compararon a un grupo control (14,8 frente al 2,1% de los controles). Haciendo mención al estudio europeo, Andrew Downey et al. recogieron que la toma de corticoides supone un riesgo potencial y que requeriría más investigación6.
Este artículo expone el caso de una mujer con diagnóstico de NET solapada relacionada con la toma de deflazacort, y en la que se observa una buena evolución.
El deflazacort es un medicamento corticoesteroide que puede tener una gran variedad de reacciones adversas, siendo escasas las referencias que lo relacionan con casos de SJS/NETB7,8,9,10.
En nuestro caso, el algoritmo de Karch-Lasagna modificado estableció como «posible» la relación entre SJS y deflazacort, existiendo una asociación temporal entre el uso del fármaco y el SJS, así como entre la suspensión del mismo y la mejoría. Además, una revisión retrospectiva realizada en Italia y que abarcó casi 11 años detectó dos casos relacionados con la administración de deflazacort con unas SC afectadas del 34% y del 100%10.
Un análisis de la supervivencia global de pacientes con SJS/TEN sobre la base de los datos recogidos en el registro europeo de reacciones adversas cutáneas graves (RegiSCAR) encontró que la tasa de mortalidad fue del 23% a las seis semanas y 34% al año3. La sepsis que conduce al fallo multiorgánico es la causa más común de muerte, con una morbilidad adicional de sangrado gastrointestinal, embolia pulmonar, infarto de miocardio y edema pulmonar3.
Este caso se ha notificado al Centro de Farmacovigilancia correspondiente