ANTECEDENTES
La proliferación celular es el resultado de la activación del ciclo celular y la entrada en él no es un proceso autónomo, sino que requiere de la puesta en marcha de una serie de mecanismos específicos. Así, Smith KA (1990)1 establece que existe también una regulación extracelular liderada por proteínas que se unen a receptores de membrana con actividad de tirosinaquinasa. Bos JL (1997)2 agrega que las proteínas codificadas por el gen RAS (11p15.5) se localizan en la cara interna de la membrana celular y se diferencian entre sí principalmente por la secuencia aminoacídica de su región hipervariable c-terminal. Rodriguez Fragoso L et al. (2004)3 publicaron que en un ciclo la célula se divide en dos y cada una de las células formadas cuenta con los elementos estructurales y funcionales que le permiten repetir el proceso de crecimiento y división. Sin embargo, para que esto suceda se necesita la replicación del genoma, la distribución equitativa de la masa celular y una segregación precisa de los cromosomas. Estos autores refirieron además que las células normales tienen la capacidad de interrumpir el ciclo celular cuando ocurre un daño y se afecta la maquinaria bioquímica o la información genética involucrada en el ciclo, tales interrupciones pueden ocurrir en las fases G1, S, G2 y M.
Visser K et al. (2009)4 establecieron que el metotrexate es el fármaco modificador de la enfermedad más usado en la artritis reumatoidea y el de primera elección. Restrepo LF et al. (2016)5, publican que el metotrexate es un análogo del ácido fólico, diseñado originalmente para inhibir la actividad de la enzima dihidrofolato reductasa encargada de convertir dihidrofolatos a tetrahidrofolatos, implicados en la transferencia de un átomo de carbono en las vías metabólicas intracelulares, tales como la síntesis de novo de purinas, pirimidinas y poliaminas, así como también de la transmetilación de fosfolípidos y proteínas. Este ácido débil tenía además propiedades inmunosupresoras y antiinflamatorias. Respecto a la actividad inmunosupresora, inhibía la proliferación de linfocitos CD3-CD4 y otras células inmunocompetentes, como los monocitos, macrófagos y neutrófilos polimorfonucleares.El metotrexate también modula citosinas como interleucinas 4 (IL-4), e interleucinas 10 (IL-10), interferón alfa y la interleucina 2 (IL-2), generando acciones antiinflamatorias e inmunoreguladoras. Jensen MK, Nyfors A (1979)6 informaron que estudios citogenéticos realizados a 22 pacientes tratados con metotrexate, en algunos se estudiaron las metafases tanto de médula ósea como de sangre periférica. En las preparaciones de médula ósea se observó un aumento del número de aberraciones cromosómicas estructurales, mientras no se observaron anomalías en las metafases de sangre periférica.
Pincus T (1995)7 publicó que la artritis reumatoidea era una enfermedad crónica de origen autoinmune, caracterizada por la inflamación de múltiples articulaciones, que con el tiempo llevaba a grados variables de destrucción del cartílago articular y del hueso yuxtaarticular, generando deformidad progresiva y con ello discapacidad, alteración de la calidad de vida y disminución de la expectativa de vida. Weyand CM et al. (1992)8 habían asociado la artritis con la presencia de HLA-DR4 (6p21.32) y/o epítopo reumatoide a un daño estructural mayor y Weyand CM et al. (1995)9 afirmaron que la homozigosidad para el epítopo, especialmente en los alelos DR0401 y DR0404 se asocia con una gravedad mayor de la enfermedad tanto articular como extraarticular. Harrison B et al. (1996)10 establecieron que la participación de un número importante de articulaciones, se relacionaría con una evolución más grave; por el contrario aquellos pacientes con pocas articulaciones inflamadas y de pequeño tamaño tendrían mejor pronóstico.
En nuestro Laboratorio de Biología Molecular y Genética prestamos el servicio de diagnóstico y consejería genética en problemas especiales derivados de la interconsulta con los departamentos de Medicina Interna, Gineco-obstetricia y Pediatría. Este caso motivó nuestra curiosidad científica debido a que en la labor rutinaria para la obtención de bandas “R“ de replicación utilizamos el metotrexate para sincronización celular como retardante del ciclo celular en fase “S” y su posterior inhibición por competencia con la bromodeoxiuridina, lo cual nos indujo a postular que un alargamiento en términos de tiempo de la mencionada fase, como es el caso de esta paciente, podría reflejarse en daños citogenéticos.
METODOLOGÍA
Datos clínicos
Mujer de 46 años de edad, con diagnóstico médico de artritis reumatoidea quien presenta inflamación en las articulaciones de los dedos de las manos y del hombro izquierdo, con impedimento para flexionar el dedo anular de la mano derecha, además de dolor que impide el movimiento de las mismas. Relata también que en ocasiones debido al dolor, no se puede levantar sin ayuda de su lecho. Como tratamiento médico previo al metotrexate recibió acetaminofen (analgésico), naproxen (antiinflamatorio), cloroquina (immunimodulador) y ácido fólico (vitamina B9 hidrosoluble). Suspendida la medicación anterior, recibió metotrexate de 25 mg, cada 8 dias, por vía intramuscular durante 1 mes, el cual fue suspendido porque era muy “horrible”, le producía mucho malestar y deseos de vomitar, y ello la llevó a un estado parcial de inapetencia. También recibió ácido fólico de 1 mg por día; sulfasalasina (analgésico y antiinlamatorio) de 250 mg por día y acetaminofen de 500 mg por día.
Estudio citogenético
Se realizó el cultivo de sangre periférica, SEGÚN la técnica de Moorhead OS et al. (1960)11, con medio PB-MAX, se analizaron 50 NÚCLEOS en división directamente al microscopio Zeizz Axioscop 40, 10x100, y teñidos con colorante de Giemsa.
RESULTADOS
Estudio citogenético
De las 50 células linfoides analizadas, 23 metafases presentaron un número modal de 46 cromosomas, fórmula 46,XX; 17 metafases con diferentes aneuploidías y 10 presentaron anomalías polimorfonucleares que incluían micronúcleo, binúcleo y trinúcleo (Tabla 1).
Tabla 1. Resultados citogenéticos cuantitativos en extendidos de cultivo de sangre periférica, según la técnica de Moorhead OS et al. (1960)11

Cariotipos y aneuploidías
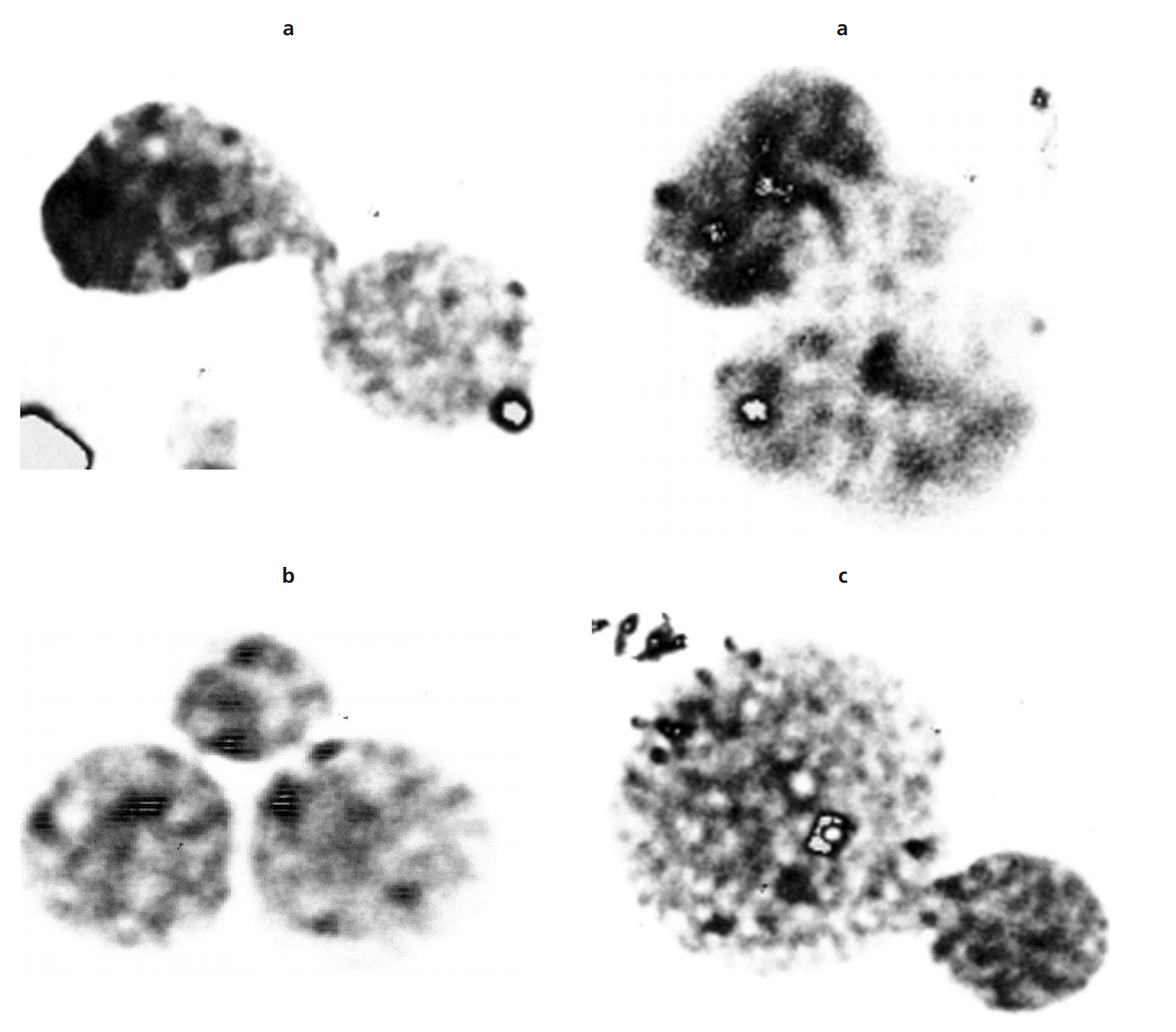
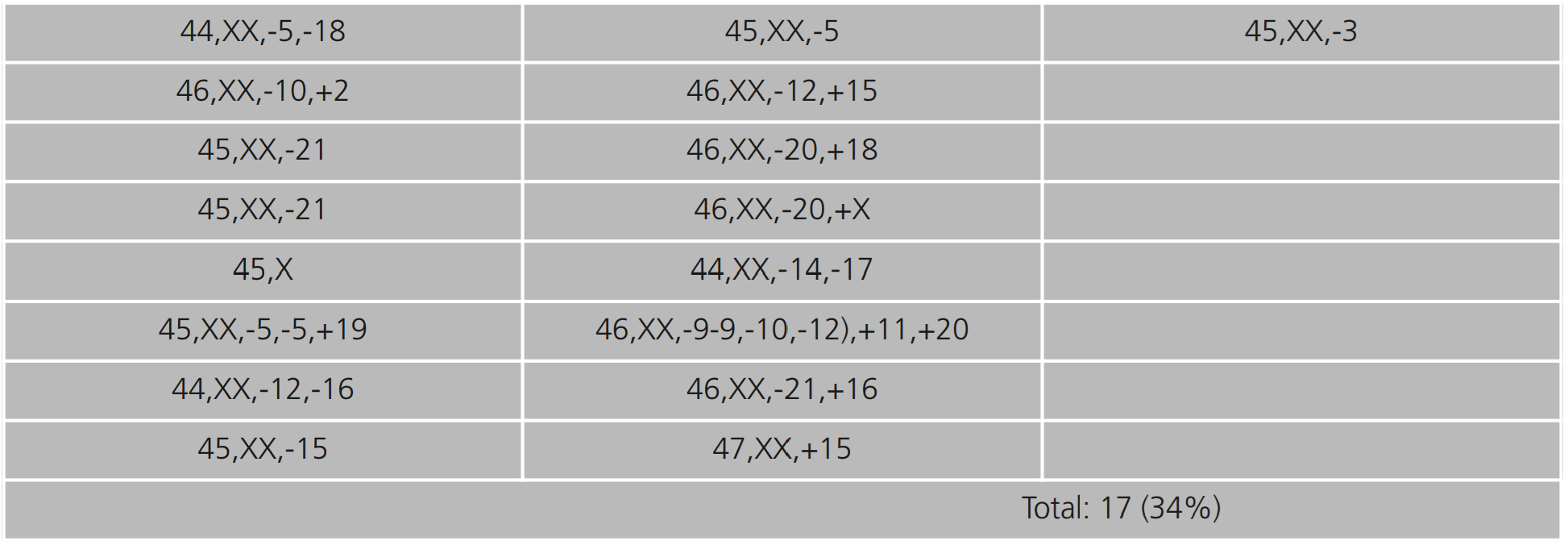
Con respecto a las 17 (34%) metafases, con aneuploidías en los diferentes grupos cromosómicos que constituyen el cariotipo humano, se encontraron diferentes variantes, especialmente hipodisomías en el grupo A(-3); B(-5); C(-9,-10,-12); D(-14,-15); E(-16,-17,-18); F(-20), hiperdisomías en el grupo A(+2); C(+11); D(+15); E(+16,+18); F(+19,+20); G(+21) y monosomía X (Tabla 2 y Figura 1).
Tabla 2. Fórmulas cromosómicas de metafases anormales en extendidos de cultivos de sangre periférica, según la técnica de Moorhead OS et al. (1960)14
Los cariotipos que aparecen en la figura 1 son una muestra de los diferentes hallazgos citogénticos aneuploidicos en cada uno de los grupos cromosómicos (Cariotipos No: 1, 2, 3, 4).
Formas polimorfonucleares
Se encontraron diferentes anomalías a nivel de los núcleos celulares como fueron núcleos binucleadas, trinucleadas y con micronúcleos para un total de anomalías de núcleos interfásicos de un 20% (Figura 2).
Consideraciones éticas
El estudio fue realizado en cumplimiento con la Declaración de Helsinki y se sometió para aprobación por el Comité de Ética Humana de la Universidad Libre Seccional Cali. La persona donante de las células linfoides para el estudio leyó y firmó el consentimiento informado antes de ser incluida en el estudio.
DISCUSIÓN
Mitelman F (1995)12, definió pérdida al azar de un cromosoma, como la pérdida del mismo cromosoma, en no más de dos metafases. La pérdida de un cromosoma particular ha sido considerada altamente significativa si es encontrada en tres o más células. La American College of Medical Genetics. Standars and Guidelines (1993)13, establecieron que en un análisis cromosómico de rutina se deben contar veinte metafases y cariotipar dos de ellas. Nosotros analizamos 50 células linfoides y encontramos 17 (34%) metafases aneuplóidicas y 10 (20%) de polimorfonucleares anormales, lo que da un total de células con núcleos anormales en división del (54%), resultado altamente significativo.
Altamirano EM et al. (2004)14, mencionaron que la depleción de folatos reducidos (FH4), que ocasionan la inhibición de la enzima DFR (dihidrofolato reductasa), determina una interrupción de la síntesis del ADN y ARN. Al mismo tiempo, interfería con la capacidad celular para reparar los daños de las cadenas de ADN, llevando este mecanismo a una ruptura de las mismas. Oosteron N et al. (2018)15 hipotetizaron que el metrotexate inhibe la metilación del ADN, es decir, impide su transcripción. Shaikh N et al. (2018)16, informaron teniendo como norte sus propias vivencias casuísticas y con el ánimo de crear conciencia, que la toxicidad del metotrexate podría ser fatal. Relacionado con las drogas que intervienen en la síntesis y daño del ADN y las que inhiben la función del huso mitótico y los microtúbulos, se hace necesario tener en cuenta las apreciaciones de los diferentes autores así, Vogt E et al. (2008)17, indicaron que el ensamblaje del punto de control del huso monitorea la unión de los microtúbulos y la tensión sobre los cromosomas en mitosis y meiosis II. Dicho ensamblaje representa un mecanismo de control que detiene las células en fase M, en presencia de un cromosoma suelto asociado con acumulación de componentes de puntos de control, en particular Mad20 (5q14.3) en los quinetocoros. Un complejo entre el factor ciclosoma (APC/C) promotor de anafase y su proteína accesoria cdc/20 (1p34.2) y proteínas de la SAC patrocinan un APC inactivo, usualmente hasta que los cromosomas están propiamente ensamblados en el ecuador del huso bajo tensión de las fibras del huso. Una vez liberado de SAC, el APC/C puede impactar proteínas como la ciclina B y la securina para su degradación por el proteosoma. Klebig C et al. (2009)18, postularon que el gen Bub1 (2q13) tiene dos funciones diferentes durante la mitosis, por un lado es esen- cial en la señalización del punto de control del huso y por el otro en el correcto alineamiento de los cromosomas en la placa ecuatorial. Tooley J, Stukenberg PT (2011)19, afirmaron que el complejo NDc80, es una maquinaria proteica grande, ubicada en el corazón del quinetocoro, que segu- ramente segrega los cromosomas durante la división celular. De Boer RM et al. (2011)20, indicaron que las mutaciones de los genes BUB1 Y BUB3 causan mosaicos aneuploidicos diversificados. Piloto Ferrer J, Sanchez-Lamart A (2016)21, escribieron una adaptación del artículo publicado por Bharadwaj R, Yu H (2004)22, que un control severo de la mitosis garantiza una segregación exacta de las cromátides hermanas en la división celular y que las células eucarióticas poseen mecanismos sofisticados para supervisar la progresión de la mitosis, para prevenir la no disyunción cromosómica que trae como resultado aneuploidías, poliploidías o células hijas binucleadas. Esta vía de transducción de señales es conocida como punto de control de ensamblaje del huso (SAC) que inhibe la entrada en anafase hasta que los quinetocoros están unidos adecuadamente a los microtúbulos del huso y los cromosomas son alineados correctamente en la placa metafásica. Mencionaron además que cuando esto no ocurre, SAC es activado por el reclutamiento de Mad2, Bub3 y BubR1, ocasionando la inhibición del complejo promotor de anafase (APC), una ubiquitín ligasa E3, que marca la degradación proteosomal. En el estudio en mención se afirmó también, que los sustratos de APC son la securina que activa la separasa. La separasa rompe la subunidad Scc1 de la cohesina, permitiendo la segregación cromosómica, en respuesta las cromátides hermanas unidas inadecuadamente al huso mitótico promueven el complejo de proteínas promotoras de SAC, que inhiben la actividad del APC permitiendo la estabilización de la securina, preservando la cohesión de las cromátides hermanas, retrasando así la entrada en anafase mitótica. Recientemente Vitiello E et al. (2019)23 indican que la presencia de un número aberrante de centriolos es una causa reconocida de aneuploidías, por lo tanto, la duplicación del centriolo debe estar estrictamente regulada. Se ha propuesto que la separación del centriolo limita la duplicación del centrosoma. En su trabajo proponen que las fuerzas generadas por actina regulan la separación del centriolo, ellos pudieron demostrar que los arreglos precisos de fuerza de miosina controlan la dirección, la distancia y el tiempo de separación del centriolo. En consecuencia, la inhibición de la contractilidad de actomiosina altera la separación del centriolo y les permitió sugerir que las fuerzas de actomiosina podrían actuar en mecanismos fundamentales de prevención de aneuploidías.
CONCLUSIONES
El hecho de no haber encontrado en este estudio de manera constante daños cromosómicos estructurales en metafase, podría eventualmente indicar que la acción del metotrexate está más direccionada a los ciclos aberrantes de duplicación del centrosoma que dan como resultado más de cuatro centriolos y del huso mitótico en general, así como a la alteración parcial de la síntesis del ADN y el ARN. Evidentemente, los genes que controlan estrictamente la división celular mitótica cuando por agresiones medio ambientales en núcleos en interfase y en división, como es el presente caso, pueden fallar en el proceso de contactar mecánicamente los centrómeros por parte de los microtúbulos (Mts) del huso acromático, en la alineación de los cromosomas en la placa ecuatorial y en la segregación exacta durante la anafase de las cromátides hermanas, originando de esa manera aneuploidías de los diferentes pares cromosómicos tanto de los autosomas como del cromosoma X. El Colegio Americano de Reumatología (2016)24 ha propuesto recomendaciones como el monitoreo del cuadro hematológico completo. Ellos han sugerido que pacientes tratados con metotrexate necesitaban pruebas regulares de laboratorio para monitorear la función renal, la función hepática y el conteo celular sanguíneo. Además, concluyeron que el metotrexate aunque es una droga empleada frecuentemente en el tratamiento de la artritis inflamatoria, aun empleada en dosis bajas, puede ser fatal en presencia de una insuficiencia renal. Finalmente pensamos que los médicos tratantes de esta patología deben tener en cuenta en el protocolo de manejo correspondiente, la cronicidad del tratamiento en razón de los hallazgos fenotípicos clínicos que acompañan su uso y un monitoreo citogenético dirigido a prevenir mutaciones que impidan el funcionamiento normal del ciclo celular.
Debido a lo anterior aconsejamos a los médicos tratantes de esta patología tener en cuenta en el protocolo de manejo correspondiente, la cronicidad del tratamiento en razón de los hallazgos fenotípicos clínicos que acompañan su uso, la terapéutica del medicamento, las alteraciones citogenéticas mencionadas y retrotrayendo nuestros resultados, un monitoreo que involucre entre 25-30 días después de suspendido el tratamiento, dado que la vida media del metotrexate está entre 8-15 horas; que el 80-90% se elimina después de 24 horas y el 10-20% restante se elimina entre 1-2% diarios y un tiempo de reposo celular entre 10-15 días, lo cual podría ser suficiente para la normalización del ciclo celular. Reiniciar inmediatamente el tratamiento antes que reaparezcan los efectos fenotípicos causados por el metotrexate.
Agradecimientos: Los autores agradecen al Centro de Investigaciones en Salud de la Facultad de Salud de Universidad Libre Seccional Cali por la financiación de este trabajo y a la Sra. Eddy Johana Diaz Mellizo por su valiosa colaboración como soporte técnico.