INTRODUCCIÓN
Antecedentes y contexto actual
En 1817 Friedrich Sertürner consiguió extraer el alcaloide más potente del opio al que llamó morfina en honor al dios griego de los sueños, Morfeo. Mediante modificaciones químicas de la morfina se han generado compuestos semisintéticos y sintéticos, entre los cuales se encuentran heroína, fentanilo y tramadol1.
El fentanilo es una molécula con bajo peso molecular 336,5 g/mol, sintetizado por primera vez en 19602. Su descubridor, Paul Janssen, buscaba un analgésico más potente y eficaz que la morfina, con una mayor liposolubilidad a fin de que pudiese penetrar con mayor facilidad a través de las membranas de las células del sistema nervioso y actuase más rápidamente3.
El fentanilo empezó a utilizarse rápidamente en Europa como analgésico intravenoso, por su elevada potencia y fácil producción. La utilización en Estados Unidos fue más tardía. La FDA lo autorizó en 1968 sospechando que esa facilidad de síntesis y esa gran potencia farmacológica lo terminarían convirtiendo en un claro candidato a transformarse en una droga recreativa, como así ha sido, desgraciadamente. Consumido solo o mezclado con heroína es el responsable de un elevado número de muertes por sobredosis4.
El fentanilo es entre 50 y 100 veces más potente que la morfina y suele prescribirse a pacientes con dolores intensos. Interacciona principalmente con el receptor opioide µ, por lo que sus acciones terapéuticas serán, fundamentalmente, la analgesia y la sedación5.
La absorción del fentanilo viene modulada por la forma farmacéutica en la que se presente, esto es, el proceso de liberación de la forma farmacéutica gobernará el grado y la velocidad de absorción. Al ser una molécula altamente lipófila se absorbe adecuadamente a través de las mucosas y además difunde rápidamente a través de la barrera hematoencefálica6. Sin embargo, por vía oral tiene tan sólo una biodisponibilidad del 30% ya que sufre un fuerte metabolismo de primer paso, tanto intestinal como hepático. Debido a estas limitaciones se desarrollaron formulaciones alternativas como son las de absorción transdérmica y transmucosa. Las primeras presentan una acción prolongada, mientras que las de absorción transmucosa son de absorción rápida, por lo que es la vía ideal para el tratamiento del dolor irruptivo7. Su distribución es rápida en cerebro, corazón, pulmones, riñones y bazo. Posteriormente sufre una redistribución más lenta en el músculo y tejido adiposo. La semivida de eliminación de fentanilo es aproximadamente de 3 horas6.
Dolor y tratamiento
La International Association for the Study of Pain (IASP) define el dolor como “una experiencia sensorial y emocional desagradable asociada a una lesión tisular real o potencial, o descrita en referencia a dicha lesión”8. El dolor puede clasificarse en función de varios aspectos como son: duración, mecanismo y curso.
Teniendo en cuenta su duración, puede ser agudo cuando es de inicio brusco y corta duración, y crónico cuando persiste durante más de un mes.
Según su mecanismo pueden citarse: a) el dolor somático que se produce en estructuras somáticas como la piel, mucosas, músculos, huesos, etc., siendo un dolor localizado; b) el dolor visceral que suele ser mal definido, impreciso y referido, asociándose a náuseas, vómitos y sudoración, y se origina en estructuras viscerales del aparato respiratorio, circulatorio, digestivo y genitourinario; c) el dolor neuropático causado por una lesión en las estructuras del sistema nervioso; y d) el dolor mixto, en el cual se pueden combinar varios de los mecanismos anteriormente comentados.
Por último, en función de su curso, se puede clasificar como: continuo o basal cuando el dolor es persistente, es decir, no llega a desaparecer nunca, aunque haya momentos de mayor o menor intensidad; y el dolor irruptivo que es una exacerbación transitoria del dolor que aparece, ya sea espontáneamente o bien con un desencadenante concreto, predecible o impredeciblemente, a pesar de existir un dolor basal estable y adecuadamente controlado9.
El dolor basal hace referencia a la presencia de un dolor continuo que tiene una duración superior a las 12 h diarias. El tratamiento de este consiste en analgésicos pautados a dosis fijas, es decir, no a demanda10. Es probable que sea necesario administrar dosis “de rescate” o fármacos coadyuvantes para el correcto control del dolor en el caso de una reactivación11. El concepto de dolor irruptivo es una traducción incorrecta del término anglosajón “breakthrough pain”, ya que no expresa con exactitud lo mismo que quiere indicar el término inglés: este concepto hace referencia a un episodio de dolor que aparece en el transcurso de otro episodio doloroso. Las diferencias entre uno y otro tipo aparecen en la tabla 1 12.
En 1990, Portenoy y Hagen definieron el dolor irruptivo (DI) como “un incremento transitorio de dolor experimentado por un paciente con cáncer que tiene dolor basal estable en tratamiento crónico con opioides”13. En España, la definición más aceptada es la que define el dolor irruptivo oncológico (DIO) como “una exacerbación aguda del dolor de rápida aparición, corta duración y de moderada a elevada intensidad, que sufre el paciente cuando éste presenta un dolor basal estabilizado y controlado con opioides”. Esta es una definición que se consensuó entre la Sociedad Española de Oncología Médica (SEOM), la Sociedad Española de Cuidados Paliativos (SECPAL), la Sociedad Española del Dolor (SED) y la Sociedad Española de Oncología Radioterápica (SEOR)12.
El DI genera en los pacientes que lo padecen un empeoramiento de la calidad de vida, ya que está asociado a sufrimiento psicológico, lo que aumenta la probabilidad de estos pacientes de sufrir ansiedad y depresión, y además produce un deterioro funcional en estas personas. Los enfermos que sufren estas crisis a menudo no están satisfechos con la terapia analgésica, por lo que se generan frecuentes visitas a hospitales, aumentando las prescripciones y las estancias hospitalarias, lo que en definitiva provoca un aumento del gasto para el sistema sanitario. Por tanto, es fundamental el diagnóstico de este tipo de dolor para que el paciente reciba el tratamiento adecuado.
En el tratamiento del DI lo ideal es usar formulaciones de liberación inmediata, con un inicio de acción de 3-15 minutos, y una duración del efecto de 1 a 2 horas. Generalmente, el fentanilo liberado a partir de estos medicamentos se absorbe a través de la mucosa bucal o nasal (administración transmucosa). Hay que señalar que el tratamiento del dolor basal no debe ser sustituido por el tratamiento del DI12.
La curva intensidad-tiempo del DI se asemeja al perfil de acción del fentanilo, por lo que es el fármaco que mejor cubre la necesidad analgésica en este tipo de dolor. Además, posee una serie de características que lo hacen idóneo para el tratamiento de dicho dolor: presenta una elevada potencia analgésica, es lipófilo, útil para tratar el dolor intenso, tiene poca variabilidad individual, una alta biodisponibilidad a través de las mucosas, una corta acción, coste-efectivo y autoadministrable12.
En función de todo lo expuesto anteriormente el objetivo principal del presente trabajo es realizar una profunda revisión bibliográfica sobre los medicamentos de fentanilo comercializados en España, desde los puntos de vista terapéutico y tecnológico, resaltando las diferentes repercusiones biofarmacéuticas que originan las distintas formulaciones.
Este objetivo global puede dividirse, a su vez, en varios objetivos parciales:
- Estudiar las distintas vías de administración del fentanilo, señalando sus ventajas e inconvenientes.
- Estudiar las distintas formas farmacéuticas comercializadas y su aplicación terapéutica en función del tipo de dolor que se origine, seleccionando la forma óptima en cada situación.
- Estudiar el consumo global de opioides en España, realizando un estudio particular en el caso del fentanilo.
MATERIAL Y MÉTODOS
El presente trabajo de revisión bibliográfica se ha llevado a cabo mediante la búsqueda de información en bases de datos como Medline, ProQuest, Web of Science, Scopus o ScienceDirect. A dichas bases de datos se ha accedido a través de los recursos electrónicos de la página web de la Universidad de Sevilla, seleccionando bases de datos de Farmacia y Medicina. Los términos empleados para llevar a cabo la búsqueda bibliográfica fueron los siguientes: "fentanilo", "dolor irruptivo", "vías de administración", "fentanilo intranasal", “fentanilo bucal” y “fentanilo transdérmico”, realizándose la búsqueda durante los últimos 30 años.
Además, para la búsqueda de los medicamentos autorizados en España y comercializados actualmente, se utilizó el Centro de Información online de Medicamentos (CIMA) de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), de donde se obtuvieron sus fichas técnicas, usadas en la elaboración de esta revisión.
RESULTADOS Y DISCUSIÓN
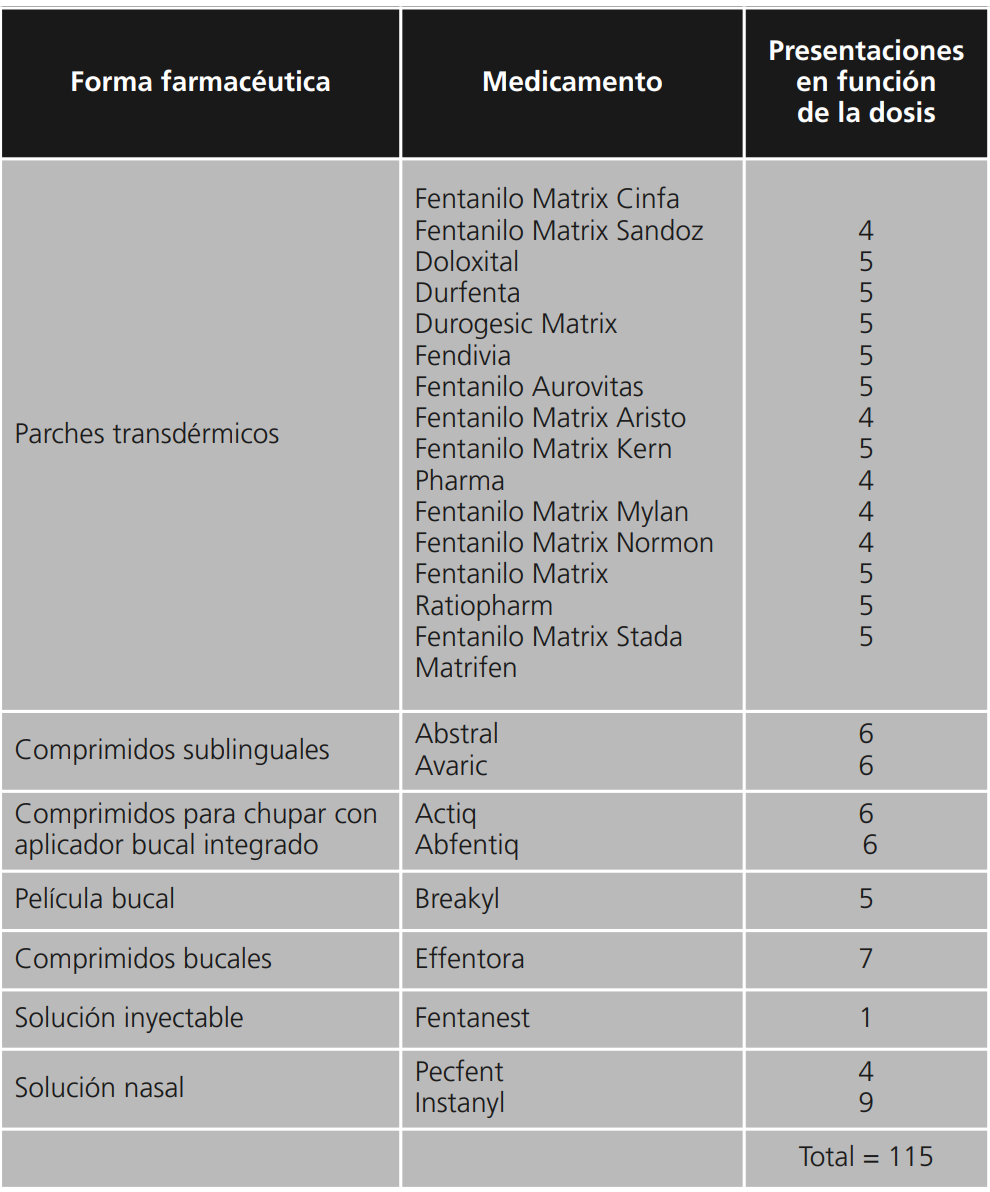
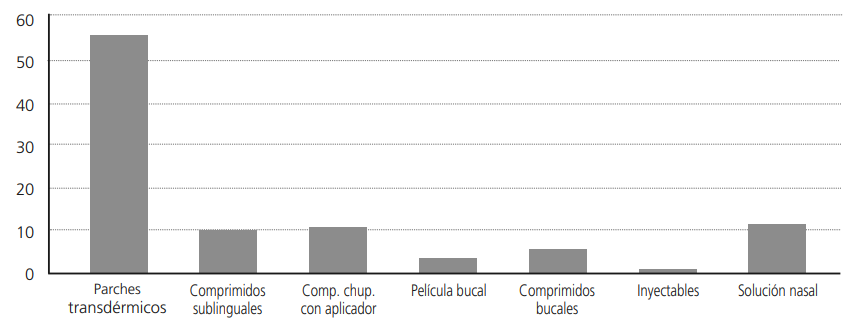
Actualmente, el fentanilo se encuentra comercializado en España en diversas formas farmacéuticas para diferentes vías de administración y para el tratamiento tanto del dolor basal (parches transdérmicos) como del dolor irruptivo (resto de formas farmacéuticas), en un total de 115 presentaciones14. La tabla 2 muestra un resumen de los distintos medicamentos comercializados en la actualidad. La figura 1 resume gráficamente la distribución porcentual en función del tipo de forma farmacéutica.
Las formas de liberación inmediata (transmucosa) constituyen un 45% del total, mientras que las de liberación controlada (parches) constituyen un 55%. Las formas de liberación inmediata están indicadas en los casos de DI mientras que las de liberación controlada están indicadas en los casos de dolor basal o crónico.
Fentanilo de liberación inmediata
El DI es una de las formas de dolor más difícil de controlar debido a las características vistas anteriormente. Además, los pacientes oncológicos en fases avanzadas de la enfermedad suelen presentar dificultades como náuseas, vómitos, disfagia y obstrucción intestinal para la administración por vía oral. Es por esto por lo que han surgido formas farmacéuticas para la administración de fentanilo por vías alternativas15. Las guías terapéuticas más actuales recomiendan el uso del fentanilo de liberación inmediata para el tratamiento del DI. Además, se ha demostrado que dichas formulaciones producen un efecto analgésico más eficaz y rápido comparado con la morfina oral16. Las vías de administración del fentanilo que actualmente se usan para el tratamiento del DI son las vías transmucosa bucal, sublingual y nasal.
La mucosa oral se caracteriza por presentar un gran flujo sanguíneo, una elevada permeabilidad y una amplia superficie, características que la hacen ideal para la absorción rápida de fármacos. Además, mediante esta vía se evita el efecto de primer paso hepático, lo que permite un aumento de la biodisponibilidad y dado que la actividad enzimática oral es baja se pueden administrar fármacos inestables enzimáticamente. En la mucosa oral encontramos distintas zonas: bucal, sublingual, gingival y maxilar, cada una de estas zonas con una permeabilidad distinta a los fármacos. Tan solo las mucosas bucal y sublingual no están queratinizadas, por lo que la absorción del fármaco es mucho más rápida. La capa epitelial de la mucosa bucal tiene un grosor de 500-600 µm, mientras que la de la mucosa sublingual tan solo 100-200 µm y además esta última está más vascularizada, por lo que tiene una absorción más rápida. Aunque esto podría compensarse con que la mucosa bucal no se ve tan afectada por la saliva y el movimiento de la lengua, que no permitiría mantener el medicamento en la zona sublingual durante un tiempo prolongado17.
Tradicionalmente la administración intranasal ha sido la vía de elección para el tratamiento de enfermedades locales, ya que por esta vía se requieren dosis menores a las que serían necesarias en su administración sistémica. Pero, actualmente, ha aumentado el interés por usar esta vía para administrar medicamentos que ejerzan un efecto sistémico. Esto es debido a que la mucosa nasal es ideal para la administración de fármacos ya que es una ruta no invasiva, se consigue evitar el efecto de primer paso hepático, se pueden administrar fármacos que no se absorban en el tracto gastrointestinal y se puede atravesar la barrera hematoencefálica con una alta biodisponibilidad y un rápido inicio de acción18. Mediante esta vía los fármacos pasan directamente a circulación sistémica, por lo que sería una alternativa óptima para pacientes en los que no se pueda usar la mucosa oral, por ejemplo, aquellos con mucositis o boca seca, al igual que los que presenten náuseas, vómitos o dificultades para tragar19. El fentanilo al presentar alta lipofilia y bajo peso molecular puede ser absorbido fácilmente a través de la mucosa nasal por difusión simple, pudiendo ser administrado por esta vía7. Esto hace que el fentanilo administrado por vía intranasal tenga un inicio de acción más rápido que los fentanilos de absorción transmucosa oral18.
El uso de una u otra vía de administración, al igual que elegir entre las distintas formas de liberación inmediata, es un tema aún controvertido porque, aunque la molécula es la misma, en función de la forma farmacéutica que se seleccione se puede variar el grado y la velocidad de absorción o lo que es lo mismo, la biodisponibilidad en magnitud y en velocidad. Debe quedar meridianamente claro que las formulaciones de liberación inmediata no son intercambiables.
La selección de una u otra forma farmacéutica se debe realizar teniendo en cuenta: las características clínicas de cada paciente; las condiciones de las mucosas, ya que se pueden ver dañadas por los tratamientos radioterápicos y esto dificultaría la absorción; y también es muy importante valorar la capacidad de uso del medicamento por parte del paciente o sus cuidadores. Para conseguir una eficacia óptima con estos sistemas es fundamental evaluar periódicamente las condiciones clínicas de los pacientes, ya que podrían afectar al resultado del tratamiento. Así mismo, habría que evaluar las condiciones de las mucosas oral y nasal, de manera que, en pacientes con problemas en la mucosa oral sería preferible usar formas de administración nasal. Mientras que, por el contrario, en pacientes con lesiones en la mucosa nasal lo más adecuado sería usar la administración transmucosa oral16.
Actualmente en España, los medicamentos de fentanilo de liberación inmediata están indicados exclusivamente para el tratamiento del DIO en adultos que ya están siendo tratados con un analgésico opioide de base. Esta es la única indicación que consta en sus fichas técnicas y es muy importante cumplir con las condiciones de uso autorizadas, como veremos en profundidad en apartados posteriores20.
Comprimidos para chupar con aplicador bucal integrado
Según la Real Farmacopea Española (RFE), los comprimidos para chupar son “preparaciones sólidas presentadas en dosis únicas destinadas a ser chupadas para obtener un efecto local o general”. Además de los excipientes propios de comprimidos, es fundamental la presencia de aromatizantes, saborizantes, edulcorantes, etc. para hacer que las propiedades organolépticas sean agradables para el paciente21.
Actualmente se encuentran comercializados en España las marcas Actiq® y Abfentiq®, con distintas dosis (200, 400, 600, 800, 1.200, 1.600 µg)22,23.
La administración es bucal, por lo que debe colocarse en la boca contra la mejilla, desplazándolo con ayuda del aplicador, de manera que se consiga la máxima zona mucosa expuesta al medicamento (Figura 2). Es muy importante que el paciente no lo mastique, debe chuparse, ya que la absorción transmucosa oral del fentanilo es más rápida que la absorción por vía oral, por lo que debe procurar tragarse lo mínimo posible15.
Existen algunos estudios donde se muestra la utilidad de estas formas farmacéuticas en pacientes oncológicos sin tratamiento del dolor basal. Así, López y colaboradores realizaron un estudio con 10 pacientes oncológicos que fueron tratados con citrato de fentanilo oral transmucosa para tratar el dolor rectal irruptivo. Estos pacientes no habían sido tratados previamente con opiáceos. Antes de recibir la medicación, se evaluó el dolor de los pacientes usando la escala visual analógica (EVA) y la puntuación media fue de 7, es decir, dolor severo. Tras el tratamiento, la puntuación media con la EVA fue de 1,9 pasando, por tanto, de un dolor severo a un dolor leve. Además, ninguno de los pacientes presentó efectos indeseables relacionados con el uso de este medicamento. Según estos resultados, los autores consideran que se puede recomendar el citrato de fentanilo oral transmucosa como analgésico ideal por su rapidez, seguridad, fácil administración y corta duración para el tratamiento del dolor rectal irruptivo. Consideran, además, que con su empleo se reducen las visitas a los servicios de urgencia y a la asistencia sanitaria general por parte de los pacientes25.
Comprimidos bucales
Según la RFE, los comprimidos bucales son “preparaciones sólidas unidosis que están destinadas a ser aplicadas en la cavidad bucal para obtener una acción sistémica”. Estos cumplen la definición general de comprimidos y deben prepararse mediante técnicas de compresión de manera que se obtengan comprimidos con una forma adecuada para el uso previsto21.
Actualmente en España se encuentra comercializado el comprimido bucal de fentanilo denominado Effentora® (Figura 3), con varias dosis: 100, 200, 400, 600, y 800 µg26.
El comprimido debe colocarse entero cerca de un molar, entre la mejilla y la encía y esperar a que se disuelva, soliendo tardar unos 14-25 minutos. El efecto analgésico comienza a los 10-15 minutos. La concentración plasmática puede disminuir en el caso de que el paciente chupe, mastique o trague el comprimido, por lo que se debe esperar a que el comprimido se vaya disolviendo por sí mismo. Tampoco deben tomar ningún alimento ni bebida cuando tengan el comprimido en la boca. Otra alternativa es colocarlo en el espacio sublingual, ya que en la ficha técnica se indica que ambas administraciones (bucal y sublingual) cumplen los criterios de bioequivalencia26.
La forma de liberación del fármaco se basa en una ligera reacción de efervescencia (la formulación contiene hidrogenocarbonato de sodio y ácido cítrico) que aumenta la velocidad y el grado de absorción del fentanilo a través de la mucosa bucal, de manera que se mejora su absorción y se consigue una biodisponibilidad del 65%15.
En un estudio comparativo, aleatorizado y cruzado realizado por Mercadante y colaboradores se comparó la eficacia y la seguridad de los comprimidos bucales de fentanilo y la morfina oral, cuando son administrados en dosis proporcionales a las dosis de opioides para el tratamiento del dolor basal. En el estudio se trataron 263 episodios de DIO y se demostró que cuando se usan dosis proporcionales al régimen de opioide basal, los comprimidos bucales de fentanilo presentan mejor eficacia y rapidez en comparación con la morfina oral y que el efecto analgésico es más intenso a los 15 y 30 minutos después de haber administrado el medicamento. Tanto el fentanilo de liberación inmediata como la morfina oral fueron bien tolerados y no se observaron efectos adversos graves27.
Comprimidos sublinguales
Los comprimidos sublinguales, según la RFE, son “preparaciones unidosis solidas que están destinadas a ser administradas bajo la lengua para obtener un efecto sistémico”. Cumplen con la definición general de comprimidos y son preparados por compresión de mezclas de polvos o granulados, de manera que se obtienen comprimidos con una forma adecuada para su uso28.
Abstral® y Avaric® son los comprimidos sublinguales que están comercializados en España para el tratamiento del DI en pacientes adultos con cáncer que están recibiendo un tratamiento de mantenimiento con opioides para tratar el dolor crónico asociado al cáncer. Existen las siguientes dosis de Avaric®: 133, 267, 400, 533 y 800 µg; y de Abstral®: 100, 200, 300, 400, 600 y 800 µg29,30.
El comprimido debe administrarse directamente bajo la lengua, en la zona más profunda (Figura 4), y hay que dejar que se disuelva completamente sin tragarlo, masticarlo o chuparlo. Tampoco se debe comer o beber mientras que el comprimido permanezca en la boca.
Avaric® emplea una formulación sublingual que desarrolló Ethypharm con una mayor biodisponibilidad y un tiempo máximo menor. Esta forma farmacéutica está formada por distintas capas. La capa de citrato de fentanilo está recubierta por una capa alcalinizante que va a aumentar la solubilidad del citrato de fentanilo y además va a favorecer la rápida disolución y absorción. El estudio realizado por Novotna y colaboradores demostró la efectividad de esta forma farmacéutica y su seguridad en el tratamiento de DI en pacientes con cáncer tratados con opioides. Además, mostraron que esta nueva formulación puede tener ventajas sobre el resto de las formulaciones de fentanilo transmucosa oral32.
Película bucal soluble
Las películas bucales son preparaciones mucoadhesivas constituidas por una o varias capas de láminas formadas por materiales adecuados, entre ellos polímeros hidrófilos que al humedecerse con la saliva forman un hidrogel que sirve para adherirse a la mucosa bucal. Estas preparaciones contienen principios activos destinados a ser absorbidos a través de la mucosa bucal y ejercer un efecto sistémico28.
El medicamento Breakyl® es una película bucal, soluble, rectangular, plana y flexible, comercializada en España desde 2012. La película tiene dos caras: una rosada que es la que contiene el citrato de fentanilo en contacto con la mucosa y otra blanca que evita que el fentanilo se libere a la saliva. Breakyl® tiene presentaciones con distintas dosis: 200, 400, 600, 800 y 1.200 µg, siendo su tamaño directamente proporcional a la dosis contenida (Figura 5)33.
Para su administración el paciente debe abrir el sobre de Breakyl® justo antes de su uso. Debe humedecer la cara interior de su mejilla con la lengua o enjugarse con agua la boca. Con las manos secas coger la película entre el pulgar y el índice y colocar la película bucal en la boca, de forma que la cara rosa entre en contacto con la cara interna de la mejilla, y mantenerlo al menos 5 segundos hasta que se adhiera. Si es necesario usar más de una película, hay que tener precaución de que no se solapen, pudiendo aplicar las películas a ambos lados de la mucosa oral. Pasados 5 minutos de su administración se pueden ingerir líquidos, pero se debe evitar tomar alimentos hasta que se haya disuelto completamente la película, lo que suele suponer entre 15 y 30 minutos33.
Preparados intranasales
Según la RFE, las preparaciones nasales son “formas farmacéuticas destinadas a ser administradas en las fosas nasales para ejercer una acción sistémica o local”. Se administran por pulverización, por lo que deben ir en un envase provisto de un dispositivo pulverizador que genere un tamaño de gota adecuado para que se depositen en la fosa nasal. Las soluciones nasales acuosas suelen ser isotónicas y contienen diversos excipientes, como un conservante antimicrobiano en el caso de presentaciones multidosis, si la solución no presenta por sí misma suficiente capacidad antimicrobiana35.
Para la administración intranasal de fentanilo, se comercializan en España dos medicamentos: Instanyl®, solución acuosa que contiene fentanilo en solución acuosa tamponada36 y PecFent®, spray con fentanilo en una matriz de pectina37. El primero se encuentra comercializado con las dosis de 50, 100 y 200 µg/dosis; además, hay una presentación unidosis. Y el segundo con 100 y 400 µg/pulverización.
A pesar de que ambos medicamentos utilizan la vía nasal, sus formulaciones y mecanismo de liberación del fentanilo son distintas. PecFent® utiliza el sistema PecSys®, que contiene pectina y permite una vaporización fina de microgotas que al entrar en contacto con los iones calcio de la mucosa nasal se gelifican, formando un gel adhesivo. Este gel libera el fentanilo que será absorbido rápidamente a través de la mucosa nasal, pero de una forma más controlada que en la otra presentación. De esta manera se consigue, por un lado, disminuir la concentración máxima, evitando picos plasmáticos indeseados causantes de los efectos adversos del fármaco, como la sedación, pero manteniendo la concentración terapéutica durante el episodio de DIO y, por otro, un tiempo máximo corto que permita un inicio de acción rápido7.
Mercadante y colaboradores realizaron un estudio comparativo, aleatorizado y cruzado para evaluar la eficacia analgésica y las reacciones adversas de estas dos presentaciones de administración intranasal para el tratamiento del DIO. Se seleccionaron para el estudio un total de 70 pacientes y se trataron 188 episodios de DIO, de los cuales en 91 se administró fentanilo intranasal y en 97 spray de fentanilo-pectina. Este estudio demostró que, aunque las dos presentaciones tienen biodisponibilidades y perfiles farmacocinéticos distintos, ambas son igualmente eficaces y bien toleradas para el tratamiento del DIO cuando se administran en dosis proporcionales al régimen de opioide basal. Además, la mayoría de los pacientes no mostró preferencia por ninguna de las dos presentaciones, ya que no encontraron diferencias significativas entre ambas19.
Estudio comparativo entre las distintas presentaciones de fentanilo de liberación inmediata
Como ya se ha comentado, los distintos medicamentos de liberación inmediata de fentanilo presentan distintos perfiles farmacocinéticos y biodisponibilidades, lo que hace que estas presentaciones no sean intercambiables entre ellas, aunque sí hay evidencias de que todas ellas son mejores alternativas a la morfina de liberación inmediata para el tratamiento del DIO38. La tabla 3 ofrece un resumen global comparativo de las formulaciones de liberación inmediata de fentanilo.
Tabla 3. Estudio comparativo de las distintas presentaciones de fentanilo de liberación inmediata transmucosa
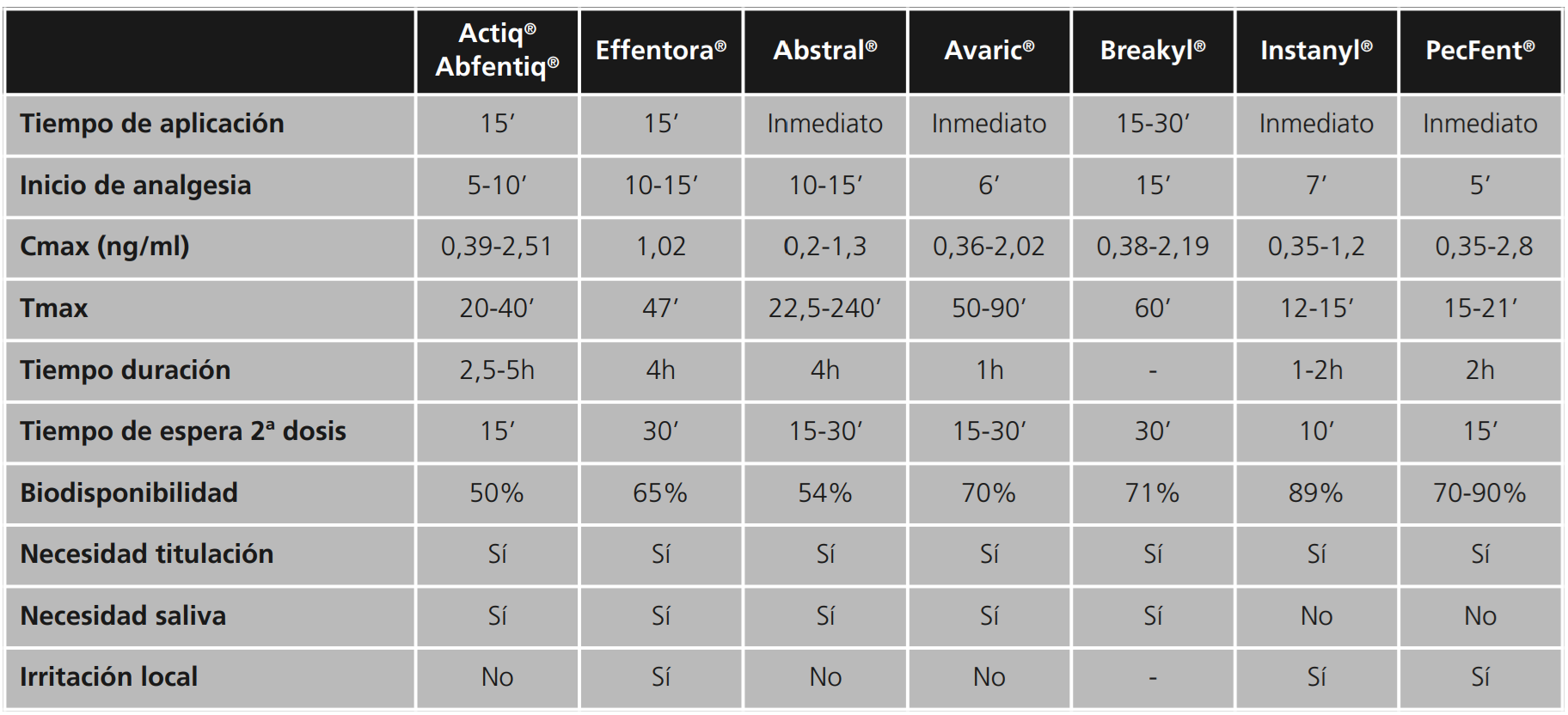
Los comprimidos para chupar con aplicador bucal integrado, Actiq® y Abfentiq®, al ser administrados en la mucosa bucal evitan el efecto de primer paso hepático. La parte absorbida a través de la mucosa bucal es la responsable del rápido inicio de acción y de la alta biodisponibilidad. Aproximadamente el 25% de la dosis total es absorbida en la mucosa bucal, mientras que el 75% restante de la dosis total se traga y se absorbe lentamente en el tracto gastrointestinal, alcanzando una biodisponibilidad absoluta de en torno al 50%. El efecto analgésico se inicia entre 5-10 minutos y las concentraciones de fentanilo se mantienen en el intervalo analgésico durante unas 2,5-5 horas38.
Estos preparados deben ser autoadministrados por el paciente, durando dicha administración unos 15 minutos, lo cual puede ser un inconveniente para pacientes crónicos deteriorados, con falta de destreza o con mala función cognitiva39. No obstante, presentan algunas limitaciones con respecto a la absorción ya que ésta puede ser variable en función de la técnica de administración: puede reducirse si la cantidad de saliva del paciente ha disminuido, si se administra sobre la lengua o las encías en lugar de sobre la mucosa bucal y si se mastica. Además puede verse alterada si antes de la administración del fármaco el paciente ha tomado líquidos que modifican el pH oral38.
El comprimido bucal Effentora®, gracias a la tecnología OraVescent®, produce una reacción de efervescencia, al entrar en contacto con la saliva, que liberará dióxido de carbono para producir ácido carbónico en la boca, disminuyendo así el pH y favoreciendo la disolución del fentanilo en forma ionizada en la saliva. Este ácido carbónico formará carbonato de sodio, aumentando el pH del medio y pasando el fentanilo a forma no ionizada, de manera que se pueda absorber por la mucosa bucal40. Así se consigue que, aproximadamente, el 50% de la dosis administrada se absorba a través de la mucosa bucal rápidamente. En cambio, el otro 50% es la parte de la dosis que se traga y que se absorberá más lentamente en el tracto gastrointestinal. Se consigue una biodisponibilidad absoluta del 65%. La disgregación del comprimido suele tardar unos 15 minutos y el efecto analgésico se inicia a los 10-15 minutos15.
Con respecto a los comprimidos sublinguales, Abstral® se disuelve rápidamente gracias a su formulación, con una biodisponibilidad absoluta del 54%. Sin embargo, Avaric® gracias a una tecnología que permite la liberación rápida del fentanilo, aumenta la velocidad y el grado de absorción con una biodisponibilidad absoluta del 70%.
Jandhyala y Fullarton realizaron un interesante estudio de los comprimidos bucales, sublinguales y para chupar de fentanilo, con el fin de comparar la eficacia entre estas tres formas farmacéuticas. Según dichos resultados, estos autores afirman que los comprimidos bucales presentan mejor eficacia que los sublinguales y para chupar en el tratamiento del DIO. Además, confirman que estas tres presentaciones de liberación inmediata son mejores alternativas que la morfina de liberación inmediata para el tratamiento del DIO41.
Con respecto a la película bucal soluble, Breakyl®, posee una absorción rápida por la mucosa bucal que supone el 51% de la dosis total administrada y que pasa directamente a circulación sistémica. El resto de dosis se traga y se absorbe en el tracto gastrointestinal con lo que la biodisponibilidad absoluta es del 71%. La película se disuelve en unos 15-30 minutos, iniciándose el efecto analgésico sobre los 15 minutos38.
Los preparados intranasales inician el efecto analgésico rápidamente, entre 5-7 minutos, con una elevada biodisponibilidad absoluta en torno al 89% (la mayor de todas las presentaciones de absorción transmucosa) aunque el efecto analgésico solo es de unas 2 horas38.
La absorción de fentanilo en este tipo de presentación puede variar en función de la cantidad de dosis que pueda gotear o que se trague y sufra efecto de primer paso, lo cual podría modificar la respuesta terapéutica. Esto es menos probable cuando se usa la solución para pulverización nasal con pectina, PecFent®, ya que este sistema, gracias a la formación de un gel, evita el goteo nasal, la ingestión del medicamento y reduce el aclaramiento mucociliar del fármaco15,38.
Como conclusión final de este apartado puede deducirse que estas formas de administración de fentanilo constituyen la mejor opción para el tratamiento del DI dada su rapidez de acción en comparación con otros opioides de liberación inmediata42.
Parches transdérmicos
Según la RFE, “los parches transdérmicos son formas farmacéuticas flexibles de tamaño variable destinados a ser aplicados sobre la piel intacta para obtener un efecto sistémico al alcanzar el principio activo la circulación sistémica tras atravesar las capas de la piel”. Están formados por una cubierta externa impermeable que hace de soporte de la preparación que contiene el principio activo y que sirve de protección. Además, tienen una banda en la cara que corresponde a la superficie de liberación, que es la que se retira antes de aplicar el parche sobre la piel. La formulación que contiene al principio activo puede encontrarse en forma de reservorio o de matriz43.
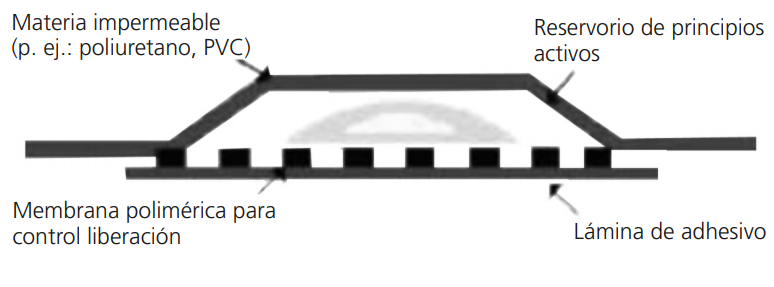
Los parches de fentanilo que se utilizaban tradicionalmente eran los de tipo reservorio, en los que la preparación del fármaco es líquida, siendo una membrana polimérica el elemento que controla la liberación del fentanilo. El medicamento está formado por una capa de revestimiento, la formulación con fentanilo, la membrana de liberación controlada y una capa adhesiva (Figura 6). Estos parches contienen una cantidad elevada de fármaco, que además puede ser fácilmente extraída y usada con fines de ocio y abuso. También pueden presentar una importante variación interindividual en la cantidad de principio activo liberada y el reservorio puede dañarse o cortarse, pudiendo provocar una sobredosis o la pérdida del principio activo44.
Debido a todos estos inconvenientes se desarrollaron nuevos parches transdérmicos de tipo matricial. En este sistema el fentanilo está dispersado homogéneamente en una matriz polimérica semisólida de un adhesivo de poliacrilato, es decir, la propia matriz que contiene al fármaco es la que también actúa como capa adhesiva (parche de primera generación) (Figura 7a). Este nuevo tipo de parches resuelve algunos de los inconvenientes citados, ya que esta nueva presentación evita las posibles pérdidas de fentanilo al dañarse el reservorio y además presenta una mayor dificultad para extraer el principio activo y que sea usado como droga de abuso. Sin embargo, estos parches matriciales tienen una cantidad de fentanilo aun mayor que los parches de tipo reservorio y presentan dificultades a la hora de ser aplicados ya que son más finos, lo que hace que puedan pegarse con facilidad sobre sí mismos, y transparentes, por lo que aumenta la probabilidad de que el paciente olvide retirárselo, aumentando el riesgo de duplicar la dosis.

Figura 7. Parches de tipo matricial. (a) matriz convencional o de primera generación y (b) matriz con membrana de control o de segunda generación45
Esto motivó el desarrollo de una segunda generación de parches matriciales, los cuales incorporan una membrana de control de la velocidad de liberación entre la matriz y la capa adhesiva (Figura 7b)45. Su función es hacer que la liberación del fentanilo desde la matriz sea más lenta que su difusión a través de la piel. Así, la membrana de control permite un paso progresivo de fentanilo a la piel (sólo un 30% en 4h vs. 90% con los parches de matriz convencional), disminuyendo el riesgo de sobredosificación. Por otro lado, garantiza una mayor estabilidad de las concentraciones plasmáticas de fentanilo durante 3 días con un alivio sostenido del dolor. La membrana ejerce de factor limitante de la velocidad de absorción del fármaco, a diferencia de los parches tradicionales o de primera generación donde la piel tiene este papel46.
Con respecto a la intercambiabilidad entre los distintos tipos de parches, Torres y colaboradores47 indican “que dada la potencia de fentanilo y los posibles cambios en la concentración plasmática al intercambiar una presentación por otra, la intercambiabilidad sólo debería realizarse bajo el control del médico que inició el tratamiento o por el médico responsable del paciente, al objeto de mantener la analgesia conseguida y evitar la aparición de efectos adversos”.
En España no se encuentra comercializado ningún parche de tipo reservorio, pero sí que hay de los dos tipos de parches matriciales. Entre los parches transdérmicos de fentanilo con matriz adhesiva pueden citarse los de los laboratorios Stada, Ratiopharm, Normon, Mylan, Kern Pharma, Aurovitas Spain, Sandoz, Cinfa, Aristo y las marcas Durogesic® Matrix® y Dolaxital®. Con sistema matricial de segunda generación están comercializados Fendivia®, Matrifen® y Durfenta®. Además, los parches transdérmicos de fentanilo están disponibles en varias dosis: 12, 25, 50, 75 y 100 µg/h.
En las formas farmacéuticas de liberación inmediata estudiadas anteriormente se señaló que su indicación era el tratamiento del DIO en adultos que ya recibían tratamiento con opiáceos para el control del dolor basal. En cambio, los parches transdérmicos están indicados para el control del dolor crónico intenso, que requiere la administración continua de opioides a largo plazo48.
Actualmente estos sistemas se pueden usar para el dolor crónico intenso en general. Sin embargo, su aparición en el mercado fue debido a las limitaciones que presentaba la morfina de administración parenteral en pacientes oncológicos, como era la dificultad de administración en pacientes ambulatorios, lo que estimuló el desarrollo de estas nuevas formas de administración. El fentanilo posee una serie de características, como son su bajo peso molecular, su alta liposolubilidad y alta potencia, que lo hacen un candidato ideal para administrarse por vía transdérmica, desarrollándose esta forma farmacéutica que permite la liberación de una dosis constante durante 3 días. Además, la permeabilidad de la piel para el fentanilo es de 0,0021 ml·min-1·(cm2)-1, cifra mucho menor que el flujo sanguíneo en la piel, lo que también influye en la absorción. De esta forma, solo podrían llegar a afectar en la absorción de fentanilo condiciones extremas en el flujo sanguíneo49.
La utilización de esta vía de administración para el fentanilo ofrece una serie de ventajas como son: evita las variaciones en la absorción y el metabolismo en la administración oral; evita el efecto de primer paso, por lo que se mejora la biodisponibilidad; permite la administración de fármacos con una semivida muy baja; logra concentraciones plasmáticas constantes, evitando los valles y picos plasmáticos que podrían causar los efectos adversos; y obtiene un régimen terapéutico muy bien aceptado por los pacientes50.
El parche transdérmico de fentanilo debe aplicarse en el torso o en la parte superior de los brazos. Se recomienda aplicar en la zona superior de la espalda en los niños, para evitar que puedan quitárselo. La zona de aplicación no debe estar irritada ni tener vello, en el caso de que así sea, el vello debe cortarse, no afeitarse, para evitar que puedan provocarse microheridas en la piel que afecten a la absorción del principio activo al alterar la piel. Si la zona de aplicación necesita limpiarse antes de la aplicación del parche no se deben usar jabones, aceites, lociones, etc., ya que pueden alterar las características de la piel o irritarla. Se limpiará únicamente con agua, y debe secarse bien antes de aplicar el parche. Una vez preparada la zona, se debe comprobar que el parche no está dañado o cortado, quitar la capa protectora y aplicar sobre la piel presionando suavemente con la palma de la mano durante unos 30 segundos. Finalmente hay que comprobar que los bordes están correctamente adheridos y lavarse las manos posteriormente48.
Una vez aplicado el parche, se produce una liberación sistémica continua (proceso cinético de orden 0) del principio activo durante 72 horas50. La liberación del principio activo se debe al gradiente de concentración que hay entre el parche y la menor concentración en la piel. La piel absorbe el fentanilo de manera que se crea un reservorio en las capas altas de ésta. A partir de dicho reservorio, el fentanilo difunde a través de la piel hasta alcanzar la circulación sistémica y ejercer su efecto. Son la matriz polimérica y la difusión del fentanilo a través de las capas de la piel las que garantizan que la liberación sea constante, consiguiendo una biodisponibilidad del 92%48, lo que indicaría que el fármaco no es degradado ni por el metabolismo cutáneo ni por la microbiota50.
Sin embargo esta absorción puede verse afectada por distintos factores como son la temperatura corporal y el flujo sanguíneo periférico, que en pacientes con fiebre incrementa un tercio la absorción del fentanilo, por lo que podría aparecer toxicidad. El ejercicio físico, que al incrementar el flujo sanguíneo cutáneo aumenta el paso del fentanilo a circulación sistémica desde el reservorio y una excesiva hidratación y presión sobre la zona de aplicación pueden aumentar también su absorción50.
Tras la aplicación inicial, las concentraciones plasmáticas de fentanilo aumentan gradualmente y se estabilizan entorno a las 12-24 horas, permaneciendo constantes durante el resto de la aplicación. Dos horas después de la aplicación del parche ya se detectan concentraciones plasmáticas de fentanilo, pero hasta pasadas 8 horas no aparece su efecto analgésico, por eso podría ser necesario administrar una dosis de rescate49.
Una vez retirado el parche, la concentración plasmática de fentanilo cae lentamente a la mitad en unas 16-20 horas, debido al reservorio de fármaco formado en la piel. Esto puede ser útil porque permite seguir teniendo controlado el dolor entre 12-24 horas después de haber quitado el parche. Pero, también hay que tener en cuenta que los efectos adversos pueden continuar una vez retirado el parche49.
Consumo de opioides en España. Caso particular del fentanilo
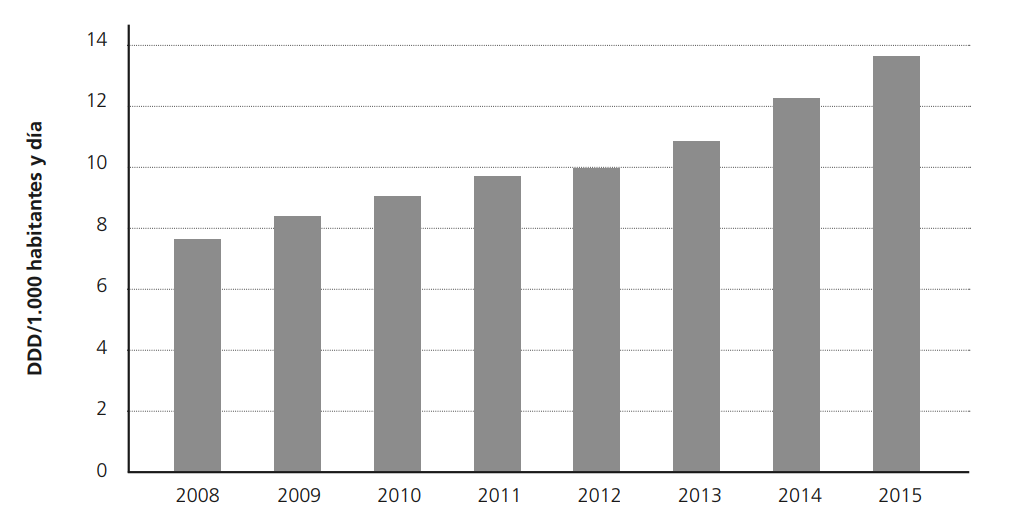
El 21 de febrero de 2018, la AEMPS publicaba una nota informativa para comunicar la importancia de respetar las condiciones de uso autorizadas para los medicamentos de liberación inmediata de fentanilo20. Esta nota aparece como consecuencia del aumento creciente del consumo global de fentanilo en España. Según el informe de utilización de medicamentos opioides en España durante los años 2008-2015, el consumo de éstos era en 2008 de 7,25 DHD (dosis diarias definidas por 1.000 habitantes y día), pasando en 2015 a ser de 13,1 DHD (Figura 8)51.
El informe hace referencia a que durante este periodo de tiempo los principios activos comercializados han permanecido más o menos estables, se ha comercializado la combinación de tapentadol y oxicodona, y han dejado de estar en el mercado dihidrocodeína y dextropropoxifeno porque no tenían un consumo muy elevado. Además, se han comercializado nuevas formas farmacéuticas de liberación rápida de fentanilo, tanto orales como nasales.
El fentanilo representa el 17,51% del consumo total de opioides en España en el 2015, pasando de 1,43 DHD a 2,33 DHD, casi el doble. La forma más usada es la de fentanilo transdérmico, que supone el 84% del total del consumo de fentanilo51.
En más del 40% de los casos se utilizó el fentanilo de liberación inmediata en pacientes con dolor irruptivo no oncológico, indicación que no está autorizada para estos medicamentos. De esta forma aumenta el riesgo al abuso y/o dependencia, ya que a nivel mundial la mayor proporción de casos de abuso y dependencia se ha dado en pacientes que estaban usando estas formas farmacéuticas fuera de indicación. Según el Sistema Español de Farmacovigilancia, aproximadamente el 60% de los casos notificados de abuso y/o dependencia como sospecha de reacción adversa eran pacientes que lo usaban para una indicación no autorizada en la ficha técnica. Basándose en estos datos la AEMPS alerta del riesgo que conlleva usar dichos medicamentos fuera de su autorización, por lo que se recomienda respetar las condiciones de autorización de las formas de fentanilo de liberación inmediata para disminuir el riesgo de abuso y/o dependencia, utilizándose exclusivamente para su indicación autorizada, el tratamiento del DIO20,52.
Debido a este elevado riesgo de provocar abuso y/o dependencia, en otros países como es el caso de Estados Unidos, sólo puede accederse al fentanilo transmucosa a través de un programa restringido de la FDA, denominado Estrategia de Evaluación de Riesgos y Mitigación. Para prescribir estos medicamentos los médicos tienen que realizar una formación específica online y tanto médicos como farmacéuticos deben llevar un registro específico de cada paciente. De esta forma se pretende reducir el riesgo de abuso y sobredosis no intencionada. Sin embargo, en España estas precauciones no se llevan a cabo todavía53.
En el mes de marzo de 2019, el grupo de trabajo de opioides de la SED llegó a una serie de conclusiones sobre el manejo de los mismos54. Este grupo consideró que, aunque la epidemia de opioides continúa en EE.UU., no existe esta epidemia ni en España ni en Europa, ya que, aunque es cierto el aumento considerable del consumo de opioides en Europa (en España el consumo se ha doblado en los últimos 20 años), las cifras de consumo son mucho menores que las de EE.UU. El pasado 2018 murieron 611 personas debido al abuso de fentanilo en España, a pesar de que el consumo de éste es bajo. Lo que está claro es que el peligro del fentanilo no está en el fármaco mismo, sino en cómo se usa éste. Por eso es fundamental la correcta formación de los profesionales sanitarios y los pacientes en el uso correcto de estos medicamentos. Así, como saber detectar en los pacientes, mediante escalas, el riesgo de abuso de opioides que presentan y que podrían provocar la adicción. Algunos de estos factores de riesgo son: la asociación de opioides con benzodiazepinas; antecedentes de abuso o psiquiátricos; edad, especialmente jóvenes; abuso del alcohol y los problemas sociales e individuales del paciente.