INTRODUCCIÓN
La hemofilia es un trastorno hemorrágico de origen genético ligado al cromosoma X. Se caracteriza por una deficiencia del factor VIII de la coagulación (FVIII), en el caso de la hemofilia A (HA), o del factor IX (FIX), en el caso de la hemofilia B. Esta deficiencia, impide una normal coagulación de la sangre, incrementándose el riesgo de sufrir hemorragias, que afectan preferentemente a articulaciones y músculos1.
La frecuencia estimada de esta enfermedad es de aproximadamente 1 caso por cada 10.000 nacimientos. En España, alrededor de 3.000 personas están afectadas por esta patología congénita, siendo la HA la más frecuente representando entre el 80 y el 85% de la población total de personas con hemofilia1,2.
El tratamiento estándar actual en los pacientes con HA es de tipo sustitutivo del factor FVIII deficitario como profilaxis o a demanda. Su administración es intravenosa, la dosis y la frecuencia dependen de la gravedad de la enfermedad y de la localización de la hemorragia1.
Alrededor del 30% de los pacientes con HA desarrollan anticuerpos neutralizantes frente al factor VIII, lo que disminuye la eficacia de su infusión. La presencia de estos inhibidores se relaciona con eventos hemorrágicos graves, mayor morbi/mortalidad, efecto negativo sobre la calidad de vida, además de aumentar el coste del tratamiento. Los pacientes con altos títulos de anticuerpos inhibidores requieren tratamiento con agentes bypass, Factor VII activado recombinante (rFVIIa-Novoseven®), o el concentrado del complejo protrombínico activado (aPCC-Feiba®), de alto coste económico3.
En la actualidad, la inducción a la tolerancia inmunológica (ITI) constituye la única opción efectiva hasta el momento para reestablecer los niveles de FVIII. La ITI consiste en la administración intensiva y periódica de FVIII durante un periodo de tiempo hasta inducir la tolerancia inmunitaria y el borrado del inhibidor4.
El coste anual promedio resultante para pacientes con HA que desarrollan inhibidor en España se estima en 430.227 €5, lo que supone una importante carga económica para el sistema sanitario. Por ello, es prioritario el diseño de estrategias cuyo objetivo sea evitar la aparición de los mismos y prevenir los sangrados.
Recientemente ha sido autorizado en España un nuevo fármaco para pacientes con HA e inhibidores, denominado emicizumab. Éste, es un anticuerpo recombinante humanizado FIXa/X de administración subcutánea, que imita la actividad del factor VIIIa posibilitando la asociación de los factores IXa y X, proteínas necesarias para la activación de la cascada natural de la coagulación, y restablecer el proceso de la coagulación sanguínea en pacientes con HA6.
El presente estudio tiene como objetivo estimar el impacto económico del uso de emicizumab en pacientes con HA e inhibidor en un hospital de tercer nivel, comparándolo con las alternativas terapéuticas disponibles hasta el momento para esta patología.
MATERIAL Y MÉTODOS
Para realizar el estudio farmacoeconómico de la HA e inhibidor en nuestro hospital, nos basamos en un estudio español de análisis de costes5 publicado en 2018, en el cual se estiman los costes medios anuales del tratamiento en España para pacientes con HA grave que han desarrollado inhibidores.
Siguiendo este estudio, se estratificaron los pacientes por: a) grupos de edad: pediátricos (<14 años y peso medio 27,6 kg) y adultos (≥14 años y peso medio 72,9 kg), y b) estrategia terapéutica. Dentro de esta estrategia, el estudio considera dos opciones de tratamiento de los episodios hemorrágicos, profiláctico y a demanda. Nosotros añadimos también la ITI como opción terapéutica, ya que es el tratamiento de elección para la erradicación de inhibidores en los pacientes que los desarrollan.
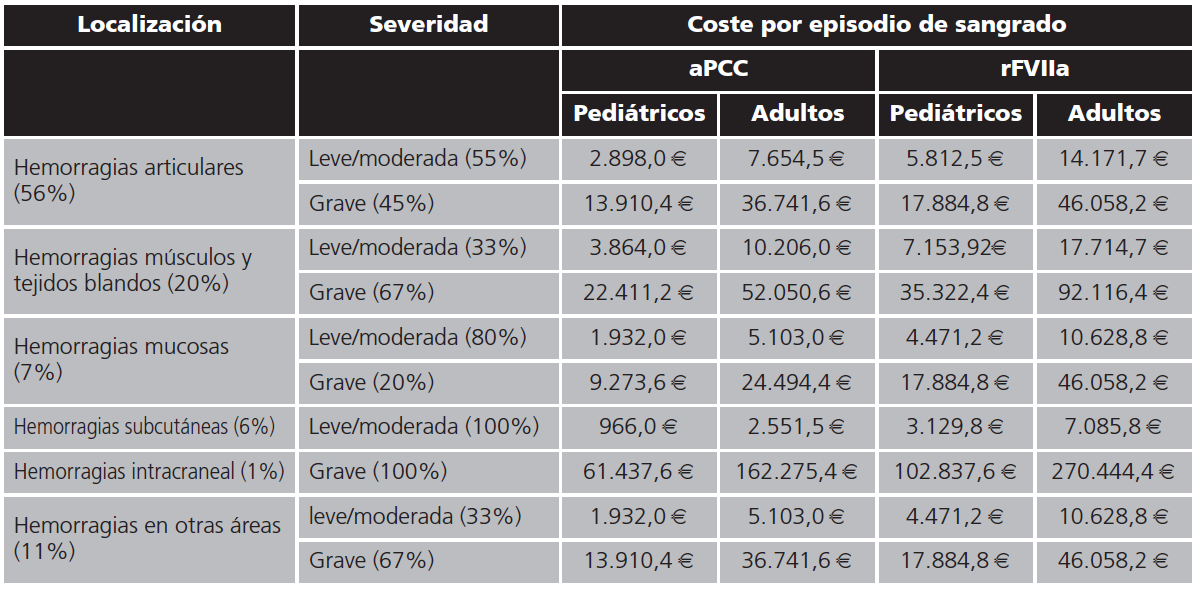
Para calcular el coste del tratamiento de los episodios hemorrágicos, se clasificaron por frecuencia en 6 posibles localizaciones (Jimenez-Yuste)5: articulares (56%), músculos y tejidos blandos (20%), mucosas (7%), subcutáneas (6%), intracraneales (1%) y otras áreas (11%). Además, se subdividieron en función de su gravedad en leves/moderadas o graves. El criterio que se empleó para clasificarlos según severidad, dependía del número de infusiones necesarias para el control de la hemorragia. Los episodios controlados con ≤3 infusiones se clasificarían como episodios leves/moderados7.
La dosis para la estrategia profiláctica, se estableció para el complejo de factores activados aPCC tanto para pacientes pediátricos como adultos, en 80 µg/kg tres veces a la semana. Esta es la pauta que más se ajusta a nuestra población, dentro del rango de dosificación indicado en ficha técnica8. Además, se consideraron 9 hemorragias/año para pacientes con este tipo de estrategia5.
Los costes de los episodios de sangrado con la estrategia a demanda se obtuvieron del análisis de coste anual nacional, teniendo en cuenta los costes unitarios en nuestro hospital de los diferentes factores empleados, en el momento de realizar en análisis: 0,54 €/UI para aPCC, 0,70 €/µg para rFVIIa. En este tipo de estrategia, se estimó un promedio de 19 hemorragias/año5.
Para la estrategia de ITI se tuvieron en cuenta los regímenes empleados en un estudio multinacional9 de pacientes con HA y altos títulos de inhibidores en tratamiento con ITI. Por un lado, un régimen de dosis baja de FVIII (50 UI FVIII/kg tres veces a la semana) y, por otro lado, un régimen de dosis altas de FVIII (200 UI FVIII/kg cada 24 horas). El número de episodios hemorrágicos estimados anuales para el régimen a dosis baja fue de 7,44 (0,62 episodios mensuales) y 3,36 episodios hemorrágicos (0,28 episodios mensuales) para el régimen a dosis altas. Para calcular el coste anual de la estrategia ITI se tuvo en cuenta el precio medio unitario al que se compraban los distintos FVIII disponibles en el hospital en el momento del análisis: 0,50 €/UI FVIII.
Para estimar el impacto económico de emicizumab, se emplearon las dosis aprobadas en la ficha técnica10 del medicamento y los precios netos a fecha de realización del análisis: vial 30 mg/ml = 2.213,68 €; vial 60 mg/0,4 ml = 4.427,36 €; vial 105 mg/0,7 ml = 7.747,89 €; vial 150 mg/ml = 10.216, 99 €. Además, se tuvieron en cuenta los posibles eventos hemorrágicos que habría que tratar a pesar de profilaxis con emizicumab. Para ello, recurrimos al ensayo en fase III Haven 111 en el que se incluyen pacientes ≥12 años con hemofilia A con inhibidores del factor VIII. En este estudio, se evalúa la tasa anual de sangrados de pacientes que habían recibido anteriormente tratamiento a demanda o profiláctico con agentes bypass frente a emicizumab. La tasa anual de sangrados fue de 2,9 eventos en el grupo con emicizumab. Además, todos los episodios notificados fueron de tipo leve/moderado tratados con Novoseven® a una dosis que se estableció para hacer nuestro análisis de 60 µg/kg.
RESULTADOS
El coste de los episodios de sangrados por paciente en nuestro hospital (Tabla 1), teniendo en cuenta la localización y severidad del mismo, así como del factor bypass empleado, se estimó en 966,0 € para un paciente pediátrico con hemorragia subcutánea tratado con el factor aPCC hasta los 270.444,4 € para un paciente adulto que sufre una hemorragia intracraneal tratado con el factor rVIIa.
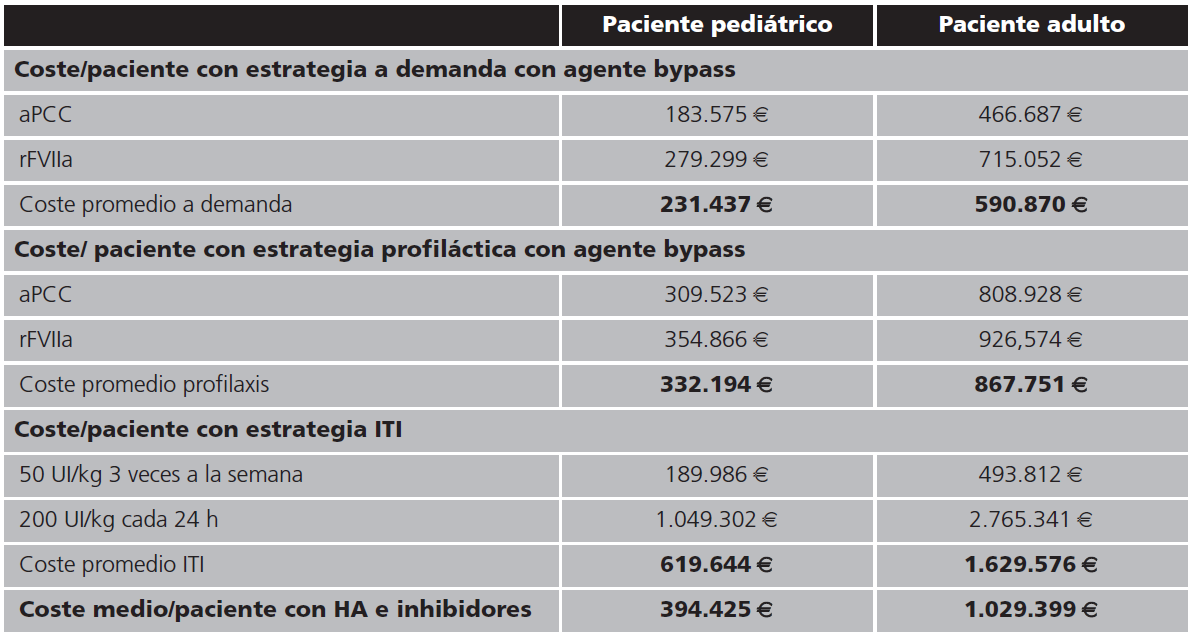
Se obtuvo un coste promedio anual en nuestro hospital del tratamiento a demanda para un paciente pediátrico de 231.437 €, oscilando desde 183.575 € para aquellos tratados con aPCC y de 279.299 € para aquellos tratados con rVIIa. El coste promedio anual del tratamiento a demanda para un paciente adulto ascendería a 590.870 € siendo de 466.687 € para aquellos tratados con aPCC y de 715.052 € para los tratados con rVIIa (Tabla 2).
El coste promedio del tratamiento con emicizumab de forma profiláctica para un paciente pediátrico fue de 243.505 € para el primer año y de 230.223 € para el resto de los años. En el caso del paciente adulto, el coste promedio anual del tratamiento con emicizumab el primer año fue de 433.882 € seguido de 402.890 € el resto de los años. Si a este tratamiento de mantenimiento con emicizumab tenemos en cuenta las 2,9 hemorragias/anuales estimadas en el estudio en fase III Haven 111, el coste medio estimado anual para un paciente pediátrico en nuestro hospital fue de 246.866 € para el primer año y de 233.584 € el resto de los años y para un paciente adulto de 442,762 € para el primer año seguido de 411.770 € para el resto de los años.
Comparando los precios medios anuales estimados para un paciente pediátrico tratado con emicizumab, con los costes medios de uno tratado con una estrategia terapéutica a demanda, observamos que el tratamiento con la nueva estrategia supone un aumento del coste medio anual del 3,7%. En el caso de un paciente pediátrico con estrategia profiláctica, el ahorro medio anual con emicizumab sería del 27,7% y en el caso de un paciente pediátrico con estrategia ITI, el coste medio anual con emicizumab sería un 61,2% menor.
En el caso de los pacientes adultos, si comparamos costes medios anuales del tratamiento con emicizumab frente a las otras alternativas terapéuticas valoradas, observamos que, en el caso de la estrategia a demanda, este supondría un coste medio anual del 27,7% más, en el caso de la estrategia profiláctica de un 50,76% más y en el caso de la estrategia con ITI, un 73,8% más.
DISCUSIÓN
La HA es una enfermedad que tiene un gran impacto económico, además de sanitario y social. La complicación más importante del tratamiento de la HA, es el desarrollo de inhibidor (~30% de incidencia), asociado a una alta morbilidad así como a un aumento de los costes5.
Existen diferentes estrategias terapéuticas para aquellos que los desarrollan, siendo la ITI la primera opción terapéutica y única capaz de erradicar los inhibidores. Los agentes bypass suelen utilizarse cuando la ITI fracasa o no es posible utilizarla, aunque también se utilizan antes, durante o después de la ITI. La elección va a depender de los protocolos de los distintos centros y características individuales de cada paciente3,4.
El tratamiento sustitutivo con FVIII de la HA es de por vida, requiriendo el empleo de la vía intravenosa, por lo que los pacientes se ven sometidos a infusiones por esta vía diariamente o varias veces a la semana. Esto acaba desembocando en un cumplimiento deficitario, lo que supone una mayor tasa de hemorragias, que terminan provocando daño en articulaciones y discapacidad en el paciente, con sus gastos asociados12,13,14.
Recientemente, el anticuerpo monoclonal emicizumab se ha incorporado al arsenal terapéutico de esta enfermedad al ser autorizado, además de financiado, por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), para profilaxis de episodios de sangrado en pacientes con hemofilia A e inhibidores del factor VIII. Emicizumab reduce significativamente el número de episodios de sangrado, aunque no es útil en el sangrado agudo, y tiene como ventaja añadida su uso por vía subcutánea10,11.
Se han publicado diversos estudios que analizan en coste del tratamiento de la HA con inhibidor utilizando diversas metodologías, pero no encontramos estudios comparativos con emicizumab. La comparación con estudios de otros países es difícil de realizar al variar el peso corporal de referencia, número de episodios hemorrágicos, pautas terapéuticas, coste de los fármacos, aunque no son muy dispares15,16,17.
Nuestro análisis de costes es claramente favorable al emicizumab, determinando un ahorro global del 39,1% en la población pediátrica y del 58,5% para la población adulta cuando se compara con la estrategia profiláctica (aPCC), a demanda con rFVIIa o aPCC e ITI con factor VIII. Este efecto se mantiene cuando se analiza cada estrategia de forma individual, salvo en el caso del tratamiento a demanda en niños que fue un 3,7% superior.
Es importante tener en cuenta en este estudio, que los datos obtenidos nos muestran solamente los gastos directos del uso de los diferentes medicamentos, se estiman que representan el 90% del total18. En ningún caso, se consideran los gastos indirectos o de afectación de la calidad de vida de los pacientes. Con esto nos referimos especialmente a las complicaciones musculo-esqueléticas causadas por los hemartros recurrentes, el tratamiento rehabilitador requerido, así como infecciones, hospitalizaciones y procedimientos quirúrgicos, y las asociadas al mal cumplimiento terapéutico19.
En este aspecto, con emicizumab, tal y como se muestra en el ensayo pivotal fase III Haven 111, la mediana anual de sangrados fue significativamente inferior cuando se comparaba con el tratamiento a demanda con agentes bypass [0 (0; 3,73) vs. 18,8 (12,97; 35,08)] o con el porcentaje de pacientes con 0 sangrados en los tratados a demanda con aPCC (5,6 vs. 62,9). Cuando se comparaba con la profilaxis con agentes bypass, la tasa anual de sangrados también era significativamente inferior [0 (0,00; 2,23) vs. 12,0 (5,73; 24,22)]. Estos datos además se reproducen con valores muy similares en los estudios pivotales en fase III Haven 2, 3 y Haven 420,21,22.
Teniendo en cuenta todos estos datos, con emicizumab estaríamos evitando muchos de estos costes indirectos asociados, frecuentes con el resto de estrategias terapéuticas.
Nuestros datos también muestran un ahorro significativo cuando se compara emicizumab con la estrategia ITI (61,2% pacientes pediátricos, 73,8% en población adulta). Sin embargo, hay que considerar que, al realizar el análisis de costes de la estrategia ITI, podríamos haber sobreestimado el coste del mismo. Para hacer un correcto análisis de esta estrategia, hay que tener en cuenta además del tiempo medio de desensibilización (12 meses), otras variables como el porcentaje de pacientes que responden a esta terapia (50-80%)9 y que por lo tanto dejarán de tener inhibidores, y por otro lado, el porcentaje de pacientes que recaen, entre el 20-50% según diferentes autores9,23. Por otra parte, en sentido contrario, también sería necesario considerar el gasto asociado al uso de agentes bypass como profilaxis durante la ITI para prevenir episodios de sangrado. En este caso, el emicizumab también podría tener un papel, aunque se precisan más estudios24.
Nuestro estudio tiene diversas limitaciones. Se trata de una estimación de costes directos basada en precios farmacéuticos de un solo hospital. Los regímenes terapéuticos, frecuencia hemorragias, localización y gravedad de las mismas, se han obtenido de la literatura. Aunque existe una amplia variabilidad clínica de la enfermedad y en las estrategias terapéuticas entre los distintos centros que tratan estos pacientes, consideramos que los datos utilizados en el análisis son representativos de la enfermedad y podrían ser extrapolables a otros centros.
A falta de más estudios, emicizumab, además de aportar mejoras clínicas y de calidad de vida a los pacientes con HA, ofrece ventajas económicas en determinadas situaciones, previamente descritas.
Conflicto de intereses: Juan Cuesta Tovar es Asesor científico para Roche. Ha participado en advisory boards de Bayer, Takeda, CLS Behring y Sobi y ha participado como ponente en eventos formativos patrocinados por Roche, Takeda, Novonordisk, y Sobi. Ana Andrea García Sacristán ha participado en un evento formativo de Roche. Nerea Domínguez ha dado charlas para Takeda y ha participado en Advisory Board para Grifols en el pasado.