INTRODUCCIÓN
El mieloma múltiple es un tipo de neoplasia crónica de la médula ósea que se produce por una degeneración maligna de las células plasmáticas o plasmocitos, que forman parte del sistema inmune al ser las encargadas de producir anticuerpos1. Con una edad media al diagnóstico de 65 años (menos del 15% de los casos se dan por debajo de los 50 años), se diagnostican 3-5 casos/año por cada 100.000 habitantes2. Es una enfermedad más frecuente en las personas de raza negra, en las que suele evolucionar de forma más agresiva.
En el mieloma, las células anormales del plasma producen solamente un tipo de anticuerpos, llamado paraproteínas, que impiden la formación de anticuerpos normales. La medida de estas paraproteínas proporciona información para el diagnóstico y control del mieloma. Las células malignas se dividen y extienden dentro de la médula ósea, propagándose a otros lugares del cuerpo donde normalmente la médula ósea es activa (espina dorsal, cráneo, pelvis, costillas, áreas alrededor de hombros y caderas). Las extremidades no suelen verse afectadas.
La clínica se debe a la acumulación de células malignas en la médula y a la presencia de paraproteínas en sangre u orina. Los síntomas más comunes son: dolor óseo, fracturas, astenia, anemia, infecciones recurrentes (neumonías, infecciones de tracto urinario), afectación renal e hipercalcemia.
En cuanto al tratamiento, la actitud dependerá de la etapa del mieloma múltiple en la que nos encontremos3. Puede ir desde el simple seguimiento (mieloma indolente) hasta el tratamiento farmacológico (mieloma activo), llegando incluso al trasplante de médula ósea. El tratamiento del mieloma múltiple ha experimentado un gran cambio gracias a la incorporación de los inhibidores de proteasoma e inmunomoduladores. Se elegirán unas terapias u otras en función de las características del individuo y de la posibilidad de recibir trasplante de progenitores hematopoyéticos. Utilizados en monoterapia o combinados, han aumentado las tasas de respuesta por lo que el control de la enfermedad y la calidad de vida de los pacientes han experimentado una notable mejoría. Sin embargo, no se ha conseguido aún que estas terapias sean curativas.
La investigación en este campo está desarrollando nuevos fármacos que se están utilizando en monoterapia o en combinación a los tratamientos existentes. Dos de estos fármacos son daratumumab y carfilzomib.
Daratumumab4 es un anticuerpo monoclonal humano IgG1κ que se une a la proteína CD38, la cual tiene una alta expresión en la superficie de las células tumorales del mieloma múltiple, así como en otros tipos celulares y tejidos a diversos niveles. Esta proteína tiene múltiples funciones tales como adhesión mediada por receptores, transducción de señales y actividad enzimática. Carfilzomib5 es un tetrapéptido inhibidor del proteasoma que se une de forma selectiva e irreversible a la treonina en el extremo N-terminal de los sitios activos del proteasoma 20S, el núcleo proteolítico del proteasoma 26S, y que muestra poca o ninguna actividad frente a otros tipos de proteasas.
Ambos fármacos han supuesto una novedad y un gran avance en los tratamientos del mieloma múltiple6, fundamentalmente en la enfermedad refractaria. Sin embargo, de estos nuevos fármacos autorizados no se tienen suficientes datos de uso en práctica clínica. De ahí el interés de hacer revisiones de los tratamientos con estos fármacos en el ámbito hospitalario.
OBJETIVOS
Evaluar la efectividad y el perfil de seguridad tanto de daratumumab como de carfilzomib en el tratamiento del mieloma múltiple refractario en nuestro hospital.
Comparar dichos resultados con la literatura publicada y los datos recogidos en ficha técnica.
MATERIAL Y MÉTODOS:
Estudio retrospectivo, observacional y unicéntrico en el que se recogieron los pacientes en tratamiento con daratumumab y carfilzomib hasta mayo de 2018 que hubieran recibido al menos un ciclo completo de tratamiento (excluyendo pacientes en ensayos clínicos), acorde al algoritmo de tratamiento de mieloma múltiple establecido en nuestro centro (carfilzomib de elección en pacientes en recaída a bortezomib; daratumumab en pacientes en recaída a bortezomib-lenalidomida). Los datos se obtuvieron a partir del programa de prescripción electrónica Oncofarm® y de la historia clínica electrónica (HCIS). Para la consulta de la literatura científica se utilizó el buscador PubMed. Se utilizó el parámetro supervivencia libre de progresión (SLP) para evaluar la efectividad, y la clasificación de la Common Terminology Criteria for Adverse Events (CTCAE)7 y los datos de la ficha técnica para evaluar la seguridad.
Las variables recogidas fueron: sexo, edad, tipo de mieloma múltiple, número de líneas previas, fármacos inmunomoduladores (IMID) e inhibidores de proteasoma (IP) previos (en el caso de daratumumab), trasplante autólogo de progenitores hematopoyéticos (TAPH) previo, esquema de inicio de tratamiento con daratumumab o carfilzomib, dosis de inicio, número de ciclos recibidos, fecha de progresión o de suspensión, retrasos en el ciclo, reacciones adversas observadas, incidencia (considerando para el análisis de seguridad sólo aquellas con una incidencia igual o superior 10%) y grado de las mismas.
RESULTADOS
1. Daratumumab
Se analizó el tratamiento en un total de 14 pacientes, con una media de edad al diagnóstico de 60,1±10,4 años (71,4% mujeres). Los tipos más frecuentes de mieloma múltiple fueron el IgG-kappa e IgG-lambda (42,9% de los casos cada uno de ellos). Un 50% recibió TAPH previo. Los pacientes habían recibido una media de 3,6±1,9 líneas de tratamiento previos. Según la ficha técnica, es necesario el uso de un IMID y un IP previo al tratamiento con daratumumab, siendo los más utilizados en nuestro estudio lenalidomida (85,7%) y bortezomib (71,4%) respectivamente.
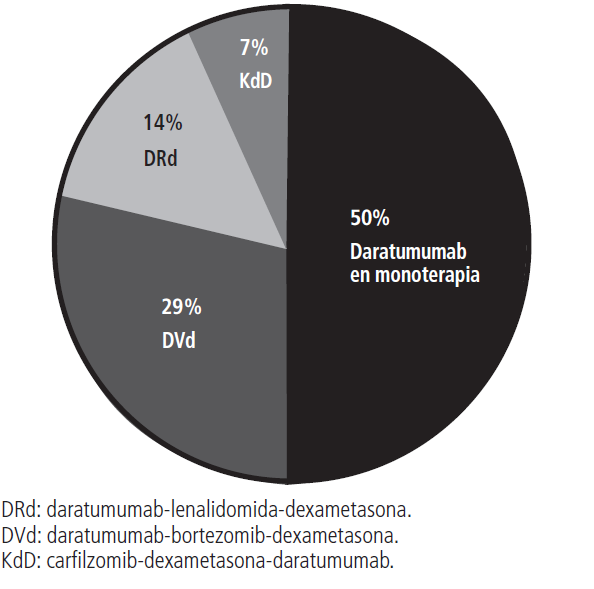
La media de dosis de inicio (16 mg/kg en todos los protocolos) fue de 1096,9±233,6 mg. La media de ciclos de tratamiento con daratumumab fue de 5,1±4,4. Los esquemas utilizados en se presentan en la figura 1, siendo los más utilizados:
- Daratumumab en monoterapia: 50% de los pacientes.
- Daratumumab-bortezomib-dexametasona (DVd): 28,6% de los pacientes (requirió de autorización individualizada por la dirección médica del hospital por no encontrarse financiado en el momento del estudio).
El 64,3% de los pacientes presentó progresión en la enfermedad. El 14,3% suspendió tratamiento (50% de ellos debido a toxicidad y 50% por TAPH; duración media hasta suspensión de 6,5 meses) mientras que el 21,4% mantenía tratamiento activo al finalizar el estudio (duración media de 2,8±2,4 meses). El 50% de los pacientes tuvo retrasos en los ciclos (85,7% por reacciones adversas). La mediana de SLP observada fue de 4,8 meses (Figura 2).
En cuanto a la seguridad, las reacciones adversas más frecuentes fueron:
➢ Relacionadas con el fármaco: trombocitopenia (50%), infección respiratoria (42,9%), tos (42,9%), neutropenia (28,6%) y diarrea (14,3%).
➢ Atendiendo a la gravedad de las mismas (reacciones adversas grados III-IV): trombocitopenia (28,6%) y neutropenia (21,4%).
2. Carfilzomib
Se incluyeron en el análisis 21 pacientes, con una media de edad al diagnóstico de 59,6±9,5 años (57,1% mujeres). El tipo más frecuentes de mieloma múltiple fue el IgG-kappa (61,9%). Un 38,1% recibió TAPH previo. Recibieron una media de 3,1±1,9 líneas de tratamiento previos.
La dosis de inicio fue variable según el protocolo utilizado y el día/ciclo de tratamiento en el mismo, según ficha técnica. Recibieron una media de 5,8±4,9 ciclos de tratamiento con carfilzomib. Los esquemas utilizados se pueden ver en la figura 3, siendo los más utilizados:
- Carfilzomib-dexametasona (Kd): 52,4% de los pacientes.
- Carfilzomib-lenalidomida-dexametasona (KRd): 28,6%.
El 38,1% de los pacientes presentó progresión de la enfermedad. El 42,9% suspendió tratamiento (44,4% de ellos por TAPH y 33,3% por toxicidad cardíaca; duración media hasta suspensión de 4 meses) mientras que el 19,1% mantenía tratamiento activo al finalizar el estudio (duración media de 11,6±4,4 meses). El 57,1% de los pacientes tuvo retrasos en los ciclos (todos ellos debido a reacciones adversas). La mediana de SLP observada fue de 5,8 meses (Figura 4).
En cuanto a la seguridad, las reacciones adversas más frecuentes fueron:
➢ Anemia (95,2%), infección respiratoria (61,9%), tos (61,9%), trombocitopenia (57,1%), disnea (42,9%), neutropenia (28,6%), insuficiencia cardíaca (28,6%), hipertensión arterial (19,1%), insuficiencia hepática (14,3%).
➢ Reacciones adversas grados III-IV: trombocitopenia (28,6%), anemia (23,8%), insuficiencia cardíaca (19,1%), infección respiratoria (14,3%).
DISCUSIÓN
1. Daratumumab
• Efectividad:
En la tabla 1 se recoge un resumen de los datos de los estudios de daratumumab citados a continuación.
Los estudios SIRIUS (MMY2002)8,9 y GEN5014,9 analizaron la eficacia de daratumumab en monoterapia, utilizando ambos la tasa de respuesta global (TRG) como variable principal de eficacia (29,2% y 36% respectivamente), no la SLP.
El estudio POLLUX (MMY3003)8,9 comparó el uso de daratumumab-lenalidomida-dexametasona (DRd) frente a lenalidomida-dexametasona (Rd). Utilizó la mediana de SLP como como variable principal de eficacia, no siendo alcanzada en el grupo DRd frente a 18,4 meses en el grupo Rd.
El estudio CASTOR (MMY3004)8,9 comparó el uso de daratumumab-bortezomib-dexametasona (DVd) frente a bortezomib-dexametasona (Vd). También utilizó la mediana de SLP para evaluar la eficacia, no alcanzándose en el grupo DVd frente a 7,2 meses en el grupo Vd.
Los resultados de los estudios SIRIUS y GEN501 permitieron a daratumumab recibir la autorización de uso en monoterapia en mayo de 2016 por parte de la Agencia Europea del Medicamento (EMA). Posteriormente, en abril de 2017, tras publicarse los resultados de los estudios POLLUX y CASTOR, obtuvo la autorización de uso en combinación con lenalidomida-dexametasona y bortezomib-dexametasona respectivamente. En estos estudios, daratumumab ofreció un perfil de eficacia claramente superior al tratamiento sin el fármaco (no se alcanzó una mediana de SLP). Todos ellos son ensayos clínicos, es decir, estudios realizados en condiciones ideales y no en práctica clínica.
Usmani et al.10 hicieron un análisis conjunto de los datos obtenidos en los estudios GEN501 parte II y SIRIUS (148 pacientes). Obtuvieron una mediana de SLP de 4 meses.
Jelínek et al.11 llevaron a cabo un estudio en República Checa en pacientes tratados con daratumumab en monoterapia (463 pacientes). La mediana de SLP observada fue de 4 meses.
Lakshman et al.12 realizaron un estudio en pacientes tratados con daratumumab con diferentes combinaciones (126 pacientes), siendo los más frecuentes: 41,3% con DPd (daratumumab-pomalidomida-dexametasona), 27% con DRd y 18,2% con DVd. La mediana de SLP fue de 5,5 meses en el global de los pacientes (5,2-7,8-3,8 meses en los esquemas más frecuentes DPd-DRd-DVd, respectivamente).
Se puede observar que la mediana de SLP de estos estudios (entre 4 y 5,5 meses) es similar a la media hallada en el nuestro y, a su vez, inferior a los datos de ficha técnica, por lo que vemos un claro descenso de la efectividad en la práctica clínica. Sin embargo, la gran diferencia del número de pacientes entre nuestro estudio y los de la bibliografía consultada y la no homogeneidad a la hora de valorar la efectividad (parámetros diferentes) son las principales limitaciones de esta comparación.
• Seguridad:
En cuanto al perfil de seguridad del fármaco, nos basamos en los datos que ofrece la ficha técnica4. Se recogen en la tabla 2 todas aquellas reacciones adversas con una incidencia ≥10%.
Haciendo una comparativa entre los eventos adversos más frecuentes observados frente a la incidencia que indica la ficha técnica, observamos:
- Mayor incidencia de trombocitopenia (50% en nuestro estudio frente a 37% en ficha técnica) y tos (42,9% frente a 31%).
- Menor incidencia de infección respiratoria (42,9% frente a 52%), neutropenia (28,6% frente a 44%) y diarrea (14,3% frente a 34%).
Si atendemos a las reacciones adversas de grado III-IV, observamos:
- Mayor incidencia en trombocitopenia (28,6% frente a 23%).
- Menor incidencia de neutropenia (21,4% frente a 37%).
Podemos observar cómo daratumumab presenta un perfil de seguridad diferente en práctica clínica, sobre todo en cuanto a la toxicidad hematológica. Destaca la gran incidencia de trombocitopenia y la menor de neutropenia, tanto en las reacciones leves como en las graves. Puede deberse al estado de los pacientes, ya que aquellos incluidos en nuestro estudio presentan un estadio de la enfermedad más avanzado. Otra limitación de nuestro estudio es que la muestra no es homogénea en cuanto a número de pacientes y a que tanto en él como en los ensayos recogidos en la ficha técnica agrupan a pacientes tratados con diferentes esquemas terapéuticos.
2. Carfilzomib
• Efectividad:
En la tabla 3 se recoge un resumen de los datos de los estudios de carfilzomib citados a continuación.
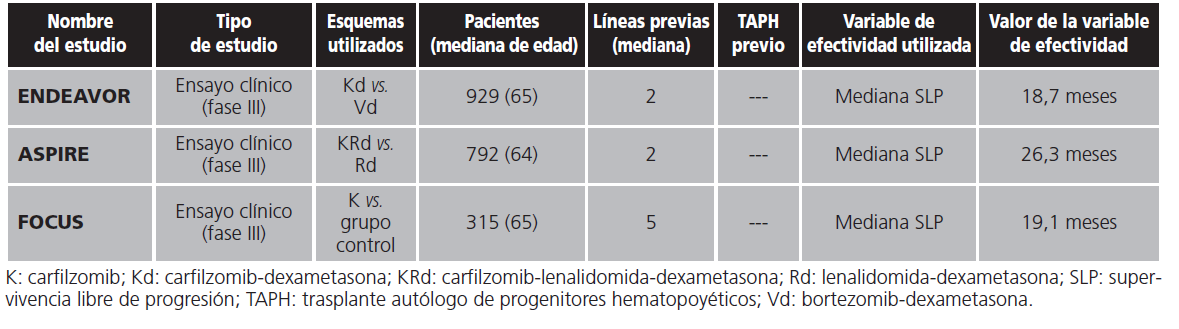
El estudio ENDEAVOR (2011-003)13 comparó el tratamiento con Kd frente a Vd. La mediana de SLP fue de 18,7 meses en el grupo Kd frente a 9,4 meses en el grupo Vd.
El estudio ASPIRE (PX-171-009)14 comparó el tratamiento con KRd frente a Rd. La mediana de SLP fue de 26,3 meses en el grupo KRd frente a 17,6 meses en el grupo Rd.
El estudio FOCUS15 comparaba el uso de carfilzomib en monoterapia frente a un grupo control (corticoides con ciclofosfamida opcional). La mediana SLP fue de 19,1 meses en el grupo de carfilzomib frente a 11,4 meses en el grupo control.
Los estudios ENDEAVOR y ASPIRE fueron los que dieron lugar a la autorización de carfilzomib ante la EMA en noviembre de 2015. En ellos, y en el estudio FOCUS, hay una mejoría relevante en cuanto a SLP respecto a los grupos que no incluían el fármaco en el tratamiento. Pero estos datos no pertenecen a situaciones de práctica clínica habitual sino a ensayos clínicos. Se puede observar que la mediana de SLP determinada en nuestro estudio se encuentra alejada de los datos de estos ensayos. Sin embargo, no se ha podido acceder a estudios de efectividad de carfilzomib en práctica clínica habitual.
• Seguridad:
Para la evaluación del perfil de seguridad de carfilzomib también nos hemos basado en los datos de la ficha técnica5. En este caso, no se recogen las reacciones adversas por incidencia en porcentaje, sino que se clasifican por categoría de frecuencia:
- Muy frecuente: aparición en ≥1/10 de los pacientes.
- Frecuente: ≥1/100 a <1/10.
- Poco frecuente: ≥1/1.000 a <1/100.
- Raras: ≥1/10.000 a <1/1.000.
Por tratarse de un listado muy extenso, se recogen en la tabla 4 los datos de ficha técnica de aquellas reacciones adversas observadas en nuestro estudio, clasificadas por la categoría de frecuencia anteriormente citada, a las que se han añadido los datos puntuales de incidencia que aporta la propia ficha.
Según esta clasificación, se aprecia que la mayoría de los eventos observados en nuestro estudio se clasifican en ficha técnica como muy frecuente, salvo insuficiencia hepática (frecuente). Esto contrasta con los datos de frecuencia de tromboembolismo venoso e insuficiencia cardíaca (frecuentes) y con el de insuficiencia hepática (poco frecuente).
Haciendo una comparativa entre las reacciones adversas de nuestro estudio frente a la incidencia que indica la ficha técnica para algunas de ellas, observamos mayor incidencia en:
- Trombocitopenia (57,1% en nuestro estudio frente a 34% en ficha técnica).
- Disnea (42,9% frente a 30%).
- Insuficiencia cardiaca (28,6% frente a 7%).
- Insuficiencia hepática (14,3% frente a <1%).
Si atendemos a las reacciones adversas de grado III-IV, observamos mayor incidencia en:
- Trombocitopenia (28,6% frente a 3,5-5,6%).
- Insuficiencia cardíaca (19,1% frente a 5%).
Podemos observar que en nuestro estudio parece que carfilzomib tendría un perfil de seguridad diferente en la práctica clínica del que indica la ficha técnica, destacando la mayor incidencia de insuficiencia hepática, insuficiencia cardíaca y trombocitopenia (estas dos últimas también en las reacciones adversas más graves). Sin embargo, esta comparación presenta una serie de limitaciones tales como la clasificación poco exhaustiva de frecuencia de la ficha técnica, los pocos datos de incidencia que nos ofrece y el hecho de que nuestro estudio ha sido realizado en un grupo de pacientes con estadios más avanzados de la enfermedad. Tanto nuestro estudio como los de la ficha técnica agrupan pacientes con diferentes esquemas de tratamiento. Sin embargo, la ficha técnica no expone con claridad cuáles fueron estos esquemas y la proporción de los pacientes incluidos en ellos, lo que supone una limitación adicional.
CONCLUSIONES
Los resultados de nuestro estudio muestran que daratumumab presenta una efectividad en concordancia con los estudios realizados en práctica clínica, aunque inferior a la que figura en la ficha técnica. El perfil de seguridad también es diferente al recogido en la misma, destacando la mayor incidencia de trombocitopenia (incluyendo las reacciones graves). Esto requeriría tener especial cuidado con este tipo de toxicidad y hacer un seguimiento más estrecho de los valores de plaquetas durante el tratamiento.
La efectividad de carfilzomib ha sido claramente inferior en nuestro trabajo a los datos de la ficha técnica, no habiendo sido posible su comparación con estudios de práctica clínica. En cuanto a la seguridad, se ha observado con respecto a los datos de ficha técnica, una mayor incidencia de toxicidad cardíaca y hematológica (trombocitopenia), incluyendo las reacciones graves.
Sin embargo, estos resultados no son concluyentes debido a las limitaciones expuestas durante el trabajo, lo que hace necesario más estudios para poder dar solidez a los mismos.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.