INTRODUCCIÓN
El cáncer de pulmón es una de las neoplasias más frecuentes en el mundo desarrollado1,2. Se ha estimado una incidencia de 470.000 casos en Europa, presentándose como el tercer tipo de tumor más común en España3. Según las características celulares, el cáncer de pulmón se clasifica en micrócítico y no microcítico (CPNM)4. El 85% de los casos diagnosticados corresponden con CPNM. A su vez y desde el punto de vista histológico, el CPNM se divide en tres subtipos: adenocarcinoma, carcinoma de células escamosas y carcinoma de células grandes.
La mayoría de los pacientes son diagnosticados de cáncer de pulmón en estadios avanzados, no siendo candidatos a cirugía. Hasta ahora, la intervención quirúrgica se presenta como la única opción terapéutica potencialmente curativa en este tipo de tumor. Sin embargo, no son pocas las alternativas terapéuticas que mejoran el pronóstico de la enfermedad en estadio irresecable localmente avanzado o metastásico. Esto se debe a que, con la irrupción de la inmunoterapia, el tratamiento del cáncer de pulmón ha sufrido una importante evolución en los últimos años. El estudio molecular se ha postulado como piedra angular para la selección de los fármacos. El ligando 1 de muerte programada (PD-L1, del inglés Programmed Death-ligand 1) o factor 1 de transcripción tiroidea (TTF-1, de Thyroid Transcription Factor-1) son dos ejemplos de los biomarcadores que se están usando -o evaluando- como factores predictivos de la eficacia de los tratamientos5,6. Estas moléculas y las vías de señalización en las que se encuentran implicadas suponen las dianas terapéuticas de fármacos como nivolumab, pembrolizumab y atezolizumab7,8,9.
El estadio III del CPNM incluye dos subpoblaciones: IIIA y IIIB. La mayoría de los pacientes con estadio IIIA y B no son candidatos a cirugía, siendo susceptibles de recibir un tratamiento de quimioterapia basada en platino concurrente con radioterapia10,11. También puede usarse secuencialmente la quimioterapia seguida de radioterapia en casos en los que no sea posible hacerlo de forma concurrente12. No obstante, el pronóstico de los pacientes con CPNM en estadio III irresecable ha sido históricamente desfavorable.
Durvalumab es un anticuerpo monoclonal autorizado para el tratamiento del CPNM localmente avanzado irresecable con una expresión tumoral de PD-L1 igual o superior al 1% que no haya presentado progresión tras quimiorradioterapia basada en platino13. Esta indicación se basa en los resultados del ensayo clínico PACIFIC14, donde se observó un aumento significativo de la supervivencia global (SG) y supervivencia libre de progresión (SLP) en aquellos pacientes con CPNM que recibieron durvalumab tras quimiorradioterapia. Los pacientes incluidos en este estudio debían haber recibido la última dosis de radiación entre 1 y 42 días antes de la randomización, presentar un adecuado estado funcional después de la quimiorradioterapia y una esperanza de vida superior a 12 semanas. Recientemente, este fármaco se ha financiado en pacientes con buen estado general (del inglés performance status, PS 0-1) que hayan recibido 2 o más ciclos de quimioterapia basada en platino, que no presenten contraindicaciones para recibir inmunoterapia y no hubieran sido tratados anteriormente con anticuerpos anti-PD1 o anti-PD-L115. Asimismo, las condiciones de financiación establecen que el tratamiento sólo podrá ser administrado durante un máximo de 12 meses. Hasta ahora, sólo se ha podido adquirir este anticuerpo en territorio nacional a través del uso compasivo. Para ello, no ha sido necesario determinar la expresión tumoral de PD-L1 en los pacientes, así como tampoco el PS, ni se restringió la duración del tratamiento.
Teniendo en cuenta la reciente comercialización del fármaco, no es de extrañar que existan pocos datos en vida real sobre la efectividad o seguridad de durvalumab para CPNM en nuestro país. Asimismo, esta escasez de resultados también se puede extender a otros territorios. El objetivo de este estudio es describir las condiciones del uso compasivo de durvalumab en CPNM localmente avanzado e irresecable, comparándose con las condiciones de financiación, así como proporcionar los resultados en vida real de efectividad y seguridad.
MATERIAL Y MÉTODOS
Diseño del estudio
Se desarrolló un estudio descriptivo retrospectivo desde el 1 de diciembre de 2017 al 29 de febrero de 2020. La adquisición de durvalumab se realizó mediante la plataforma de Gestión de Medicamentos en Situaciones Especiales de la Agencia Española del Medicamento16, cumpliendo con las regulaciones de los programas de uso compasivo.
Población
Fueron incluidos todos los pacientes diagnosticados de CPNM tratados con durvalumab mediante uso compasivo tras haber recibido quimioterapia basada en platino concurrente con radioterapia, y que no hubieran presentado progresión a este esquema. Los pacientes recibieron una dosis bisemanal de 10 mg/kg de durvalumab en perfusión intravenosa hasta progresión clínica o radiológica de la enfermedad, o toxicidad inaceptable.
Extracción de datos
Se emplearon el programa de gestión de citostáticos (Farmis®) y la historia clínica electrónica (Drago-AE®) para registrar los datos de los pacientes incluidos en el estudio. Se recogieron los siguientes parámetros demográficos: edad, género, peso corporal, estadio, PS, esperanza de vida, expresión tumoral de PD-L1 u otros biomarcadores, y progresión a quimiorradioterapia. Por otra parte, se registró información sobre los tratamientos empleados: días entre la finalización de radioterapia y comienzo de durvalumab, esquemas y número de ciclos de tratamientos previos, duración y número de ciclos del tratamiento con durvalumab. Usando estos datos, se estimó el período de seguimiento de los pacientes y se compararon las condiciones del uso compasivo de durvalumab en nuestros pacientes con los criterios de financiación establecidos por el Informe de Posicionamiento Terapéutico17.
Variables evaluadas y análisis de datos
La efectividad del tratamiento con durvalumab fue valorada mediante dos variables: la SG, definida como el tiempo transcurrido entre la administración de la primera dosis de durvalumab y el fallecimiento del paciente; y la SLP, definida como el tiempo entre la primera administración de durvalumab y la progresión clínica o radiológica confirmada de la enfermedad. Para calcular tanto la media de SG como de SLP se utilizó el método Kaplan Meier mediante el programa IBM SPSS Statistics® Base 2218. La seguridad de durvalumab fue analizada mediante el registro de las reacciones adversas (RAs), grado de las mismas, interrupciones y suspensiones del tratamiento asociadas.
Resultados
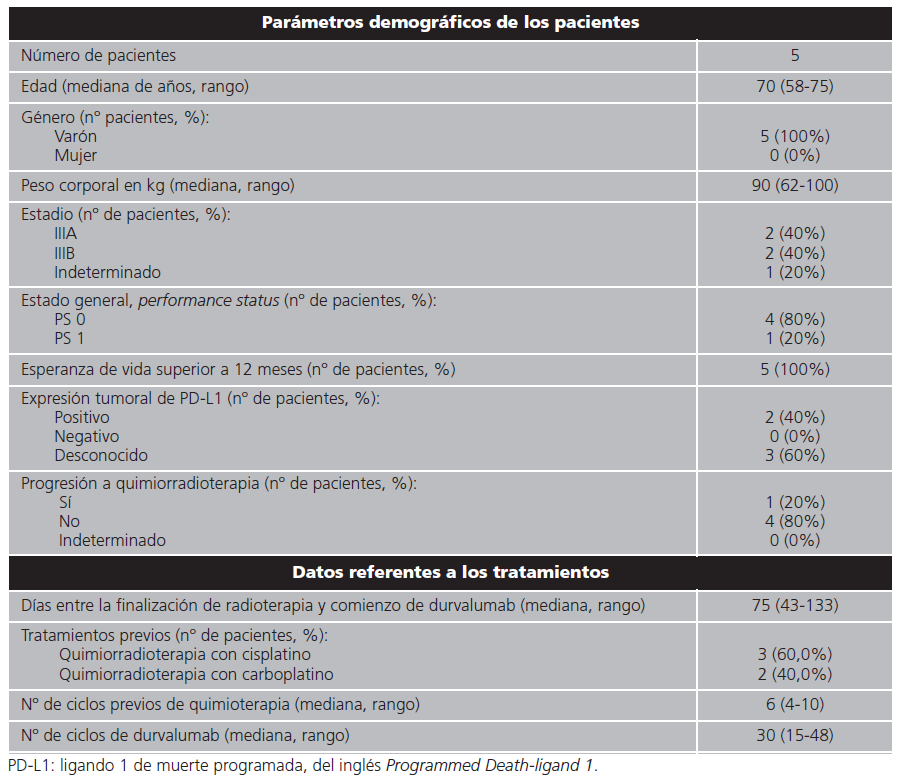
Fueron reclutados 5 pacientes en el estudio. Todos fueron varones. La mediana del peso corporal medio fue 90 (62-100) kg. El estadiaje se distribuyó uniformemente entre IIIA y IIIB, ya que se diagnosticaron 2 pacientes de cada estadio. En un paciente no se registraron datos sobre el estadio de la enfermedad. El 80% de los pacientes presentaron un PS 0. Todos los pacientes tenían un pronóstico de vida superior a los 12 meses. La expresión tumoral de PD-L1 fue positiva en 2 pacientes (40%), cuantificándose en un 80% en uno de ellos y no pudiendo determinarse en el otro. En otro de los pacientes se determinó expresión del biomarcador TTF-1. Cuatro pacientes (80%) no habían progresado a quimiorradioterapia antes de recibir durvalumab. En el paciente restante no se pudo descartar la progresión antes de la administración de durvalumab. No obstante, las pruebas diagnósticas realizadas con anterioridad al comienzo del tratamiento de durvalumab no fueron concluyentes, ya que existía incertidumbre sobre la naturaleza del nuevo foco. No se pudo determinar con certeza si la etiología era infecciosa, pseudoprogresión o progresión tumoral. En este caso, la confirmación de la progresión de la enfermedad a quimiorradioterapia se realizó 4,3 meses después del inicio del tratamiento con durvalumab.
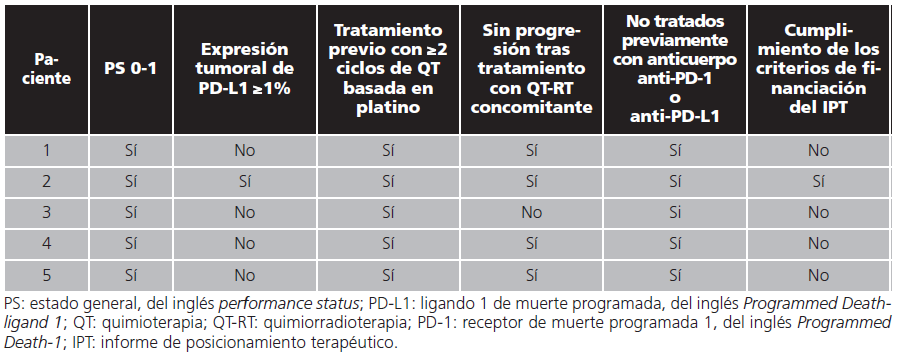
La mediana de seguimiento de los pacientes fue de 19 (7-25) meses. La mediana del número de días entre la finalización de la radioterapia y el comienzo de tratamiento con durvalumab fue de 75 (43-133) días. Ningún paciente había recibido inmunoterapia con anterioridad. Tres pacientes (60%) recibieron un esquema de quimioterapia previa que contenía cisplatino, aunque ninguno de ellos presentó la misma combinación de agentes antineoplásicos. Un paciente recibió cisplatino asociado a gemcitabina, otro junto con taxanos y otro cisplatino en combinación con pemetrexed. Por otra parte, los dos pacientes restantes fueron tratados con esquemas de carboplatino que tenían asociados taxanos. La mediana del número de ciclos de quimioterapia previa fue de 6 (4-10). La mediana de duración del tratamiento con durvalumab fue de 19 (7-25) meses. La mediana del número de ciclos administrados fue 30 (15-48). Los datos de parámetros demográficos de los pacientes, así como la información sobre los tratamientos, puede consultarse en la tabla 1. En lo referente a las condiciones del uso compasivo de durvalumab, un paciente (20%) cumplía todos los criterios de financiación descritos en el Informe de Posicionamiento Terapéutico17. El cumplimiento de los requisitos de financiación por los diferentes pacientes con CPNM localmente avanzado e irresecable tratados con durvalumab en uso compasivo se muestra en la tabla 2.
Tabla 2. Cumplimiento de requisitos de financiación por los pacientes con CPNM localmente avanzado e irresecable tratados con durvalumab en uso compasivo
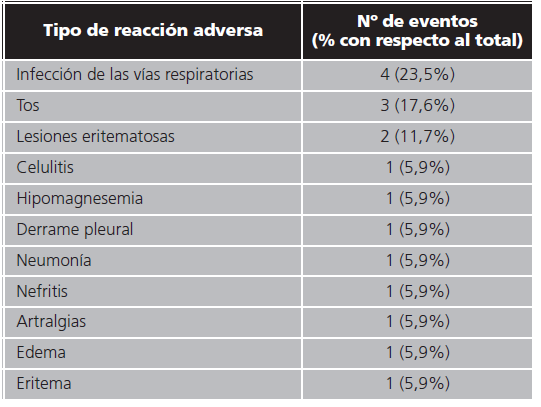
No se registró ningún fallecimiento durante el estudio. Por tanto, no se pudo calcular la media de SG a los 19 meses de seguimiento. Por otra parte, se diagnosticó progresión tumoral en un paciente. La media de SLP estimada fue de 20,8 (13,6-28,1) meses. Todos los pacientes presentaron RAs, registrándose un total de 17 episodios cuya distribución está representada en la tabla 3. Las RAs más frecuentes fueron: 4 episodios (23,5%) de infecciones respiratorias, 3 (17,6%) de tos y 2 (11,7%) de lesiones eritematosas. Se notificaron 16 (94,1%) episodios de RAs de grado 1, mientras que uno -neumonía- fue de grado 3. Se produjeron 8 interrupciones de tratamiento, distribuidas en 3 (60%) pacientes. En un paciente se observó una interrupción por gripe; en otro paciente se registraron 2 interrupciones por neumonía (desencadenando en un ingreso hospitalario); y en el restante se produjeron 5 interrupciones de tratamiento: 2 por infecciones respiratorias y 3 por alteración en el aclaramiento de creatinina. No se observaron suspensiones de tratamiento.
DISCUSIÓN
Los resultados obtenidos en este estudio pueden arrojar información sobre la escasa concordancia entre las condiciones del uso compasivo de durvalumab en pacientes con CPNM localmente avanzado e irresecable, y la resolución de financiación descrita en el reciente Informe de Posicionamiento Terapéutico17. Si bien es cierto que el uso compasivo de los fármacos puede favorecer el acceso a las nuevas alternativas terapéuticas, no hay que olvidar la incertidumbre que, en muchos casos, tiene inherente. En nuestro caso, es especialmente llamativa la autorización de tratamientos en pacientes en los que no se determinó el biomarcador PD-L1, esencial en el pronóstico de la respuesta según los resultados descritos en el estudio PACIFIC14.
Partiendo de consideraciones como la descrita, podemos deducir la inequidad que se pudiera producir entre pacientes que reciben un fármaco mediante uso compasivo y los que no. Por un lado, si un determinado tratamiento aporta un beneficio a los pacientes que lo reciben, y este finalmente no se financia, se estaría favoreciendo a los pacientes con acceso al uso compasivo con respecto al resto. Por otro, si un determinado fármaco presenta datos prometedores que no son confirmados en estudios más maduros, se podría estar perjudicando a los pacientes que acceden al medicamento. Este último contexto puede ocasionar importantes conflictos, e incluso se han descrito casos en estudios post-autorización19. Por otra parte, un excesivo acceso al uso compasivo podría dificultar acuerdos en las negociaciones de precios entre los organismos competentes en materia de sanidad y las empresas farmacéuticas.
Durvalumab en CPNM localmente avanzado e irresecable ha demostrado una considerable efectividad, ya que no se produjo ningún fallecimiento durante el período de seguimiento. También presentó una seguridad aceptable, ya que casi todas las RAs registradas fueron de primer grado, y aunque se observaron algunas interrupciones de tratamiento, no se registró ninguna suspensión. Este hecho denota que el manejo de durvalumab puede ser abordado por especialistas sin demasiadas complicaciones.
Cabe recordar que este es uno de los primeros trabajos que describe resultados en vida real de durvalumab. Teniendo en cuenta que este anticuerpo ha sido financiado con una duración máxima de 12 meses de tratamiento15 y nuestro artículo aporta información con un seguimiento de 19 meses, se puede afirmar que pocos estudios nacionales podrán reproducir datos similares a los presentados. Asimismo, los estudios con diseño retrospectivo como el presente pueden complementar -que no sustituir- los datos proporcionados por literatura de mayor entidad científica. De esta manera, se pueden describir casos que se presentan en la práctica clínica habitual y que escapan a las condiciones de uso de los fármacos en los ensayos clínicos. Tal es el caso de pacientes como uno de los incluidos en el presente estudio, con una progresión a quimiorradioterapia confirmada tras la administración de durvalumab, y que fue tratado posteriormente con radioterapia local.
Por otra parte, este trabajo tiene como limitación principal el pequeño tamaño muestral, debido a la falta de comercialización del fármaco. La escasez de datos sobre la expresión de biomarcadores en los pacientes, como PD-L1, supone otro sesgo. Considerando la fuerte evidencia que respalda la relación entre respuesta a inmunoterapia y la determinación del marcador predictivo PD-L120 en el cáncer de pulmón, nos queda profundizar en el efecto que pueden producir elevadas expresiones de otros biomarcadores, como TTF-121.
Conclusiones
Existen importantes discrepancias entre el uso compasivo de durvalumab en pacientes con CPNM localmente avanzado e irresecable, y las condiciones de financiación del fármaco. Esta circunstancia podría producir inequidad entre pacientes.
Durvalumab ha demostrado una importante efectividad y una tolerancia aceptable en la práctica clínica. Considerando las limitaciones de este trabajo, los resultados deben ser valorados con cautela. Este estudio es uno de los primeros en describir resultados de salud en vida real de durvalumab, por lo que podrían complementar la información obtenida de los ensayos clínicos.
Todos los autores han contribuido intelectualmente, han tenido en cuenta las responsabilidades éticas, reúnen las condiciones de autoría y han aprobado la versión final del mismo.
Responsabilidades éticas: Para desarrollar este estudio los autores cumplieron con todos los criterios éticos y legales. Este manuscrito ha sido elaborado respetando las recomendaciones internacionales sobre investigación clínica (Declaración de Helsinki de la Asociación Médica Mundial).
Confidencialidad de los datos: Todos los autores declaran que se han seguido los protocolos establecidos por sus respectivos centros sanitarios para acceder a los datos de las historias clínicas.
Conflictos de intereses: Gil-Sierra MD participó en un advisory board de Janssen Pharmaceutica. El resto de los autores no posee conflictos de interés.