INTRODUCCIÓN
Las infecciones fúngicas tienen una baja incidencia en la población general; no obstante, en pacientes inmunodeprimidos, trasplantados o sometidos a quimioterapia supone una causa importante de morbimortalidad. Se estiman 250.000 casos de aspergilosis invasiva y 700.000 casos de candidiasis invasiva anualmente en el mundo1. No se conoce la prevalencia e incidencia exacta de estas patologías debido a deficiencias en los sistemas de notificación de casos, la no obligatoriedad en la declaración de estas enfermedades o los pocos estudios publicados. De cualquier modo, la mortalidad asociada a estas patologías supera los 1,6 millones de personas anuales en el mundo1.
El tratamiento de elección de la aspergilosis invasiva según las últimas guías europeas2 en el caso de pacientes con neoplasia hematológica y trasplante de progenitores hematopoyéticos (TPH) es voriconazol o isavuconazol en aspergilosis pulmonar y voriconazol en aspergilosis extrapulmonar. En el caso de pacientes con trasplante de órgano sólido (TOS) o pacientes VIH, el tratamiento de elección es voriconazol. En algunos casos puede ser necesaria la profilaxis antifúngica con posaconazol como fármaco de elección en pacientes con TPH y voriconazol en pacientes con TOS.
Pese a ser considerado el gold standard actualmente, el tratamiento con voriconazol puede tener limitaciones al ser un inhibidor potente del citocromo 3A4 que en pacientes en tratamiento con inmunosupresores y múltiples fármacos puede producir numerosas interacciones. Además, requiere monitorización de sus niveles, puede dar lugar a hepatotoxicidad, insuficiencia renal y alteraciones neurológicas2,3.
Isavuconazol es un fármaco antifúngico de la familia de los azoles, designado como medicamento huérfano en 20144 y comercializado en España en 20165. Al igual que el resto del grupo, su mecanismo de acción se basa en inhibir la síntesis del ergosterol, componente fundamental de la membrana celular de los hongos5,6. Está indicado en las aspergilosis invasivas o en las mucormicosis en las que el tratamiento con anfotericina B liposomal no ha sido efectivo5. Su espectro antifúngico es similar al que presenta voriconazol, incluyendo las especies de Candida krusei resistentes a fluconazol, las principales especies de Aspergillus ssp. y mucorales7. Presenta mejor perfil farmacocinético que los azoles de segunda generación puesto que es hidrosoluble; puede tomarse con o sin alimentos, no hace falta que se formule con ciclodextrinas en su presentación intravenosa e inhibe en menor medida el citocromo 3A47. Además, según varios estudios publicados, isavuconazol no precisa monitorización farmacocinética de rutina al no haberse hallado asociación entre los niveles plasmáticos y variables de efectividad y seguridad8,9.
El objetivo de este estudio es identificar y describir las interacciones farmacológicas potenciales de isavuconazol, estudiar el impacto clínico de las interacciones más relevantes y establecer recomendaciones terapéuticas para las que se han encontrado en pacientes ingresados.
MATERIAL Y MÉTODOS
Estudio observacional descriptivo retrospectivo en el que incluyeron a todos los pacientes tratados con isavuconazol desde su comercialización hasta diciembre de 2019 en un hospital de clase cinco según la clasificación Clúster de hospitales10.
Se realizó un seguimiento del tratamiento de los pacientes a través de la prescripción electrónica integrada en la historia clínica electrónica. Se recogieron variables demográficas y los fármacos que recibió el paciente de forma concomitante a isavuconazol durante más de 48 horas. Se revisaron los tratamientos con la aplicación Lexicomp® para detectar las potenciales interacciones y se clasificaron en tres categorías según su gravedad: leve para las clasificadas como B por Lexicomp, moderado para las C y grave para las D y X. Se analizó el mecanismo de acción de cada potencial interacción y se relacionó con los fármacos implicados, estableciéndose recomendaciones terapéuticas para cada una de ellas.
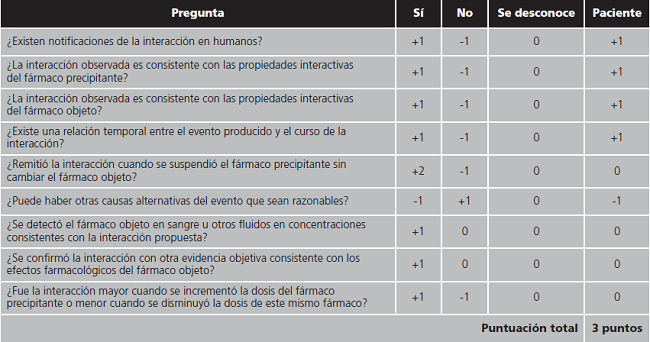
Para establecer el impacto clínico, se revisaron las historias clínicas de los pacientes con las interacciones de mayor gravedad (clase D y X de Lexicomp®). En el caso de hallar alguna reacción adversa relacionada con el tratamiento, se aplicó el algoritmo de Horn11 para establecer la probabilidad de que el efecto este producido por la interacción farmacológica.
RESULTADOS
Durante el periodo de estudio, se analizaron un total de 84 ingresos en 59 pacientes (42,4% mujeres) con edad media de 61±13,9 años en pacientes tratados con isavuconazol. La mediana de duración del tratamiento, excluyendo aquellos de menos de 48 horas, fue de 12,5 (6-20,5) días. Se analizaron 206 fármacos concomitantes diferentes, encontrándose interacciones potenciales con 35 de ellos. Se produjeron un total de 209 interacciones potenciales con isavuconazol en el 84,5% de los ingresos. El 84,7% (n=177) de estas interacciones fueron de carácter moderado (categoría C), mientras que el 8,1% (n=17) fueron de carácter grave (categoría D y X), siendo estas últimas interacciones potenciales del grupo de los azoles.
La mediana de interacciones potenciales por episodio de tratamiento fue de 21-3. La potencial interacción más frecuente fue con tacrolimus en 36 ingresos en 20 pacientes, siendo de categoría C. Las interacciones potenciales de categoría D que se produjeron fueron con fentanilo (n=3), colchicina (n=2) y tolvaptán (n=2). Las interacciones potenciales de categoría X que se produjeron fueron con claritromicina (n=4), domperidona (n=4), rifampicina (n=1) y primidona (n=1).
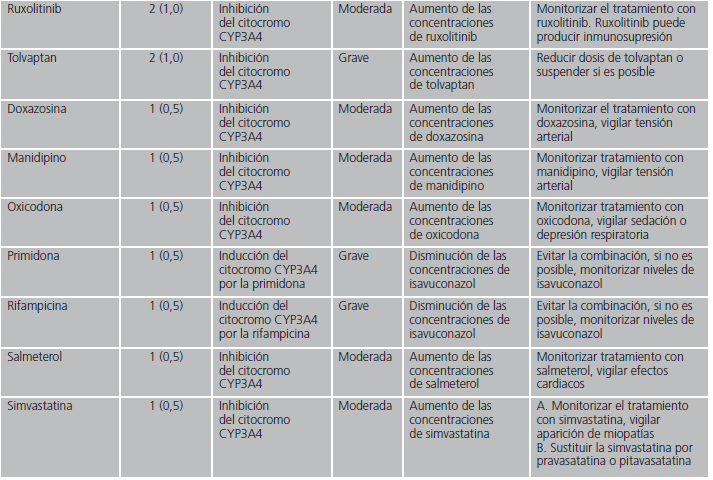
En las interacciones registradas, el principal mecanismo de acción implicado fue el efecto inhibidor sobre el citocromo CYP3A4 de isavuconazol (82,8%). Otros mecanismos minoritarios fueron la inhibición por isavuconazol de la enzima glucuronil-transferasa, la inducción del citocromo CYP2D6 por el azólico o la inducción por parte del otro fármaco implicado del citocromo CYP3A4. En la tabla 1 se detallan en orden decreciente de frecuencia los fármacos detectados con potencial interacción, el mecanismo por el que interaccionan, así como sus posibles consecuencias y las recomendaciones en función de la relevancia clínica.
Tabla 1. Mecanismo de las interacciones farmacológicas detectadas con isavuconazol y recomendaciones farmacéuticas.
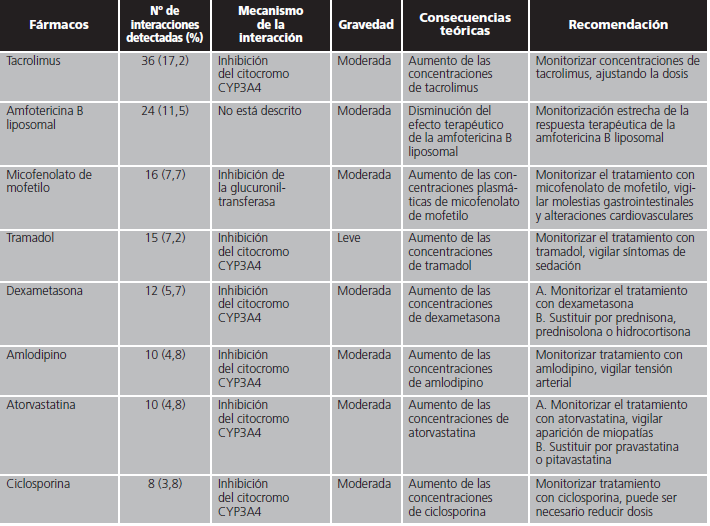
Tabla 1 (cont.). Mecanismo de las interacciones farmacológicas detectadas con isavuconazol y recomendaciones farmacéuticas.
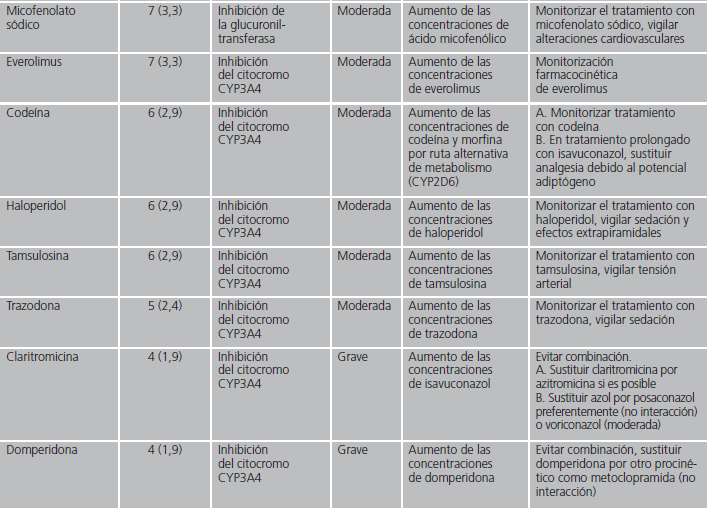
Tabla 1 (cont.). Mecanismo de las interacciones farmacológicas detectadas con isavuconazol y recomendaciones farmacéuticas.
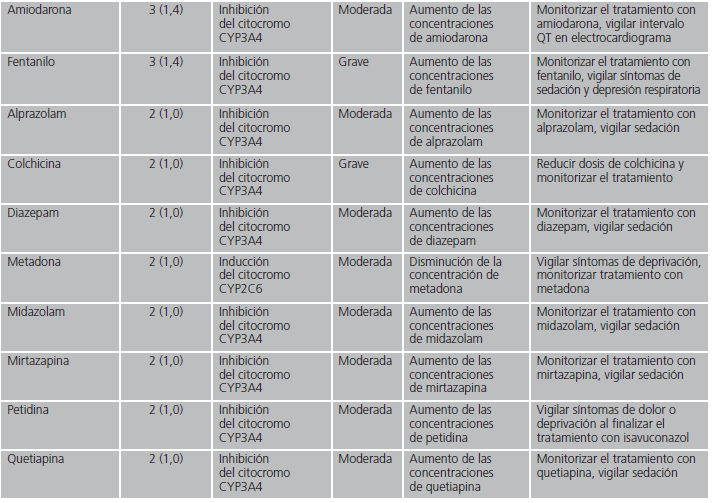
Tabla 1 (cont.). Mecanismo de las interacciones farmacológicas detectadas con isavuconazol y recomendaciones farmacéuticas.
En cuanto a la relevancia clínica, solo se detectó en una paciente un aumento progresivo de la fosfatasa alcalina coincidente con el inicio de tratamiento concomitante con isavuconazol y claritromicina, alcanzando 952 U/L mes y medio después del inicio de ambos fármacos. El perfil hepático continuó deteriorado durante todo el tratamiento concomitante y no se pudo comprobar si mejoraba al retirar la combinación puesto que la paciente falleció un día después de suspender el tratamiento debido a insuficiencia respiratoria aguda en el contexto de progresión tumoral de un adenocarcinoma de páncreas diseminado. Al aplicar el algoritmo de Horn o escala de probabilidad de interacciones farmacológicas, se obtuvo una puntuación de 3, considerando la interacción como posible.
DISCUSIÓN
Las interacciones farmacológicas son una fuente conocida de efectos adversos graves que pueden llevar a la hospitalización. En el estudio realizado por Dechanont et al.12, se estimó que el 1,1% de las hospitalizaciones se producen como consecuencia de interacciones farmacológicas. No obstante, no se conoce la frecuencia con la que las potenciales interacciones farmacológicas producen una reacción adversa, ya que existen pocos estudios en los que se evalúa el impacto clínico real de las mismas. En el artículo publicado por Reis et al.13, estimaron que un 7% de las reacciones adversas a medicamentos se debieron a interacciones farmacológicas, y que por tanto, podrían haber sido evitados.
En nuestro estudio, la posible interacción que se detectó con mayor frecuencia fue la producida por tacrolimus e isavuconazol. Dado que las infecciones fúngicas tienen mayor prevalencia en pacientes trasplantados que en la población sana, es coherente que los pacientes en tratamiento con inmunosupresores, precisen tratamiento con antifúngicos azólicos. Se produce por la inhibición del citocromo 3A4, enzima responsable del metabolismo del tacrolimus, por lo que aumentan las concentraciones del mismo y es necesario monitorizar de forma estrecha sus niveles plasmáticos6,14. Está interacción es común a todo el grupo de antifúngicos azólicos, ya que todos son inhibidores de este citocromo en mayor o menor medida, siendo voriconazol, itraconazol y posaconazol inhibidores potentes citocromo 3A414. Dado que isavuconazol es un inhibidor más débil, teóricamente la interacción con este último tiene menor relevancia. En un estudio farmacocinético realizado en 20 pacientes que tomaron isavuconazol y tacrolimus en combinación y por separado, se obtuvo que la concentración máxima de tacrolimus en tratamiento concomitante con isavuconazol fue un 42% más elevada14. En cuanto a la relevancia clínica, un paciente abandonó el estudio debido a sensación de calor, rubor y hormigueo con la combinación del tratamiento sin que ninguno de los pacientes desarrollara hepatotoxicidad o insuficiencia renal14.
Respecto a las interacciones que potencialmente tienen mayor gravedad y cuya combinación está contraindicada, son aquellas con claritromicina, domperidona, rifampicina y primidona. Dos de los fármacos (primidona y rifampicina) se caracterizan por ser inductores potentes del citocromo 3A415,16, enzima encargada del metabolismo de isavuconazol, por lo que, en presencia de estos fármacos, reducen los niveles del azólic pudiendo limitar su efectividad. En un estudio farmacocinético realizado en 24 pacientes, se demostró que en combinación con rifampicina, la concentración máxima de isavuconazol se redujo a un 75% con respecto a la administración en monoterapia de este antifúngico17. Debido a esto, en estos casos, sí puede ser necesaria la monitorización de los niveles de isavuconazol para mantener la efectividad del mismo. En cuanto a claritromicina, es inhibidor del citocromo 3A418 por lo que puede aumentar las concentraciones de isavuconazol y, por tanto, su toxicidad. Respecto a la domperidona, no se recomienda su uso con fármacos que inhiban el citocromo 3A4 debido a que aumentan las concentraciones de domperidona y su toxicidad19.
En nuestro estudio, se detectaron posibles interacciones farmacológicas en más del 80% de las prescripciones con isavuconazol. Esto indica una necesidad de revisión de estos tratamientos con un análisis exhaustivo de la medicación concomitante prestando especial atención a las alteraciones analíticas o manifestaciones clínicas del paciente que pudieran responder a una potencial interacción (por ejemplo, aumento de la sedación en un paciente tratado con tramadol e isavuconazol o miopatías en el caso de atorvastatina e isavuconazol).
La principal fortaleza de nuestro trabajo es que, según nuestro conocimiento, se trata del primer estudio que recopila las posibles interacciones más frecuentes y las recomendaciones terapéuticas asociadas en la población potencialmente candidata a ser tratada con isavuconazol.
Entre las limitaciones del estudio se encuentran el carácter retrospectivo del estudio y el bajo tamaño muestral, ya que isavuconazol está considerado como medicamento huérfano y el número de pacientes tratados con este fármaco es escaso.
CONCLUCIONES
La potencial interacción medicamentosa más frecuentemente detectada en los pacientes tratados con isavuconazol fue con tacrolimus, siendo esta considerada de gravedad moderada. En cuanto a las interacciones farmacológicas potenciales graves, se detectaron en un porcentaje inferior al 10% de los ingresos y solo en una paciente se detectó una posible reacción adversa asociada a esta interacción, no pudiéndose clasificar como definitiva por el algoritmo de Horn.