INTRODUCCIÓN
La enfermedad inflamatoria intestinal (EII) engloba un grupo muy heterogéneo de patologías inflamatorias, asociadas tanto a factores ambientales como genéticos1. La EII de inicio temprano se manifiesta antes de los 6 años de edad2. Se presenta hasta en el 15% de los pacientes pediátricos afectados de EII con una incidencia total del 4/100.000 en la población3. En estos pacientes hay un alto riesgo de alteraciones monogénicas (epitelio, células fagocíticas,…) en contraposición con las de los adultos, predominantemente poligénicas. Hasta el 35% se consideran como “no clasificables” al no identificarse una etiología genética específica2. Múltiples estudios avalan la reducción en la diversidad de la flora o “disbiosis” como causa principal4.
Se ha descrito frecuentemente refractariedad en pediatría a las terapias inmunosupresoras comúnmente empleadas2. El interés del caso radica en el empleo de antibioterapia oral como adyuvancia para el control de los brotes de actividad en un paciente pediátrico ingresado en nuestro centro.
DESCRIPCIÓN DEL CASO
Niño de dos años de edad con EII no monogénica, colitis no clasificable y corticodependiente. No alergias conocidas. Se encuentra en seguimiento por la Unidad de Gastroenterología Pediátrica desde abril 2019. Inició mesalazina oral a 750 mg/día con posterior introducción de prednisolona a 1 mg/kg y ascenso a 2 mg/kg. Se introdujo azatioprina a 1,2 mg/kg en julio con intensificación en octubre a 2,7 mg/kg. Se inició infliximab (IFX) intensificado a 10 mg/kg en las semanas 0-1-4 en diciembre.
En febrero acude al Servicio de Urgencias por febrícula, dolor abdominal intenso y repercusión funcional. Heces hemáticas. El análisis de sangre (Tabla 1) muestra elevación de marcadores inflamatorios. No come y tiene dificultad en la toma de la medicación. Ingresa para tratamiento analgésico y control del brote inflamatorio.
Tabla 1. Parámetros medidos en los análisis sucesivos.
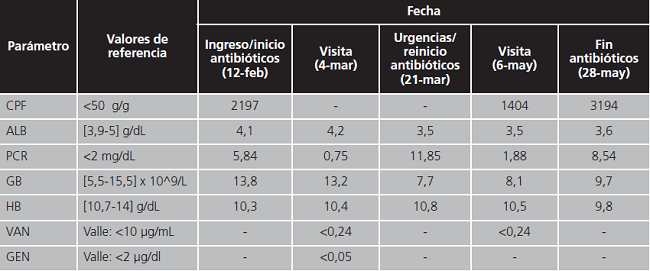
CPF: calprotectina fecal; ALB: albúmina; PCR: proteína C reactiva; GB: leucocitos; HB: hemoglobina; VAN: vancomicina; GEN: gentamicina.
Se pauta terapia corticoidea y se coloca sonda nasogástrica (SNG) para facilitar la administración de su medicación oral domiciliaria y con fines nutritivos, iniciándose nutrición enteral hipercalórica sustitutiva, así como suplementos orales con colecalciferol (1.000 U/día) y sulfato ferroso a 30 mg/kg/día.
Se detecta toxina de Clostridium difficile (CD) en heces. Dado el historial del paciente, se plantea terapia antimicrobiana oral con vancomicina 125mg/8h y gentamicina 30mg/8h durante 21 días como adyuvancia en inducción de la remisión. Se tramita la autorización por Dirección Médica para uso en condiciones distintas a las autorizadas en ficha técnica según protocolo del centro y se inicia precozmente vancomicina. Desde el Servicio de Farmacia se elaboran cápsulas de gentamicina como fórmula magistral pediátrica y se dispensan con una semana de diferencia respecto de la vancomicina.
Para la elaboración de 100 cápsulas de gentamicina 30 mg se emplearon: cápsulas número 2, 3 g de gentamicina sulfato polvo como principio activo y 17,5 g de dextrinomaltosa polvo como excipiente. Se utilizó capsulero y técnica según protocolo de encapsulación de nuestro centro.
Finalmente se reintroduce la corticoterapia domiciliaria y después de 12 días de ingreso el paciente es dado de alta con vistas a completar la antibioterapia por SNG hasta mediados de marzo.
En revisiones posteriores, al margen de que se encuentra mejoría en el curso de la enfermedad (Tablas 1 y 2), se decide el 11 de marzo la segunda reinducción de IFX intensificado por no haber alcanzado los niveles plasmáticos requeridos de mantenimiento. El 21 de marzo acude nuevamente a Urgencias por empeoramiento general y se detecta toxina de CD por lo que se reinicia el tratamiento de base con vancomicina y gentamicina manteniéndose hasta el 28 de mayo, fecha en la que se interrumpe también el fármaco biológico. Durante ese período se registran brotes de actividad de la EII (Tablas 1 y 2).
DISCUSIÓN
Se ha observado una pobre respuesta a la terapia convencional en EII temprana1. Nuestro paciente recibió pluriterapia optimizada e intensificada. Pese a que el mantenimiento concomitante con biológicos (IFX) y tiopurinas (azatioprina) en pacientes pediátricos es controvertido por el potencial incremento de linfoma e infecciones5, la poca respuesta a la monoterapia motivó su uso. El paciente ingresó por un brote de actividad lo que indujo a la necesidad de valorar terapias alternativas.
Dada la implicación descrita de la disbiosis en la exacerbación de los brotes4, se planteó la terapia combinada de antibióticos. No hay estudios específicos que avalen su eficacia y seguridad en EII. Revisando la literatura se encontró una serie de 5 niños diagnosticados de EII no monogénica que habían sido previamente tratados con los fármacos inmunosupresores habituales y recibieron inducción con la doble antibioterapia (excepto uno, en monoterapia con vancomicina) obteniéndose una mejoría inicial en el 80% y la remisión mantenida en el 60% durante el tiempo de seguimiento. Ninguno experimentó reacciones adversas (RAM) asociadas1. Debido al beneficio descrito en la revisión y a la aparente seguridad del tratamiento, con actuación local y mínima absorción, se autorizó su uso en situaciones especiales por la Dirección Médica del centro.
En nuestro paciente, se describe una remisión inicial en la primera introducción del tratamiento, con descenso de los reactantes inflamatorios y mejora en su sintomatología (Tablas 1 y 2). Sin embargo, durante la segunda reinducción, experimentó varios brotes de actividad inflamatoria de intensidad variable coincidiendo con los bajos niveles de IFX, obligando a su suspensión definitiva. En la tabla 1 se recogen los niveles plasmáticos de los antibióticos, prácticamente despreciables. No se describieron RAM.
La serie de casos publicados se asemeja a nuestro paciente tanto en la edad de aparición de la enfermedad como en el componente no monogénico, siendo 3 de ellos también de etiología “no clasificable”. En relación con las terapias previas, solo 2 de los niños habían recibido una pluriterapia previa similar a nuestro caso y ambos obtuvieron muy buena respuesta a las sucesivas reinducciones, manteniendo la remisión durante el período de seguimiento. De los 3 restantes, uno la alcanzó, otro no mejoró y el último se benefició únicamente de la primera inducción, al igual que nuestro paciente.
A la vista de todo lo comentado, cabe resaltar la gran variabilidad en la respuesta a los antibióticos por parte de los pacientes pediátricos con EII. Si bien se presenta como una potencial terapia, será necesario llevar a cabo estudios para determinar qué pacientes se pueden beneficiar de ella así como determinar su seguridad a largo plazo, en aparición de resistencias y empeoramiento de la disbiosis.















