INTRODUCCIÓN
La seguridad del paciente oncológico en tratamiento con cualquier medio disponible de la actualidad exige la participación interdisciplinar. Este planteamiento proporciona una visión corresponsable y enriquecedora de los recursos disponibles y de sus diferentes enfoques profesionales1. Aunque la seguridad del paciente es una prioridad en oncología, pocas herramientas miden los eventos adversos (EA) y dentro de ello los efectos adversos a drogas (EA), tan relevantes en estas patologías cuando se trata con medicamentos quimioterápicos. Esta información es importante para cuantificar la carga del daño en los pacientes con cáncer y para identificar oportunidades para la prevención de esos daños. Los EA se refieren a resultados que resultan de la atención médica con estos medicamentos2.
A pesar del avance que ha supuesto en la supervivencia de los pacientes oncológicos, la aparición de nuevos agentes quimioterápicos y nuevas combinaciones, estos han traído consigo numerosos efectos adversos que pueden llegar a comprometer el tratamiento y, por consiguiente, el pronóstico de la enfermedad3.
Los fármacos antineoplásicos suprimen la proliferación del tumor actuando sobre los mecanismos de reproducción celular, tanto a nivel del ADN, del ARN o sobre componentes citoplasmáticos imprescindibles para la división celular. La quimioterapia convencional continúa siendo un pilar fundamental en el tratamiento del cáncer. De hecho, las indicaciones para la quimioterapia son cada vez más numerosas, para un espectro cada vez más amplio de tumores. Esta es la razón de la existencia de una mayor diversidad de toxicidades, que deben ser identificadas y reducidas. Un manejo correcto de las mismas se traduce en un mejor control de los síntomas y una mejor calidad de vida para los pacientes4.
Un EA a un medicamento se define como una reacción tóxica no intencionada de un fármaco utilizado a dosis estándar con fines profilácticos, diagnósticos o terapéuticos5. Algunos EA se observan en todos los pacientes expuestos, mientras que otros, sólo se producen en poblaciones susceptibles. La valoración de los EA por los fármacos antineoplásicos es compleja debido a:
La administración de citostáticos se acompaña demúltiples efectos adversos que son consecuencia directa de la acción terapéutica del fármaco, ya que no es selectiva sobre las células malignas.
Con frecuencia se emplea la combinación de dos omás fármacos antineoplásicos, con el fin de prevenir las resistencias y lograr sinergismo con menor toxicidad.
Los tratamientos siempre llevan asociados otros medicamentos (antieméticos, corticoides, atropina, antihistamínicos H2), para prevenir ciertos efectos adversos, sobre todo reacciones de tipo anafilácticas o de hipersensibilidad.
El mecanismo de acción implicado es desconocido yobjeto de controversia en muchos casos por las limitaciones existentes al momento de estudiar la presencia de mecanismos inmunológicos.
Informar sobre los EA es uno de los elementos más importantes de una publicación de ensayos clínicos, no obstante la informacion real disponible es controversial.
En los últimos años los nuevos tratamientos incorporados como los anticuerpos monoclonales y factores de regulación inmune, han prolongado la sobrevida de los pacientes con cáncer refractario a esquemas terapéuticos de primera línea6.
Los EA son múltiples: el manejo incorrecto de los mismos, la impredicibilidad de los daños crónicos no informados o no detectados, la escasa dotación de tecnología para manejar estos medicamentos, colaboran con la aparición de ellos.
Se estudió que los EA a quimioterápicos pueden ser prevenibles, si se emplean sistemas de seguridad o si se diseñan sistemas con múltiples barreras que puedan impedir los eventos que dañen al paciente, como por ejemplo los derivados de una administración incorrecta, las extravasaciones, los que tienen origen en una dosis incorrectamente calculada, etc7.
Existen diversas herramientas que miden el daño asociado a medicamentos en los pacientes, la primera de ellas es el Global Trigger Tool (GTT) o herramienta de gatillos8, que fue diseñada por el Institute for Healthcare Improvement (IHI) y utiliza disparadores como el aumento de la creatinina sérica, utilización de naloxona, deterioro del sensorio, entre otros, para detectar posibles EA. A partir de estos marcadores se puede reconocer si hubo o no EA a quimioterapia en pacientes oncológicos, luego de encontrar esa información hay que analizar si hubo o no EA. La segunda herramienta es la revisión tradicional de la historia clínica completa (RHCC), la cual requiere tiempo de revisión, sobre todo, cuando se trata de neoplasias muy crónicas y pacientes complejos con diversas comorbilidades.
Los costos de los eventos adversos a medicamentos son altos, se ha estudiado que estos eventos implican prolongación de estancia y otras variables de resultado clínicos negativos9.
El objetivo de este estudio es conocer la incidencia de los EA asociados a quimioterapia con dos herramientas de detección, caracterizarlos y analizar sus implicancias económicas.
MATERIALES Y MÉTODOS
Diseño: estudio observacional, prospectivo, de incidencia de una muestra de pacientes oncológicos.
Participantes: se aleatorizaron 350 pacientes con cáncer atendidos en el hospital del estudio de inicio a fín, sea por fallecimiento o por alta definitiva, durante los años 2010-2018.
El estudio se realizó en un hospital argentino de alta complejidad.
Se utilizaron las herramientas: Global Trigger Tool (GTT) del IHI en su versión original (Anexo I), y la revisión manual sin gatillos, busqueda a través de la lectura total de la HC durante todo el tiempo que ello requiera. Se utilizó el cuestionario de Schumock10para valorar el aspecto prevenible de los EA y el algoritmo de Naranjo y col.11para valorar causalidad. Se usó la escala del National Council Coordinating for Medication Error Reporting and Prevention (NCCMERP)12, para valorar la gravedad de los eventos con las categorías: E-I, siendo E daño menor que requiere intervención clínica e I daño que provoca la muerte por medicación. Las revisiones de las historias clínicas las hicieron farmacéuticos entrenados en farmacovigilancia. Los revisores fueron cuatro, dos revisores para trabajar con la herramienta GTT ya que así lo describe esta metodología y si hay discrepancias en los hallazgos recurren a un tercer observador que resuelve la discrepancia. Dos revisores independientes realizaron la revisión de las historias clínicas completas (RHCC) mediante lectura total de las mismas. Los revisores fueron entrenados en las metodologías, y fueron farmacéuticos con formación en farmacovigilancia y en seguridad del paciente.
Las variables independientes estudiadas fueron: sexo, edad, presencia de radioterapia, presencia de cirugía, de terapia hormonal, de metástasis, polifarmacia. Se definió polifarmacia a la presencia simultánea de más de 4 medicamentos según la OMS13. ECOG (Escala Eastern Cooperative Oncology Group) con un puntaje de 1-5 siendo 0 competamente activo, 5 muerte, 4 completamente inactivo14.
La fuente bibliográfica de consulta de medicamentos fue UpToDate on line15, versión agosto 2018.
Análisis estadístico: se calcularon medidas de tendencia central y de dispersión de variables independientes y proporciones porcentuales con sus intervalos de confianza, se realizaron regresiones binarias y curva de ROC. Se utilizó el programa estadístico SPSS 21® IBM (Statistical Package for the Social Sciences) version 21 para Windows.
Se consideró significancia estadística a un valor de p<0,05, con un IC 95%. El cálculo del tamaño muestral se calculó estimando una proporción de eventos del 45%, con un error alfa de 0,5, precisión del 3% e IC del 95%. Se realizó la curva ROC para valorar la especificidad y sensibilidad de Global Trigger Tool (GTT), y del sistema manual. Se analizaron los factores asociados a EA con sus Odd ratio (OR) ajustados.
Se relevaron las hospitalizaciones completas. Se estudiaron los costos sanitarios de las hospitalizaciones con perspectiva hospitalaria a través del área de facturación del hospital, considerando 1 dólar americano (USD): $38 pesos argentinos según Banco Central de la República Argentina a diciembre de 2018. Se compararon los costos emitidos por facturación de hospitalizaciones con y sin EA.
Comité de Ética: se contó con la aprobación del Comité de Ética Institucional y con la aprobación del Comité de Investigación del hospital donde se realizó el estudio.
RESULTADOS
Se estudiaron 350 pacientes, media de edad: 56,9, mediana: 43,4, rango: 19-85, desvío estándar (DE): 29,7. La distribución por sexo fue: femenino 54,3% (n=190), masculino: 45,7% (n=160). Los pacientes distribuidos en rangos de edad fueron: <45 a: 55 (15,7%) casos, 46-69 a: 218 (62,3%) casos, >70 a: 77 (22%) casos.
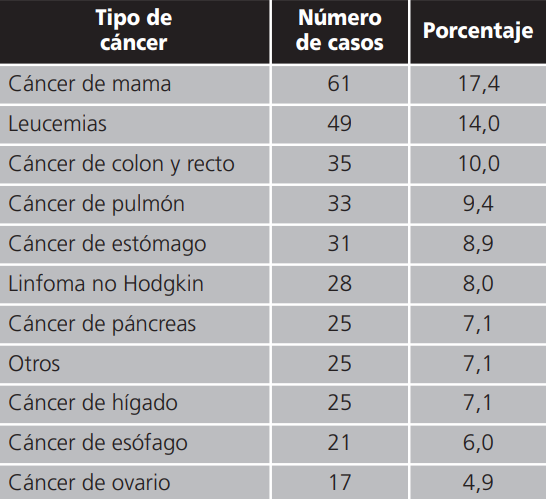
La media de días de hospitalización de todas las hospitalizaciones analizadas, por paciente fue: 48,2±23,4 (IC 95% 38,5-53,8) días, una media de 3,4 episodios de hospitalizaciones por paciente. Los días paciente analizados fueron 12.460. Los diagnósticos mayoritarios fueron: cáncer de mama: 61 (17,4%), leucemias 49 (14%), cáncer de colon y recto 35 (10%), cáncer de pulmón: 39 (9,4%), linfoma no Hodgkin: 28 (8%), cáncer de páncreas: 25 (7,1%), hepatocarcinoma: 25 (7,1%), se detallan en la tabla 1.
Los pacientes con metástasis fueron 181 (51,71%),siendo las mayoritarias hepática: n=75 (41,43%), y ósea:69 (19,71%).
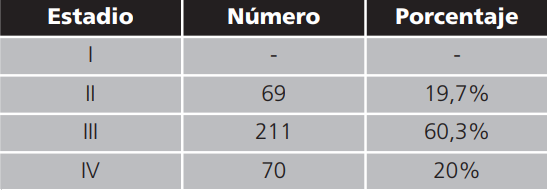
Los estadios de enfermedad se detallan en la tabla 2.
La media total de medicamentos empleados por paciente fue 18,98±4,67 (IC95% 15,72-22,04), rango 4-26 en internación, 7,65±3,53 en ambulatorio (IC95% 4,32-11,61), rango 4-11. La polimedicación en toda la muestra estuvo presente en el 89,7% (n=312) de los casos (IC95% 77,5-93,8).
El número de pacientes con EA fue: 323 en los cinco años. La incidencia acumulada (IA) fue: 0,923 es decir 92,3% pacientes en 5 años y la densidad de incidencia (DI) fue 0,186 en cinco años es decir 18,6%.
El número de EA en la muestra fue 1.601 con la revisión manual, una media de 4,57 EA/paciente en el total de la muestra. Los indicadores de EA fueron: 457,42 EA/100 altas, y 118,57 EA/1.000 días paciente hospitalizados. Se contabilizaron 152,47 EA/1.000 dosis de oncológicos administrados. Con la revisión de GTT se hallaron 1.578 EA, una media de 4,50 EA/paciente. Los indicadores de EA fueron: 450,8 EA/100 altas, y 126,64 EA/1.000 días paciente y 141,45 EA/1.000 dosis de medicamentos oncológicos administrados. Los tipos de EA se detallan en la tabla 3.
Tabla 3. Caracterización de los eventos adversos según órgano y sistema afectado.
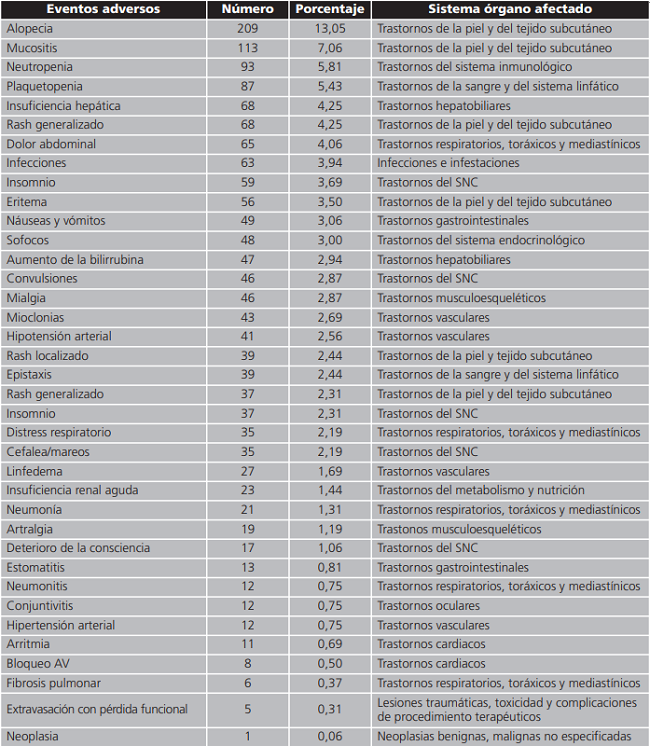
SNC: sistema nervioso central.
La sensibilidad y especificidad de las herramientas de detección se visualizan en la tabla 4.
Tabla 4. Sensibilidad y especificidad de los eventos adversos a drogas encontradas con los dos métodos.

ADES: eventos adversos a drogas.
GTT: Global Trigger Tool.
Como vemos los dos instrumentos proactivos tienen buen poder predictivo pero la herramienta GTT lleva menor tiempo de revisión. El número de EA encontrado no es significativamente diferente desde lo estadístico, son muy similares y eso posiciona con ventaja a la herramienta de gatillos sobre la revisión completa de la historia clínica que exige la completitud de la misma como condición básica, mientras que con la herramienta de gatillos se exige esta condición pero en menor medida porque lo que se busca son los gatillos no los eventos. La revisión manual lleva una media de 123,4±26,5 minutos en cada historia clínica mientas que GTT solo 20 minutos (p=0,005), 6 veces menor.
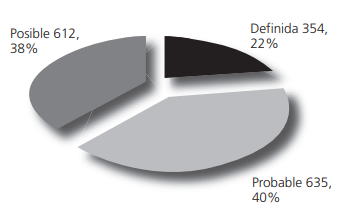
Las categorías de causalidad del fármaco según Naranjo se detallan en la figura 1.
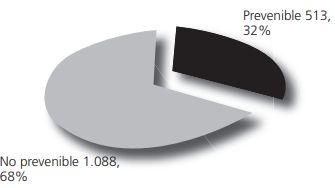
Los fármacos mayormente involucrados en los EA fueron: ciclofosfamida (n=230), etopósido (n=190), paclitaxel (n=120), vincristina (n=99), docetaxel (n=70), oxaliplatino (n=61), trastuzumab (52), cisplatino (n=49), doxorrubicina (n=45), fluorouracilo (n=42), metrotrexato (n=40). Los EA prevenibles se visualizan en la figura 2.
Las características epidemiológicas de los pacientes con y sin EA figuran en la tabla 5.
Tabla 5. Características epidemiológicas de pacientes con y sin ADES.
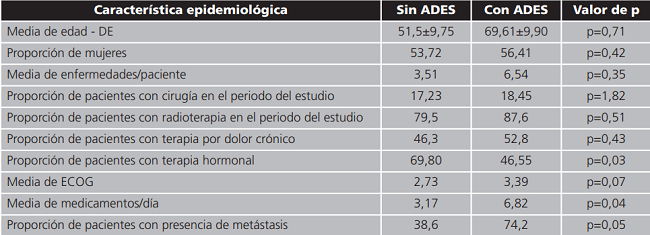
ECOG: (Escala Eastern Cooperative Oncology Group). Las diferencias significativas se dan en: presencia de terapia hormonal, media de medicamentos por día, presencia de metástasis.
Las diferencias significativas se dan en: presencia de terapia hormonal, media de medicamentos por día, presencia de metástasis.
Las categorías de daño según el NCCMERP se muestran en la figura 3.
La longitud de estancia es mayor con niveles de significación en el caso de pacientes con EA que sin EA.
La longitud de estancia con y sin EA figuran en la tabla 6, y las variables asociadas a la aparición de EA en la tabla 7.
Tabla 6. Longitud de estancia con y sin eventos adversos a drogas.

ADES: eventos adversos a drogas. La longitud de estancia es mayor con niveles de significación en el caso de pacientes con ADES que sin ADES.
Tabla 7. Variables asociadas a aparición de eventos adversos a drogas.
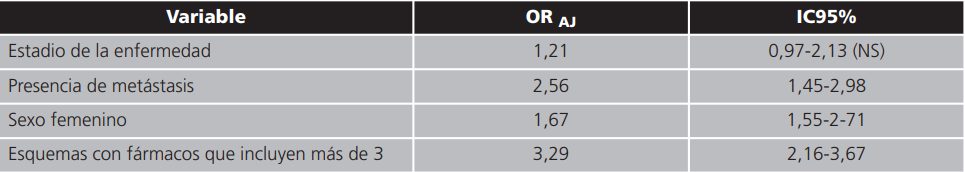
ADES: eventos adversos a drogas. La única variable no asociada a ADES fue estadio de la enfermedad. Las demás variables estarían asociadas en una regresión binaria ajustada por edad.
La única variable no asociada a EA fue estadio de la enfermedad. Las demás variables estarían asociadas en una regresión binaria ajustada por edad.
Los valores de facturación en hospitalizaciones con y sin EA se muestran en la tabla 8.
DISCUSIÓN
Los EA son relevantes, la incidencia encontrada en estudios similares ha sido del 75%15 (menor a lo encontrado por este estudio), hay pocos estudios que han monitorizado a los pacientes durante tanto tiempo con herramientas proactivas. Los EA más frecuentes fueron: alopecia, mucositis, neutropenia, plaquetopenia, insuficiencia hepática, rash generalizado, dolor abdominal, infecciones, insomnio, eritema, náuseas y vómitos estos significaron más del 60% de los EA encontrados, tal como menciona el estudio de Kronschinsky16.
En estudios observacionales17 realizados en muestras de pacientes oncológicos en los cuales se recogen las reacciones adversas mostradas a lo largo de su tratamiento con quimioterapia, las toxicidades más frecuentes, sin importar el tipo de tratamiento o localización del proceso neoplásico incluyen: anemia, leucopenia, neutropenia, trombocitopenia, infecciones, hepatotoxicidad, nefrotoxicidad, náuseas y vómitos, diarreas y neurotoxicidad. Reacciones similares a las que encontramos en nuestro estudio. Un estudio menciona que las reacciones dermatológicas son muy frecuentes, muy principalmente la alopecia que cobra su importancia por la apariencia física que impacta en la vida emocional, psíquica y social de estos pacientes, en nuestro estudio fue una de las principales reacciones halladas18.
El estudio de Unbeck19 analizó la metodología de screening de eventos del Harvard Practice Study120 y encontró que este método halló mayor número de EA que el GTT. De la misma manera la metodología GTT es criticada por los estudios de Mattsson21-22 porque las coincidencias entre los evaluadores y los eventos hallados son muy dispares, si bien esto es una realidad, no hay demasiadas herramientas superadoras de hallazgos de EA que sean simples y accesibles de usar, más allá del reporte voluntario que está descartado como herramienta de pesquisa. De todos modos, en nuestro estudio la concordancia entre los revisores ha sido buena, la base fundamental es la comprensión de la metodología y el entrenamiento en su utilización. Lo importante es que los eventos que se hallan con cualquier herramienta sirvan para contabilizarlos en el tiempo, detectarlos tempranamente, reducirlos, mitigarlos, etc.
En relación a la evaluación de la causalidad con Naranjo, se complica por la fragilidad y complejidad de los pacientes, así como por la multiplicidad de medicamentos usados en los tratamientos23. Lo más recomendable es la utilización de enfoques integrados de detección y valoración de causalidad, y mitigación, nuestro estudio analizó la causalidad solo con el algoritmo de Naranjo siendo esto una debilidad.
En cuanto a los costos asociados a los EA, existe una revisión que menciona que los costos debidos a eventos adversos prevenibles en un entorno hospitalario oscilan entre un mínimo de € 2.851 a un máximo de € 9.01524 (entorno de pacientes hospitalizados). Nuestro estudio mostró que los valores facturados en pacientes con EA y sin EA en dólares americanos son significativamente diferentes (USD 5.343,75 vs. 15.287,5), estos valores en conversión de moneda están dentro del rango encontrados por el estudio mencionado.
La debilidad del estudio es haber analizado solo las historias clínicas, tomando la información de esta fuente y asumiendo que en su gran mayoría las reacciones estaban registradas, por ello es que se usó la herramienta Global Trigger Tool (GTT) que más allá de encontrar EA registradas, los busca proactivamente aunque no estén descritos como tal. Otra debilidad es haber analizado los pacientes de una sola institución y no de varias instituciones para ampliar el número de pacientes, amplificar la perspectiva y el enfoque del estudio y la representatividad de la muestra.
Las herramientas de detección usadas son útiles con curvas de ROC similares, dando cuenta de su sensibilidad y especificidad pero la revisión manual lleva más tiempo que la revisión mediante gatillos y con ello ofrece una gran dificultad para ponerla en práctica.
En un estudio llevado a cabo por Pearce et al.25, en distintos centros de atención oncológica con la finalidad de recoger todas las reacciones adversas debidas a quimioterapia, incluyó un grupo de 441 pacientes, de los cuales 141 tenían diagnóstico de cáncer colorrectal. Las características generales de los pacientes incluidos en este estudio eran similares a las de este estudio, solamente que había un mayor predominio de los pacientes en etapa IV. La frecuencia de reacciones sanguíneas tipo leucopenia y trombocitopenia tuvieron el tercer lugar en orden de frecuencia.
No hay estudios que hallan estudiado la revisión de métodos proactivos de gatillos y de lectura completa de historias clínicas, en este estudio se muestra este hallazgo en pacientes complejos como los pacientes oncológicos. La revisión completa sin gatillos lleva 6 veces el tiempo de la revisión de gatillos para encontrar similares resultados. El 89,5% de los EA encontrados por la metodología de los gatillos fueron encontrados por la revisión de la historia clínica completa.
CONCLUSIONES
El número de pacientes con EA fue: 323 en los cinco años. La incidencia acumulada (IA) fue: 0,923 es decir 92,3% pacientes en 5 años y la densidad de incidencia (DI) fue 0,186 en cinco años es decir 18,6%.
El número de EA en la muestra fue 1.601 con la revisión manual, una media de 4,57 ADES/paciente en el total de la muestra. Los indicadores de EA fueron: 457,42 EA/100 altas, y 118,57 EA/1.000 días paciente hospitalizados. Se detectaron 152,47 EA/1.000 dosis de oncológicos administrados. Con la revisión de GTT se hallaron 1.578 EA, una media de 4,50 EA/paciente. Los indicadores de EA fueron: 450,8 EA/100 altas, y 126,64 EA/1.000 días paciente y 141,45 EA/1.000 dosis de medicamentos oncológicos administrados.
Se hallaron 1.601 EA. El 89,5% fueron encontrados por ambos métodos: GTT y revisión completa de las historias clínicas. La terapia hormonal, la presencia de metástasis y la media de medicamentos por paciente son características con diferencias significativas en pacientes con y sin EA.
La longitud de estancia es mayor con niveles de significación en el caso de pacientes con EA que sin EA (más del doble).
Los costos facturados en hospitalizaciones son mayores con que sin EA con niveles de significación (más del doble).