INTRODUCCIÓN
El mieloma múltiple (MM) es la segunda neoplasia hematológica en orden de frecuencia. Se define como una neoplasia de células B clonales caracterizada por la acumulación de células plasmáticas (CP) malignas en la médula ósea (MO). Las células mielomatosas secretan una inmunoglobulina de carácter monoclonal que puede ser detectada en el suero y/u orina, y a su vez, como consecuencia de su interacción con el micromedioambiente de la MO, desencadenan un aumento de la actividad osteoclástica que se traduce en la presencia de lesiones óseas1-3. Esta enfermedad se caracteriza principalmente por la presencia de anemia, hipercalcemia, insuficiencia renal y lesiones óseas (World health Organization, 2008).
Según las recomendaciones de consenso establecidas por el Panel 3 del International Myeloma Workshop4, los criterios diagnósticos para diferenciar las gammapatías monoclonales de significado incierto (GMSI), el MM asintomático y el MM sintomático son los siguientes:
Detección y concentración de proteína monoclonal sé-rica (IgG o IgA). Se considera MM y no GMSI cuando la concentración proteica supera los 3 g/dL.
Concentración de células plasmáticas en médula ósea.Diferenciamos el MM de las GMSI en el caso de que este porcentaje sea igual o superior al 10%.
Evidencias de daños orgánicos, entre los que se pue-den destacar: hipercalcemia, daño renal (si la creatinina sérica presenta una concentración superior a los 2 mg/dL), anemia, lesiones óseas como fracturas, osteopenia severa o lesiones líticas.
Además, también se han descrito múltiples alteraciones citogenéticas relacionadas con el MM, siendo la más frecuente la translocación del locus de las cadenas pesadas en el cromosoma 14q325.
El MM representa el 1%6 de todas las neoplasias y aproximadamente el 10% de las hemopatías malignas. Es una enfermedad relativamente frecuente que incide principalmente en personas mayores de 50 años (tan sólo el 15% tienen menos de 50 años), la mediana de edad en el momento del diagnóstico es de 65 años7. Su incidencia se sitúa en torno a 4 casos por cada 100.000 habitantes y año. La mediana de supervivencia de los pacientes con MM es de unos 3 años. No obstante, el curso de la enfermedad puede ser muy variable, desde casos muy agresivos hasta otros con un comportamiento indolente con supervivencias superiores a 10 años2. En España existen unos 10.000 casos y cada año, se diagnostican 2.000 más.
Es una enfermedad tratable y, aunque sigue siendo incurable, su pronóstico ha mejorado y cada vez hay más series que superan los 5 años de mediana de supervivencia. Esto se debe a un cambio terapéutico casi revolucionario en el que ya hay indicios que indican la posibilidad de superar al trasplante autólogo. Todo se debe atribuir a la introducción de 3 nuevos fármacos con gran eficacia en esta enfermedad: talidomida, bortezomib y lenalidomida8. El primero de todos ellos fue la talidomida que a finales de los 90 demostró capacidad de inducir respuestas en un tercio de los pacientes resistentes9. Posteriormente se descubrió que la inhibición del proteasoma, a través de un fármaco denominado bortezomib también era capaz de rescatar hasta un 40% de enfermos refractarios incluso a talidomida y trasplante, con una supervivivencia libre de progresión superior a 6 meses10,11. El tercer fármaco aprobado para tratamiento de mieloma en recaída o refractarios ha sido la lenalidomida, que en combinación con dexametasona logra un 60% de respuestas y una supervivencia libre de progresión cercana al año12-13.
Siguiendo las directrices establecidas por el Panel 1 del International Myeloma Workshop Group14,15, se puede definir MM en recaída como “aquel mieloma previamente tratado, cuyo avance requiere el inicio de lo que se conoce como terapia de rescate y caracterizado por no poder clasificarse como MM refractario ni como MM refractario en recaída”.
Existen diversas indicaciones terapéuticas aprobadas por la Agencia Europea del Medicamento (EMA) para el tratamiento del MM, basadas en diferentes combinaciones de fármacos, como talidomida, bortezomib y lenalidomida. Las indicaciones europeas en práctica clínica se basan en diversas estrategias (talidomida con melfalán y prednisona; bortezomib en monoterapia o con melfalán y prednisona; lenalidomida con dexametasona; entre otras)16,17.
Por otra parte, también ha habido estudios clínicos sobre la eficacia de las diferentes estrategias terapéuticas para el tratamiento del mieloma múltiple en recaída10. Tanto bortezomib en monoterapia como lenalidomida más dexametasona han demostrado superioridad frente a dosis elevadas de dexametasona en ensayos clínicos aleatorizados, alcanzando tasas de respuesta global (TRG) del 38%18 y del 60-61%19-21, respectivamente. Además, hay estudios de combinaciones como VTD (bortezomib, talidomida y dexametasona)22 y VRD (bortezomib, lenalinomida y dexametasona), que produjeron TRGs del 67%23 y 63%24, respectivamente.
En la práctica clínica actual los posibles tratamientos de MM en recaída incluyen casi siempre combinaciones de los siguientes fármacos: lenalidomida, bortezomib, dexametasona, prednisona, doxorrubicina, talidomida, melfalan, ciclofosfamida, bendamustina, pomalidomida, daratumumab y carfilzomib.
El objetivo principal de este estudio fue evaluar la efectividad en términos de tiempo hasta progresión, desde el momento del diagnóstico hasta la tercera progresión, en pacientes diagnosticados de mieloma múltiple según la práctica clínica habitual:
Secuencia 1 (recogida retrospectivamente): 1ª línea basada en bortezomib, 2ª línea con bortezomib y 3ª línea basada en lenalidomida frente a
Secuencia 2 (recogida prospectivamente): 1ª línea basada en bortezomib, 2ª línea con lenalidomida y 3ª línea basada en bortezomib.
Como objetivos secundarios se planteó describir los acontecimientos adversos que ocurren a lo largo del estudio durante las tres líneas de tratamiento y la SG.
MATERIAL Y MÉTODOS
Se trata de un estudio post-autorización observacional no intervencionista de seguimiento retrospectivo/prospectivo, unicéntrico, realizado en un hospital de tercer nivel desde enero de 2015 hasta octubre de 2019, diseñado para describir la efectividad y la seguridad de dos secuencias de tratamiento diferentes (bortezomib-bortezomib-lenalidomida frente a bortezomib-lenalidomida-bortezomib) utilizados según la práctica clínica habitual en las tres primeras líneas de tratamiento de MM, en pacientes que no eran candidatos a trasplante de médula ósea.
Todos los sujetos incluidos en el estudio fueron seguidos durante un periodo definido por las siguientes dos fases:
Fase retrospectiva: Se analizaron los pacientes que ha-bían recibido bortezomib como retratamiento en 1ª recaída y lenalidomida en 2ª recaída, tras haber recibido una 1ª línea con bortezomib, durante dos años, para poder compararlos con la nueva secuencia que se plantea en la fase prospectiva del estudio.
Fase prospectiva: Se determinaron los pacientes queiban a recibir lenalidomida en 1ª recaída, seguido de bortezomib en 2ª recaída durante dos años, para poder establecer si la secuenciación de ambas alterntivas es efectiva y optimiza los recursos.
Se incluyeron a pacientes mayores de 18 años diagnosticados de MM, con estadio I-III de la enfermedad, no candidatos a trasplante de medula ósea y que firmasen voluntariamente el consentimiento informado.
Se excluyeron a pacientes que estuvieran participando en algún ensayo clínico intervencionista o que rechazasen participar en el estudio, a mujeres embarazadas y a pacientes que no quisieran firmar el consentimiento informado.
La variable principal del estudio fue el tiempo hasta progresión (TTP) de cada secuencia de tratamiento, que se determinó de acuerdo con los criterios del IMWG. Concretamente se definió el TTP como la suma de tiempos desde que se diagnosticaba el paciente hasta que comenzaba con la 4ª línea de tratamiento, es decir tiempo desde el diagnóstico hasta que tiene lugar la 3ª recaída. Entendiendo por progresión de la enfermedad como la presencia de un incremento de los niveles en suero de la proteína M ≥ a 1g/dl, o un incremento de proteína M en orina ≥ 500mg/24h (recaída biológica) y/o según los criterios IMGW tener recaída clínica, que requiere uno o más de los siguientes indicadores directos de aumento de la enfermedad y/o disfunción de órgano, que se consideran relacionadas con el trastorno proliferativo de células plasmáticas subyacente (CRAB):
Hipercalcemia: calcio sérico ≥11,5 mg/dl
Insuficiencia renal: creatinina sérica >2 mg/dl
Anemia: normocítica, normocrómica con hemoglo-bina <10 g/dl
Lesiones óseas: lesiones líticas, osteopenia severa ofracturas patológicas
Las variables secundarias del estudio fueron:
Supervivencia global
Efectos adversos que se produzcan
Variables demográficas del paciente:
Edad
Sexo
Otras definidas en el análisis estadístico.
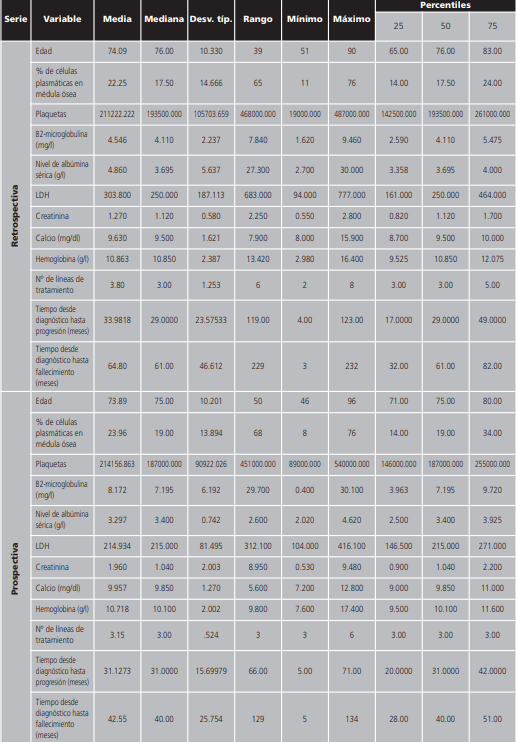
El análisis estadístico se realizó en base a los datos disponibles, sin emplear técnicas de sustitución de valores ausentes (missings), y describiendo el número de missings en cada análisis. Se realizaron análisis descriptivos de todas las variables por separado, mediante tablas de frecuencias absolutas y relativas en el caso de las variables cualitativas y cuantitativas discretas, y mediante los estadísticos media, desviación estándar, valores extremos y cuartiles, en el caso de variables cuantitativas continuas.
Análisis bivariante: Para comprobar las posibles diferencias en las principales variables estudiadas entre los dos brazos de tratamiento, se utilizó el test t de Student para muestras independientes o Mann-Whitney en caso de no normalidad. Para las variables cualitativas se empleó el test de Chi-cuadrado (en tablas rxs) o el test de Fisher (en tablas 2x2). La hipótesis de normalidad se comprobó con el test de Shapiro Wilks.
Análisis de supervivencia: Se realizó con el método de Kaplan Meier, calculando las probabilidades de supervivencia, supervivencia global y libre de progresión. Se calcularon las medias y medianas de supervivencia, así como sus intervalos de confianza al 95%.
El nivel de significación que se determinó para detectar diferencias significativas fue p<0,05; el software que se utilizó en los distintos análisis fue IBM Corp. Released 2012. IBM SPSS Statistics for Windows, Version 21.0. Armonk, NY: IBM Corp.
El presente estudio se llevó a cabo en consonancia con el código ético de la Organización Mundial de la Salud sobre estudios con humanos (Declaración de Helsinki). Todos los pacientes participantes fueron informados debidamente y cumplimentaron y firmaron el consentimiento informado. Los investigadores asignaron un código de identificación a cada uno de sus pacientes para así mantener la confidencialidad de los datos (Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de derechos digitales). El estudio fue aprobado por el Comité Coordinador de Ética de la Investigación Biomédica de Andalucía (CCEIBA).
RESULTADOS
Durante el periodo de estudio se reclutaron a 110 pacientes: 55 en la fase retrospectiva y 55 en la fase prospectiva. El 49% fueron hombres, con una edad media de 72 años y el 51% fueron mujeres, con una edad media de 75 años. De los 110 pacientes reclutados el 35% fueron exitus. Entre las comorbilidades más frecuentes, el 50,9% de los pacientes presentó hipertensión arterial, el 19% diabetes mellitus tipo 2, el 18,1% tenía enfermedad renal crónica, un 10% algún tipo de anemia y un 2% enfermedad pulmonar obstructiva crónica (EPOC). Según el sistema de clasificación internacional (ISS) del mieloma múltiple, el 68,1% de los pacientes tenían un estadío III, el 23,8% en estadío II y un 8,1% estadío I. El 53,6% de los pacientes presentaron un MM de tipo IgG Kappa, el 21,7% tenían un MM de tipo IgG Lambda, el 21,8% era MM IgA Kappa y el 2,9% era IgA Lambda. El 45,4% de los pacientes presentaron lesiones osteolíticas. Los estadísticos descriptivos de las variables cuantitativas según la serie quedan recogidos en la tabla 1.
Los esquemas de tratamiento más utilizados fueron los basados en bortezomib y lenalidomida: esquema VISTA (bortezomib combinado con melfalan y prednisona), VCD (bortezomib combinado con ciclofosfamida y dexametasona), VD (bortezomib combinado con dexametasona) y lenalidomida combinado con dexametasona. En la serie retrospectiva fueron tratados con esquemas basados en bortezomib en primera línea el 100% de los pacientes, de los que el 72,7% fueron retratados con un esquema basado en bortezomib como segunda línea de tratamiento y un 94,5% utilizaron lenalidomida más dexametasona como tercera línea de tratamiento. En la serie prospectiva fueron tratados con esquemas basados en bortezomib como primera línea de tratamiento el 100% de los pacientes, de los que el 80% fueron tratados con lenalidomida más dexametasona como segunda línea de tratamiento y el 65,4% se trataron repitiendo un esquema basado en bortezomib como tercera línea. La tabla 2 muestra la respuesta obtenida en los pacientes que habían sido tratados con un esquema de tratamiento basado en bortezomib en la serie retrospectiva y la serie prospectiva.
Tabla 2. Tabla de contingencia Respuesta tras bortezomib * Serie.
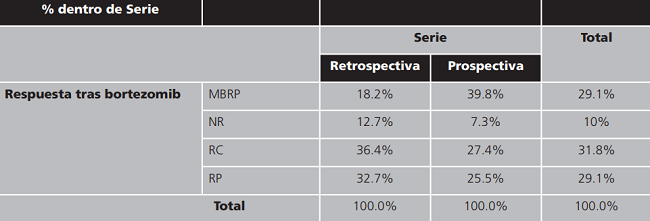
MBRP: muy buena respuesta parcial; NR:no respuesta; RC: respuesta completa; RP: respuesta parcial.
La tabla 3 muestra la respuesta obtenida en los pacientes que habían sido tratados con lenalidomida en la serie retrospectiva y la serie prospectiva.
Tabla 3. Tabla de contingencia Respuesta tras lenalidomida * Serie.
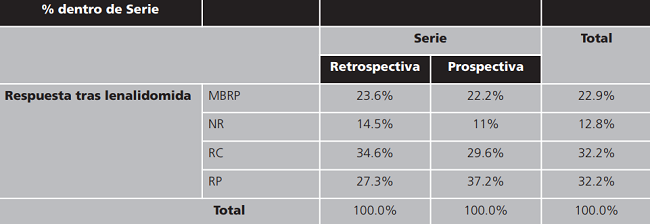
EE: enfermedad estable; MBRP: muy buena respuesta parcial; NR: no respuesta; RC: respuesta completa, RP: respuesta parcial.
Según un estudio de Kaplan Meyer para tiempo hasta progresión el tiempo mediano libre de progresión fue de 29 meses y el 100% de los pacientes del estudio progresó a lo largo del tiempo de tratamiento (Tabla 4).
Tabla 4. Medias y medianas del tiempo de supervivencia.
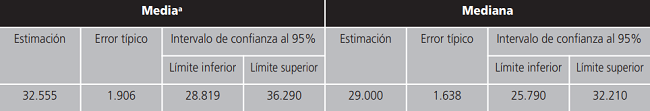
a:la estimación se limita al mayor tiempo de supervivencia si se ha censurado.
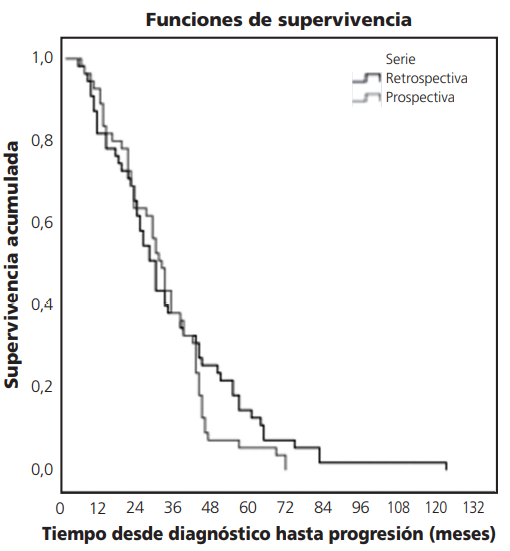
Se realizó un estudio de Kaplan Meyer para el tiempo hasta progresión según serie (Tabla 5) y se observó que el tiempo mediano libre de progresión fue de 29,0 meses para los pacientes de la serie retrospectiva y de 31,0 meses para los pacientes de la serie prospectiva.
Tabla 5. Medias y medianas del tiempo de supervivencia.
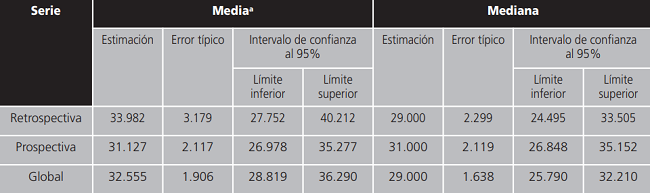
a:la estimación se limita al mayor tiempo de supervivencia si se ha censurado.
El Test de Log Rank indicó que no existían diferencias estadísticamente significativas entre las curvas de supervivencia de los pacientes según la serie (Tabla 6 y Figura 1).
Tabla 6. Comparaciones globales.
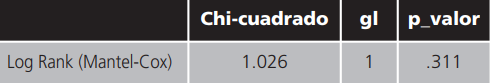
Prueba de igualdad de distribuciones de supervivencia para diferentes niveles de Serie.
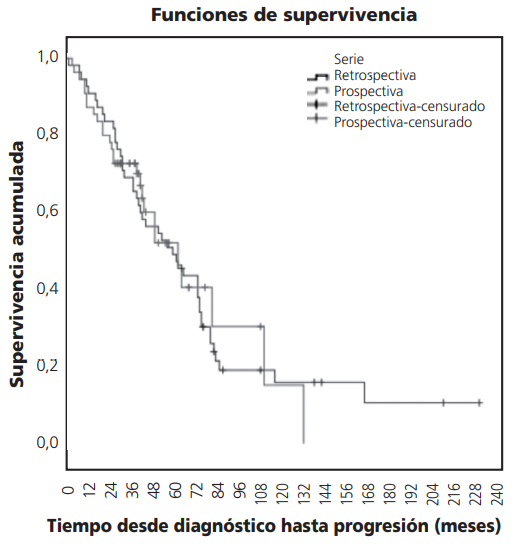
También se realizó un estudio de Kaplan-Meyer para la supervivencia global según serie y se obtuvo una mediana de supervivencia global de 61,0 meses para los pacientes de la serie retrospectiva y de 64,0 meses para los pacientes de la serie prospectiva (Tabla 7). El test de Log Rank indicó que no existían diferencias estadísticamente significativas entre las curvas de supervivencia global de los pacientes según serie (Tabla 8, Figura 2).
Tabla 7. Medias y medianas de Supervivencia Global.
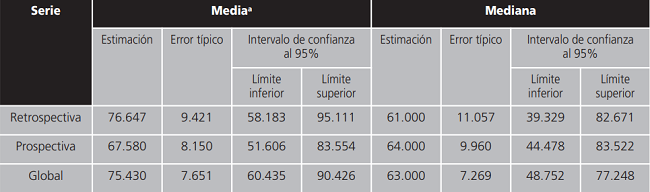
a:la estimación se limita al mayor tiempo de supervivencia si se ha censurado.
Tabla 8. Comparaciones globales.
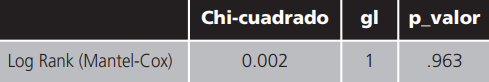
a:Prueba de igualdad de distribuciones de supervivencia para diferentes niveles de Serie.
Las reacciones adversas más frecuentes que se detectaron con la utilización de esquemas de tratamiento basados en bortezomib fueron neuropatía periférica que tuvo lugar en un 17,2% de los pacientes y neutropenia que se dio en un 3,6% de los pacientes. En cuanto a las reacciones adversas más frecuentes que se detectaron con el uso de lenalidomida fueron neutropenia que tuvo lugar en un 4,5% de los pacientes y diarrea que se dio en un 2,7% de los pacientes.
DISCUSIÓN
En la actualidad, no existen estudios que describan en términos de resultados en salud las diferentes secuencias de tratamiento, utilizando bortezomib o lenalidomida en primera recaída en pacientes con MM, y resulta interesante conocer las diferencias en el perfil de efectividad y seguridad entre estos dos enfoques, que es lo que se pretende con la realización de este trabajo.
Sólamente hay un ensayo donde se describen tres fármacos ((talidomida, bortezomib y lenalidomida) potencialmente utilizados en segunda línea de tratamiento. En este ensayo, los pacientes que habían recibido tratamiento previo con melfalán-prednisona-bortezomib, lenalidomida obtiene más respuestas parciales (73% vs 41%) que bortezomib, y esta diferencia es estadísticamente significativa25. En este estudio también se obtienen más respuestas parciales con lenalidomida que bortezomib (37.2% vs 32.7%). Los pacientes que recaen de forma precoz tras VISTA, es decir con TFI (treatment free interval-intervalo libre de tratamiento) <12 meses o SLP <24 meses, tienen escasas respuesta al retratamiento con bortezomib (<25%). Sin embargo, los pacientes con recaídas tardías tras VISTA (TFI >12 meses, SLP >24 meses) responden a bortezomib en un 75%. El 41% de los pacientes pretratados con bortezomib responden a bortezomib según el ensayo VISTA25. En este estudio el 87,3% de pacientes que fueron pretratados con bortezomib respondieron a bortezomib como retratamiento en la fase retrospectiva y el 89% respondieron a lenalidomida como segunda línea de tratamiento en la fase prospectiva.
Hoy en día, no existe una cura definitiva para el mieloma múltiple, por lo que la meta para el médico es conocer cómo controlar la enfermedad el mayor tiempo posible, con el fin de proporcionar una mejor oportunidad clínica para el paciente. Por esta razón, la primera recaída del paciente es la segunda oportunidad de alcanzar una respuesta óptima y duradera.
El análisis de los ensayos MM-009 y MM-010 mostró que lenalidomida más dexametasona en primera recaída mejoraba significativamente todos los parámetros de eficacia, en contra de su uso en líneas avanzadas, lo que reducía el coste por mes libre de progresión. La combinación de lenalidomida y dexametasona también demostró ser eficaz en primera recaída en términos de SG y SLP en los pacientes que habían recibido bortezomib en primera línea de tratamiento26. Por otro lado, no existe mucha evidencia sobre el uso de bortezomib en segunda línea después de una primera línea con bortezomib (retratamiento con bortezomib). Sin embargo, se han publicado datos de un total de 130 pacientes (con una mediana de 2 líneas previas de tratamiento) que recibieron retratamiento con bortezomib. Tiempo hasta la progresión (TTP): 8,4 meses27. En este estudio donde se muestra la experiencia en vida real sobre el tratamiento de 110 pacientes diagnosticados de mieloma múltiple en recaída se obtuvo un tiempo mediano libre de progresión de 29,0 meses para los pacientes de la serie retrospectiva, que son los que habían sido retratados con bortezomib, y de 31,0 meses para los pacientes de la serie prospectiva, que son los que fueron tratados con lenalidomida en primera recaída, por lo que la tercera recaída sucedería más temprano en la secuencia 1 que en la secuencia 2. Destacar que los datos de la mediana de supervivencia global concuerdan con lo comentado, siendo de 61,0 meses para los pacientes de la serie retrospectiva y de 64,0 meses para los pacientes de la serie prospectiva.
Hoy en día, la mayoría de los pacientes son tratados siguiendo la secuencia 2, en lugar de la secuencia 1. Sin embargo, creemos que es necesario documentar y describir los resultados en salud de estas dos secuencias de tratamiento en nuestro centro, para tener en cuenta nuestros propios datos de TTP, SG y perfiles de seguridad de las dos secuencias en la práctica clínica habitual. Es importante destacar que se espera que haya un sesgo en la información recopilada de forma retrospectiva como limitación de este estudio.
CONCLUSIONES
Aunque no hubo diferencias estadísticamente significativas entre las curvas de supervivencia y curvas de supervivencia global de los pacientes según serie, en términos de resultados en salud, la secuencia 2 de tratamiento que utilizó la lenalidomida en primera recaída resultó más efectiva y segura que la secuencia 1 de tratamiento que utilizó el bortezomib como retratamiento, porque se obtuvieron mejores datos de % de respuesta al tratamiento, de mediana de tiempo hasta progresión y menor incidencia de efectos adversos.