INTRODUCCIÓN
El síndrome del intestino corto (SIC) es un trastorno metabólico relacionado con la malabsorción, se manifiesta como consecuencia de una superficie intestinal insuficiente1 . Se considera SIC cuando se produce una pérdida superior al 50% de superficie del intestino delgado (ID) o la existencia inferior a 200 cm de longitud del ID. Existen diferentes motivos para realizar una resección extensa, los principales son enfermedad de Crohn, infarto mesentérico, enteritis actínica, neoplasia intestinal, traumatismo abdominal, cirugía bariátrica y anomalías congénitas 2,3 . La prevalencia en Europa es 0,4-6 casos por cada millón de habitantes, y en España la cifra es 1,5 casos/millón de habitantes. La principal clínica es diarrea, deshidratación por pérdida de electrolitos (potasio, magnesio, calcio), hipersecreción gástrica que favorece la aparición de úlceras, acidosis metabólica, sobrecrecimiento bacteriano, pérdida de peso y osteomalacia debido al déficit de vitamina D 4 . Esta pérdida de macro y microelementos es debida a que el yeyuno es el sitio fundamental de digestión y absorción de la mayoría de los nutrientes. La resección yeyunal determina una pérdida de superficie absortiva y reduce de manera significativa la absorción de nutrientes. Del mismo modo, el íleon es el sitio de absorción de vitamina B12 y ácidos biliares. Cuando se resecan >100 cm del íleon, sobrevienen diarrea profunda y malabsorción de ácidos biliares. En consecuencia, existe malabsorción de vitaminas liposolubles y vitamina B12. Además, los ácidos biliares no absorbidos en el colon provocan diarrea secretora. El tratamiento actual requiere de una coordinación de un equipo multidisciplinar compuesta por: cirugía, digestivo, nutrición, farmacia, endocrino, enfermería. El objetivo es seguir una estrategia individualizada compuesta por:
Empoderamiento del paciente
Control de dieta y líquidos
Controles analíticos
Medicación complementaria
Atención psicológica
El tratamiento está compuesto por reposición de pérdidas de líquido y electrolítos, suplementos de vitaminas y minerales, tratamiento farmacológico, soporte nutricional adecuado y tratamiento quirúgico.
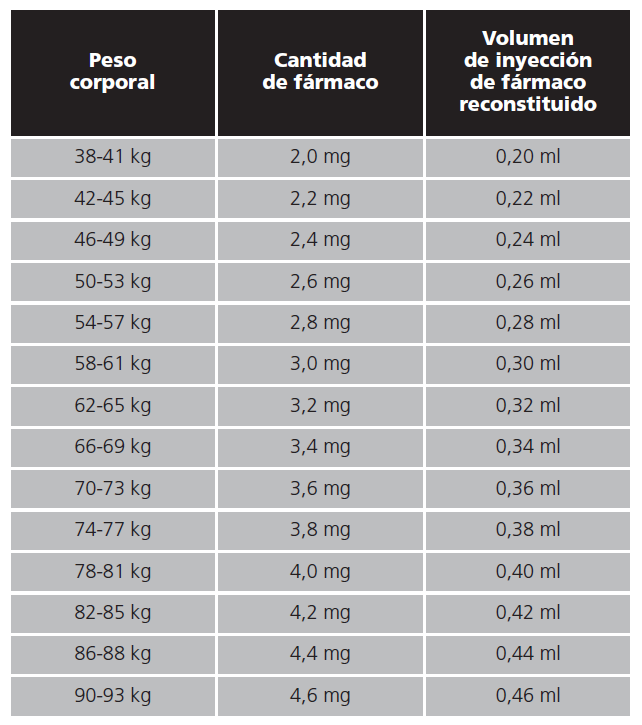
Con respecto al tratamiento farmacológico, el objetivo es la reducción de la sintomatología y cambiar el curso de la enfermedad. Para reducir la sintomatología destaca la prescripción de antisecretores gástricos (inhibidores de la bomba de protones y anti histamina 2 o antiH2), antidiarreicos para enlentecer el tránsito intestinal (principalmente loperamida) y análogos de la somatostatina para reducir las pérdidas intestinales (octeótrido). Por otro lado, con el fin de cambiar el urso de la enfermedad se han desarrollado los análogos de péptidos similares al glucagón GLP-2: teduglutide (tabla 1)5. El objetivo de este último es restaurar la estructura y función intestinal, favorecer el crecimiento de la mucosa (figura 1), reducir el vaciado gástrico y aumentar la absorción de fluidos y nutrientes. A continuación, describimos la experiencia de una paciente en tratamiento con teduglutide.
DESCRIPCIÓN CASO CLÍNICO
Mujer 50 años diagnosticada de enfermedad de Cronh en 1995. Con la siguiente sintmatología: 3-6 deposiciones liquidas diarias, importante pérdida peso y dolor abdominal. Durante 5 años estuvo controlada con corticoides hasta que genero resistencia. Inició en el año 2000 tratamiento con inmunosupresores, en primer lugar con metotrexato y posteriormente con azatioprina; tuvo que abandonar ambos medicamentos por mala tolerancia. Por ello, en 2001 inició tratamiento con infliximab 5 mg/kg que genera un beneficio clínico significativo durante 5 años, hasta que ingresa por fístulas perianales y un cuadro obstructivo que obliga a pasar por quirófano de manera urgente. En 2007, con clínica de estenosis intestinal es necesario realizar una resección de 39 centímetros intestinales. Durante los 5 siguientes años, la enfermedad se mantiene estable con moderados abscesos intestinales que se resuelven con antibioterapia. En los años 2013 a 2017 es ingresada en el hospital por enfermedad de Crohn de carácter fistulizante que obliga a realizar 3 cirugías con resección intestinal. En 2018 por diversas complicaciones (oliguria, insuficiencia renal, hipertransaminasemia...) se realiza una ileostomia. En ese momento se incluye en el Servicio de Farmacia como paciente portadora de nutrición parenteral domiciliaria (NPD) para complementar sus necesidades nutricionales. Un año después, inicia tratamiento con teduglutide 0,05 kg/día de administración subcutánea, con el fin de estimular el crecimiento de la mucosa y favorecer la absorción de nutrientes y fluidos. Actualmente la paciente ha reducido los sueros a 1,5 litros al día, ha mejorado la diuresis, ha ganados 4,5 kilogramos y ha mejorado la consistencia de las heces por la ileostomía, sin presentar reacciones adversas al medicamentos.
DISCUSIÓN
A pesar de los beneficios de la nutrición parenteral a largo plazo en pacientes con alteraciones intestinales, puede favorecer la aparición de ciertas complicaciones secundarias. Cabe destacar la sepsis asociada al catéter, oclusiones venosas e insuficiencia hepática como las principales complicaciones. La mayoría de los pacientes no ingresan en el hospital, sino que se controla al paciente mediante consultas externas y revisiones periódicas6,7. La teduglutide es un análogo del GLP-2 que representa el primer abordaje terapéutico no sintomático para el SIC. En los ensayos clínicos realizados hasta la fecha se ha demostrado que recupera la función de absorción intestinal y que reduce significativamente la dependencia de la NP (en al menos un 20% del volumen semanal), consiguiendo incluso la independencia total en algunos pacientes.
Otro aspecto a tener en cuenta es la eficiencia del tratamiento, a lo que hay que añadir los costes indirectos del manejo de los efectos adversos y la actividad asistencial. Según un estudio realizado por el NICE, la relación coste-efectividad incremental estimada para teduglutide comparado con cuidado estándar es 218.187,7 €, por año de vida ajustado por calidad ganada para adultos8.
En este caso, como sucede en los ensayos pivotales y estudios de extensión (STEPS y STEPS-2,3) se consiguió una reducción del aporte de volumen de la nutrición parenteral y de la fluidoterapia9. La paciente toleró la medicación sin efectos no deseados graves, solo destacar la distensión abdominal y una reacción en el lugar de la inyección de carácter leve-moderado.
A pesar de ello, es necesario un mayor seguimiento para valorar el impacto de este tratamiento a largo plazo. La formación de equipos multidisciplinares en el manejo de este tipo de pacientes es esencial, junto con un adecuado empoderamiento del paciente.