INTRODUCCIÓN
Los medicamentos biosimilares son definidos, según la Agencia Europea del Medicamento (EMA), como medicamentos biológicos que contienen una versión del principio activo de un producto biológico original ya autorizado (denominado medicamento de referencia u original), una vez finalizado su periodo de exclusividad en el mercado, y tras haber demostrado similaridad con el producto de referencia. La EMA fue la primera en establecer una normativa regulatoria1 para medicamentos biosimilares en 2004. Este desarrollo regulatorio sirvió de base para otros países.
Actualmente hay comercializados en Europa distintos tipos de medicamentos biosimilares, indicados en el tratamiento y prevención de diferentes enfermedades y situaciones clínicas. Omnitrope® (somatropina) fue el primer producto aprobado en la Unión Europea (UE) como biosimilar en 2006. Hasta la fecha, la EMA ha recomendado la aprobación de 77 biosimilares para su uso en la UE2.
La EMA es la responsable de la aprobación de biosimilares a nivel europeo. Sin embargo, aunque es responsable de evaluar la biosimilaridad, la EMA no emite recomendaciones sobre la intercambiabilidad del biosimilar con su medicamento de referencia o entre biosimilares. Dichas decisiones son competencia de las agencias reguladoras a nivel nacional de cada estado miembro de la UE.
Este vacío legislativo es uno de los factores que provoca que, para los profesionales de la salud autorizados a prescribir medicamentos, la sustitución entre el biosimilar y el producto de referencia no sea tan homogénea como ocurrió en su día con los medicamentos genéricos. En el informe anual de Prestación Farmacéutica en el Sistema Nacional de Salud3 se observa como, por ejemplo, en el año 2018, biosimilares de fármacos como filgrastrim tenía un porcentaje de consumo del 90,4% respecto al total del principio activo mientras que otros como etanercept o rituximab no superaban el 6%. También la ausencia de datos de switching, para fundamentar las decisiones clínicas, puede repercutir negativamente en la capacidad del profesional sanitario para ofrecer un tratamiento óptimo4.
En los últimos años se han publicado numerosos estudios que evalúan las consecuencias derivadas de la intercambiabilidad entre el medicamento original y su biosimilar y que avalan la seguridad del cambio al no haberse encontrado diferencias en cuanto a eficacia, seguridad ni inmunogenicidad tras el mismo5,6.
Un grupo de fármacos sobre los que la EMA ha aprobado biosimilares desde hace varios años son los inhibidores del factor de necrosis tumoral (anti-TNF), como adalimumab, etanercept e infliximab7, que han demostrado su eficacia en el tratamiento de muchas enfermedades inflamatorias (EI).
Estos fármacos biológicos tienen un papel fundamental en el arsenal terapéutico y se han convertido, por ejemplo, en el factor de coste más importante de las EI, ya que suponen el 64% y el 31% del gasto sanitario total en enfermedad de Crohn (EC) y la colitis ulcerosa (CU), respectivamente8.
Debido al papel decisor de las Comunidades Autónomas (CC.AA) en la introducción de los fármacos biosimilares, a través de las Comisiones de Farmacia y Terapéutica autonómicas u hospitalarias, puede resultar interesante analizar el porcentaje de penetración de estos fármacos según la política sanitaria llevada a cabo en cada región. El objetivo primario de este estudio es analizar la entrada de medicamentos biosimilares anti-TNF en nuestro hospital, en pacientes con AR como tratamiento de primera línea, a partir de una política de prescripción obligatoria en pacientes naive y posibilidad abierta de switch en pacientes en tratamiento. El objetivo secundario es analizar su impacto económico en pacientes con AR en nuestro centro.
MATERIAL Y MÉTODOS
Se realizó un estudio unicéntrico, retrospectivo y observacional en un hospital de tercer nivel. Se incluyeron en el estudio aquellos pacientes con diagnóstico de artritis reumatoide (AR) que eran tratados por primera vez con un fármaco biológico (biosimilar u original), entre febrero de 2017 y febrero de 2021. Con el fin de analizar mejor los datos, el periodo de estudio se dividió en cuatro, cada uno de ellos de un año de duración. Se excluyeron los pacientes que previamente habían participado en algún ensayo clínico para el tratamiento de la AR o que ya habían recibido tratamiento con algún medicamento biológico.
Al inicio del estudio, en febrero 2017, las opciones terapéuticas en nuestro hospital, con medicamentos biológicos, en esta indicación eran: abatacept, adalimumab, certolizumab, etanercept, golimumab, tocilizumab, infliximab, rituximab. Posteriormente en diciembre de ese mismo año se añadieron tofacitinib y baricitinib. El último fármaco en estar disponible en nuestro hospital fue el sarilumab en octubre de 2019. Las fechas de introducción de los medicamentos biosimilares anti-TNF fueron: abril 2015 (infliximab), diciembre 2017 (rituximab), febrero 2018 (etanercept) y, por último, febrero 2019 (adalimumab).
El protocolo de uso establecido en nuestra región, para el uso de estos medicamentos biosimilares, obliga a la prescripción del fármaco biosimilar, en el caso de pacientes naive, y permite, bajo criterio médico, la posibilidad de cambio en aquellos pacientes que ya estuvieran en tratamiento con ese principio activo.
Todos los datos se obtuvieron del programa de prescripción electrónica asistida (PEA®). Se recogieron las siguientes variables: sexo, edad, fecha de inicio con el fármaco biológico y número de pacientes en tratamiento con cada fármaco, tanto biosimilar como original, para cada uno de los cuatro años del periodo de estudio.
Las variables de resultado recogidas fueron el porcentaje de pacientes que iniciaban tratamiento cada año con cada fármaco biológico y el porcentaje de variación anual de utilización de fármacos anti-TNF que tenían biosimilar respecto al resto de alternativas.
También se analizaron todos los pacientes en tratamiento con medicamento original o biosimilar anti-TNF (adalimumab, infliximab y etanercept). El periodo de estudio fue de febrero 2018 a febrero 2021 porque es en febrero 2018 cuando se introduce el etanercept, como primer biosimilar anti-TNF subcutáneo en nuestro hospital. Se seleccionaron los servicios de Reumatología, Dermatología y Digestivo, teniendo en cuenta que son los tres servicios mayoritarios de uso de estos fármacos. Se obtuvieron mensualmente del programa PEA® los siguientes datos para cada uno de los medicamentos anti-TNF: número total de pacientes en tratamiento, número de pacientes en tratamiento con biosimilar y número de pacientes tratados con original para cada principio activo para cada uno de los tres servicios seleccionados. Las variables de resultado recogidas fueron el porcentaje de pacientes en tratamiento con biosimilar, el porcentaje de incremento mensual en la prescripción de los biosimilares anti-TNF.
Para estimar el impacto económico, se seleccionaron los pacientes con AR y se calculó el coste total de los anti-TNF tanto para biosimilares como para productos originales durante todo el periodo de estudio.
RESULTADOS
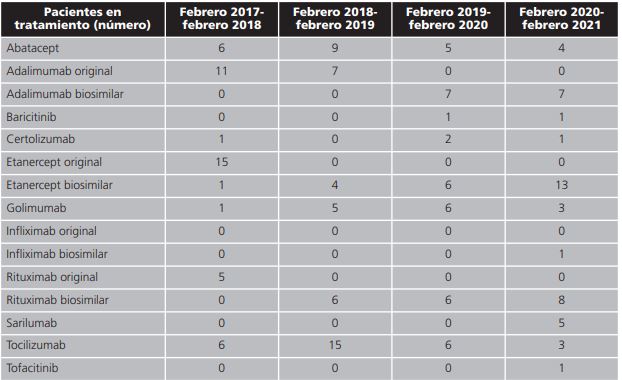
Durante el periodo de estudio, un total de 178 pacientes con diagnóstico de AR fueron tratados por primera vez con un fármaco biológico (biosimilar u original), según la distribución que se muestra en la tabla 1.
La tabla 2 recoge el número de pacientes que iniciaron tratamiento durante el periodo de estudio, dividido por año, y el fármaco elegido para el inicio de tratamiento.
En el primer año de evaluación, el 56,5% de los pacientes iniciaban tratamiento con adalimumab y etanercept original mientras que, un 13% lo hacían con abatacept y tocilizumab y un 10,9% con rituximab original. En cambio, durante el segundo año, las prescripciones de inicio mayoritariamente se hacían con tocilizumab (32,6%) que sumaba, prácticamente, el mismo porcentaje que el de todos los anti-TNF (34,7%). En el tercer año del estudio, el fármaco más prescrito pasó a ser adalimumab biosimilar con un 17,9%. Etanercept biosimilar, golimumab, rituximab biosimilar y tocilizumab tenían un 15,4% de prescripciones y ya se realizó el primer inicio con un inhibidor selectivo y reversible de la Janus quinasa, como baricitinib. Durante el último año del estudio los medicamentos biosimilares (adalimumab, etanercept, infliximab, rituximab) tenían un 61,7% de las prescripciones. El porcentaje de prescripción de sarilumab alcanzaba el 10,7%, seguido de un 8,5% en abatacept. Golimumab y tocilizumab tenían un porcentaje de prescripción del 6,4% y el de baricitinib, certolizumab y tofacitinib era un 2,1%.
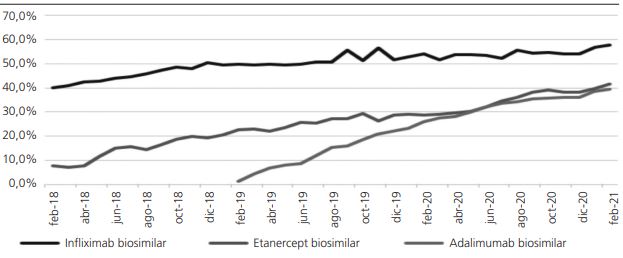
A fecha final de seguimiento, un total de 877 pacientes estaban en tratamiento con los anti-TNF infliximab, etanercept y adalimumab, tanto biosimilares como originales. El porcentaje de uso del biosimilar de infliximab estaba en un 54,6%, sobre un total de 152 pacientes, siendo Digestivo el servicio con más prescripciones de biosimilar (66,7%). En tratamiento con etanercept había 127 pacientes, 53 biosimilar y 74 con original, y, por tanto, con un porcentaje de uso de biosimilar de un 41,7%, siendo Reumatología el servicio con más prescripciones de biosimilar (42,9%). En el caso de adalimumab, el porcentaje de uso del biosimilar era del 39,3% siendo el principio activo con mayor número de prescripciones activas (598). Dermatología era el servicio con mayor número de prescripciones de este biosimilar, un 57,2%.
Adalimumab presenta el mayor porcentaje incremental mensual medio de prescripciones de fármaco biosimilar con un 1,53%, mientras que etanercept alcanza un 0,93% e infliximab un 0,59%. Esta evolución en el porcentaje de pacientes en tratamiento con biosimilar se observa en la figura 1.
Los mayores porcentajes históricos de prescripciones de biosimilares anti-TNF, respecto al total del principio activo, fueron de 57,7% para infliximab, 41,4% para etanercept y 39,3% para adalimumab.
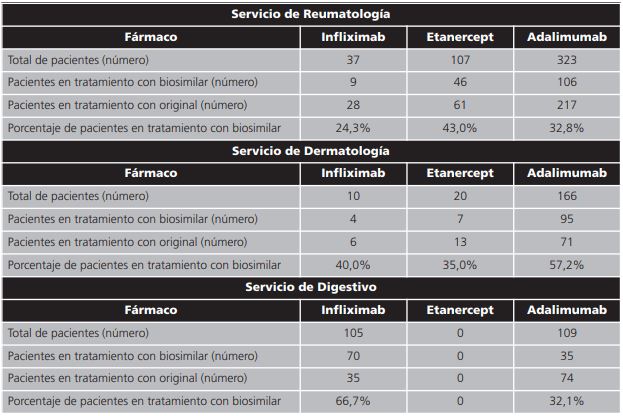
Por especialidades el porcentaje de biosimilares anti-TNF prescritos, a fecha final de seguimiento, fue: Reumatología (infliximab 24,3% etanercept 43,0% y adalimumab 32,8%). Dermatología (infliximab 40,0%, etanercept 35,0% y adalimumab 57,2%) y Digestivo (infliximab 66,7% y adalimumab 32,1%) (tabla 3).
Tabla 3. Distribución de pacientes tratados con anti-TNF a fecha fin de seguimiento y distribuidos por servicios.
En la figura 2, donde se muestra el porcentaje de pacientes en tratamiento con medicamentos biosimilares anti-TNF por servicios, se observa que, durante el período de estudio, infliximab mantiene prácticamente la misma tendencia en los servicios de Reumatología y Digestivo, mientras que en el servicio de Dermatología disminuye continuamente a partir de septiembre de 2019. Respecto al etanercept la tendencia en el servicio de Reumatología es una progresión ascendente, mientras que en el servicio de Dermatología el porcentaje de pacientes que se mantienen con el biosimilar es más fluctuante. El porcentaje de pacientes en tratamiento con adalimumab muestra una tendencia ascendente en los tres servicios, destacando un incremento más rápido en el servicio de Dermatología con respecto a los otros dos servicios.

Figura 2. Evolución del porcentaje de pacientes en tratamiento con medicamentos biosimilares anti-TNF por servicios.
Respecto al impacto económico, desde febrero 2018 a febrero 2021, en nuestro centro el uso de estos tres fármacos anti-TNF biosimilares en pacientes con AR, ha supuesto un ahorro de 213.530 €, repartidos en 12.964 € en el primer año, 72.091€ y 128.475 € para el segundo y tercer año, respectivamente.
DISCUSIÓN
Los biosimilares disponibles en la UE para el tratamiento de EI cumplen todos los requisitos establecidos para su aprobación y, además, cada vez más datos de uso en la vida real están confirmando la seguridad y eficacia de estos fármacos9. La falta de datos hace difícil conocer el porcentaje de entrada de biosimilares entre las diferentes regiones y las condiciones de uso en los distintos hospitales10. La gran heterogeneidad interregional observada en la penetración de los biosimilares se debe, en parte, a las diferencias en las estrategias adoptadas para la introducción de biosimilares de cada CC.AA. En nuestro estudio, se muestra como es la penetración de estos fármacos con una política de biosimilares restringida solo al uso en pacientes naive a ese tratamiento.
Estos datos, obtenidos de forma retrospectiva de la práctica clínica habitual, revelan que, durante el primer año de estudio, entre febrero de 2017-febrero de 2018 no hubo cambios en la prescripción de infliximab, hasta esa fecha único biosimilar introducido en nuestro centro como tratamiento de primera línea en pacientes con AR. El etanercept biosimilar se introdujo en nuestro hospital en febrero de 2018. En esta fecha se produjo una desviación en la prescripción, con un aumento en el número de inicios de tratamiento con fármacos originales como golimumab, tocilizumab y abatacept. Así, entre febrero de 2018-febrero de 2019 las prescripciones con golimumab aumentan y las de tocilizumab alcanzan, prácticamente, el mismo porcentaje que el de todos los anti-TNF. El aumento del abatacept es menor, pero se puede considerar significativo al comparar los datos de los cuatro años de estudio. Esta desviación hacia la prescripción de medicamentos originales pudo deberse a que, al inicio, el cambio de prescripción entre original y biosimilar fue motivo de preocupación para los facultativos debido a la falta de datos clínicos y recomendaciones11, y a una posible desconfianza de iniciar directamente el tratamiento con un biosimilar. En la literatura científica, las principales preocupaciones que rodean el uso de los biosimilares son, la posibilidad de generar mayor inmunogenicidad, problemas de seguridad y pérdida de eficacia12.
En febrero de 2019 con la introducción del adalimumab biosimilar, los inicios de tratamiento con etanercept y adalimumab se mantuvieron en rangos estables con relación a los años anteriores. Fueron las prescripciones con golimumab las únicas de medicamentos originales que continuaron en ascenso. En el último año del estudio, las prescripciones con adalimumab biosimilar se mantuvieron y aumentaron en el resto de los biosimilares, a pesar de la incorporación de nuevos originales. Por tanto, en los dos últimos años del estudio hay un aumento de las prescripciones de biosimilares a pesar de la introducción de nuevos originales, siguiendo así las últimas recomendaciones de la Sociedad Europea de AR (EULAR), que establecen que los biosimilares deben incluirse en el algoritmo de tratamiento en las mismas condiciones que los originales13.
Desde la introducción en el mercado sanitario del primer biosimilar en el año 2006 hasta la actualidad, se ha hecho visible una desigual aceptación y contribución de los biosimilares a nivel internacional en Europa y, a nivel regional, en España. Actualmente el uso de biosimilares y los procedimientos de cambio en la práctica clínica diaria varían sustancialmente de un país a otro14,15.
En nuestro hospital, durante el periodo de análisis, el uso de estos biosimilares anti-TNF ha supuesto un ahorro, coincidente con lo publicado en otros estudios16-18. La situación es diferente cuando el cambio del original al biosimilar se hace sin tener en cuenta el criterio médico, en este caso el cambio puede dar lugar a un aumento de los costes debido a un mayor uso de los recursos sanitarios tras el cambio19. Una de las razones para volver a cambiar puede ser debido al efecto nocebo. Este efecto puede afectar negativamente a la aceptación en los pacientes y repercutir en la calidad de vida, la adherencia al tratamiento y el potencial ahorro de los biosimilares. Las respuestas nocebo a los biosimilares pueden ser desencadenadas por múltiples factores relacionados con el paciente y mecanismos psicológicos influidos por la información proporcionada a los pacientes y el entorno terapéutico20. Es necesaria una adecuada formación de los profesionales sanitarios, especialmente los prescriptores, ya que bien informados y con confianza, facilitan la toma de decisiones con los pacientes y pueden minimizar los efectos nocebo relacionados con los biosimilares. La información exhaustiva proporcionada a los pacientes, así como un diálogo eficaz entre el médico y el paciente, son la clave de la persistencia con la terapia biosimilar21.
En la incorporación de los biosimilares se deben valorar aspectos terapéuticos y oportunidades para la sostenibilidad del sistema sanitario, pero también cuestiones conductuales y de gestión sanitaria global para un mayor beneficio, de los sistemas sanitarios, la salud y la calidad de vida de los pacientes. La mayoría de los estudios publicados hasta el momento informan sobre la eficacia y seguridad del cambio de un original a un biosimilar22,23 y muchos otros, analizan el cambio obligatorio del biosimilar al original24,25. No se han encontrado estudios que valoren la introducción de un biosimilar, siguiendo las mismas condiciones que en nuestro hospital, lo que dificulta la comparación de nuestros resultados en relación con estudios previos.
Este estudio tiene puntos fuertes y limitaciones. Los puntos fuertes son la amplia muestra de pacientes estudiada, en un escenario de 4 años. Además, no solo pacientes con AR, sino que también describe el uso de fármacos biosimilares por otros servicios, como Dermatología y Digestivo. Entre las limitaciones a la hora de interpretar los resultados de este estudio cabe destacar, que el estudio sólo incluía pacientes de nuestro centro, y dado que las condiciones de introducción de biosimilares en nuestro hospital incluían un uso obligatorio en los inicios y el switch bajo criterio médico, esto supone cierta limitación para comparar resultados con otros hospitales donde la política de introducción de biosimilares puede ser diferente.
CONCLUSIONES
Teniendo en cuenta la política de introducción de biosimilares en nuestro centro, solo obligatoria para pacientes naive, el uso de biosimilares anti-TNF se ha consolidado en los dos últimos años a pesar de la incorporación de nuevos originales en el tratamiento de la AR. El porcentaje de uso de cada biosimilar anti-TNF refleja el cumplimiento del protocolo establecido, ya que las cifras actuales son consecuentes con el tiempo de existencia de cada biosimilar en el hospital.
A pesar de estas limitaciones por protocolo, el ahorro económico es significativo y permite generar un fondo económico útil para innovaciones terapéuticas. Considerando las diferentes políticas de introducción de biosimilares existentes, sería interesante que se realizarán estudios similares en otras regiones de nuestro país para poder establecer que política de uso de biosimilares puede ser más aceptada.