INTRODUCCIÓN
La incorporación adecuada de un nuevo fármaco en terapéutica precisa una evaluación y posicionamiento bien sustentados en pruebas clínicas, y para eso se requiere que haya sido comparado en ensayo clínico con el tratamiento estándar1,2. Sin embargo, las recomendaciones actuales de la FDA3 y la EMA4,5 se limitan a sugerir esta necesidad de forma sucinta y relativa. Por otra parte, el estándar de tratamiento en el momento en que se diseña el estudio puede haber variado años más tarde, cuando el fármaco es aprobado por las agencias reguladoras para su introducción en terapéutica. También es posible que el estándar o tratamiento habitual presente resultados muy pobres o incluso dudosos; si el nuevo tratamiento ha mostrado un efecto considerable en la fase II no comparativa y la afección tratada es grave, diseñar un ensayo clínico comparativo puede ser éticamente discutible, ya que los pacientes de la rama control podrían verse muy perjudicados con respecto a los de la rama experimental. Asimismo, en enfermedades muy poco frecuentes o en terapias dirigidas por un marcador con muy baja prevalencia, puede ser más difícil desarrollar un estudio que, distribuyendo a los pacientes en dos ramas para la comparación, alcance un tamaño de muestra adecuado y una potencia estadística suficiente para encontrar diferencias6. Los nuevos medicamentos para enfermedades raras tienen menor probabilidad de ser estudiados en ensayos clínicos aleatorizados7.
En consecuencia, es un hecho recurrente que los estudios de evaluación para el posicionamiento de nuevos medicamentos constaten la carencia de una comparación adecuada con el tratamiento estándar8,9. También se dan situaciones en las que el comparador utilizado es el tratamiento estándar para una parte de los pacientes incluidos en el estudio, pero no para otra parte relevante de los mismos10,11. La carencia de una comparación adecuada con el estándar no solo aumenta la incertidumbre para incorporar los nuevos fármacos en terapéutica en el lugar más adecuado para los pacientes, sino que también dificulta la realización de los estudios económicos necesarios para tomar decisiones adecuadas de precio y financiación1. Por tanto, se trata de un problema de primer orden para la salud pública y para los sistemas sanitarios.
El objetivo del presente estudio es cuantificar la frecuencia con la que nuevos medicamentos carecen de una comparación con el estándar de tratamiento en el momento de su aprobación, analizando los Informes de Posicionamiento Terapéutico (IPT) publicados por el Ministerio de Sanidad español.
MATERIAL Y MÉTODOS
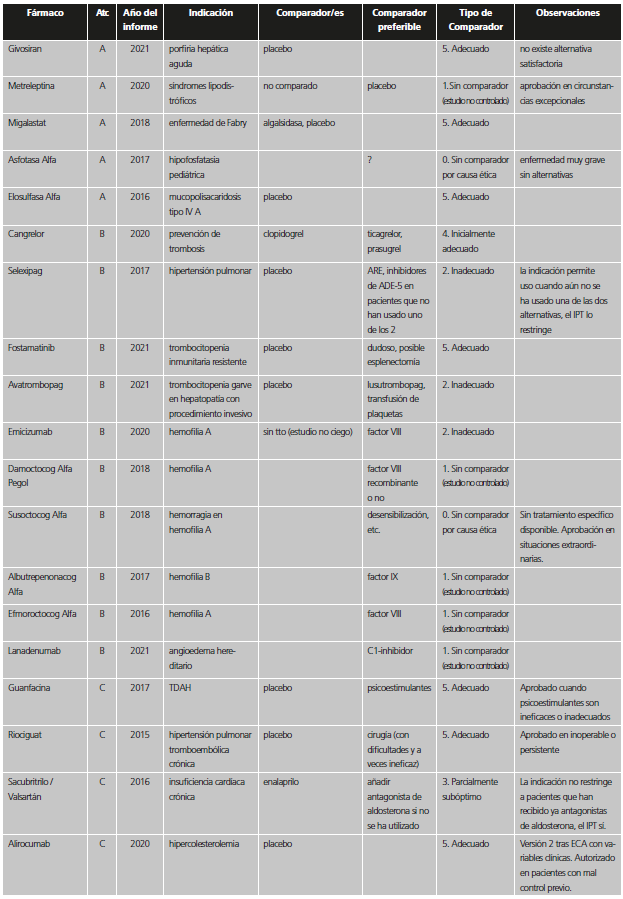
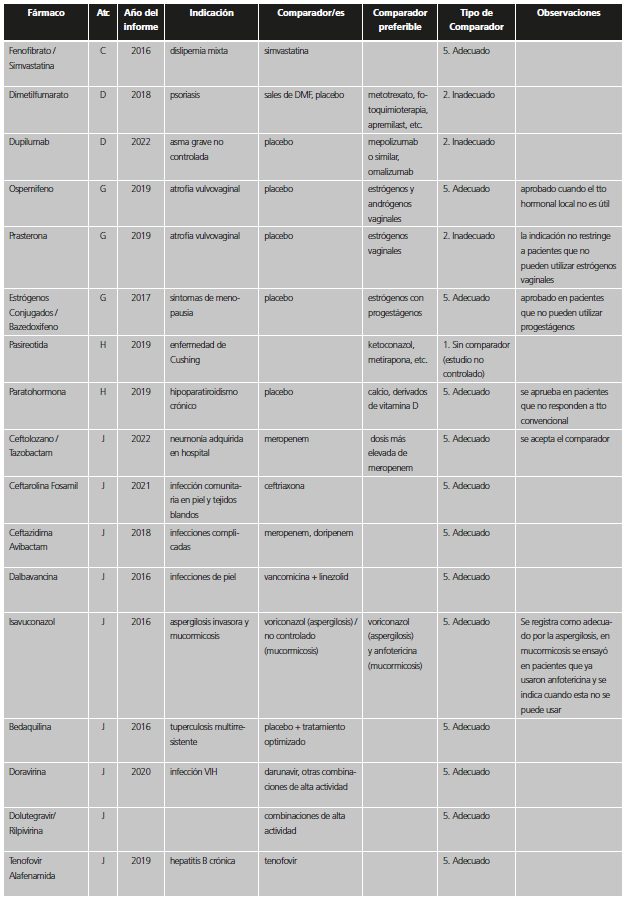
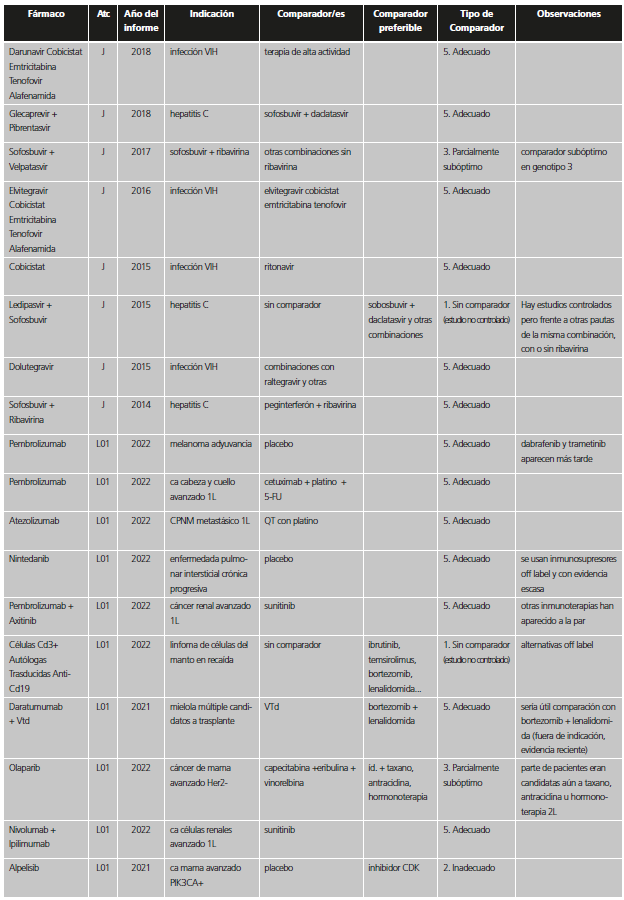
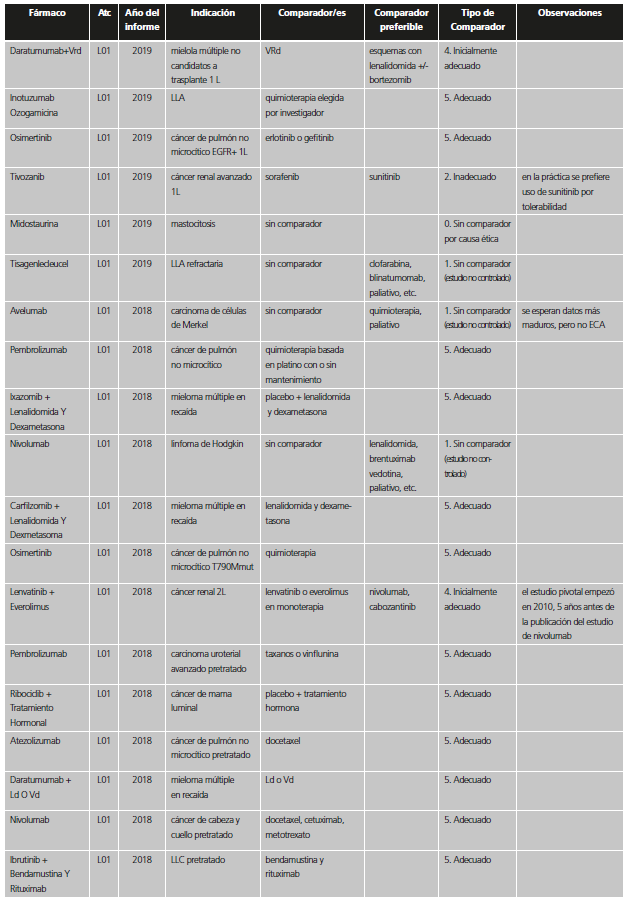
Con el fin de reconocer las distintas situaciones, se establecieron seis categorías dependiendo de la adecuación del comparador utilizado en los estudios previos a la aprobación. Dichas categorías fueron agrupadas en dos valoraciones de calidad. Para ello, se consideró que, dadas las circunstancias, la comparación era suficiente si el nuevo medicamento se había probado frente al que era estándar de tratamiento en el momento de la autorización de la Comisión Europea o, al menos, al inicio del ensayo, o bien no se hizo estudio comparativo por una posible causa ética (tabla 1). En el caso de ensayos con comparador activo o placebo que no eran el tratamiento estándar, pero en los que el fármaco se había restringido en la indicación aprobada a pacientes que no pudieran usar el tratamiento estándar o que no pudieran usar otros tratamientos en general, se consideró que el comparador era adecuado (categoría A), ya que aportaba información suficiente para la indicación finalmente aprobada.
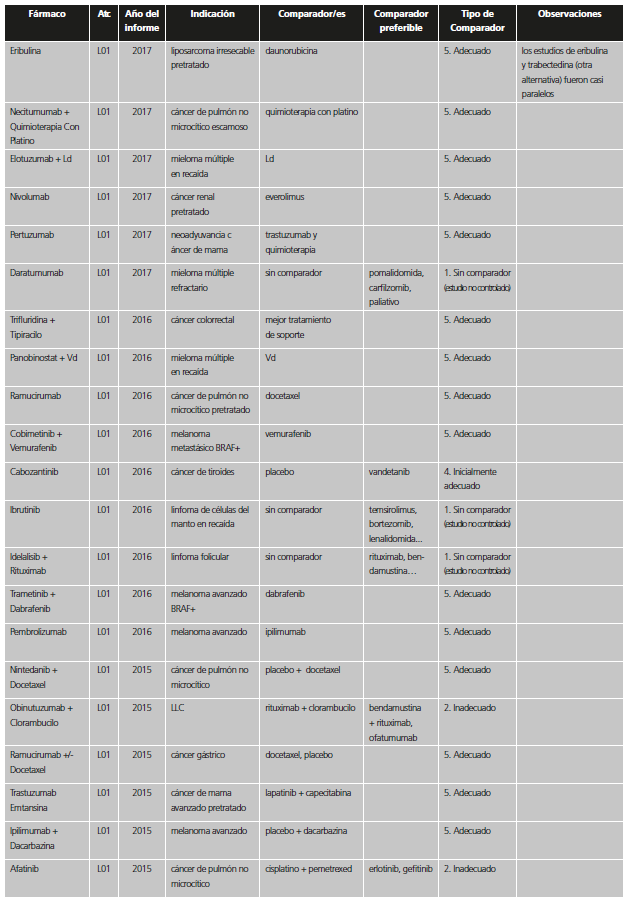
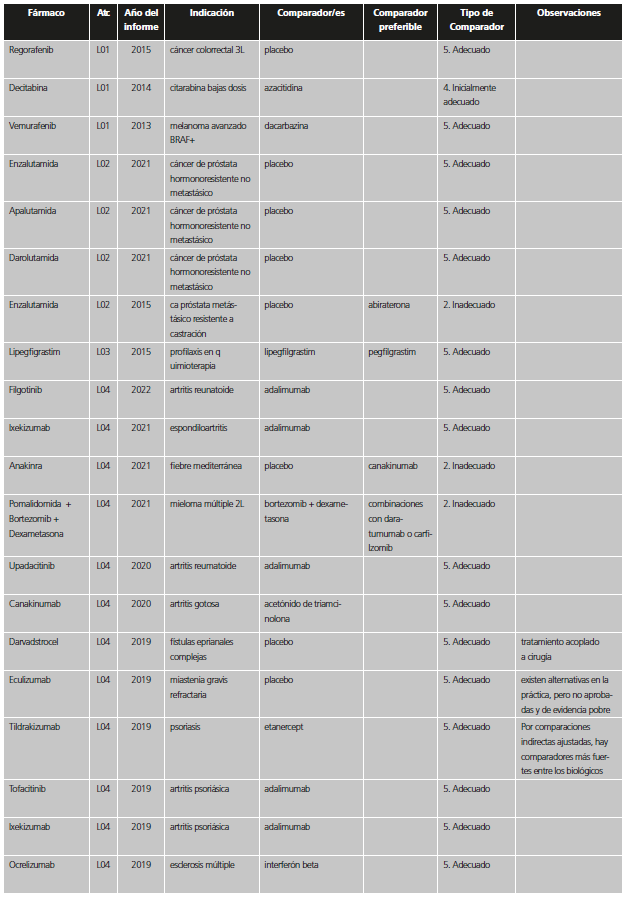
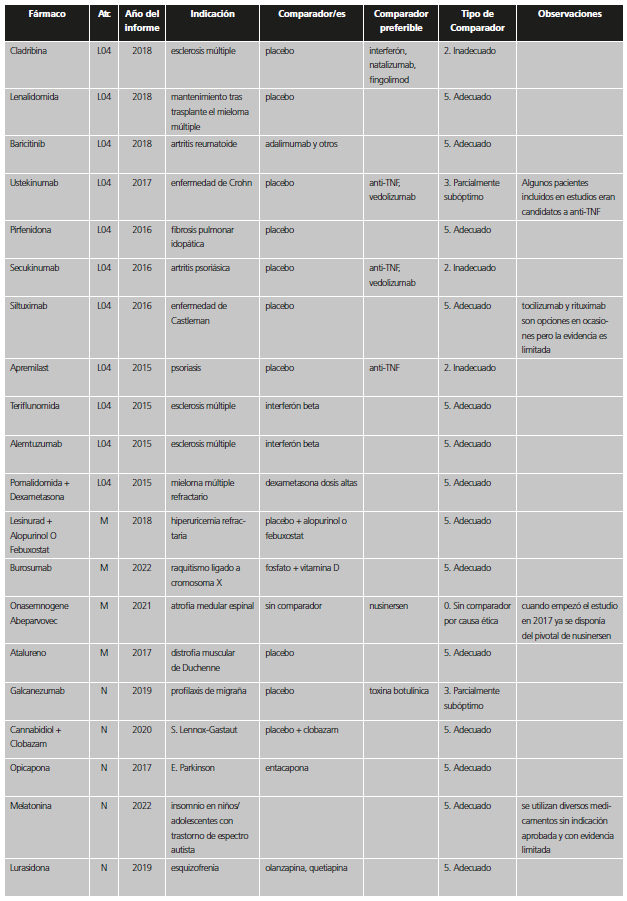
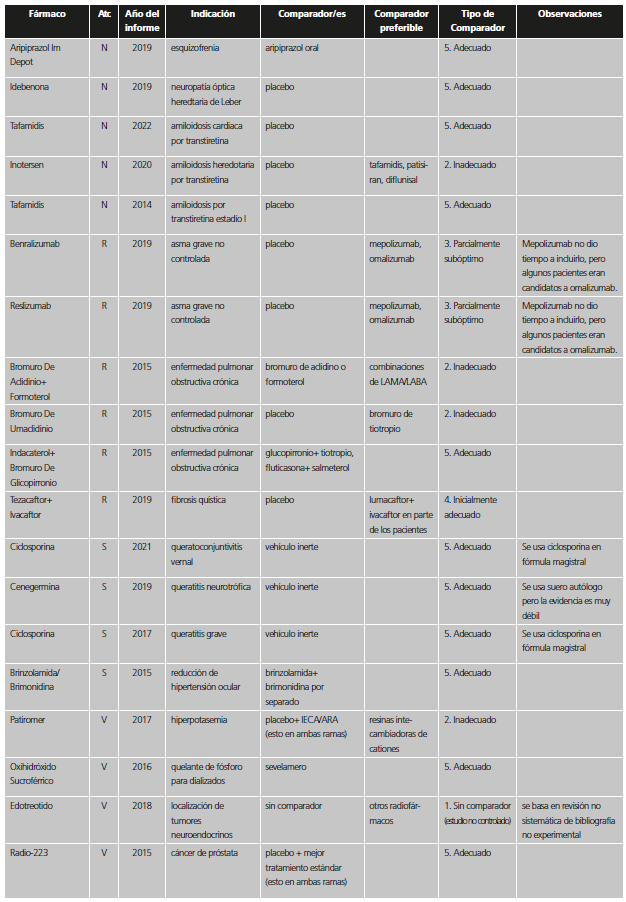
Tabla 1. Categorías y valoración del comparador utilizado en los estudios pivotales previos a la aprobación de nuevos medicamentos / indicaciones.
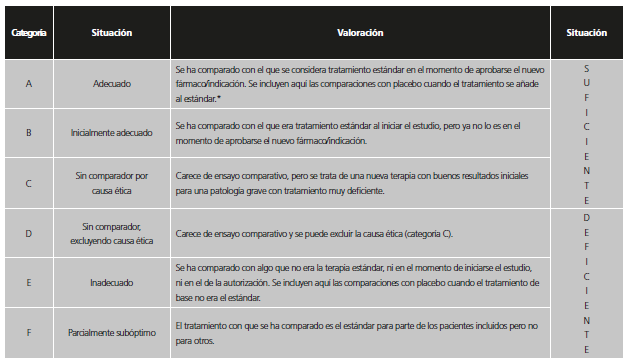
*Se incluyen también aquí situaciones en las que no se comparó con el estándar en los pacientes del ensayo, pero la indicación se encuentra restringida a pacientes que no puedan usar el estándar o que no pudieran usar otros tratamientos en general.
La información sobre comparadores, tratamiento estándar y prevalencia se extrajo del IPT; en caso de duda se recurrió al European Public Assessment Report (EPAR)12 u otras fuentes científicas. Las fechas de aprobación del nuevo fármaco/indicación e inicio de los estudios para diferenciar entre las categorías de “inadecuado” e “inicialmente adecuado” se extrajeron del EPAR y de la web clinicaltrials.gov13. Si se incluían varias indicaciones en un IPT, se analizó la más prevalente. Cuando en un mismo estudio se incluían diferentes comparadores, se valoró el comparador más adecuado.
La variable principal fue la proporción de nuevos fármacos/indicaciones con comparación suficiente (categorías A, B o C) o deficiente (D, E o F). Se tomó una muestra aleatoria del 50% (N=186) de los IPT publicados hasta el momento del estudio, estratificada por grupos terapéuticos. Con una proporción esperable de comparaciones valoradas como “suficientes” del 60% y un nivel de confianza del 95%, esta muestra permitiría una precisión del 7%.
Se analizó la prevalencia de la enfermedad en los casos de ausencia del comparador (categoría D), para estimar en qué proporción de los casos en que no se había realizado estudio comparativo, la disponibilidad de pacientes podría ser similar a la de una enfermedad ultrarrara (menos de 2 pacientes/100.000 habitantes). Se analizaron también los resultados según año de publicación del IPT y clasificación ATC del medicamento.
RESULTADOS
Se analizaron 186 IPT con nuevos medicamentos o indicaciones, publicados entre 2013 y marzo de 2022. La comparación se estimó como suficiente en un 73,7% (IC95 66,9-79,5) de los casos, siendo adecuado el comparador (categoría A) en el 66,1%, inicialmente adecuado (categoría B) en el 5,4% y en el 2,2% se carecía de comparación por causa ética (categoría C). El 26,3% restante (IC95 20,5-33,1) presentaban comparaciones deficientes en el ensayo pivotal, ya fuera por comparador inadecuado (11,3%), parcialmente subóptimo (5,4%) o ausencia de un estudio comparativo excluyendo la justificación ética (9,7%) (Fig. 1). La proporción de comparaciones aceptables osciló entre el 56% y el 75% anual, sin una tendencia apreciable a lo largo del tiempo (Fig. 2). El grupo terapéutico con más IPT fue el de antineoplásicos (L01, N=72), con un 75,0% (IC95 63,9-83,6) de comparaciones aceptables (Fig. 3). De los fármacos con comparación considerada deficiente por ausencia de estudio comparativo, el 58% (11/19) correspondió al tratamiento de enfermedades ultrarraras o condiciones con prevalencia asimilable (menos de 2 pacientes/100.000 habitantes).

Figura 1. Valoración de los comparadores en los estudios pivotales de nuevos fármacos/indicaciones con respecto al tratamiento estándar en la indicación europea. Muestra: 186 IPT (50% de los publicados entre 2013 y marzo 2022).

Figura 2. Proporción de comparadores de calidad suficiente (adecuados, inicialmente adecuados, o sin comparador por causa ética) en autorizaciones europeas por año de publicación del IPT. Se omiten 2013 y 2014 por contar con una muestra N<5.
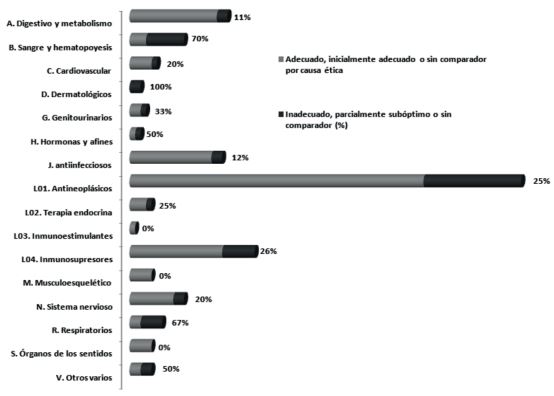
Figura 3. Proporción de comparadores de calidad suficiente (adecuado, inicialmente adecuado o sin comparador por causa ética) o insuficiente (inadecuados, parcialmente subóptimos, o sin comparador excluida causa ética) por grupo terapéutico. Autorizaciones europeas con IPT publicado entre 2013 y marzo 2022. La longitud de la barra indica el tamaño de la muestra de cada grupo. El porcentaje se refiere a la carencia de una comparación de calidad suficiente.
DISCUSIÓN
El estudio muestra una proporción relevante de medicamentos aprobados sin una comparación suficiente. Van Luijn et al. publicaron en 2008 un estudio en el que estimaron que el 71% de los nuevos fármacos se habían comparado con el tratamiento recomendado en el momento de la autorización europea, cotejando el comparador con el European Public Assessment Report1. Eso equivaldría a la categoría A del presente estudio, que ha encontrado un 66% tomando como base los IPT españoles. Por su parte. Goldberg et al. encontraron que solo un 51% de las aprobaciones FDA contaban con ensayos clínicos comparativos en el momento de su aprobación14; lo que equivaldría a las categorías A, B, E y F del presente estudio, que sumarían un 88%. Wang y Kesselheim publicaron que la probabilidad de disponer de estudios comparativos es inferior para las nuevas indicaciones de un fármaco ya aprobado que para la indicación original15.
En algunos casos, la ausencia de comparador en los estudios pivotales podría estar causada por una muy baja prevalencia –enfermedades ultrarraras o situaciones asimilables- que dificulta reunir el número de pacientes necesario para un ensayo comparativo. En tales situaciones se podrían emplear diseños alternativos para poder efectuar una comparación, como los estudios cruzados o comparaciones intrapaciente con los resultados de otros fármacos en líneas previas6. Este último diseño se ha usado, por ejemplo –aunque de forma posterior a la aprobación-, en el caso de larotrectinib para cáncer con fusión en la kinasa del receptor de tropomiosina16. Los diseños citados permiten un análisis comparativo que, aunque presente mayor incertidumbre y necesite ajustes para ser valorado, mejora la fiabilidad de cualquier comparación indirecta naive y también la de comparaciones con controles históricos que pueden ser seleccionados ad hoc.
Para paliar la falta de una comparación adecuada se recurre en la evaluación a comparaciones indirectas ajustadas17. Con frecuencia esto se encuentra dificultado por ausencia de las condiciones necesarias18, como son la presencia de un comparador común en los ensayos clínicos respectivos y la similitud en el diseño de los mismos. Además, estos análisis pueden carecer de la potencia estadística suficiente para disponer de una comparación precisa.
Aun si no es factible una comparación indirecta ajustada por el resultado del comparador común, puede quedar la opción, con mayor incertidumbre asociada, de recurrir a una comparación indirecta ajustando las características individuales de los pacientes (matching-adjusted indirect comparison, MAIC por sus siglas en inglés)19. En cualquier caso, la fiabilidad de los resultados nunca podrá darnos las garantías de un ensayo clínico bien diseñado, por lo que este problema debería ser prevenido, cuando sea evitable, en el momento del diseño de los estudios y los primeros contactos del promotor con las agencias reguladoras. En aquellas situaciones en las que el fármaco no se compara con el estándar pudiendo haberlo hecho, la indicación debería restringirse a pacientes que no puedan recibirlo, como ya sucede en algunos casos.
En cuanto a los estudios económicos, los resultados ponen de manifiesto la necesidad de fijar su escenario y sus comparadores. En los casos en que el comparador no sea adecuado, el estudio económico debe buscar la comparación con el estándar recurriendo a comparaciones indirectas ajustadas. Esto es también válido para cuando el ensayo clínico se diseñó frente a un estándar que luego ha dejado de serlo. En los casos en los que el comparador no es el estándar para una parte de la población, habrá que estudiar y/o valorar de forma separada ambos escenarios, con comparadores y valoraciones de la incertidumbre diferentes20.
Cabe preguntarse si, en el caso de contar toda la información disponible sobre el estándar de tratamiento y comprenderla, los pacientes habrían aceptado entrar a un ensayo en el que éste no se utiliza, lo que implica que, de caer en el grupo control, recibirán un tratamiento subóptimo. Esta situación merece una reprobación ética, y además probablemente se asocie a deficiencias en el propio consentimiento informado de entrada a los estudios. Sería preciso que los promotores, las instituciones investigadoras, las autoridades sanitarias y las agencias reguladoras dedicaran mayores esfuerzos a asegurar que los mínimos estándares éticos se cumplan21.
Además, cualquier investigación supone un riesgo para los pacientes, y eso conlleva la responsabilidad para los investigadores de que el diseño de los estudios de los nuevos medicamentos sea lo más adecuado posible para obtener el máximo rendimiento científico y sanitario. El enfoque regulatorio tradicional según el cual es suficiente que un fármaco demuestre un balance beneficio/riesgo positivo para ponerlo en el mercado –enfoque comercial de mínimos- debería progresar a un enfoque auténticamente sanitario. Introducir un nuevo fármaco en terapéutica es mucho más que ponerlo en el mercado. Supone contar con la información necesaria para ubicarlo adecuadamente frente al resto de opciones, de forma que beneficie de forma óptima a los pacientes. La información debe permitir también la realización de estudios económicos fiables para adecuar su precio y decidir sobre su financiación.
CONCLUSIONES
Aproximadamente uno de cada cuatro nuevos medicamentos o indicaciones carece de una comparación suficiente en el momento de empezar a ser utilizado en la práctica clínica. La proporción no mejora a lo largo de los diez últimos años. En pocos casos, este problema podría tener justificación por tratarse de una enfermedad ultrarrara y la dificultad de encontrar pacientes para el estudio.
Las agencias reguladoras deberían progresar en su enfoque y ser más exigentes en la cuestión de los comparadores elegidos para los ensayos clínicos pivotales. En realidad, la mayoría de los fármacos ya se están comparando adecuadamente; no se entiende que exista una minoría de casos en los que se permite una comparación inadecuada cuando esos fármacos podrían haberse comparado con el estándar.