Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Pharmacy Practice (Granada)
versão On-line ISSN 1886-3655versão impressa ISSN 1885-642X
Pharmacy Pract (Granada) vol.4 no.3 Redondela Jul./Set. 2006
| Investigación original |
Evaluación de las reacciones adversas de los antituberculosos en pacientes hospitalizados
Evaluation of anti-tuberculosis induced adverse reactions in hospitalized patients
Kheirollah GHOLAMI, Elahe KAMALI, Mahboubeh HAJIABDOLBAGHI, Gloria SHALVIRI.
| ABSTRACT Background: Tuberculosis has been one of the common diseases of human communities. Besides of disease-related complications, there are serious adverse reactions due to Anti-tuberculosis (Anti-TB) drug therapy. Key words: Tuberculosis. Inpatients. Adverse Drug Reaction Reporting Systems. Drug Toxicity. Iran. | RESUMEN Antecedentes: La tuberculosis ha sido una de las enfermedades comunes de la humanidad. Además de las complicaciones relacionadas con la enfermedad, existen efectos adversos graves debidos al tratamiento antituberculoso (Anti-TB). Palabras clave: Tuberculosis. Pacientes hospitalizados. Sistemas de comunicación de reacciones adversas. Toxicidad de medicamentos. Irán. |
Kheirollah GHOLAMI, PharmD. Profesor y director del Departamento de Farmacia Clinica. Facultad de Farmacia. Universidad de Teherán de Ciencias Médicas. Teheran, (Irán)
Elahe KAMALI. PharmD. Centro de Monitorización de Reaciones Adversas, Subsecretaría de Alimentación y Medicamentos, Ministerio de Sanidad. Teherán (Irán).
Mahboubeh HAJIABDOLBAGHI, MD. Profesor y Director del Departamento de Enfermedades Infecciosas del Hospital Imam Khomeini. Universidad de Teherán de Ciencias Médicas. Teheran, (Irán)
Gloria SHALVIRI. PharmD. MPH, Centro de Monitorización de Reaciones Adversas, Subsecretaría de Alimentación y Medicamentos, Ministerio de Sanidad. Teherán (Irán).
INTRODUCCIÓN
La tuberculosis ha sido una de las enfermedades frecuentes en las comunidades durante los pasados 40 años. La Organización Mundial de la Salud (OMS) ha comunicado que un tercio de la población del mundo está infectada con Mycobacterium tuberculosis, produciéndose 8,4 millones de nuevos casos de tuberculosis en 1999.1 Esta gran incidencia de la infección ha provocado una gran morbilidad que se debe, en parte, a las reacciones adversas graves producidas por los medicamentos anti-tuberculosis.2,3
La frecuencia y naturaleza de las RAM de los antituberculosos ha sido una preocupación en muchas comunidades. Una de las RAM graves detectadas en este estudio es la hepatotoxicidad. Hay diferencias en la tasa comunicada de hepatotoxicidad inducida por anti-TB en diferentes estudios.4-6 Esta reacción podría estar afectada por el genotipo de los pacientes que reciben estos medicaments, p.e. los pacientes acetiladores rápidos son más susceptibles de la hepatotoxicidad inducida por la isoniazida. Los estudios demuestran que el riesgo de hepatotoxicidad en los pacientes de India es mayor que el comunicado en los occidentales (11,5% contra 4,3%).7 Teniendo en cuenta la diferencia comunicada entre asiáticos y occidentales en desarrollar hepatotoxicidad inducida por anti-TB, es necesario detectar la tasa de RAM inducidas por anti-TB con énfasis en las reacciones hepatotóxicas, en pacientes iraníes, ya que podría ser útil para revisar protocolos terapéuticos.
Según nuestro conocimiento, este es el primer estudio que evalúa las RAM inducidas por anti-TB en pacientes iraníes.
MÉTODOS
Este estudio descriptivo fue realizado en un departamento de enfermedades infecciosas de un hospital universitario de 1200 camas, desde julio 2001 a julio 2002. Todos los pacientes diagnosticados de TB pulmonar entraron en el estudio. Estos pacientes recibían rutinariamente la combinación de cuatro tuberculostáticos (isoniazida, rifampicina, pirazinamida y etambutol). La hepatitis se definió como un incremento de los enzimas hepáticos más de cinco veces el valor basal acompañado de síntomas clínicos incluyendo ictericia, nausea, vómitos, dolor abdominal y anorexia. Los pacientes con enfermedades hepáticas crónicas tales como cirrosis o hepatitis crónica fueron excluidos del estudio. Se registró la demografía del paciente, la historia de la enfermedad, el historial farmacoterapéutico, y el diagnóstico final. Todos los pacientes que recibieron anti-TB fueron monitorizados para sus efectos adversos. La definición de RAM usada en este estudio es la de la OMS cualquier respuesta nociva o no intencionada a un medicamentos, que ocurre a dosis normalmente utilizadas para profilaxis, diagnóstico o tratamiento de una enfermedad o para la modificación de funciones fisiológicas.8
La detección y monitorización se hizo entrevistando a los pacientes, revisando análisis clínicos e historiales médicos. Rutinariamente se consultaba con los médicos obre los problemas clínicos de los pacientes y se registraban las RAM. Se cumplimentaba una tarjeta amarilla, el formulario utilizado para comunicar RAM al Centro de Farmacovigilancia, para cada RAM detectada.
Para evaluar la probabilidad, gravedad y preventabilidad de las reacciones se utilizaron respectivamente el algoritmo de Naranjo9, el cuestionario de Hartwig10 y el cuestionario de Schumock.11
RESULTADOS
Durante el periodo de estudio, 83 pacientes fueron diagnosticados de tuberculosis. Estos pacientes fueron introducidos en el tratamiento rutinario. De estos pacientes, 44 (53%) desarrollaron al menos una reacción adversa. Se detectó un total de 81 reacciones adversas en este estudio. Los 44 pacientes con RAM fueron 23 mujeres y 21 hombres.
La aparición de reacciones adversas llevó a la prolongación de la estancia hospitalaria en 26 (59%) pacientes. La tasa de reacciones adversas varió en los distintos grupos etarios. Parece que con los anti-TB utilizados en este estudio, la tasa de RAM aumenta con la edad (tabla 1).
Los órganos-sistemas más frecuentemente afectados fueron hígado y sistema biliar (37%) y aparato gastrointestinal (21%) (Tabla 2). La reacción adversa más grave fue la hepatitis (25,9%), llevando a la muerte a dos pacientes (tabla 3). En este estudio, 30 (36,1%) pacientes mostró elevación de valores de transaminasas. Sin embargo, solo 3 pacientes desarrollaron un nivel de enzimas tres veces superior al basal. Pero ninguno de esos pacientes mostró ninguna prueba clínica o bioquímica de hepatotoxicidad. Se observaron incrementos en al ácido úrico plasmático en 3 pacientes (3,7%) debidos a la pirazinamida. Estas reacciones aparecieron a los 26,7 días de media después de comenzar el tratamiento y precedieron a una artritis. Después de interrumpir la pirazinamida, el nivel de ácido úrico volvió a valores normales (2,1-8,5 mg/dl) en 10 días. La isoniazida provocó reacciones tales como estreñimiento (17,3%) y neuropatía periférica (6,2%), mientras que la rifampicina fue la mayor causa de dolor de cabeza (8,7%), erupción y picor (4,9%) y diarrea (3,7%).
La única reacción adversa que se sospechó que estaba inducida por el etambutol fue alteraciones de la visión tales como visión borrosa y ardor ocular observadas en dos pacientes (2,4%).
La principal intervención realizada en los pacientes don RAM detectada fue la interrupción del tratamiento (34,5%). Esta intervención se realizó cuando se detectó hepatotoxicidad y/o hiperuricemia. En el 21% de los pacientes con RAM detectada, el tratamiento anti-TB prosiguió con tratamiento sintomático. En el 7,4% de los casos, se realizó una reducción en el tratamiento anti-TB. No hubo tratamiento específico para aliviar los síntomas en el 333,4% de los casos. Estas reacciones fueron fundamentalmente aquellas en las que el paciente no tenía un problema grave, como el dolor de cabeza o el estreñimiento.
El resultado en el 71,6% de las reacciones adversas de este estudio fue una mejoría definitiva. Los medicamentos anti-TB se retiraron después de observar la reacción adversa en el 34,5% de los pacientes. En el 21% de las reacciones se realizó tratamiento sintomático.
La evaluación de la causalidad de las RAM reveló que 7 (8,6%) casos se consideraron ciertos, 35 (43,2%) como posibles y 39 (48,2%) como probables (tabla 4).
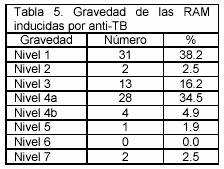
La evaluación de la gravedad de las RAM indicó que la mayoría de las RAM detectadas tenían nivel 1 de gravedad (38,2%) y 4a (34,5%). (Tabla 5)
No se detectó ninguna reacción adversa de los anti-TB en las primeras 24 horas de tratamiento. La mayoría de las reacciones adversas se detectaron en los primeros 10 días (figura 1). La frecuencia de reacciones adversas en los días 10-20 disminuyó al 19%. En los días 21-30 la tasa de RAM detectadas fue del 21,4%. Las reacciones adversas graves que provocaron hospitalización ocurrieron principalmente en los días 21-30 de uso de medicamentos.
DISCUSIÓN
Entro los 83 pacientes que entraron en el estudio, 44 (53%) mostró al menos una reacción adversa. Este relativamente elevado porcentaje de reacciones adversas indica que se necesita mayor evaluación de la susceptibilidad de los pacientes iraníes en a desarrollar RAM inducidas por anti-TB. Daphne Yee et al. realizaron un estudio para estimar la incidencia y factores de riesgo de los principales efectos adversos de los medicamentos anti-TB de primera línea.12 Evaluaron a 430 pacientes tratados con anti-TB entre 1990 y 1999. Los resultados del estudio mostraron que la incidencia de grandes efectos adversos era de 1,48 por 100 personas/mes de exposición (CI95%=1,31 a 1,61) para pirazinamida, comparado con el 0,49 (CI95%=0.42 a 0.55) para isoniazida, 0.43 (CI95%=0.37 a 0.49) para Rifampina y 0.07 (CI95%=0.04 a 0.10) para Etambutol. La aparición de efectos adversos importantes en ese estudio estaba asociada con el género femenino (ratio de riesgo ajustado 2.5; CI95%=1.3 a 4.7), edad superior a 60 años (ratio de riesgo 2.9; CI95%=1.3 a 6.3), nacidos en Asia (ratio de riesgo ajustado 2.5; CI95%=1.3 a 5.0), y resultado positivo a virus de la inmunodeficiencia humana (ratio de riesgo ajustado 3.8; CI95%=1.05 a 13.4). Entre estos factores de riesgo, la edad superior a 60 años y la nacionalidad asiática pueden considerarse variables interactivas que inducen alta tasa de RAM en nuestro estudio. Los resultados de este estudio, así como comunicaciones anteriores, muestran que con el aumento de edad, la frecuencia de RAM aumenta.
En nuestro estudio, la principal causa de ingreso fueron las reacciones adversas en 13,6% de los pacientes. En un estudio similar realizado en población iraní internada en un hospital general, las RAM se comunicaron como la principal causa de ingreso en el 8% de los pacientes.13 En otro estudio realizado para detectar reacciones adversas inducidas por antiinfecciosos en pacientes iraníes hospitalizados, la tasa total de hospitalización a causa de unas RAM se estimó en el 2,2%.14 Estos resultados sugieren que los medicamentos anti-TB pueden causar RAM más graves causantes de hospitalización comparado con otros grupos de medicamentos usados en servicios de infecciosos o generales, como fueron los otros dos estudios.
Se observó hepatitis en 21 pacientes (25,9%), llevando a la muerte a 2 pacientes. Se ha estimado que el 10-20% de los receptores de isoniazida desarrollan elevación de enzimas hepáticos.15 Sin embargo, en caso de daño hepático suave subclínico, la reacción no progresa a hepatitis declarada y se recupera completamente a pesar de continuar con la isoniazida. Por el contrario, si aparecen síntomas clínicos, podría haber ocurrido toxicidad hepatocelular, lo que se asocia con mayor tasa de fatalidad que en los pacientes en los que la isoniazida se retiró inmediatamente. El mecanismo exacto de la hepatotoxicidad la isoniazida no está claro. La rápida o lenta velocidad de acetilación de la isoniazida en el hígado se ha discutido como probable mecanismo de la hepatotoxicidad de la isoniazida. Antes se creía que los acetiladores rápidos podían tener más riesgo de hepatitis por isoniazida que los acetiladores lentos. La monoacetil-hidrazida, el metabolito hepatotóxico de la isoniazida, se forma más rápidamente en los acetiladores rápidos que en los lentos. Por el contrario, los acetiladores rápidos también eliminarán este compuesto más rápidamente que los lentos, lo que debería equiparar el riesgo de toxicidad entre amos. Un estudio demostró una diferencia entre la incidencia de hepatitis entre hombres y mujeres asiáticos. Como ambos grupos eran acetiladores rápidos, este estudio sugirió que la hepatitis probablemente esté causada por otros factores que no son el genotipo acetilador. Así que parece que el estado acetilador sólo no explica el desarrollo de hepatitis por isoniazida. Sin embargo, los resultados de este estudio sugieren que se necesitan más estudios para evaluar el incremento del riego de hepatitis inducida por isoniazida entre los asiáticos.
Algunas evidencias sugirieron inicialmente que el uso concomitante de isoniazida y rifampina podría elevar la incidencia de hepatotxicidad. Se cree que la rifampina puede inducir el metabolismo de la isoniazida a las hepatotoxinas. Un meta-análisis realizado por Steele y col. mirando la incidencia de hepatitis en todos los estudios de 1966 a 1989 que utilizaron regímenes con isoniazida sin rifampina, rifampina sin isoniazida, y regimenes con ambos, reveló que la incidencia de hepatitis clínica era mayor en regimenes con ambos (2,7%) que en los de isoniazida sola (1,6%). Los autores sugirieron que este efecto era aditivo y no sinérgico, por tanto el uso de los dos medicamentos conjuntos no esta contraindicado. Sin embargo, debería tenerse cuidado en poblaciones de alto riesgo como los ancianos, los alcohólicos, lo que toman otros agentes hepatotóxicos, y los que presentan enfermedad hepática previa. Si las transaminasas se elevan con el uso de anti-TB, generalmente se alcanzan valores séricos normales a las tres a seis semanas de comenzar el tratamiento. El diagnóstico rápido del daño hepático por los anti-TB reducirá la tasa de mortalidad de pacientes. La tasa de muertes debidas a daño hepático será del 50% si se continúa con el medicamento después del aumento de transaminasas por encima de tres veces el valor basal. Pero con la retirada del tratamiento, esta tasa puede descender al 10%.16
El aumento del nivel de trasaminasas se debe principalmente a la isoniazida. Por otro lado, la rifampina generalmente causa colestasis, lo que eleva la fosfatasa alcalina y la bilirrubina. Las toxicidades hepáticas pueden ser el principal efecto adverso de los tres principales anti-TB, isoniazida, rifampina y pirazinamida.
Generalmente, para disminuir el riesgo de daño hepático de estos tres medicamentos pueden ser útiles los siguientes puntos:
Registrar los niveles basales de enzimas hepáticos antes de prescribir el tratamiento anti-TB.
Monitorizar los niveles séricos de transaminasas en los pacientes de más de 20 años. Esta monitorización debería realizarse dos veces a la semana en las primeras dos semanas y una vez a la semana en los siguientes dos meses.
Retirar el tratamiento inmediatamente después de que las transaminasas se eleven tres veces por encima del nivel basal.
Evitar el uso concomitante de anti-TB con inductores del CYT-P450.
Evitar el uso concomitante de anti-TB con otros medicamentos hepatotóxicos.
CONCLUSIÓN
En conclusión, los medicamentos anti-TB podrían causar efectos adversos significativos tanto en cantidad como en gravedad. Estas reacciones adversas pueden llevar a la hospitalización, aumento de estancia hospitalaria e incluso muerte. Los asiáticos pueden desarrollar con más frecuencia las reacciones adversas, tales como hepatitis, inducidas por este grupo de medicamentos. Este resultado sugiere que el protocolo de tratamiento anti-TB para asiáticos puede necesitar ser revisado para prevenir las hepatotoxicidades fatales. Para confirmar esta hipótesis, se necesitan más estudios con poblaciones mayores.
| Referencias |
1. World Health Organization. Global Tuberculosis Control. WHO report 2001. Geneva, Switzerland: WHO/CDS/TB; 2001. 287. [ Links ]
2. Kopanoff DE, Snider DE, Caras GJ. Isoniazid-related hepatitis. Am Rev Respir Dis 1978:117:991-1001. [ Links ]
3. Burman WJ. Reves RR.. Hepatotoxicity from Rifampin plus Pyrazinamide. Lessons for Policymakers and Messages for Care Providers. Am J Respir Crit Care Med 2001; 164: 1112-3. [ Links ]
4. British Thoracic and Tuberculosis Association: Short course chemotherapy in pulmonary tuberculosis. Lancet 1975; 119-24. [ Links ]
5. Tanaja DP, Kaur D. Study on hepatotoxicity and other side effects of antituberculosis drugs. J Indian Med Assoc 1990; 88:278-80. [ Links ]
6. Snider DE, Long MW, Cross FS, Farer LS. Six months Isoniazid and Rifampin therapy for pulmonary tuberculosis: report of a United States Public Health Service cooperative trial. Am Rev Respir Dis 1984; 77:233-42. [ Links ]
7. Sharma SK., Balamurgan A., Saha PK., Pandey RM. Mehra NK. Evaluation of clinical and immunogenetic risk factors for the development of hepatotoxicity during Antituberculosis treatment. Am J Respir Crit Care Med. 2002;166:916-9. [ Links ]
8. World Health Organization. Uppsala Monitoring Center. Safety monitoring of medicinal products, guidelines for setting up and running pharmacovigilance center, Geneva, 1996. [ Links ]
9. Naranjo CA., Busto U., Sellers EM. A method for estimating the probability of Adverse Drug Reactions. Clin Pharmacother 1981; 30:239-45. [ Links ]
10. Hartwig SC., Siegel J., Schneider PJ. Preventability and severity assessment in reporting Adverse Drug Reactions. Am J Hosp Pharm, 1992; 49:2229-32. [ Links ]
11. Schumock GT, Thornton JP. Focusing on the preventability of Adverse Drug Reactions. Hosp Pharm. 1992; 27:538. [ Links ]
12. Yee D, Valiquette C, Pelletier M, Parisien I, Rocher I, Menzies D. Incidence of Serious Side Effects from First-Line Antituberculosis Drugs among Patients Treated for Active Tuberculosis. Am J Resp Crit Care Med. 2003. 167: 1472-7. [ Links ]
13. Gholami K., Shalviri G. Factors associated with preventability, predictability and severity of ADRs. Ann Pharmacother 1999; 33:236-40. [ Links ]
14. Gholami K, Parsa S, Shalviri G, Sharifzadeh M, Assasi N. Anti-infectives-induced adverse drug reactions in hospitalized patients. Pharmacoepidemiol Drug Safe 2005; 14:501-6. [ Links ]
15. Kays MB. Tuberculosis. In: Koda-Kimble MA, Young LY, Kradijan WA, Guglielmo JB, Allfredge BK, Corelli RL. Applied Therapeutics, The Clinical Use of Drugs. Eighth Edition 2005. Lippincott Williams and Wilkins. p.71-83. [ Links ]











 texto em
texto em