1. ¿Qué es terapia génica y cómo se desarrolla?
La terapia génica es una línea de investigación que tiene como finalidad generar tratamientos a nivel genético, para enfermedades que presentan dificultades al tratarse por medios convencionales (Shah et al., 2004). En esta línea de investigación, se realiza un remplazo de los genes afectados de una enfermedad en particular; por genes terapéuticos (es decir sanos), con el fin de restablecer una función específica, que ha sido suprimida o defectuosa. Para realizar esto, se utilizan diversos métodos; que pueden ir desde emplear cargas eléctricas para abrir poros en la membrana celular, hasta la implementación de virus modificados genéticamente para implantar los genes terapéuticos a una zona del genoma celular en particular (Seow & Wood, 2009).
Es de aclarar que, si bien se puede realizar el remplazo genético en células germinales y en células somáticas, y es impredecible los efectos de las modificaciones genéticas, existe un consenso social, político y científico, de realizar esta línea de investigación en células somáticas, pues al ser células diferenciadas, la modificación de su material genético estará limitado al individuo (García y Gonzales, 2008), además de que al realizarse la modificación en un individuo adulto, no se compromete su autonomía, pues el individuo valorada la pertinencia de este tipo de investigación a participan. Situación que no ocurre con las células germinales, no solo porque las modificaciones a dichas células pueden transmitirse a la descendencia del individuo (Gao et al., 2002), lo que podrían implicar una desventaja evolutiva (Mejía, 2005), sino que, al ser células no diferenciadas, carecen de la capacidad de consentir de manera autónoma su participación en estas investigaciones.
La realización de esta línea de investigación se emplean estrategias ex vivo e in vivo, donde se realiza la transferencia genética (Osorio, 2011), en las que se pueden utilizar virus modificados genéticamente para acarrear los genes terapéuticos a las células objetivo (Richard et al., 2001). No obstante, el implemento frecuente de dichos virus pueden presentar dificultades como una sobrexpresión del sistema inmune (Martínez-Flores et al., 2006); o la modificación de regiones del genoma que no tienen una función en el desarrollo de la enfermedad a tratar (Regueiro et al., 2004).
Otros métodos que se utilizan para realizar la transferencia genética son la implementación de una porción de ADN modificado genéticamente que, vehiculado mediante una solución salina, se suministra a las células por medio de una inyección intramuscular (Bermúdez-Morales et al., 2005) y la electroporación, es decir, la aplicación in vitro de una carga eléctrica, a la célula objetivo, para abrir los poros de la membrana celular, y permitir la entrada del gen que se pretende insertar en su interior (Rozalén et al., 2003). Los métodos, utilizados en la investigación de terapia génica, deben cumplir con parámetros como una eficaz transferencia genética, una estable y constante expresión de los genes implantados, entre otras condiciones técnicas que conlleven a una terapia exitosa, con el fin de trasladarla a un nivel clínico (Rodríguez et al., 2005).
Esta línea de investigación se presenta en dos etapas, una etapa de investigación básica, donde se investiga la construcción y la eficiencia de la transferencia genética, así como, los posibles efectos que el empleo de los métodos utilizados puede tener en animales experimentales. Y en una etapa clínica, donde se realizan ensayos clínicos de distintas fases, en seres humanos, con el fin de probar la seguridad, toxicidad y efectividad de los tratamientos, surgidos de dicha línea de investigación para una posterior aplicación y/o comercialización en el sector salud (Lazcano-Ponce et al., 2004).
2. La línea de investigación de terapia génica en España y México
Alrededor del mundo, países como Estado Unidos (Shah et al., 2004), Reino Unido (McCrudden et al., 2018) y Japón (Sumi et al., 2017), se mantienen a la vanguardia en este tipo de investigación, tanto en el desarrollo de investigación básica, como en ensayos clínicos de terapia génica. No obstante, países hispanohablantes también han incursionado en la investigación en terapia génica. España, por ejemplo, se presenta como uno de los países hispanohablante con una participación global, referente a investigación de terapia génica. En el 2018, 1.2% de los ensayos clínicos de terapia génica, a nivel mundial, se han realizado en este país (Ginn et al., 2018). Por lo que, el país ibérico, se considera como un representante de esta línea de investigación, en habla hispana, en cuestión de ensayos clínicos.
España se coloca en el lugar 26 en cuanto a desarrollo humano (PNUD, 2018), y cuenta con una inversión en ciencia de 125.5 millones de euros para financiar proyectos de investigación biomédica, de acuerdo con el Plan Estatal de Investigación Científica y Técnica y de Innovación 2017-2020, del Ministerio de Ciencia, Innovación y Universidades (MICINN, 2018). El presupuesto que este país tiene en investigación biomédica; ha promovido la realización de proyectos de investigación de terapia génica en varias regiones del país, tanto en etapa de investigación básica como ensayos clínicos. La Universidad de Navarra, por ejemplo, ha realizado terapia génica con vectores adenovirales, modificados genéticamente, para el tratamiento del cáncer, investigación que se ha llevado a cabo en ensayos clínicos con fines de inmunoterapia (Huarte et al., 2006)
Asimismo, la investigación de terapia génica en territorio español, ha realizado colaboraciones con instituciones como la Universidad de Helsinki, realizando ensayos clínicos utilizando vectores adenovirales para el tratamiento de pacientes que presentan tumores avanzados, en el Instituto Catalán de Oncología (Nokisalmi et al., 2010). El hospital Universitario del Niño Jesús en conjunción con la Fundación Marcelino Botín, y el Centro de Transfusión de Madrid, han investigado el tratamiento de terapia génica para tumores en fase de metástasis (García-Castro et al., 2005). De igual forma, la Universidad Autónoma de Madrid ha realizado comparaciones entre los vectores virales para evaluar las eficiencias y complicaciones de su implementación (Felipe et al., 2001).
Los proyectos de investigación de terapia génica, realizados en España, se amparan en una legislación ajustada a los avances que esta investigación tiene en el país en el cual se desarrollan (Larios, 2006). La legislación española, en este caso, consta de 3 marcos regulatorios, aplicables a la investigación de terapia génica. El primer marco regulatorio es la ley 14/2007 de Investigación Biomédica, el cual regula las investigaciones biomédicas a nivel básico. Dicha legislación permite que exista una colaboración entre el gobierno español y la Federación Española de Enfermedades Raras (FEDER), con el fin de incentivar la realización de proyectos de investigación biomédica, por medio del cofinanciamiento público y privado (BOE, 2007).
Para el caso de ensayos clínicos de terapia génica, el Real Decreto 1090/2015 por el que se regulan los ensayos clínicos con medicamento (BOE, 2015), estipula que; los diferentes comités que avalan los ensayos clínicos de terapia génica en territorio español se realicen considerando lo estipulado en la Declaración de Helsinki (AMM, 1964). Así, el comité de Ética de la Investigación de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), dará el aval necesario para realizar un ensayo clínico en territorio español actuando como autoridad vigilante de los ensayos clínicos, gestionando el Registro Español de Estudios Clínicos, y siendo el organismo responsable de vigilar los resultados de los ensayos clínicos de terapia génica.
Sumado a los marcos normativos anteriores, el Real Decreto 477/2014 por el que se regula la autorización de medicamentos de terapia avanzada de fabricación no industrial, enuncia los requerimientos necesarios para que un medicamento de terapia avanzada, como la terapia génica, sea autorizado para ser aplicado en pacientes individuales que estén en instituciones hospitalarias. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), en este sentido, será la autoridad responsable de la autorización del uso de los medicamentos de terapia avanzada, los cuales; deben de presentar los resultados de investigación básica y clínica para cumplir con las garantías de calidad, seguridad y eficacia; necesarias para aplicarse bajo la responsabilidad profesional exclusiva de un médico colegiado, con el fin de cumplir una prescripción facultativa (BOE, 2014).
Aunque países latinoamericanos como Argentina (Salsano & Finocchiaro, 2010), y Colombia (Barrera et al., 2008), han incurrido en la investigación de terapia génica, se considera a México como el primer país, de América Latina, en realizar un ensayo clínico de terapia génica (Rojas-Martínez et al., 2013). Por ello, aunque no figure a una escala mundial, México tiene una presencia importante en lo que respecta a investigación de terapia génica. De acuerdo con el Programa de las Naciones Unidas para el Desarrollo (PNUD, 2018), México se encuentra en el lugar 74 de los índices e indicadores de desarrollo humano 2018; e invierte anualmente un estimado de 350 millones de pesos (equivalente a 14.5 millones de euros) para financiar proyectos de investigación científica, por medio del Consejo Nacional de Ciencia y Tecnología (CONACYT) según cifras del presupuesto de egreso de la federación de 2018.
Si bien la inversión pública, en México; no está totalmente dirigida a la investigación biomédica, se ha incursionado en la línea de investigación en terapia génica en algunas instituciones educativas y de salud. La Universidad de Guadalajara ha realizado pruebas con ratas Wistar para investigar el tratamiento de la cirrosis mediante terapia génica (Gálvez-Gastélum et al., 2010). De igual manera, el Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", en colaboración con la Universidad de Hamilton en Canadá, también ha realizado proyectos de terapia génica investigando tratamientos para tuberculosis en ratas, con el objetivo de reforzar su sistema inmune (Francisco-Cruz et al., 2013), y el Instituto Politécnico Nacional ha realizado investigación de terapia génica para el tratamiento del Parkinson (Nadella et al., 2014).
En el ámbito legal, la normativa mexicana que regula los proyectos de investigación de terapia génica, recae en dos marcos normativos: la ley General de Salud (1984) y su Reglamento en Materia de Investigaciones (1984). La ley General de Salud (1984) tiene dos apartados que abarcan la investigación de terapia génica: el primero trata sobre el genoma humano, y el segundo está enfocado a las investigaciones para la salud. En el caso del genoma humano, este marco regulatorio manifiesta que la investigación, desarrollo y productos del genoma humano estarán dirigidos al uso enfocado a la protección de la salud, y en él se reconoce al genoma humano y su conocimiento como patrimonio de la humanidad (Cámara de Diputados, 1984).
La ley General de Salud establece que los comités de bioética y de ética en investigación serán los encargados de evaluar las investigaciones con seres humanos y estarán registrados ante la Comisión Nacional de Bioética (COMBIOÉTICA). Los comités de investigación y de bioseguridad se establecen con el fin de avalar, de manera general, las investigaciones para la salud en México. Asimismo, la Secretaria de Educación Pública (SEP), en coordinación con la Secretaria de Salud (SS), y con la participación del Consejo Nacional de Ciencia y Tecnología (CONACYT), son las encargadas de orientar el desarrollo de estas investigaciones, por lo que, los comités de investigación y bioseguridad estarán registrados ante las instituciones anteriormente mencionadas.
El Reglamento de la ley General de Salud en Materia de Investigaciones (1984), por su parte, manifiesta que se requiere autorización de la Secretaria de Salud para crear y hacer uso de ácidos nucleicos recombinantes que se utilicen como vectores. El uso de dichos vectores se realizará asegurando su contención biológica, siendo el comité de bioseguridad el encargado de establecer los paramentos necesarios para realizar las investigaciones que requieran el uso de dichos vectores (ámara de Diputados, 1987C). Asimismo, se establece que los comités de bioética y de ética en investigación serán los encargados de evaluar las investigaciones con seres humanos y que dichas investigaciones se realizarán en tanto el conocimiento que se busque no pueda obtenerse por otro medio, teniendo consentimiento informado de parte de los participantes y ponderando que los beneficios de dicho estudio son mayores que los posibles riesgos.
Este pequeño esbozo del aparato legislativo de la investigación de terapia génica, en México y España, manifiesta el trasfondo legal con que se cuenta, en ambos países, para realizar dicha actividad. En dicha comparativa se pone de manifiesto que, mientras que en el país ibérico se presenta delimitada en cuanto al marco específico para cada fase de la investigación, en México se considera un marco regulativo para todas las investigaciones biomédicas en general, incluyendo a la terapia génica.
3. La investigación de la terapia génica, un desafío bioético
La terapia génica, como línea de investigación, es influenciada en su ejercicio por aspectos no cognoscitivos de la investigación, tales como el presupuesto, la legislación, la población objetivo, entre otros elementos necesarios para realizar terapia génica. Los factores que influyen en la realización de esta línea de investigación pueden estar sujetos a una esfera política determinada (Chalmers, 2006), la cual a su vez, es retroalimentada por los avances de las investigaciones científicas (la propia terapia génica) para delimitar las condiciones y el contexto en el cual los resultados de las investigaciones se planteen aplicar. Así pues, la investigación de terapia génica se encuentra inmersa en un contexto determinado, interactuando con diferentes sistemas sociales que, al influirse mutuamente, definen características específicas de la misma, con base al contexto en el cual se realicen (Agazzi, 1996).
La complejidad de la investigación de terapia génica, más allá de la investigación en sí, puede denotar, con base a sus características, un enfoque y/o énfasis determinado, en el cual, los resultados de la investigación y posterior aplicación lleven al surgimiento de dilemas bioéticos como la discriminación por características genéticas, limitaciones en cuanto al acceso de todas las personas a tratamientos de terapia génica e incluso la apropiación de material genético y su posterior uso comercial (Bergel, 2002). Teniendo esto en cuenta, es importante conocer, cuáles son las características de la investigación de terapia génica, y como dichas características, a fin de evaluar los dilemas bioéticos que pueden surgir, derivados de las aplicaciones de la terapia génica en campos como el de la salud (Gutiérrez-Samperio, 2002).
Así pues, dado los escasos estudios de bioética en la investigación de terapia génica (Oliva-Sánchez et al., 2013), en el presente estudio se hace un esfuerzo por identificar, de primer momento, las características que tiene la investigación de terapia génica en México y España con el fin de conocer la complejidad del panorama bioético de esta línea de investigación en ambos países. Con ello se pretende presentar un referente para análisis bioéticos posteriores que identifiquen, de forma precisa, el panorama bioético de investigaciones biomédicas, como la terapia génica, y su interacción con el contexto en donde se busca aplicar.
4. Materiales y métodos
El presente trabajo es un estudio de corte exploratorio cuyo fin es identificar, mediante la aplicación de un cuestionario, las tendencias de los estudios de investigadores mexicanos y españoles que desarrollan terapia génica. Se identifican las características técnicas, bioéticas y legales, entre otras, que dicha línea de investigación tiene en México y España.
4.1. Elaboración de cuestionarios
Se elaboraron dos cuestionarios estructurados de opción múltiple, siendo un cuestionario para cada grupo de investigadores de cada país (México y España). Ambos cuestionarios comprendieron 26 preguntas distribuidas en cuatro apartados que corresponden a una característica en particular de la investigación de terapia génica. A continuación se muestra en la Tabla 1 la estructura de los cuestionarios.
4.2. Investigadores participantes
Para este estudio se realizó un muestreo no probabilístico por conveniencia, en el cual, se enviaron, vía correo electrónico a investigadores mexicanos y españoles que, de acuerdo al Sistema Nacional de Investigadores 2017 (SNI) del Consejo Nacional de Ciencia y Tecnología (CONACYT, 2017) y al sitio web de la Sociedad Española de Terapia génica y Celular (SETGyC, 2018), tienen proyectos y/o son autores de artículos científicos relacionados con investigación de terapia génica. mediante este muestreo se obtuvieron un total de 27 investigadores participantes, de los cuales 11 investigadores son mexicanos y 16 españoles. Siendo, cada uno de ellos, pertenecientes a distintos institutos de investigación.
4.3. Análisis estadísticos
Se implementaron dos análisis estadísticos. Un análisis descriptivo en el cual se agruparon las respuestas constantes para expresar los resultados de manera general, en gráficas de barras con porcentaje. Y un análisis de correspondencia múltiple (ACM), para identificar las características específicas de la investigación de terapia génica de cada país.
5. Resultados descriptivos
Con los datos obtenidos de la aplicación de los cuestionarios a los investigadores participantes se identificó que la estrategia in vivo es la más utilizada en investigaciones mexicanas y españolas, siendo el 54% y el 57% para las investigaciones de ambos países. Por otro lado, la línea de investigación de terapia génica en México se centra en la regulación genética, la terapia de sustitución y la viroterapia, todas ellas con un 22% de investigaciones. Por lo contrario, las investigaciones españolas se centran en la inmunoterapia y la terapia de sustitución en un 36% y 28% de las investigaciones, respectivamente. Como se muestra en la Figura 1, el método más utilizado para realizar la transferencia genética es la utilización de vectores adenovirales que presentan un porcentaje de utilización del 38% en las investigaciones mexicanas y un 32% en las investigaciones españolas.
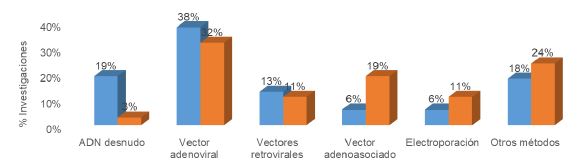
Figura 1: Métodos de transferencia genéica, utilizados en la investigación de la terapia génica en México y España. En azul el porcentaje de investigaciones mexicanas y en naranja el porcentaje de las investigaciones españolas.
Con base en los sistemas de salud de cada país, Secretaria de Salud (2015) para México y Red Nacional de Vigilancia Epidemiológica con el Ministerio de Sanidad, Consumo y Bienestar Social (2016) para España. Se identificó que un 81% de las investigaciones mexicanas llevan a cabo investigación de terapia génica, para enfermedades consideradas de salud pública. Mientras el 71% de las investigaciones españolas, abordan tratamientos para enfermedades consideradas raras, como se puede apreciar en la Figura 2.
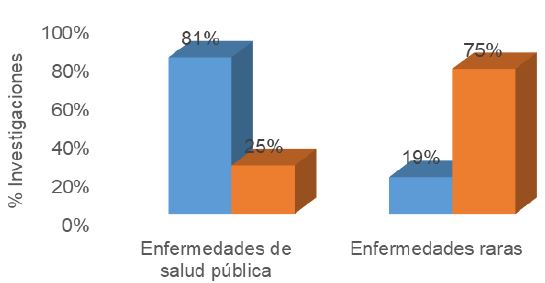
Figura 2: Clasificación de enfermedades que se investigan mediante terapia génica en México y España, con base en la Secretaria de Salud (Salud, 2015) y el Ministerio de Sanidad, COnsumo y Desarrollo Soial (MSCDS, 2016) En el azul el porcentaje de investigaciones mexicanas y en naranja el porcentaje de investigaciones españolas.
La especie más utilizada para realizar investigación de terapia génica es Mus musculus, siendo considerado en el 50 % de las investigaciones mexicanas y en el 71% de las investigaciones españolas. En ambas investigaciones, el criterio por el cual se recurre a esta especie es la búsqueda de mejoras en el ensayo de nuevas terapias para tratar la enfermedad, motivo que se identificó en el 40% de las investigaciones mexicanas y el 48% de las investigaciones españolas de terapia génica. Las especies animales, utilizadas para la realización de este tipo de investigación, tienen su origen en los bioterios de los institutos en los cuales se desarrolla la investigación. Este hecho se identificó, en el 60% de las investigaciones mexicanas y en un 36% de las investigaciones españolas.
Como se observa en la Figura 3, el porcentaje de investigaciones españolas que desarrollan ensayos clínicos de terapia génica es del 50%, mientras que el 81% de las investigaciones mexicanas se realizan en investigación básica. en una fase pre-clínica.
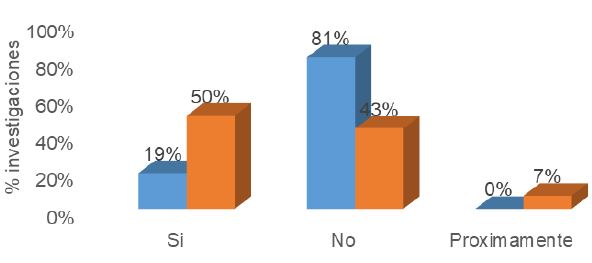
Figura 3: Ensayos clínicos que se realizan en las investigaciones de terapia génica en México y España. En azul el porcentaje de investigaciones mexicanas y en naranja el porcentaje de investigaciones españolas.
En las investigaciones de terapia génica, tanto mexicanas como españolas, una de las situaciones que se presenta es la dificultad de monitorear, es decir, dar seguimiento a los animales experimentales utilizados en dicha investigación, siendo el 28% de las investigaciones mexicanas y el 27% de las investigaciones españolas las que presentan dicha situación. Asimismo, se identificó que un 64% de las investigaciones mexicanas y un 37% de las investigaciones españolas tienen una eficacia parcial o total en los resultados de esta línea de investigación.
Se identificó que el 38% de las investigaciones mexicanas están avaladas por el conjunto de comités de investigación, bioética, y bioseguridad. Mientras que el 32% de las investigaciones de terapia génica en España, son avaladas, en porcentaje igual, por un comité de bioseguridad y un comité de investigación. Dichos comités, que avalan investigación de terapia génica en los dos países, están registrados ante las instituciones donde se realiza la investigación, fenómeno que se presenta en el 40% de las investigaciones mexicanas y en el 44% de las investigaciones españolas. Los marcos legales que se identificaron, para la realización de investigación de terapia génica son; el Reglamento de la Ley General de Salud en Materia de Investigaciones (1984) para el 43% de las investigaciones mexicanas, seguida de la Ley General de Salud (1984) con un 25%. Las investigaciones españolas, por su parte, en un 29% fundamentan su trabajo en la declaración de Helsinki (1964) y en un 25% al Real Decreto 477/2014 que Regula la Autorización de Medicamentos de Terapias Avanzadas de Fabricación no Industrial.
Las investigaciones de terapia génica en México y España cuentan con diferentes financiamientos, siendo el 64% de las investigaciones mexicanas financiadas por el sector científico gubernamental (CONACYT). Por lo que se refiere a las investigaciones españolas, el 25% son financiadas por parte de asociaciones civiles.
6. Resultados de análisis de correspondencia múltiple
Los resultados del análisis de correspondencia múltiple indica que, entre los diversos métodos para realizar la transferencia genética en las investigaciones de terapia génica, existe una asociación entre la investigación mexicana con los vectores adenovirales. Mientras que la investigación española tiene una asociación con los vectores retrovirales, como se muestra en la Figura 4.
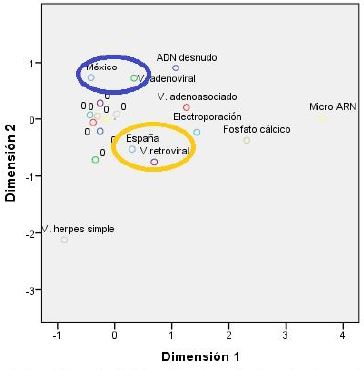
Figura 4: Métodos de transferencia génetica utilizados en las investigaciones de terapia génica (ADN desnudo, Electroporación, Fosfato de cálcico, Micro ARN, Vector adenoviral, Vector adenoasociado, Vector de herpes simple y Vecor retroviral). En azul se señala la asociación de México con el método de Vector adenoviral. En naranja se señala la asociación de España con el métido de Vector retroviral.
Referente a los criterios por los cuales se utilizan modelos animales, como Mus musculus se observa, como se ilustra en la Figura 5, una asociación entre la investigación mexicana con el criterio de identificación de genes problema. En tanto, la investigación española se asociada al criterio de mejora de los ensayos para la terapia.
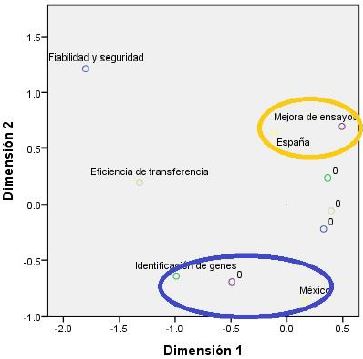
Figura 5: Criterios para utilizar modelos animales en investigaciones de terapia génica (Eficiencia de la transferencia de genes implantados, Fiabilidad y seguridad de los vectores utilizados, identificación de genes problema y Mejora de ensayos para la terapia). En azul se señala la associación de México con el criterio de identificación de genes problema. En naranja se señala la asociación de España con el criterio de Mejora de ensayos para la terapia.
Se identificó, con relación a los comités que avalan las investigaciones de terapia génica, una asociación entre la investigación mexicana y el comité de investigación. Mientras que la investigación española se asocia con el comité de bioseguridad, como se muestra en la Figura 6.
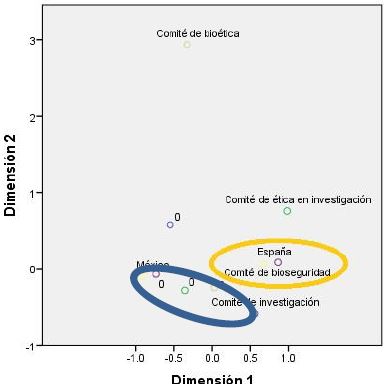
Figura 6: Comités que avalan investigaciones de terapia génica. (Comité de bioética, Comité de bioseguridad, Comité de ética en la investigación, y Comité de investigación). En azul se señala la asociación entre México y el Comite de investigación. En naranja se señala la asociación entre España y el Comité de bioseguridad.
7. Discusión
En esta investigación se identificó que, aunque los vectores adenovirales se utilicen en ambos países (Delgado-Enciso et al., 2007), (Barajas, 2001). México tiene una correspondencia con dichos vectores, en tanto que España es correspondiente con vectores retrovirales. Sin embargo, la presencia del sistema inmune elimina gran parte del vector utilizado, en tratamientos que requieren una aplicación continua de un vector adenoviral (Martínez-Flores et al., 2006). No obstante, nuestros resultados indican que, en México y España, la presencia del sistema inmune al administrar este vector, no influyen en la efectividad de las investigaciones de terapia génica.
La variabilidad de la eficacia de la investigación de terapia génica, en ambos países, se puede deber al empleo de una variedad de métodos para realizar la transferencia genética a las células objetivo (Alméciga-Díaz & Sáenz, 2006). Si bien con los resultados de esta investigación encontramos una diversidad de métodos para realizar la transferencia genética entre ambos países, no se descarta que la implementación, de manera simultánea, de técnicas como la radioterapia, puedan influir en la función de vectores, como los virales, para una transferencia genética sin mayores complicaciones que comprometan los resultados de la investigación (Naoum et al., 2017).
La investigación básica se enfoca en la mejora de las técnicas de transferencia genética en ambos países, como lo demuestran nuestros resultados sobre utilización de animales experimentales. Sin embargo, en las investigaciones españolas, se encontró que, en la utilización de estas especies, se tiene participación de comités de uso de animales experimentales. Por lo que, la participación de dicho comité se suma a autorización de proyectos de terapia génica en España por parte de los comités de investigación, bioética y bioseguridad, para avalar dichos proyectos. No obstante, el aval de las investigaciones de terapia génica realizadas en México, se limitan a la participación de los comités de ética de la investigación.
La integración de los comités de uso de animales experimentales, para validar la investigación de terapia génica en España, se encuentra respaldada por los documentos tomados en cuenta para realizar dichas investigaciones, pues la declaración de Helsinki (1964), misma que es considerada en la investigación española, tiene un apartado sobre dicha temática, y el aval de las investigaciones españolas de terapia génica, por parte de un comité de experimentación animal (Whitelaw et al., 2016). Aunque en España la participación de dicho comité se deba a una imposición legal, que se establece en atención de al Real Decreto 53/2013 para atender la experimentación con especies animales. Consideramos que no se debe tomar de esta manera, ya que desde una postura bioética se deben tener criterios claros para evitar abusos y emplear alternativas en el uso de animales experimentales, como la tres erres de Russel y Burch (Concepción Alfonso et al., 2007)
En el caso de la investigación de terapia génica en México, si bien, no encontramos la participación de un comité de experimentación animal, para avalar las investigaciones mexicanas, el Reglamento de la Ley General de Salud en Materia de Investigaciones (1984) contiene un apartado dirigido a las investigaciones con animales experimentales (Camara de Diputados, 1987). No obstante, la ausencia de un comité de experimentación animal se puede deber a que la Norma Oficial Mexicana NOM-062-ZOO-1999 (SEGOB, 1999), sobre especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio, adjudique la existencia de un Comité Interno para el cuidado y uso de Animales de Laboratorio, a la propia institución donde se realizan dichas investigaciones.
Se identificó que la investigación de terapia génica en México y España, tienen resultados prometedores a nivel básico, no obstante, las investigaciones españolas han realizado varios ensayos clínicos (Ginn et al., 2018). Esta situación se relaciona con el financiamiento de estas investigaciones por parte de organismos privados, los cuales pueden cubrir los costos para realizar un ensayo clínico, en comparación con los países latinoamericanos, como México, donde el financiamiento público no logra abarcar el elevado costo para desarrollar un ensayo clínico, por carecer de los recursos económicos necesarios. Por ello, pese a los avances en los resultados en terapia génica en las investigaciones de México, éstas se limitan a un compromiso limitado (Linden & Matte, 2014).
El financiamiento por parte de capital privado, promueve el establecimiento de un marco jurídico específico para las investigaciones de terapia génica española (Larios, 2006). Sin embargo, la falta de marcos regulativos específicos sobre investigación de la terapia génica en México, para las fases de investigación básica y en etapas clínicas presentan un reto para el estado mexicano debido a que, en la adecuación y promoción de las leyes para el ejercicio científico, es pertinente considerar las necesidades propias del país, que promuevan la realización de la terapia génica en investigación básica y clínica disponiendo, además, de una normativa adecuada y de políticas públicas que delimiten la realización de la terapia génica (Oliva-Sánchez et al., 2013).
La participación de compañías privadas y transnacionales influyen también en el establecimiento de las enfermedades a investigar por medio de la terapia génica, con metas ajenas a la salud y más alineadas a intereses económicos y/o políticos (Frenk & Gómez-Dantés, 2007). En la investigación española, por ejemplo, al trabajarse con enfermedades consideradas raras, se puede beneficiar a países desarrollados, que concesionen patentes a empresas transnacionales y se encarguen de la producción y distribución de bienes en salud a una escala global (Guzmán y Pluvia, 2004). Esto puede representar una dificultad para países en desarrollo como México, con una investigación enfocada en enfermedades de salud pública, cuyos productos de investigación de terapia génica sean susceptibles de patentes de índole internacional (Hernández y Díaz, 2007).
En este sentido, la realización de la terapia génica denota la necesidad de realizar estudios que analicen, desde posturas bioéticas, las investigaciones científicas. Este análisis debiera evaluar los dilemas bioéticos que pueden surgir derivados de los nuevos avances tecnológicos y sus aplicaciones en diversos campos como en la ingeniería genética (Gutiérrez-Samperio, 2002). Esto representa una importancia relevante considerando que el ámbito moral también es parte del ambiente en el que se envuelve el sistema científico, de manera que se ven influidos mutuamente (Agazzi, 1996). En esta necesidad de analizar desde la bioética las investigaciones como la terapia génica, es importante considerar principios morales, como el principio de responsabilidad, justicia y equidad, por mencionar algunos, para la praxis de las investigaciones de la terapia génica.
Considerar principios bioéticos para las investigaciones de terapia génica, puede promover el establecimiento de normas mínimas para la realización de las mismas, por medio de un proceso de deliberación dinámico cuyas soluciones siempre queden abiertas a una revisión, con base a los avances científicos (Cortina, 2002). El papel de la bioética, en este sentido, es desarrollar un espacio de deliberación interdisciplinaria que colabore en la creación de un carácter ético de las sociedades; y en la forja del carácter justo y prudente del ámbito de la investigación biotecnológica, como la terapia génica, desde principios éticos, como los mencionados, para promover una praxis de la investigación de la terapia génica desde una postura interdisciplinaria.
Conclusión
Desde este esfuerzo por identificar el panorama bioético de la investigación de la terapia génica de México y España, determinamos que la investigación de la terapia génica en México, se encuentra limitada a la investigación básica dado que, carece de los elementos necesarios para su realización en el plano clínico. No obstante, hay algunos esfuerzos de investigaciones que se realizan considerando un aspecto de salud pública como fin de dichas investigaciones. La investigación española tiene elementos que pueden denotar una terapia génica formalizada legalmente, tanto en investigación básica, como en ensayos clínicos.
Consideramos que el estatus que las investigaciones de terapia génica en ambos países, pese a tener algunas características similares, se diferencian principalmente por la participación de capital público y/o privado, para llevar los avances producidos de investigación básica, a una fase clínica. La influencia del estatus de esta línea de investigación, principalmente en España, permea en el establecimiento de políticas públicas específicas para la realización de dichas investigaciones. Sin embargo, queda abierta la posibilidad de que el establecimiento de dichas políticas públicas para la investigación de terapia génica se realice bajo influencia de factores económicos o políticos específicos, inherentes a los compromisos que los actores sociales relacionados, tengan en los dos países examinados en este trabajo.
Asimismo, es pertinente mencionar que la utilización de especies animales, en este tipo de investigación en México, debe ser sancionado y en su caso, avalado por comités de ética clínica y/o de bioética de una manera clara, como sucede en España, cuidando siempre del uso adecuado de las especies animales intervenidas en la investigación.