1. Introducción
Las situaciones de emergencias sanitarias plantean desafíos tanto para la salud pública como para la investigación. Dichas emergencias pueden producirse por distintos factores tales como desastres naturales (terremotos, inundaciones, aludes, tsunamis, erupciones, huracanes, incendios naturales), desastres producidos por el hombre (guerras, atentados, accidentes industriales, incendios intencionales) o por agentes infecciosos. A su vez, estas situaciones pueden comprometer a un solo país o a varios, transformándose en una emergencia sanitaria global.
La Organización Mundial de la Salud (OMS) realizó en el año 2009 una consulta técnica que culminó con la publicación del documento "Ética de la investigación en la respuesta internacional a epidemias", en el cual se remarcó la necesidad de sostener la vigencia de las pautas éticas en situaciones de emergencia, a la vez de favorecer las revisiones de los proyectos de investigación en tiempos más breves que los utilizados habitualmente, pero manteniendo su rigurosidad (WHO, 2010).
A raíz de las dificultades experimentadas durante la epidemia por el virus del Ébola ocurrido en África Occidental, la OMS elaboró las "Guías para el manejo de problemas éticos en brotes de enfermedades infecciosas", donde estableció que la elaboración previa de procedimientos y sistemas de toma de decisión es la mejor manera de asegurar que se tomen decisiones éticamente apropiadas en caso de ocurrir un brote epidémico e instó a los países y organizaciones a desarrollar estrategias prácticas y herramientas que permitan ser aplicados en sus propios contextos sociales, culturales y políticos (WHO, 2016).
La infección por el virus del Zika, cuyo brote se identificó en el año 2015 en Brasil y se extendió a otros países de la región, planteó también serios dilemas éticos, en particular por el síndrome congénito asociado (microcefalia, retraso mental y discapacidades). En ocasión de dicha epidemia, en el año 2016, el Programa Regional de Bioética de la Organización Panamericana de la Salud (OPS) realizó una consulta a especialistas en ética y otros profesionales pertenecientes a los ministerios de salud, OPS y OMS con el propósito de brindar orientación ética a las respuestas que debían darse durante el brote. En dicho documento, nuevamente se enfatizó el deber ético de realizar investigaciones durante el brote, para reducir la incertidumbre con respecto a la enfermedad, formular intervenciones y prácticas adecuadas para su manejo y para evaluar la seguridad y eficacia tanto de pruebas diagnósticas, como de tratamientos y/o vacunas (OPS, 2016). Un aspecto que resalta dicho informe es "la necesidad de crear de manera continua capacidad local para hacer investigación a fin de fortalecer la capacidad de respuesta a brotes", considerando a dichas iniciativas como prioritarias.
A pesar de contar con estas recomendaciones relacionadas con la necesidad de establecer pautas y procedimientos para la evaluación y realización de investigaciones éticas en situaciones de emergencias desde hace varios años, no se ha avanzado de manera uniforme en las diferentes regiones. En su reporte "Un mundo en peligro", la Junta de Vigilancia Mundial de la Preparación (GPMB por sus siglas en inglés) informó que en 2018, sólo un tercio de los países contaban con las capacidades requeridas en virtud del Reglamento Sanitario Internacional y que "la gran mayoría de los sistemas nacionales de salud serían incapaces de hacer frente a una afluencia importante de pacientes infectados con un patógeno respiratorio que se transmitiera con facilidad y provocara una elevada mortalidad" (GPMB, 2019).
Es así como la pandemia producida por COVID-19, nos enfrentó como nunca a desafíos en el campo de la ética de la investigación. La masividad de la afección y su velocidad de propagación nos ha interpelado para dar respuestas en tiempos breves, sin menoscabar la rigurosidad de las evaluaciones en desmedro de la protección de los potenciales participantes.
Aún en países con sistemas de salud sólidos, con amplios recursos económicos, la pandemia introdujo serias dificultades. Si las trasladamos a países con sistemas no tan consolidados y con menores recursos, los riesgos que se enfrentan saltan a la vista. La capacidad de respuesta desde el punto de vista de la ética de la investigación puede verse comprometida en regiones donde la estructura de los comités de revisión y su poder no están fuertemente establecidos.
La OPS ha elaborado una serie de documentos en los que se retoma la temática de la investigación en el contexto de pandemia, a través de los cuales se establecieron recomendaciones para los comités que evalúan proyectos de investigación (OPS 2020a, OPS 2020b).
La posibilidad de explotación o abuso en las investigaciones desarrolladas en situaciones de emergencia son altas, ya que en pos de encontrar alivio al sufrimiento de los pacientes, se pueden presentar investigaciones de dudosa validez científica y hasta con serio riesgo de daño para los participantes. La creación, mantenimiento y apoyo de sistemas sólidos de investigación en todos los países, incluyendo los comités de evaluación ética, son los pilares en los que se basa el informe de la OMS, para lograr la cobertura sanitaria universal (OMS, 2013).
El presente trabajo se realizó a los fines de conocer, hasta qué punto en nuestra región los Comités de Ética en Investigación (CEI) estaban preparados para enfrentar una situación de emergencia de estas características, teniendo en cuenta la oportunidad de generar aprendizajes y perspectivas para el futuro.
2. Objetivos
El objetivo general del presente trabajo fue conocer las capacidades de los Comités de Ética en países de América Latina y el Caribe, con relación a su actuación en situaciones de emergencias sanitarias por desastres y brotes de enfermedades.
Como objetivos específicos se establecieron los siguientes:
Evaluar la existencia de redes de comunicación entre los Comités, ante situaciones de emergencias sanitarias.
Evaluar la existencia de procedimientos para la actuación de los Comités, ante situaciones de emergencias sanitarias.
Evaluar los tiempos considerados como adecuados por parte de los Comités para la evaluación de proyectos de investigación en el contexto de la pandemia por COVID-19
Identificar los dilemas éticos que se han presentado con relación a las investigaciones en el contexto de la pandemia por COVID-19
3. Material y método
Se realizó un estudio exploratorio de tipo descriptivo, cuali-cuantitativo, para el cual se diseñó como instrumento de recolección de datos una encuesta ad-hoc compuesta por 29 preguntas cerradas y abiertas contemplando algunos aspectos generales sobre la organización del comité (área geográfica de influencia, actividad regulatoria, de evaluación o ambas, acceso a plataformas informáticas para el funcionamiento, cambios en la modalidad del trabajo por la pandemia, tiempos considerados razonables para la aprobación de protocolos en el contexto de emergencia, dilemas éticos encontrados en las investigaciones para COVID-19).
El protocolo fue aprobado el 6 de julio de 2020 por un Comité de Ética en Investigación acreditado en la Ciudad de Buenos Aires.
Se invitó a participar a diferentes Comités de Ética de América Latina y el Caribe, para lo cual se relevaron las direcciones de correo electrónico de los registros públicos existentes, con el fin de conformar un listado para el envío de la encuesta. Para evitar la duplicación de datos provenientes de un mismo comité, se recabó la dirección de correo electrónico al responder la encuesta y se solicitó indicar el nombre del Comité. El envío inicial se realizó a principios de agosto de 2020 y con el fin de reducir el sesgo de falta de respuesta, se enviaron dos recordatorios, uno a mitad del período de recolección y el segundo, cerca de la fecha de cierre de este. La recepción de respuestas finalizó el 31 de mayo de 2021.
4. Resultados
La encuesta tuvo un total de 772 visualizaciones y 183 destinatarios manifestaron la intención de responder, de los cuales efectivamente 122 (67%) completaron las preguntas. Luego de excluir las respuestas repetidas, la muestra quedó conformada por 106 comités.
La distribución de las respuestas por países se ilustra en el Gráfico 1.
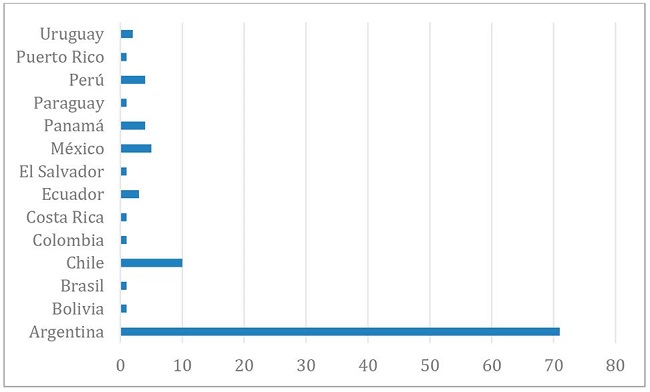
Gráfico 1. Distribución porcentual de los países de pertenencia de los comités que participaron en la encuesta (n=106).
De acuerdo a su área de influencia, 73 comités (68.8%) se desempeñaban a nivel institucional exclusivamente, 19 lo hacían en más de un área (17.9%), 6 a nivel provincial (5.6%), 4 a nivel nacional (3.77%) y 4 a nivel regional (3.77%).
Al momento de responder la encuesta, el 45% refirió que en su región o país no existían comités específicos para la evaluación de investigaciones en el contexto de emergencias sanitarias, previo a la pandemia por COVID. El 32% dijo no saber si existían ese tipo de comités y un 23% respondió que sí existían.
Con respecto a la existencia de una red de comunicación eficiente y efectiva entre los Comités. El 26% respondió que no existía previamente, pero se consideraba fuertemente desarrollarla a la brevedad, el 24% respondió que dicha red existía previamente a la pandemia, 16% no tenía conocimiento de la existencia de redes, 15% estaban desarrollándola y el 11% respondió que no existía y no se estaba considerando confeccionar ninguna red para la interacción de los comités. Hubo un 8% que no respondió a la pregunta.
También se interrogó si el comité contaba con procedimientos o protocolos de actuación frente a situaciones de emergencias sanitarias, catástrofes o brotes de enfermedades, con anterioridad a la pandemia. Nos interesó en particular discriminar, en el caso que no los tuvieran, si a raíz de la pandemia los estaban elaborando o pensaban hacerlo y si lo consideraban sólo para la coyuntura COVID o para un espectro más amplio de condiciones.
Las respuestas se ilustran en el Gráfico 2.
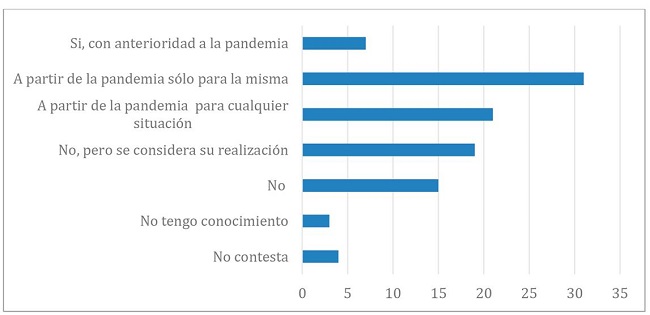
Gráfico 2. Distribución porcentual de la Existencia de procedimientos de actuación para emergencias sanitarias.
4.1. Modalidad de trabajo del comité
El 74% de los comités ha manifestado haber modificado el modo de recibir la documentación debido a la situación sanitaria y resguardos que impuso la pandemia por COVID. Con respecto a la modalidad de las reuniones, el 87% respondió que modificó la misma debido al distanciamiento social, adoptando la modalidad virtual exclusiva el 78%. En relación a lo anterior, un 77% de los CEI respondió que todos sus miembros tenían acceso a internet.
Al preguntar si habían decidido modificar el quórum necesario para la aprobación de estudios en el contexto de la pandemia, el 65% de los comités decidió mantener el número habitual de participantes y un 18% decidió establecer el quórum con un número menor.
4.2. Tiempos de evaluación de proyectos COVID
En virtud de los requerimientos de celeridad para la evaluación ética y metodológica de protocolos de investigación referidos a COVID-19, se les preguntó a los comités qué tiempos consideraban razonables para desarrollar dicha tarea, según el tipo de protocolo. Para los estudios observacionales, de bajo riesgo, el 32% consideró razonable un plazo de 3 a 5 días, 26% de 6 a 9 días, 21% de 10 a 13 días y solamente el 8% hasta 2 días. En cambio, para el caso de ensayos clínicos con drogas experimentales, el 33% consideró como razonable un plazo de 14 o más días, 25% de 10 a 13 días, 23% de 6 a 9 días, 12% de 3 a 5 días y ninguno hasta 2 días. La tendencia hacia una mayor cantidad de días considerados como razonables para la evaluación de protocolos, se profundiza en los ensayos clínicos con vacunas para COVID 19, donde un 40% estimó razonable un plazo de 14 o más días. En todas las categorías hubo un 7% que no respondió la pregunta.
Los datos se ilustran en el Gráfico 3.
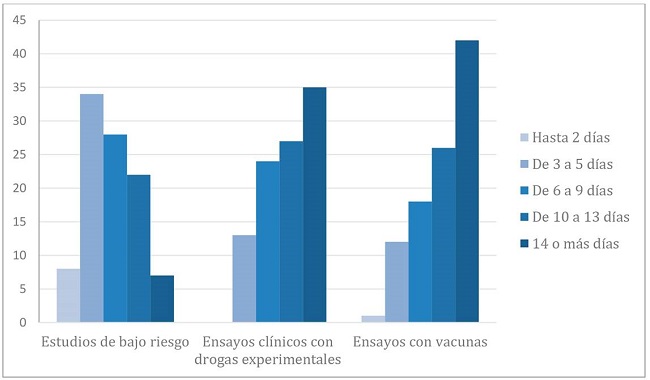
Gráfico 3. Distribución porcentual de los. Tiempos considerados razonables para la evaluación de protocolos COVID según tipo de estudio.
Sobre los tiempos administrativos que se consideran razonables para comunicar la aprobación de un protocolo al IP, un 47% respondió un plazo de 2 hasta 2 días, mientras que un un 28% contestó de 3 a 5 días
4.3. Conflictos éticos en protocolos COVID
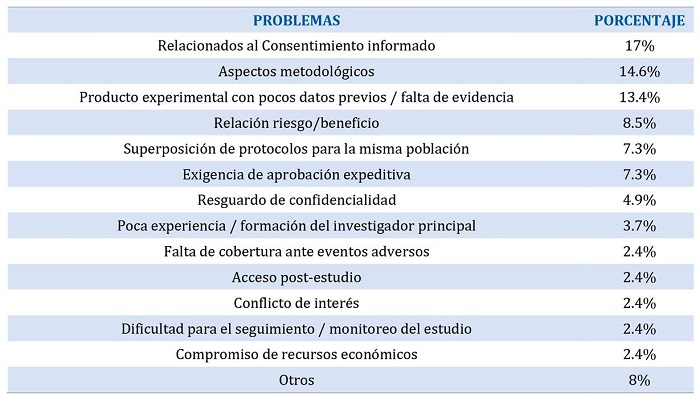
Entre los dilemas éticos enfrentados por los comités durante la evaluación de protocolos para COVID, la mayoría mencionó aspectos relacionados al consentimiento informado (17.1%), particularmente en cuanto al procedimiento y modalidades para su obtención y en menor medida en la información brindada en el mismo o pedidos de exención indebidos.
Otros dilemas éticos referidos fueron déficits metodológicos, ya sea en el diseño o cálculo muestral (14.6%), producto experimental con escasos datos previos o falta de evidencia (13.4%), relación riesgo/beneficio desfavorable o de difícil evaluación (8.53%), superposición de protocolos para la misma población (7.3%) y la exigencia de aprobación en tiempos acotados (7.31%).
Los resultados se ilustran en la Tabla 1.
Tabla 1. Distribución porcentual de problemas éticos identificados en protocolos de investigación para COVID 19.
Al preguntar respecto a los puntos más conflictivos observados en los consentimientos informados para los estudios sobre COVID 19, el 40,6% identificó al proceso para su obtención, el 15,9% hizo referencia a la omisión de información para los participantes, el 13% a la incapacidad de pacientes graves para consentir y el 7,2% identificó como punto conflictivo un lenguaje poco claro. Solamente un 2.9% mencionó la extensión de los formularios de consentimiento informado como un aspecto conflictivo.
El 21% de los Comités encuestados ha manifestado haber rechazado investigaciones en COVID por cuestiones éticas.
4.4. Estudios de infección humana controlada
Con respecto a la aceptabilidad de protocolos de infección clínica controlada o estudios de desafío en humanos (human challenge studies) para estudiar vacunas contra COVID-19, el 15% de los CEI refirió que podría considerar aceptable un estudio de infección humana controlada para probar una vacuna contra COVID 19., el 28% consideró que no, el 39% no sabe y el 18% no contestó.
Frente a la consulta abierta sobre qué dilemas éticos plantean a los comités los estudios de infección humana controlada por COVID 19, un 38,1% se relaciona con problemas en la relación riesgo-beneficio, un 23,8% menciona la falta de priorización de la integridad del individuo y un 22,2% consideró que estudios de estas características vulneraría el principio de no maleficencia.
5. Discusión
Este trabajo, llevado a cabo entre agosto de 2020 y mayo de 2021, durante el pico de la pandemia en gran parte de Latinoamérica, constituye un punto de partida como intento de describir el grado de preparación que los Comités de Ética en Investigación de la región, ostentaban para enfrentar situaciones de emergencia. En un marco de enorme esfuerzo, los CEI han logrado adaptarse a un inédito escenario, erigiéndose en actores claves para la investigación, como catalizador necesario entre las urgencias de la ciencia en la búsqueda de respuestas frente la pandemia y la protección de los sujetos participantes de los estudios referidos a COVID-19.
El repaso de los resultados relevados en el contexto de emergencias sanitarias anteriores que ha atravesado la región en su historia reciente, evidencia la falta de estructuras sustentables para la evaluación ética en contextos de emergencia. Un número sustancialmente bajo de encuestados reconoció la existencia de dispositivos en funcionamiento antes del COVID-19 para tales fines (procedimientos específicos, comités especiales, etc.).
A pesar de las recomendaciones emitidas por organismos internacionales con respecto a la necesidad de prepararse para una eventual emergencia sanitaria (WHO 2016, GPMB 2019, Saxena et al 2019), el porcentaje de Comités que contaban con lineamientos de acción para dichas situaciones, con anterioridad a la pandemia por COVID 19, fue muy escaso. No obstante, la situación vivida instó a varios de ellos a elaborar nuevos procedimientos. Sin embargo, un 21% los confeccionó exclusivamente como respuesta al contexto COVID, pero no para un espectro más amplio de posibles emergencias sanitarias y un 15% no consideró necesario su incorporación.
No está ampliamente difundida la interacción y la conformación de redes entre los comités. Nuestro equipo se encontró con cierta dificultad para acceder a los datos de contacto de los Comités en las fuentes de acceso público disponibles. Esto puede ser un factor que dificulte el intercambio y la comunicación fluida entre los comités.
La realidad planteada por la pandemia, obligó a modificar la modalidad de trabajo, la forma de recibir la documentación de los proyectos y de reunión de los comités, pasando a llevarse a cabo exclusivamente de manera virtual en la gran mayoría de los casos. Para algunos, también existió la posibilidad de acceso a plataformas informatizadas para la gestión de la actividad de los comités. Probablemente, la amplia accesibilidad a estas herramientas por parte de los miembros, haya influido en la decisión de no modificar el quórum necesario para sesionar, referida por la mayor proporción de comités.
De acuerdo con la Orientación y estrategia para agilizar la revisión y supervisión éticas de investigaciones relacionadas con COVID-19 elaborada por la OPS, si bien el tiempo hasta la decisión final depende de diversos factores, deberían cumplirse los siguientes plazos: el protocolo de investigación debe remitirse a los miembros del comité de ética dentro de las 24 horas de recibido, los miembros revisores no deben tardar más de 72 horas en evaluar el protocolo de investigación y la reunión debe realizarse tan pronto como los miembros hayan culminado sus revisiones (OPS 2020b).
Partiendo de la base que los tiempos previstos en la guía constituyen un horizonte deseable y no revisten carácter imperativo, algunos de los resultados de la investigación dan cuenta del contraste con la percepción de razonabilidad por parte de los CEI encuestados, quienes en el 32% de los casos valoraron como razonable un plazo de evaluación entre 3 y 5 días para estudios observacionales sin intervención, mientras que el porcentaje disminuyó claramente para ensayos clínicos con drogas experimentales o vacunas (12,5% y 11% respectivamente). Si bien la heterogeneidad de los CEI que respondieron la encuesta (diferentes países y diversos niveles de acción) no permite establecer un patrón generalizable, las respuestas constituyen un llamado de atención que amerita una evaluación más exhaustiva.
La misma guía sugiere como alternativas para la organización de la evaluación ética de investigaciones sobre COVID-19 la creación de Comités especiales, ya sea bajo la modalidad ad hoc, regional (nacional, regional extraterritorial; provincial o subnacional) o bien la delegación de la revisión en un único o varios CEI institucionales tradicionales. Sin embargo, la región relevada no parece tener un soporte normativo adecuado para emplear estrategias de esta índole. Algunos de los resultados sugieren esta afirmación. Por ejemplo, un 59% de los encuestados consideró que la aprobación de un CEI no puede ser válida en más de una institución y un 38% no consideró aceptable -de acuerdo a las regulaciones de su país- nombrar a un CEI que pueda aprobar investigaciones en más de una institución. Sobre este punto, se consultó específicamente a los encuestados si sus jurisdicciones cuentan con comités especiales para evaluar proyectos vinculados a emergencias sanitarias y un 45% manifestó la negativa, mientras que un 23% manifestó contar con algún tipo de comité especial (nacional, regional, provincial o institucional) específico para emergencias sanitarias.
La inédita situación planteada por la pandemia por COVID-19 debido a su alto nivel de contagiosidad, que determinó un masivo distanciamiento y, en algunos casos directamente el aislamiento social, sumado al desconocimiento de la enfermedad y la falta de tratamiento, agregó una nueva dimensión en la forma en que se diseñaron los protocolos de investigación y los procedimientos relacionados a los mismos. Esto se trasluce en la mayor preocupación referida por los CEI, con relación al proceso de obtención del consentimiento informado. Hubo que diseñar otros mecanismos para la obtención de los consentimientos y en muchos casos, esto estaba en desacuerdo con los requisitos legales imperantes en la región o país. Tal es el caso del no reconocimiento como válido por parte de algunas autoridades regulatorias de otra modalidad de consentimiento que no sea en papel, con la firma ológrafa del participante, e inclusive en algunos casos, la presencia obligatoria de testigos.
El tratarse de una patología nueva con afectación mundial determinó que se propusieran un sinnúmero de investigaciones de todo tipo, situación que colaboró con otros problemas mencionados por los CEI, tales como estudios con fallas metodológicas en su diseño, con poca potencia estadística por tener muestras pequeñas o incluso estudios sin validez científica. También generó preocupación en los comités la superposición de protocolos para la misma población y la posibilidad que a los pacientes se los invadiera reiteradamente para su participación en varios tipos de estudios simultáneamente. La falta de experiencia o de formación adecuada en investigación por parte de los investigadores fue otro elemento señalado, aunque con menor frecuencia.
Las múltiples presiones para el hallazgo de un tratamiento o vacunas eficaces multiplicaron exponencialmente el número de ensayos clínicos, tanto con medicamentos existentes como con drogas experimentales. Esto determinó el uso de productos experimentales con escasos datos de investigaciones previas o bien la propuesta de tratamientos con falta de evidencia, que fueron otros de los problemas mencionados por los CEI. En este escenario, la evaluación de la relación riesgo / beneficio por parte de los comités resultó muchas veces dificultosa.
La exigencia de reducir los tiempos de evaluación, también fue referida como problemática. Si bien no podemos realizar un análisis puntual, estimamos que esta situación probablemente se fue agudizando en la medida que aumentaba el número de investigaciones.
Algunos aspectos problemáticos mencionados con menor frecuencia, cobran sin embargo, a nuestro entender, un valor importante en el contexto de recursos limitados de nuestra región. Nos referimos en particular a la falta de cobertura ante posibles eventos adversos serios, al acceso post-estudio para las intervenciones eficaces (particularmente importante en el caso de las vacunas) y al compromiso de recursos económicos derivados para la realización de las investigaciones en lugar de ser volcados a la asistencia de la emergencia sanitaria. Un ejemplo de ello era la disponibilidad de equipos de protección personal que no era razonable asignar a las investigaciones en lugar de destinarlos para la atención de los pacientes.
Al momento de diseñar esta investigación, existían iniciativas para el desarrollo de protocolos de infección humana controlada (human challenge studies) e inclusive la OMS había elaborado un documento con recomendaciones para su realización (Day Sooner, 2021 WHO 2020). Por ese motivo, quisimos conocer la postura de los comités de la región frente a este tipo de estudios. Sólo el 15% refirió que podía considerarlo aceptable para probar una vacuna contra COVID. El 39% de los CEI manifestó dudas respecto de la posibilidad de aprobarlos y el 28% se manifestó en contra de la realización de ensayos clínicos con esas características. Las argumentaciones esgrimidas para la postura de rechazo con relación a las investigaciones de vacunas realizadas con esta metodología para COVID-19, se refirieron a que las mismas se encuentran reñidas con el principio de no maleficencia, por tener un balance riesgo/beneficio desfavorable para los sujetos. Hubo un 18% de comités que no respondió a esta pregunta.
Durante el período de recolección de las respuestas, existía un conocimiento sustancialmente menor al que actualmente ha arribado la ciencia respecto a la enfermedad. En ese marco, no parece ser éticamente aceptable la inoculación de un virus a un sujeto sano sin conocer los mecanismos para mejorar y/o revertir el curso de la infección. Por otro lado, tomando en cuenta los ascensos en las curvas de contagios para la región durante el período relevado, difícilmente pueda justificarse la necesidad de provocar de modo voluntario una enfermedad cuya probabilidad de contraer era lo suficientemente alta. Es importante recordar también que este tipo de ensayos se planteaban fundamentalmente para estudios con vacunas. En la región, con diferentes niveles de avance en cada país en particular, hacia fines de 2020 ya se contaba con algunas vacunas aprobadas para uso de emergencia.
Por último, es preciso advertir que el presente estudio tiene varias limitaciones. Si bien se intentó realizar una amplia distribución de la encuesta, la proporción de comités participantes de la Argentina, y dentro de ella de la Ciudad Autónoma de Buenos Aires y la Provincia de Buenos Aires, es mucho mayor que el resto. Al mismo tiempo, esas dos jurisdicciones concentraron el mayor número de casos y volumen de investigaciones en COVID de Argentina, particularmente en los meses en los cuales se realizó la encuesta. Si bien han participado comités de varios países de Latinoamérica, el tamaño de la muestra no nos permite desagregar los resultados para hacer una comparación entre los mismos, así como no podemos considerar este estudio representativo de toda la región.
6. Conclusiones
Las respuestas de los CEI participantes sugieren que, a pesar de las recomendaciones y documentos previos generados a partir de experiencias recientes en la región, no se encontraban preparados de antemano para enfrentar situaciones de emergencia.
Indudablemente, la actuación de los CEI evidencia una rápida reacción frente al contexto reciente, a través de la instalación definitiva de nuevas capacidades y herramientas para la deliberación, toma de decisión y gestión de las evaluaciones éticas. Sin embargo, estas nuevas estructuras y procedimientos parecen haber resuelto los desafíos propios que la pandemia por COVID-19 ha impuesto, sin demostrar una vocación de respuesta permanente para las futuras situaciones de emergencia.
Como ha quedado demostrado, la probabilidad de ocurrencia de nuevas emergencias sanitarias, ya sea de tipo infeccioso o no, es muy alta, por lo que consideramos que las lecciones aprendidas a raíz de la pandemia actual, deberían capitalizarse como preparación para situaciones futuras.
Consideramos, en concordancia con el Consejo de Bioética de Nuffield, que la preparación y planificación adecuadas para emergencias son de vital importancia y son esenciales ya que pueden ayudar a evitar la emergencia o hacerla más manejable en caso que ocurra. Además contar con dicha preparación implica que es más probable que se cumplan los requisitos para que la investigación sea ética y valiosa (Nuffield Council on Bioethics, 2020).
Para ello debemos reformular la manera de pensar los problemas éticos hacia un abordaje global, con un enfoque preventivo. Si algo nos ha enseñado la pandemia es que las redes de colaboración entre los CEI deberían convertirse en una regla, por constituir una herramienta relevante para un análisis común de los dilemas éticos que supone investigar una enfermedad global, desconocida y potencialmente mortal. Gran parte de los problemas que fueron mencionados por los CEI participantes son susceptibles de hallar la solución en el intercambio de experiencias o evaluaciones conjuntas.
Entendemos que estas expresiones de deseo sólo resultan realizables en la medida que los CEI se vean fortalecidos, con apoyo concreto de los Estados (nacionales, regionales, provinciales, etc.), las entidades académicas y las áreas que gestionan la investigación en los servicios de salud públicos y privados.














