Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Sanidad Militar
versión impresa ISSN 1887-8571
Sanid. Mil. vol.68 no.3 Madrid jul./sep. 2012
https://dx.doi.org/10.4321/S1887-85712012000300004
Condiciones de transporte de medicamentos en misiones internacionales de las Fuerzas Armadas. Diseño de un estudio de estabilidad especifico para operaciones
Conditions of drugs transportation in international missions of the Armed Forces. Design of a specific stability study of operations
Zamanillo Sainz A.1, Verón Moros M.2, Juberías Sánchez A.3, Cabrera Merino J.I.3, Mañes Pradas J.P.4
1 Tcol. Farmacéutico. Inspección General de Sanidad. Jefatura de Apoyo y Ordenación Farmacéutica. Madrid. España.
2 Lda en Farmacia. Centro Militar de Farmacia de la Defensa. Madrid. España.
3 Tcol. Farmacéutico. Centro Militar de Farmacia de la Defensa. Burgos. España.
4 Tcol. Farmacéutico. Dirección de Sanidad del Ejército del Aire. Madrid. España.
Accesit del premio Fidel Pagés Miravé 2011
Dirección para correspondencia
RESUMEN
Introducción: El abastecimiento de los recursos sanitarios es una parte crítica del apoyo sanitario en las operaciones de nuestras Fuerzas Armadas. El transporte de medicamentos y productos sanitarios se realiza por vía aérea. La regulación del medicamento exige que las condiciones de almacenamiento y transporte se efectúen de modo que su calidad se mantenga íntegra durante el periodo de validez del mismo, por lo que un trasporte de calidad no debe generar riesgos sobre los medicamentos, derivados de exposiciones a elevados grados de calor, frío, humedad, otros factores negativos, microorganismos o plagas. Podremos caracterizar, por tanto, las condiciones ambientales asociadas a un transporte mediante la medición de la Temperatura y la Humedad Relativa.
Objetivo: Cualificación del transporte de medicamentos. Diseño de un Estudio de Estabilidad específico para Operaciones (EEO).
Material y métodos: Se efectúa una monitorización de los transportes efectuados al ROLE 2 E (Herat) durante un ciclo anual. Se utilizan Data logger: LOG 32 con rango de medición -40 a +70oC y 0 a 100% HR y programa para cálculo de los parámetros de cualificación de los envíos, para la cualificación y evaluación del transporte. Distintos aparatos de laboratorio y sus correspondientes métodos para el ensayo de estabilidad. Paquete estadístico SPSS versión 15 para el tratamiento de resultados.
Resultados: Las temperaturas máximas y mínimas registradas en los 18 transportes monitorizados, a lo largo de 13 meses, muestran valores que no rebasan los límites establecidos en el ensayo de estabilidad propuesto. La HR media se mantuvo, de manera habitual, durante el periodo monitorizado, en valores inferiores al 50%. Los resultados analíticos de los medicamentos sometidos al ensayo de estabilidad, basado en la aplicación de oscilaciones térmicas en diferentes ciclos, arrojan valores que se sitúan dentro de las especificaciones del producto terminado, no apreciándose diferencias significativas entre los productos testigo y los sometidos a variaciones térmicas, demostrándose que las oscilaciones de temperatura entre 2oC y 50oC establecidas para el ensayo, durante un periodo de 7 días, no afectan a las características de los medicamentos seleccionados en este estudio.
Conclusiones: Evaluadas las características ambientales del transporte durante un ciclo anual, no se aprecian diferencias estacionales destacables entre los diferentes envíos. Desde el punto de vista ambiental, el transporte de medicamentos a Role 2E (Herat), resulta cualificado, demostrándose la calidad del mismo. Todos los elaborados fabricados en el Centro Militar de Farmacia de la Defensa, seleccionados en este estudio y que han sido sometidos al nuevo ensayo de estabilidad, se mantienen dentro de las especificaciones, por lo que no se observa alteración en la calidad de los mismos. Para el control del transporte de medicamentos a las Misiones Internacionales, se considerarán condiciones seguras de transporte, oscilaciones térmicas comprendidas entre 2oC y 50oC durante al menos 7 días.
Palabras clave: Transporte de Medicamentos. Estabilidad. Misiones Internacionales.
SUMMARY
Introduction: The supply of medical materiel and pharmaceuticals is a critical part of medical support in our military operations. The transport of medical materiel and drugs is provided by Air. The drug regulation requires performed storage and transportation conditions so that its quality are maintained during the whole period of drug validity, so a quality transportation should not generate risks to drugs derived from high temperature, cold, humidity or other negative factors, such as microorganisms or pests. We characterize, therefore, the environmental conditions associated to the transport with the measurement of the temperature and relative humidity.
Objective: Qualification of drug transport. Design of a specific stability study to Operations (SSO).
Materials and Methods: Monitoring is performed for the drugs transport ROLE 2 E (Herat) during an annual cycle. Data logger are used: LOG 32 with measurement range -40 to +70 oC and 0 to 100% RH and program for calculating the parameters of qualified shipments for the qualification and evaluation of transport. Different laboratory equipments and their corresponding methods for stability testing. SPSS version 15 for the treatment of results.
Results: The maximum and minimum recorded temperatures in the 18 transports monitored, during 13 months, show values that not exceed the limits in the proposed test stability. Mean relative humidity was maintained on a regular basis during the period monitored, at values below 50%. The analytical results of the drugs tested against stability, based on the of fluctuations temperature application in different cycles, give values that are within the specifications of the finished product, without significant differences between control products and the products subjected to thermal variations, showing that the oscillations of 2 oC and 50 oC set for the trial, during a period of 7 days, do not affect the drugs characteristics selected in this study.
Conclusions: Have been evaluated environmental characteristics of transportation during an annual cycle, showing there are not remarkable seasonal differences between the various shipments. From the environmental standpoint, drugs transportation to Role 2 (Herat) is qualified. All medicines produced by the Military Pharmacy Center of Defense, choosen in this study and which have been subjected on the new stability test, remain within specification, by what alteration is not observed in the quality of the same ones. In order to control the drugs transport to the International Mission, temperature fluctuations between 2 oC and 50 oC during at least 7 days would be considered safe conditions.
Key words: Drug Transport. Stability. International Mission.
Introducción
El abastecimiento de los recursos sanitarios es una parte crítica del apoyo sanitario en las operaciones de nuestras Fuerzas Armadas. De las diversas operaciones en las que ha intervenido España, la misión en Afganistán puede considerarse, hasta la fecha, como la más compleja de todas. Es allí donde la participación del contingente español en la Fuerza Internacional de Asistencia para la Seguridad (ISAF), alcanzó en febrero de 2010, un número superior a los 1.500 militares, más 40 guardias civiles1. En la actualidad, se mantiene un Equipo de Reconstrucción Provincial, con acciones en apoyo a la seguridad y a la acción humanitaria, en colaboración con la Agencia Española de Cooperación Internacional para el Desarrollo, un Batallón de Maniobra en la Base de Qala e Naw, para apoyo a las cuatro provincias del Mando Regional Oeste y una Base de Apoyo en Herat.
El hospital español, desplegado en la Base de Herat, tiene capacidad para proporcionar atención sanitaria básica secundaria, alcanzando la categoría de Role 2 Reforzado (Role 2 Enhanced)2 según la clasificación de hospitales en la Doctrina Sanitaria de la OTAN.
Con el fin de mantener el nivel de medicamentos (stock) precisos para cubrir las necesidades del Role 2E, se tramitan las solicitudes de reposición, con una periodicidad que varía entre 10 y 15 días, a la Dirección Sanidad del Ejército del Aire, a través de la Sección de Logística Sanitaria del Mando de Operaciones del Estado Mayor de la Defensa.
El transporte de medicamentos y productos sanitarios a Zona de Operaciones se realiza por vía aérea, para lo que se dispone, normalmente, de dos vuelos mensuales. El avión empleado para transporte de mercancías es un "ILYUSHIN il 76" que despega de la Base Aérea de Torrejón y aterriza en el aeropuerto de Herat 24 horas después, incluyendo una parada de repostaje. El traslado hasta el avión y la distribución posterior, se lleva a cabo en vehículos terrestres, los envíos pueden sufrir algún periodo variable de almacenamiento en tránsito.
El transporte de medicamentos es una actividad crítica dentro del ciclo logístico. Las condiciones de las vías de comunicación, meteorológicas y de accesibilidad, tanto como el volumen, peso, condiciones de conservación de la carga y demás factores relacionados, confieren al transporte la importancia que posee en el apoyo sanitario en las Operaciones. La regulación del medicamento exige que las condiciones de almacenamiento y transporte se efectúen de modo que su calidad se mantenga íntegra durante el periodo de validez del mismo3, por lo que un trasporte de calidad no debe generar riesgos sobre los medicamentos, derivados de exposiciones a elevados grados de calor, frío, humedad, otros factores negativos, microorganismos o plagas4. Podremos caracterizar, por tanto, las condiciones ambientales asociadas a un transporte mediante la medición de la Temperatura y la Humedad Relativa.
Temperatura y su influencia en la calidad de los medicamentos
La cinética de degradación de los medicamentos está determinada por la temperatura5. Además de esta influencia directa, algunas formas farmacéuticas, como supositorios, óvulos o cremas, son bastante sensibles a elevaciones de temperatura6. Por otro lado, valores reducidos de este parámetro pueden causar una inestabilidad física del medicamento, como en el caso de las emulsiones, en las que es posible una degradación irreversible si se enfrían hasta alcanzar el punto de congelación de la fase acuosa5,7.
En un entorno no controlado, como puede ser el transporte, la posibilidad de variaciones de temperatura, durante su desarrollo, es elevada8, por lo que debe considerarse el posible efecto perjudicial de estas variaciones bruscas sobre sistemas cerrados como el acondicionado primario de los medicamentos. En estos casos son probables tanto la aparición de fenómenos de fatiga del material, debido a contracciones y dilataciones sucesivas del volumen interior y del material del envase5, como de inestabilidad física del medicamento9.
La exposición térmica del medicamento durante el almacenamiento y transporte, puede ser medida, registrada y expresada de diversas maneras; para ello se utilizan los siguientes parámetros: Temperatura Cinética Media (TCM), temperatura media (TM), temperaturas máxima y mínima de un periodo.
La TCM es una medición de la acumulación de estrés térmico a que se someten los productos durante un tiempo determinado. Se considera que, durante el periodo de tiempo establecido, el medicamento se ha almacenado a una temperatura constante cuyo valor es el de la TCM calculada, considerándose, por tanto, como la temperatura que determina los efectos del almacenamiento10. En el cálculo de la TCM (Figura 1) presentan un mayor peso las temperaturas máximas alcanzadas durante el periodo considerado.

Figura 1. Fórmulas para el cálculo de la TCM.
La temperatura media (TM) se corresponde con la media aritmética de las mediciones de temperatura efectuadas durante un periodo, la diferencia existente entre la TCM y la TM de un periodo dado estará determinada por la amplitud de las excursiones u oscilaciones de temperatura ocurridas en ese periodo.
La temperatura máxima y mínima de un intervalo determinado establecerán la máxima amplitud térmica del periodo establecido y será representativa del gradiente de temperatura soportado.
Humedad Relativa y su influencia en la calidad de los medicamentos
La humedad es una causa de la inestabilidad en los medicamentos ya que, además de facilitar el desarrollo microbiano, favorece las reacciones de los siguientes parámetros: hidrólisis y oxidación, siendo el oxígeno disuelto en agua más activo, incrementándose su actividad con la temperatura11.
La Humedad relativa (HR) es la relación existente entre la cantidad de agua contenida en un volumen de aire y la que contendría a saturación, a la misma temperatura12. La HR es, por tanto, un parámetro que se determina en función de la temperatura. La exposición de un medicamento a la humedad ambiental durante un intervalo de tiempo, puede ser determinada mediante el empleo de la HR media. La HR máxima y mínima del intervalo establecen la máxima amplitud registrada y el gradiente de humedad soportado.
El uso de materiales semipermeables13 en la confección de envases, puede afectar a la calidad de los medicamentos contenidos, según los valores de HR presentes en el ambiente. Así, valores elevados de HR incidirán en los sólidos envasados mediante modificación de sus propiedades físicas, como disminución de la dureza, facilitando el desarrollo microbiológico o posibilitando la producción de reacciones degradativas de hidrólisis. Por el contrario valores reducidos de HR, provocarán evaporación de líquidos y alteración de propiedades físicas, como aumento de la dureza, en algunos sólidos14.
Es necesario considerar que las variaciones periódicas de temperatura ambiental modifican la tensión de vapor del agua contenida en un departamento estanco, como en el caso de un blíster con comprimidos o cápsulas, y ello sería la causa de que se produzcan transferencias de agua del interior del medicamento a la cámara de aire y viceversa, con el consiguiente arrastre o alteración de componentes11.
Se puede considerar que la humedad ambiental influirá sólo en periodos de almacenamiento o transporte prolongado, debido a la barrera protectora proporcionada por el acondicionado primario del medicamento15; sin embargo, las fluctuaciones térmicas podrán influir en la acción de la humedad presente en el interior del envase primario.
Ensayos de estabilidad de medicamentos y transportes
Los ensayos de estabilidad previstos para la comercialización de medicamentos16, que no precisen cadena de frío, consideran la evaluación del comportamiento del medicamento almacenado en ambiente de 40oC y 75% de HR durante seis meses (condiciones aceleradas). Estas condiciones tienen como objetivo evaluar el efecto de cortos periodos de tiempo fuera de las condiciones de almacenamiento propuestas para el medicamento14. En el desarrollo de estos ensayos no se tiene en cuenta la influencia que las variaciones cíclicas de temperatura puedan presentar en la calidad del medicamento17.
Algunos autores e instituciones, plantean la necesidad de diseñar estudios de estabilidad que consideren la incidencia de los ciclos térmicos que puede sufrir el medicamento durante su periodo de vida11,17,18. En relación con el transporte, los siguientes aspectos, relacionados con posibles variaciones de temperatura durante su desarrollo, deben ser objeto de atención:
a) El proceso de transporte internacional puede efectuarse mediante una sucesión de condiciones climáticas diversas, considerando la división del mundo en zonas climáticas14,19.
b) Determinadas situaciones en el transporte son susceptibles de generar riesgos relacionados con oscilaciones térmicas15,20,21, tales como cargas en bodegas de aviones sin aislamiento térmico, abandono de cargas a la intemperie, trasporte en ambientes desérticos con variaciones térmicas importantes entre el día y la noche.
c) Vehículos y contenedores metálicos expuestos al sol pueden alcanzar importantes temperaturas en su interior6.
d) Contenedores cerrados es posible que generen condensaciones en su interior debido a variaciones de la humedad relativa con la temperatura5.
e) Medicamentos almacenados en vehículos durante largos períodos de tiempo, como en el caso de ambulancias, pueden sufrir una disminución del contenido del o los principios activos6,22,23.
En relación con las condiciones ambientales establecidas para estudios de estabilidad, aplicados a productos no refrigerados ni congelados, podemos considerar que el almacenamiento durante todo el ciclo de vida del medicamento, incluido transporte, será óptimo si se produce en las condiciones ambientales para ensayos de estabilidad a largo plazo (25oC ± 2oC y 60% ± 5% HR) y no se registran modificaciones por encima de las condiciones establecidas para estudios acelerados (40oC ± 2oC y 75% ± 5% HR), correspondientes a Zona climática II, en la que se incluye España12.
La exposición puntual y transitoria a las condiciones del ensayo acelerado no tendrá efectos sobre la estabilidad o calidad de estos medicamentos, ya que han tenido que demostrar que, en su exposición a una temperatura constante, regulada y controlada de 40oC, han mantenido sus características originales de calidad sin degradarse6.
Lo indicado hasta el momento, nos permite definir un entorno ambiental para efectuar la cualificación y evaluación de un transporte de medicamentos que no precisen cadena de frío:
a) El transporte se llevará a cabo con las debidas garantías si durante su desarrollo no se supera la temperatura definida en los estudios acelerados.
b) El transporte será mejor cuando las condiciones ambientales del mismo sean próximas a las establecidas para estudios a largo plazo.
c) Temperaturas cercanas a la congelación de fases acuosas se consideran inadecuadas, debido a sus efectos nocivos sobre las características físicas de algunos medicamentos.
d) Podemos establecer un entorno térmico seguro para el transporte cuyos límites se encuentren entre los 40oC y temperaturas superiores a la congelación del agua (0oC).
e) Debe procurarse la mínima producción de oscilaciones térmicas durante su desarrollo.
De acuerdo con lo anterior, podemos calificar el transporte, desde el punto de vista de los intervalos de temperatura en que se desarrolle, del siguiente modo:
a) Rango óptimo de temperatura: entre 5oC y 25oC.
b) Franjas superior e inferior mejorables: entre 25oC a 40oC y entre 5oC a 0oC respectivamente.
c) Condiciones no recomendables: Temperaturas superiores a 40oC e inferiores a 0oC.
Justificación del estudio
El transporte de medicamentos para el abastecimiento a misiones internacionales de las Fuerzas Armadas, genera la necesidad de controlar los riesgos asociados al mismo y asegurar que no afectará a la calidad de los medicamentos transportados. Los medicamentos que no requieren unas condiciones especiales de conservación (cadena de frío o congelación) pueden resultar expuestos a condiciones ambientales cambiantes derivadas de los medios de locomoción utilizados, periodos de espera y almacenamiento en tránsito, que pueden incidir negativamente en su calidad17.
Conocer las condiciones ambientales que se producen durante el transporte de medicamentos a una zona alejada del territorio nacional, nos permitirá determinar la calidad de los envíos efectuados y establecer la necesidad de ciertos ensayos, complementarios a la estabilidad de los medicamentos transportados, que aseguren su adecuado comportamiento durante el transporte.
Con el fin de evaluar la calidad del transporte, será preciso constatar las condiciones en que se desarrolla y establecer un perfil de los riesgos ambientales asociados al mismo; riesgos derivados de los valores de temperatura24 y HR alcanzados, así como las variaciones cíclicas de estos parámetros mostradas durante el desarrollo. Para ello, se procederá a monitorizar los envíos efectuados, mediante la medición periódica de la temperatura y humedad. Los ensayos de estabilidad complementarios considerarán los intervalos extremos de temperatura fijados para la cualificación del transporte (40oC y 0oC) y estarán basados en las oscilaciones ambientales registradas.
Objetivos
I. Evaluar calidad del transporte de medicamentos a la zona de operaciones en Afganistán.
II. Establecer un perfil térmico para la cualificación del transporte, estableciendo las condiciones extremas que proporcionen seguridad.
III. Proponer ensayos complementarios para evaluar la estabilidad y comportamiento de medicamentos sometidos a oscilaciones de temperatura y humedad. Diseño de un Estudio de estabilidad específico para operaciones (EEO).
IV. Definir las condiciones climáticas del los ensayos complementarios.
V. Evaluar la calidad de una selección de medicamentos, remitidos a operaciones, por formas farmacéuticas de interés, sobre los que se efectuarán los ensayos complementarios de estabilidad.
Material y métodos
Cualificación y Evaluación del transporte
Materiales
- Data logger: LOG 32 con rango de medición -40 a +70oC y 0 a 100% HR y capacidad de almacenamiento de datos 32 KB con captura cada 10 minutos. Se coloca en una caja que forma parte del pedido de medicamentos. El equipo se acompaña de un documento donde se consignan fecha y hora de preparación del envío y fecha y hora entrega en la farmacia de ROLE 2E (Herat), esto permite acotar la duración del transporte y la selección de los datos para efectuar la cualificación del transporte.
- Programa para cálculo de los parámetros de cualificación de los envíos. Se diseña una aplicación informática a medida en Visual Basic (VBA), con un sistema gestor de base de datos SGBD Microsoft Access, como entorno visual para el tratamiento de los datos. El sistema lleva a cabo la importación, soporte y gestión del cálculo de los parámetros, a través de filtros basados en acotaciones temporales de los datos registrados por data-logger (Figura 2). Estas acotaciones vendrán determinadas por la información contenida en los documentos de recogida de datos.
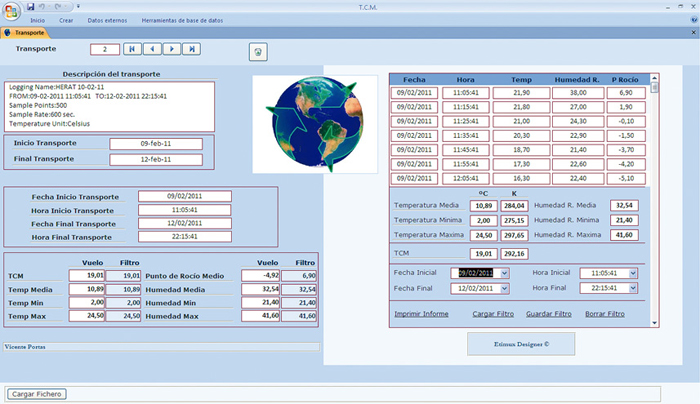
Figura 2. Programa para cálculo de los parámetros de los envíos.
Métodos
Parámetros de cualificación del envío: Se obtienen a partir de los registros obtenidos en cada transporte. Son los siguientes:
- Temperatura cinética media (TCM).
- Ta Media (TM).
- Intervalo Tmáx-Tmin. Los registros máximo y mínimo durante el periodo monitorizado (13 meses); determinan la máxima diferencia de temperatura asociada al transporte.
- HR media: Permite comparar junto a TCM, las condiciones de almacenamiento durante el transporte, con las condiciones de estabilidad aplicadas en zona climática II (España)16.
- HRmin-HRmáx: Máxima amplitud registrada durante el transporte. Los registros máximo y mínimo, durante el periodo monitorizado (13 meses), determinan la máxima diferencia de humedad asociada al transporte.
Ensayo de estabilidad (EEO).
Materiales
- Cámara frigorífica Westinghouse.
- Estufa de cultivo Selecta Modelo 2000206.
- Data logger para registro de las condiciones en cada ciclo.
- Medicamentos sometidos a ensayos: Se seleccionan tres lotes de cinco elaborados representativos de las diferentes formas farmacéuticas fabricadas y transportados a operaciones: Antigripales DEF comprimidos, Doxiciclina DEF cápsulas de gelatina dura, Metamizol Magnésico DEF cápsulas de gelatina dura, Sulfadiazina de plata DEF crema y Bronquial DEF solución.
- Equipo para ensayo de disolución Vankel mod. 7000 con siete cubetas de 900 ml y agitación por paletas tipo 2 USP, junto a baño termostático con espectrofotómetro UV/vis Varian Cary asociado.
- Recipiente estanco, con solución de azul de metileno y bomba de vacío de asociada, para determinación estanqueidad.
- Espectrofotómetro UV/vis Varian Cary 2000.
- Equipo Agilent modelo 1200 para cromatografía líquida de alta resolución (HPLC).
- Peachímetro automático, Crison con electrodo de vidrio.
- Densímetro electrónico, Antor Para.
- Balanza de precisión Metler Toledo AT 200.
- Durómetro automático Pharmatest mod. WHT 11.
- Electronic Digital Caliper marca Comecta.
- Probeta graduada para medición de volumen, Pobel.
Métodos
- Ensayo de estabilidad para transporte: Se diseña un ensayo de estabilidad basado en los datos reportados por la monitorización de los envíos y bibliografía consultada. Debido a la escasa duración del envío, la incidencia de la HR en las condiciones ambientales será muy reducida, por lo que el perfil ambiental del ensayo se basa en variaciones cíclicas de temperatura. Se comprobará la influencia de estas variaciones sobre la calidad de los medicamentos sometidos a ensayo.
• Condiciones ambientales del ensayo: Se propone una oscilación de temperatura comprendida entre 2oC y 50oC (±2oC). La temperatura inferior evitará congelaciones de la fase acuosa de los productos ensayados, la temperatura superior se corresponde con los ensayos de estabilidad en condiciones aceleradas para cualquier parte del mundo14. Se monitorizan las temperaturas de almacenamiento con un data logger que acompaña a los medicamentos sometidos a investigación.
• Número de ciclos: Se establecen ciclos, con una duración de 24 horas, en los que se alternan la temperatura máxima (50oC±2oC) y mínima (2oC±2oC), establecidas para el ensayo, durante un número de días que comprenda, al menos, la duración media del transporte más un 50%, por posibles retrasos25. Se propone un estudio de 7 ciclos de 24h. Se utilizan 15 muestras de diferentes medicamentos en este ensayo.
• Parámetros evaluados: Al término de la sucesión de estos ciclos se efectúan las siguientes determinaciones a los medicamentos sometidos a ensayo:
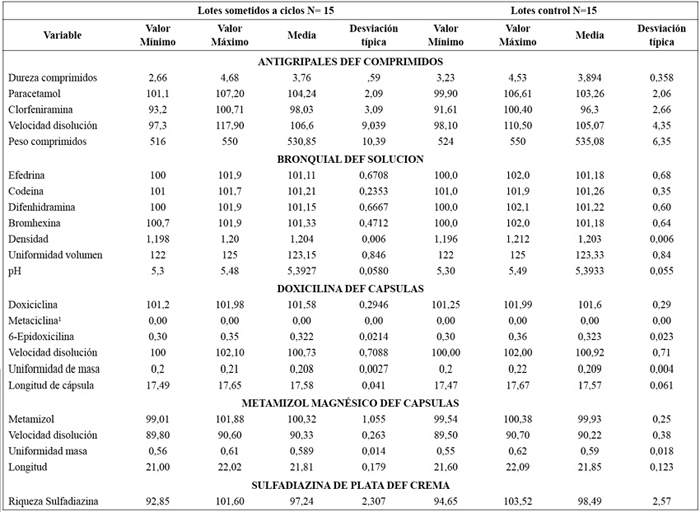
Uniformidad de contenido en principio activo, Uniformidad de masa, Uniformidad de volumen, Longitud de la cápsula, Dureza de comprimidos, Estanqueidad del envase, Ensayo de disolución en formas orales sólidas, pH en soluciones, Contenido en sustancia activa (crema), Cambios organolépticos y Alteraciones físicas visibles. Se realizan las mismas determinaciones a medicamentos del mismo lote (n=15) no sometidos a las condiciones del ensayo, como grupo testigo de control.
• Criterio de aceptación: En los medicamentos evaluados no deben aparecen cambios significativos, determinados por la pérdida de las especificaciones del producto, que se recogen en la Tabla 1.
Tabla 1. Criterios de aceptación de las especificaciones. 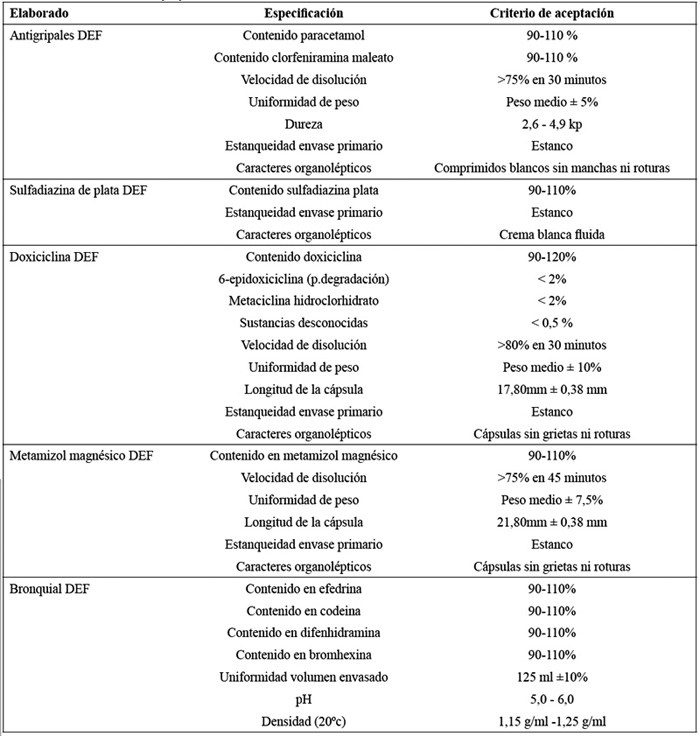
- Uniformidad de contenido de la sustancia activa en el producto terminado: Se utiliza el método descrito en la Real Farmacopea Española26. Los principios activos se determinarán de acuerdo a la técnica descrita en la monografía correspondiente: Paracetamol, Efedrina, Codeína, Bromhexina, Difenhidramina, Clorfeniramina maleato, Metamizol magnésico. Doxiciclina y sus sustancias relacionadas según Farmacopea de Estados Unidos27.
- Uniformidad de masa (comprimidos y cápsulas): Según método descrito en la Real Farmacopea Española28.
- Ensayo estanqueidad envases: Los envases a ensayar se introducen en solución de azul de metileno al 1% y se hace vacio. Observar que la solución de azul de metileno no se ha introducido en el interior del envase.
- Ensayo de disolución (comprimidos y cápsulas): Se utiliza el método descrito en la Real Farmacopea Española29.
- Contenido en sustancia activa Sulfadiazina de plata (crema): Método descrito en la Farmacopea de Estados Unidos30.
Tratamiento estadístico de los resultados
Para el tratamiento de los datos se utilizó el paquete estadístico "Statistical Package for the Social Sciences" (SPSS) versión 15. Se realiza la comparación de medias con la prueba "t" de Student para muestras relacionadas.
Resultados
Los registros correspondientes a la monitorización ambiental de los envíos de medicamentos a Herat, durante los 13 meses que comprende el estudio, se reflejan en la Tabla 2.
Tabla 2. Condiciones del transporte. 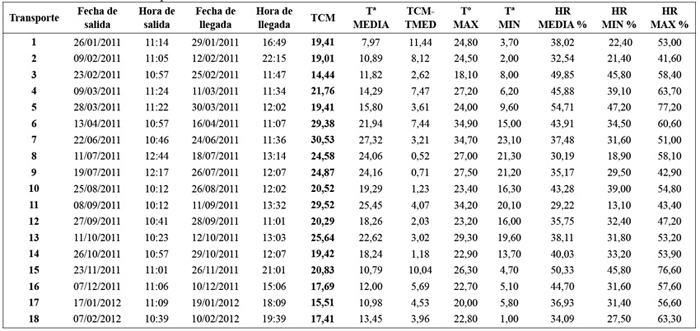
Las condiciones de transporte, determinadas por la temperatura cinética media de cada uno de los envíos, se reflejan gráficamente en la Figura 3, donde se comparan con las zonas de riesgo determinadas por la temperatura soportada durante el transporte.
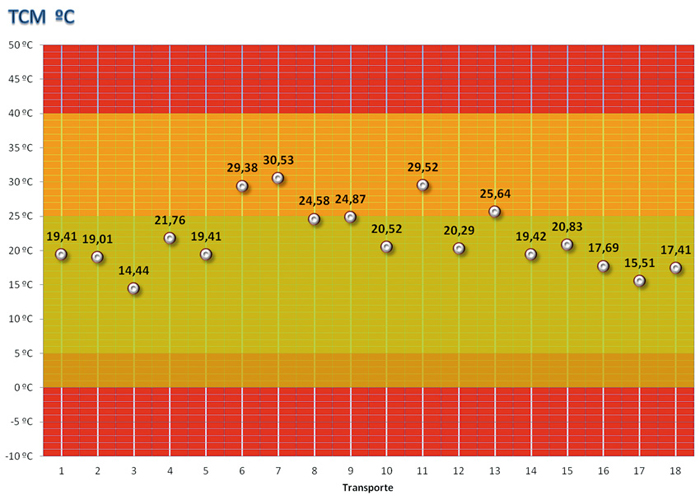
Figura 3. Seguimiento de la TCM en cada uno de los transportes.
En la Tabla 3 se recogen los datos descriptivos de los resultados de las variables estudiadas en los medicamentos sometidos al estudio de estabilidad propuesto, junto a los resultados de esos mismos parámetros, en los productos testigo no sometidos a variaciones cíclicas de temperatura.
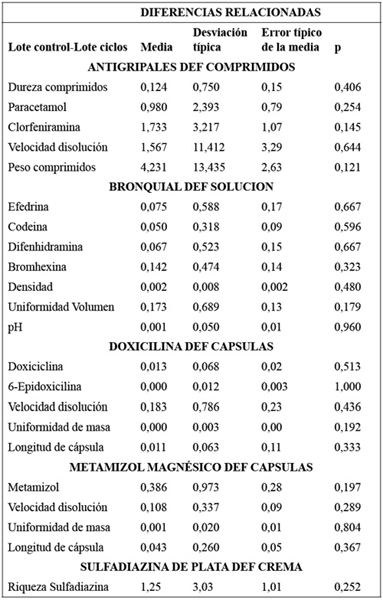
En la Tabla 4 se muestra la comparación de datos apareados entre estos dos grupos del estudio para los cinco elaborados objeto de este estudio.
Los envases de los medicamentos evaluados, mantuvieron sus condiciones de estanqueidad. Ningún medicamento analizado mostró pérdida de sus características organolépticas, descritas en Tabla 1.
Discusión
Las temperaturas máximas y mínimas registradas en los 18 transportes monitorizados, a lo largo de 13 meses, muestran valores que no rebasan los límites establecidos en el ensayo de estabilidad propuesto para transporte de medicamentos: 2oC-50oC (±2oC). Las condiciones de este ensayo pueden considerarse, por tanto, más agresivas que las determinadas en el transporte (Tabla 2).
En este estudio no se han considerado las otras dos Misiones Internacionales en las que participan nuestras Fuerzas Armadas: Operación Libre Hidalgo en Líbano (Role 1) y Operación Atalanta en aguas del Océano Índico (Role 2 embarcado), debido a la similitud de zonas climáticas por las que transcurre el transporte aéreo, que suministra los medicamentos a ambas Áreas de Operaciones, respecto a la misión desarrollada en Herat.
La TCM de cada uno de los envíos arroja valores próximos a la temperatura de almacenamiento establecida para condiciones a largo plazo, siendo el valor máximo registrado 30,53oC y el mínimo 14,44oC (Tabla 2 y Figura 3). La mayoría de las TCM calculadas (14 resultados sobre 18) se sitúan en el entorno óptimo para transporte (5oC-25oC). Cabe destacar que no se aprecian diferencias importantes en el valor de la TCM relacionadas con el periodo estacional durante el que se efectúa el transporte, este hecho muestra la reducida exposición a condiciones térmicas adversas durante el desarrollo del envío.
En ningún momento se alcanzaron temperaturas de congelación que pudieran afectar a soluciones o fases acuosas de los medicamentos transportados. Tampoco se alcanzó la temperatura de 40oC±2oC establecida para ensayos acelerados. Estos resultados muestran unas condiciones de almacenamiento, durante el transporte, que evitan las temperaturas extremas y en el entorno de los ensayos propuestos por la ICH Q1A16, apareciendo como factor determinante de la calidad, las oscilaciones de temperatura que pudieran producirse durante su desarrollo. En este sentido, cabe destacar las escasas diferencias existentes entre TCM y Temperatura media en la mayoría de los vuelos; no obstante, la existencia de oscilaciones térmicas se hace patente en los vuelos 1, 2, 4 y 15, donde la diferencia térmica (TCM-Ta media) obtuvo un valor superior al 50 % del valor de la temperatura media del transporte (Tabla 2). Las condiciones registradas son indicativas de la calidad del transporte efectuado hasta ROLE 2-E (Herat).
La HR media se mantuvo, de manera habitual, durante el periodo monitorizado, en valores inferiores o próximos al 50% (Tabla 2). La máxima HR alcanzada, llegó a un 77,2% en el transporte número 5, cuya HR media se situó en 54,71%; estas condiciones son menos agresivas que las establecidas para ensayos a largo plazo. De los datos indicados se deduce la baja influencia de la HR en las condiciones ambientales de los envíos de medicamentos a Afganistán. No obstante, la influencia de este parámetro, como condicionante esencial de la calidad del transporte, debe ser considerada en aquellos transportes de prolongada duración y entono ambiental con valores elevados de HR, tal es el caso del transporte marítimo de medicamentos.
Los resultados analíticos de los medicamentos sometidos al ensayo de estabilidad, basado en la aplicación de oscilaciones térmicas en diferentes ciclos, arrojan valores que se sitúan dentro de las especificaciones del producto terminado (Tabla 1 y Tabla 3), no apreciándose diferencias significativas en las comparación de las medias (P>0,05) de las variables analizadas entre los productos testigo y los sometidos a variaciones térmicas, demostrándose que las oscilaciones de temperatura entre 2oC y 50oC establecidas para el ensayo, durante un periodo de 7 días, no afectan a las características de los medicamentos seleccionados en este estudio (Tabla 4). Al margen de los resultados satisfactorios obtenidos en los elaborados seleccionados en este estudio, se puede valorar la implantación de un estudio de estabilidad basado en las oscilaciones térmicas de este trabajo y que sea de aplicación, de modo complementario a los estudios de estabilidad que se vienen realizando, a los elaborados producidos por los Servicios Farmacéuticos de la Defensa, con el fin de establecer una horquilla de seguridad térmica aplicable a los envíos de medicamentos. En este sentido, algunos autores17,31 proponen el diseño de documentos de transporte, basados en estudios de estabilidad que comprendan variaciones térmicas cíclicas aplicadas a los medicamentos objeto de transporte, que establezcan los límites de temperatura y duración del transporte, conforme a los datos ambientales del entorno de la distribución.
Conclusiones
El transporte de medicamentos al Hospital español en Herat (Afganistán), evaluado en este estudio, presenta condiciones ambientales que se aproximan a las establecidas para los estudios a largo plazo para la Zona Climática a la que pertenece España.
Evaluadas las características ambientales del transporte durante un ciclo anual, no se aprecian diferencias estacionales destacables entre los diferentes envíos. Desde el punto de vista ambiental el transporte resulta cualificado, demostrándose la calidad del mismo.
Todos los elaborados fabricados en el Centro Militar de Farmacia de la Defensa, seleccionados en este estudio y que han sido sometidos al nuevo ensayo de estabilidad diseñado, se mantienen dentro de las especificaciones de calidad establecidas, sin mostrar ningún cambio significativo en los parámetros analizados.
Para el control del transporte de medicamentos a las Misiones Internacionales de nuestras Fuerzas Armadas, se considerarán condiciones seguras de transporte, oscilaciones térmicas comprendidas entre 2oC y 50oC durante al menos 7 días.
Agradecimientos
Los autores de este trabajo quieren expresar su agradecimiento a las siguientes personas colaboradoras en diversas tareas:
• D. Juan Antonio Álvarez Muñoz (Dpto. Control de Calidad - CEMILFARDEF - Burgos)
• D. Vicente Portas Rodríguez (Dpto. Informática - CEMILFARDEF - Burgos)
• D.a Rosa M.a Herguedas Ramos (Dpto. Control de Calidad - CEMILFARDEF - Burgos)
• D.a Susana Pérez Muñoz (Dpto. Control de Calidad - CEMILFARDEF - Burgos)
• D.a Juana González Blanco (Dpto. Control de Calidad - CEMILFARDEF - Madrid)
• D. Luis García Sierra (Dpto. Control de Calidad - CEMILFARDEF - Madrid)
• D.a Lourdes Ferreiro Carrillo (Dpto. Control de Calidad - CEMILFARDEF - Madrid)
• D.a Carmen Díaz Nagueruela (Dpto. Control de Calidad - CEMILFARDEF - Madrid)
• Igualmente a los farmacéuticos militares que han sido desplegados en la Farmacia del ROLE 2 español en Herat (Afganistán) durante la realización del presente trabajo.
Bibliografía
1. Documentos del Foro de la Sociedad Civil. No 3. Feliu Ortega, L. Las Misiones de las Fuerzas Armadas Españolas en el Exterior. Octubre 2010. [ Links ]
2. North Atlantic Treaty Organization (NATO). Nato Standardization Agency (NSA). Allied Joint Medical Support Doctrine - AJP-4.10. February 2002. [ Links ]
3. Ley 29/2006, de 26 de julio, de garantías y uso racional de medicamentos y productos sanitarios. BOE número 178. Artículo 70. [ Links ]
4. Generalitat de Catalunya. Departament de Salut. Direcció General de Recursos Sanitaris. "Guía de Buenas Prácticas en el Transporte de Medicamentos". Septiembre 2005. [ Links ]
5. Salazar, R. "Estabilidad de medicamentos". Asociación Española Farmacéuticos de la Industria (AEFI). Sección Catalana. Barcelona 1998: 27. [ Links ]
6. Agencia Española de Medicamentos y Productos Sanitarios. Comunicación de Seguridad. Información sobre el buen uso de los medicamentos en caso de ola de calor. 22 de junio de 2011. [ Links ]
7. European Medicines Agency. EMA/INS/GMP/638479/2010. 19 October 2010. Concept paper on storage conditions during transport. [ Links ]
8. SANTÉ CANADA. Inspectorat de la Direction générale des produits de santé et des aliments. Lignes directrices concernant le contrôle de la température des médicaments pendant l'entreposage et le transport. GUI-0069. Le 28 janvier, 2011:9. [ Links ]
9. Salazar, R. "Estabilidad de medicamentos". Asociación Española Farmacéuticos de la Industria (AEFI). Sección Catalana. Barcelona 1998: 28. [ Links ]
10. Gallardo, C, Rojas, JJ, Florez, O. "La temperatura cinética media en los estudios de estabilidad a largo plazo y almacenamiento de los medicamentos". Universidad de Antioquia, Medellín (Colombia). Vitae, revista de la Facultad de Química farmacéutica 2004;11(1):67-72. [ Links ]
11. Salazar, R. "Estabilidad de medicamentos". Asociación Española Farmacéuticos de la Industria (AEFI). Sección Catalana. Barcelona 1998: 24. [ Links ]
12. Salazar, R. "Estabilidad de medicamentos". Asociación Española Farmacéuticos de la Industria (AEFI). Sección Catalana. Barcelona 1998: 25. [ Links ]
13. MatWeb. Material Property Data. www.matweb.com. [ Links ]
14. Torres Suarez AI, Gil Alegre ME. Monografías de AEFI (Asociación Española de Farmacéuticos de Industria). 2004. "Estabilidad de medicamentos. Requisitos de los estudios según la normativa actual". [ Links ]
15. Taylor, J. Recommendations on the control and monitoring of storage and transportation temperatures of medicinal products. The Pharmaceutical Journal 2001;267:128-131. [ Links ]
16. European Medicines Agency. ICH Topic Q1A (R2). Stability Testing of new Drug Substances and Products. August 2003. [ Links ]
17. Lucas, TI, Bishara, RH, Seevers, RH. "Stability program for the distribution of drug products". Pharmaceutical Technology. July 2004: 68-73. [ Links ]
18. European Medicines Agency. Submission of comments on Concept paper on storage conditions during transport (EMA/INS/GMP/638479/2010). 28 february 2011. [ Links ]
19. Torres Suarez AI, Gil Alegre ME. "Globalización de los requisitos para la comercialización de medicamentos: importancia de la humedad ambiental en el diseño de los estudios de estabilidad": An. R. Acad. Nac. Farm.; 2005(71):111-126. [ Links ]
20. Arribas, B, Caro, F, Del Río LA. "Cualificación de cajas de embalaje en envíos de producto farmacéutico. Cualificación de embalaje". Industria Farmacéutica, 157:56-59. [ Links ]
21. Carré, A, Iglesias, A. "Nuevas necesidades de transporte. Nuevas respuestas". Farmaespaña Industrial, 2011(41):70-71. [ Links ]
22. Geddes, D. "Medications carried in ambulances are not always stored at proper temperatures, study finds". UPSTATE Medical University. February 19, 2003. [ Links ]
23. Gammon, DL, Su S, Jordan J, Patterson R, Finley PJ, Lowe C, Huckfeldt R. Alteration in prehospital drug concentration after thermal exposure. Am J Emerg Med 2008 ;26(5):566-573. [ Links ]
24. SANTÉ CANADA. Inspectorat de la Direction générale des produits de santé et des aliments. Lignes directrices concernant le contrôle de la température des médicaments pendant l'entreposage et le transport. GUI-0069. Le 28 janvier, 2011:6. [ Links ]
25. SANTÉ CANADA. Inspectorat de la Direction générale des produits de santé et des aliments. Lignes directrices concernant le contrôle de la température des médicaments pendant l'entreposage et le transport. GUI-0069. Le 28 janvier, 2011:5. [ Links ]
26. Real Farmacopea Española 3a Edición 2005. Agencia Española de Medicamentos y Productos Sanitarios (Ministerio de Sanidad y Consumo): 258. [ Links ]
27. United States Pharmacopoeia/National Formulary. USP 31/NF 26. Edición Española 2008: 2205-2206. [ Links ]
28. Real Farmacopea Española 3a Edición 2005. Agencia Española de Medicamentos y Productos Sanitarios (Ministerio de Sanidad y Consumo): 257-258. [ Links ]
29. United States Pharmacopoeia/National Formulary. USP 31/NF 26. Edición Española 2008: 251-254. [ Links ]
30. United States Pharmacopoeia/National Formulary. USP 31/NF 26. Edición Española 2008: 3579-3580. [ Links ]
31. Kevin O'Donnell "Mean Kinetic Temperature Storage vs. Shipping and the Vagaries of Regulatory Requirements" Contract Pharma 2008; July/August:30 [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
azamsai@oc.mde.es
Recibido: 28 de junio de 2012
Aceptado: 8 de julio de 2012