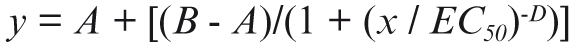INTRODUCCIÓN
La ricina es una toxina muy potente que se extrae de las semillas de la planta Ricinus communis de la familia Euphorbiaceae. Esta toxina actúa bloqueando la síntesis proteica, con resultado de muerte celular, lo que conduce al fallo multiorgánico y, finalmente, la muerte entre las 36-72 horas posteriores a la exposición, dependiendo de la ruta de exposición, que puede ser ingestión, inhalación e inyección1. En la semilla, la ricina se encuentra asociada con una lectina, la aglutinina de Ricinus communis (RCA-I o RCA120), que presenta actividad hemaglutinante con una toxicidad mucho menor que la ricina2. La similitud entre las cadenas polipeptídicas de ambas toxinas es del 84-93%. Esto provoca que, en muchas técnicas diagnósticas, sobre todo inmunológicas, haya una reacción cruzada entre ambas toxinas, obteniéndose falsos positivos con la aglutinina3.
La consideración del uso de ricina como arma química se inició en 1918 en la I Guerra Mundial, cuando programas militares investigaron la viabilidad de bombas de diseminación de ricina mediante aerosoles (recibiendo el nombre de Componente W). Durante la II Guerra Mundial, Estados Unidos y Gran Bretaña trabajaron juntos para el desarrollo de la denominada “Bomba W”. Parece que fue también utilizada en el asesinato del periodista búlgaro Georgi Markov en Gran Bretaña en 1978, utilizando un paraguas modificado para su administración por inyección4,5. En la década de los 80 hubo sospechas de su uso como arma por parte de Iraq. Desde 1995 a la actualidad se han producido distintos intentos de asesinato con ricina a distintos funcionarios y cargos públicos, fundamentalmente en forma pulverulenta dispuesta dentro de un sobre. Por ejemplo, entre los años 2003 y la actualidad, fueron enviadas cartas con ricina a la Casa Blanca6. También ha sido encontrada en grupos relacionados con organizaciones terroristas1.
La mejor defensa ante un incidente con agentes de guerra biológica consiste en evitar la exposición, lo que implica la necesidad, al menos, de una detección cercana al tiempo real de los niveles presentes de dichos agentes durante el ataque. Una detección temprana y rápida tras la exposición es además una herramienta muy eficaz para reducir la morbilidad y mortalidad asociada a la exposición de la toxina.
Para dar una respuesta rápida y eficiente ante una posible amenaza para la Salud Pública Nacional y desactivar en un tiempo mínimo aquellas falsas alarmas que afectan a la Seguridad Ciudadana, se creó la Red de Laboratorios de Alerta Biológica (RELAB) mediante Orden PRE/305/2009, de 10 de febrero. La RELAB presta apoyo al Gobierno de la Nación, como infraestructura científico-técnica especializada del Sistema Nacional de Conducción de Situaciones de Crisis. La RELAB ha establecido un mecanismo de comunicación ágil y eficaz de las alertas y/o amenazas de origen biológico que se puedan producir con las autoridades en cada caso competentes para esta labor y, muy en especial, con las Fuerzas y Cuerpos de Seguridad del Estado y Autonómicos y con el Centro de Coordinación de Alertas y Emergencias Sanitarias del Ministerio de Sanidad, Servicios Sociales e Igualdad.
Dentro de la RELAB, el Área de Defensa Biológica del Instituto Nacional de Técnica Aeroespacial “Esteban Terradas” (INTA)-Campus la Marañosa, es laboratorio de referencia.
El principal objetivo de este trabajo es el diseño y la realización de un protocolo de diagnóstico rápido de detección e identificación de ricina en las muestras sospechosas.
MATERIAL Y MÉTODOS
Muestra
Las muestras analizadas sospechosas de contener ricina normalmente son de naturaleza pulverulenta, cuando se presentan en estado sólido, o bien muestras líquidas.
La muestra tomada por los Cuerpos y Fuerzas de Seguridad implicados es enviada al laboratorio de referencia siguiendo una cadena de custodia según el protocolo establecido por la RELAB.
Las muestras se reciben y se preparan para su análisis de acuerdo a procedimientos normalizados del laboratorio.
Métodos de análisis
El protocolo de análisis que hemos desarrollado consta de dos tipos de diagnóstico, uno inmunológico y otro proteico.
Diagnóstico inmunológico
Imnunoensayo
Se realiza mediante un inmunoensayo tipo ELISA7 (Enzyme-Linked ImmunoSorbent Assay: Ensayo Inmunoabsorbente Ligado a Enzimas) tipo sándwich. Esta técnica de ELISA consta de varias etapas:
Tapizado: un anticuerpo de captura (anticuerpo específico de ricina) es inmovilizado en los pocillos de una placa multipocillo, formato 96 pocillos (Nunc MaxiSorp® 96 well plate), tras su adición en los pocillos e incubación durante aproximadamente 12 horas a 4 °C.
Bloqueo: con Albúmina de Suero Bovino (BSA) al 0,05 % (p/v) en tampón fosfato salino pH 7,4 (PBS) incubando la placa a 37ºC durante 1 hora. En este punto, para disminuir el tiempo de respuesta del laboratorio, las placas son almacenadas para su posterior uso, continuando, entonces, el inmunoensayo en el paso siguiente. Para esto, las placas han de ser preparadas y almacenadas de la siguiente manera: las placas se secan completamente en una cabina de citostáticos, se sellan con papeles de acetato adhesivo especiales para placas multipocillo de 96 pocillos, y se almacenan a 4ºC hasta un año.
Adición por triplicado de la muestra y de los controles. Como controles positivos se realizan dos curvas, una curva patrón de ricina en concentraciones decrecientes de 1 µg/mL a 500 ng/mL y una segunda curva control que consiste en tres concentraciones de ricina incluidas en la curva anterior a las que se le añade 10 % de muestra. Como control negativo se utiliza BSA, una proteína globular con un peso molecular similar a la ricina. La placa se incuba a 37 °C durante 1 hora, en agitación orbital.
Adición del anticuerpo de detección (anticuerpo específico de ricina, marcado con una enzima (peroxidasa) o con biotina) e incubación a 37 °C durante 1 hora, en agitación orbital.
En el caso de que el anticuerpo esté marcado con biotina, adición de estreptavidina-peroxidasa e incubación a 37°C durante 30 minutos, en agitación orbital.
Adición, como sustrato de la peroxidasa, de orto-fenilendiamina (OPD) (0,5 µg/mL en tampón citrato-fosfato, añadiendo el peróxido de hidrógeno 30 % a la solución de OPD, en proporción 1/2000). Se incuba la placa de 5 a 10 minutos a temperatura ambiente, hasta desarrollo de color.
Adición de ácido sulfúrico 2N para detener la reacción.
Lectura de la absorbancia a 490 nm (A490nm).
En todas las etapas, el volumen añadido a los pocillos es 100 µL/pocillo, excepto en el caso del ácido sulfúrico, en el que se añaden 50 µL/pocillo. Entre las diferentes etapas del inmunoensayo previas a la adición del sustrato, se realiza una fase de lavado, con tampón fosfato salino (PBS), para eliminar el excedente.
Los anticuerpos utilizados son anticuerpos monoclonales in house. El uso de anticuerpos monoclonales garantiza la reproducibilidad del ensayo.
La manipulación de la muestra ha de hacerse en la cabina de citostáticos, al menos hasta la fase de adición del anticuerpo de detección.
Optimización del ensayo
Sensibilidad: Para mejorar la sensibilidad se modifican el marcado del anticuerpo de detección en el ELISA anteriormente descrito: Se utiliza en un caso el marcado con biotina y en el otro caso el marcado con peroxidasa, y se realizan ambos ensayos en paralelo.
Desarrollo de placas previamente preparadas y almacenadas: Para reducir el tiempo de respuesta del laboratorio tras la recepción de una muestra sospechosa de contener ricina, se utilizan placas previamente tapizadas y bloqueadas almacenadas a 4ºC que permitan iniciar el inmunoensayo en etapas avanzadas.
Tratamiento estadístico de los resultados
La cuantificación de ricina se calcula partiendo de los valores de absorbancia a una longitud de onda de 490 nm, obtenidos en el ensayo de ELISA. Se representan los valores de absorbancia medida a 490 nm frente a su correspondiente concentración de ricina conocida. Las curvas obtenidas se ajustan a una ecuación logística de cuatro parámetros (4 Parameter Logistic, 4PL) según la siguiente fórmula:
Siendo y la A490nm, A la A490nm mínima, B la A490nm máxima, x la concentración, EC50 la concentración que produce un 50% de A490nm máxima y D la pendiente del punto de inflexión de la curva sigmoidal.
Se define como límite de sensibilidad el valor más bajo de la curva que difiere estadísticamente del valor del blanco (mediante t-Student). Los valores de las muestras superiores al valor mínimo establecido se interpolan en la curva para obtener su valor teórico de concentración.
El tratamiento estadístico se realiza con el software GraphPad Prism 5.
Diagnóstico proteico
El diagnóstico proteico se realizó mediante la técnica de SDS-PAGE8) (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis). Esta técnica permite determinar el tamaño y el número de cadenas polipeptídicas de cada una de las proteínas que pudiera contener la muestra. De este modo, un resultado positivo obtenido en el ELISA es confirmado a través de su estructura proteica, confirmándose así los resultados por dos técnicas diagnósticas, y eliminándose así también los falsos positivos que pudieran encontrarse. Para ello se realiza este ensayo en condiciones tanto reductoras como no reductoras. Las muestras son previamente tratadas y mezcladas con un tampón Laemmli, en una cabina de citostáticos. Para las condiciones reductoras se añade β-mercaptoetanol. Las muestras son hervidas a 90 °C durante 10 minutos y cargadas en geles de poliacrilamida 4-20 %, 24 µL/pocillo, de tal manera que esté incluido todo el rango de proteínas que pudiera haber en la muestra, desde las de menor peso molecular a las de mayor peso molecular. Se utilizan geles Criterion™ TGX™ (Tris-Glycine eXtended) precast de Biorad. Para la visualización de los geles, se utiliza un tinte fluorescente (Oriole™ Fluorescent Gel Stain de Bio-Rad), y tras 90 minutos de incubación a temperatura ambiente, en agitación orbital y en cabina de gases, se visualizan los geles en un transiluminador, obteniéndose así el perfil de las diferentes bandas proteicas que pudiera haber en la muestra.
En este ensayo se utiliza como control positivo ricina y como control negativo proteína aglutinina, con la que la ricina comparte gran similitud estructural, siendo inmunológicamente difícil de discriminar. La muestra se carga por duplicado tanto en condiciones reductoras como en condiciones no reductoras así como el estándar de peso molecular.
RESULTADOS
Ante una alerta/amenaza biológica, la Unidad de Gestión (UG) de la RELAB activa al laboratorio responsable, iniciándose así el protocolo de actuación. La muestra se analiza con máxima prioridad y los resultados obtenidos se comunican a la UG-RELAB que gestiona la información entre los órganos concernientes.
Diagnóstico inmunológico
La sensibilidad obtenida en el ensayo utilizando el marcado con biotina fue de 0,23 ng/mL mientras que el ensayo en el que el marcado utilizado fue directamente la enzima peroxidasa, mostró una sensibilidad de 0,49 ng/mL. (Figura 1) El ensayo que utiliza el marcado con biotina, supone un incremento en el tiempo de ensayo de aproximadamente 1,5 horas respecto al ensayo que utiliza como marcado la peroxidasa (Tabla 1).
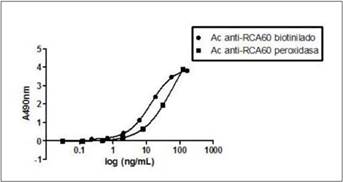
Figura 1 Curvas logísticas según modelo 4PL. La curva logística correspondiente a los anticuerpos marcados con biotina (•) presenta una r2 = 0,9998, EC50=13,57 y una sensibilidad de 0,23 ng/mL. La curva logística correspondiente a los anticuerpos marcados con peroxidasa (■) presenta una r2 = 1, EC50=64,37, una sensibilidad de 0,249 ng/mL y un mayor rango dinámico que la curva correspondiente a los anticuerpos marcados con biotina.
Tabla 1 Resumen de los resultados de los ensayos realizados en la optimización del ensayo ELISA para la determinación de ricina en muestras sospechosas.
| Tipo de Marcaje | Tiempo de ensayo | Placas pre-tapizadas y pre-bloqueadas | Sensibilidad (ng/mL) |
|---|---|---|---|
| Biotina | Tapizado (+/- 12 horas) + ensayo (7 horas) | 5 horas | 0,23 |
| Peroxidasa (HRP) | Tapizado (+/- 12 horas) + ensayo ( 5,5 horas) | 3,5 horas | 0,49 |
Diagnóstico proteico
La utilización de los geles Criterion™ TGX™ precast, que logran una separación electroforética en 30 minutos así como el revelado con el tinte fluorescente tipo Oriole, permite obtener una caracterización electroforética de la muestra en 3 horas. Además, el uso de dicho tinte fluorescente permite visualizar una concentración proteica de hasta 1 ng/pocillo de proteína.
La ricina presenta un peso molecular de unos 60 - 66 KDa. En el ensayo SDS-PAGE, la ricina muestra en condiciones no reductoras, una sola banda de unos 60 - 66 KDa, y en condiciones reductoras dos bandas de unos 30 KDa. La aglutinina, que tiene un peso molecular de unos 120 KDa, presenta en condiciones no reductoras una banda con un peso similar a 120 KDa y en condiciones reductoras tres bandas comprendidas entre los 40 y 30 KDa (Figura 2).
DISCUSIÓN
Las técnicas inmunológicas son las técnicas diagnósticas de elección, por su especificidad y sensibilidad y por la rapidez de diagnóstico respecto a otras técnicas que necesitan un procesamiento previo de la muestra9,10.
En este trabajo, el ensayo elegido es un ensayo inmunológico de tipo ELISA sándwich, en el que el anticuerpo de detección se encuentra biotinilado. Es un ensayo con una alta sensibilidad, similar o mejor a la de determinados ELISAs comerciales (1,5 ng/mL) y a ciertos ELISAs desarrollados in house11) (2 - 5 ng/mL). Además, esta sensibilidad se encuadra dentro del rango de sensibilidad obtenido en los distintos ELISAs in house optimizados para la detección de ricina en diferentes laboratorios europeos12. Sin embargo, la importancia de nuestros resultados consiste en haber conseguido un protocolo de actuación que combina un ensayo ELISA, con una buena sensibilidad y capaz de ofrecer resultados en un corto tiempo (3,5 horas), con un ensayo SDS-PAGE que complementa, confirma o matiza, los resultados del ELISA.
Ante la naturaleza desconocida de las muestras, se estableció la realización en paralelo de una segunda curva patrón, construida a partir de varios puntos de la curva patrón de ricina a los que se les añadió un porcentaje conocido de la muestra. Después, se compara la A490nm obtenida en los puntos que presentan la misma concentración de ricina. Si la matriz de la muestra no interfiere en la unión con el anticuerpo, el valor de A490nm ha de ser el mismo en ambos casos. Sin embargo, si se obtiene una disminución estadísticamente significativa en la A490nm del punto de la curva patrón que tiene muestra, implica que la matriz de la muestra, que es desconocida, está interfiriendo en la unión antígeno-anticuerpo, con lo que una señal de A490nm negativa obtenida en los pocillos que contienen únicamente la muestra no necesariamente indicaría ausencia de muestra, es decir, podría tratarse de un falso negativo. Gracias a esta estrategia, es posible disminuir significativamente la probabilidad de obtención de falsos negativos, ligada a todo ensayo inmunológico y colorimétrico.
En cuanto a la sensibilidad del ELISA, si bien es cierto que la utilización de anticuerpos policlonales frente al uso de anticuerpos monoclonales puede incrementar en cierta medida el grado de sensibilidad del ensayo al reconocer varios epítopos de la ricina10, este incremento se produce dentro del mismo rango de sensibilidad (ng - pg/mL), y el uso de anticuerpos monoclonales garantiza la reproducibilidad del ensayo al ser producido cada uno por su clon. Por otra parte, la sensibilidad podría incrementarse en el futuro variando el sistema de detección utilizado, bien variando el sustrato sobre el que la enzima unida a la biotina actúa, de tal manera que el producto no sea coloreado sino, por ejemplo, fluorescente10, o bien, modificando el sistema de detección mediante un sistema de detección óptico13 o de tipo plasmón superficial14.
Por otra parte, tal y como ha sido previamente descrito, la ricina guarda una gran similitud con la aglutinina que es una proteína derivada de la misma semilla e inmunológicamente difícil de discriminar15. También existen otras proteínas codificadas por el genoma de la semilla de Ricinus communis con la que la ricina guarda una alta homología y que han sido designadas como ricina A, B, C, D y E16. La realización de un SDS-PAGE en paralelo permite visualizar las proteínas existentes en la muestra, lo que complementa los resultados encontrados en el ELISA. Así, una señal positiva será confirmada a través de un SDS-PAGE permitiendo descartar aquellas señales positivas debidas a la presencia de aglutinina o de cualquier otra proteína desconocida contenida en la muestra que pudiera reaccionar con los anticuerpos, porque no puede preverse todas las reacciones cruzadas que pudieran existir con muestras ambientales que presentan una gran diversidad de matrices (agua, arena de distintas composiciones, suelos…).
Así, este protocolo asegura la detección de ricina utilizando dos técnicas complementarias, ofreciendo, en un breve tiempo de respuesta del laboratorio, una buena sensibilidad en la detección.