Introducción
En los últimos años, los avances en la evaluación biomédica de los atletas ha hecho que los científicos consideren nuevos factores que pueden ser modificados por la actividad física intensa, y que puedan influir de manera importante en el rendimiento de los deportistas1. Un creciente énfasis se ha puesto en el papel de los metales macro y traza en la salud humana y la enfermedad2.
Así, el magnesio (Mg) es un cofactor en más de 300 reacciones enzimáticas en las que se metabolizan los alimentos y se forman nuevos productos químicos3. Está también involucrado en la producción de energía celular y la degradación del glucógeno. Las pruebas acumuladas han mostrado una relación directa entre el Mg y el rendimiento deportivo. Algunos estudios han informado que la concentración en suero o plasma se redujo después del ejercicio4-6. En general, a largo plazo, ejercicios de alta intensidad, como senderismo o natación, dieron como resultado una disminución en los niveles de Mg.
El fósforo (P) juega un importante papel en el metabolismo de los hidratos de carbono, contribuyendo a la absorción intestinal de la glucosa mediante el proceso de la fosforilación. Estimula la reabsorción tubular renal de la glucosa por el mismo sistema y se une a los lípidos para formar fosfolípidos que forman parte de las membranas celulares. El P orgánico forma parte de un compuesto de los glóbulos rojos conocido como 2,3-difosfoglicerato, que facilita la liberación de oxígeno desde los eritrocitos a las células musculares7. El P es básico en la formación de moléculas fundamentales para la producción de energía, como el adenosín trifosfato, el creatinfosfato y el ácido fosfoenolpirúvico.
El arsénico (As) está presente en los tejidos humanos en un rango que oscila de los 10 a los 500 μg/kg−1, encontrándose en menores concentraciones en el corazón y mayores en el hígado8. El As es conocido por ser tóxico para el hombre9. La concentración en orina es un buen indicador sobre la exposición al mismo10. Varios compuestos de As pueden interferir con la actividad de diversas enzimas, especialmente aquellas con grupos sulfidrilos. Así, puede estar involucrada en el ciclo de Krebs11. La toxicidad por As procedente de los alimentos y del agua ingeridos puede desencadenar varios problemas de salud, tales como mutaciones, carcinogénesis y efectos teratogénicos que pueden desencadenar varias disfunciones orgánicas12,13.
El contenido de boro (B) en los tejidos humanos varía entre los < 0.2 y < 0.5 mg/kg−1; sus concentraciones más elevadas se encuentran en los riñones y el hígado, y las más bajas, en la piel8. Penland planteó que el B puede jugar un papel en la función de la membrana celular, el metabolismo mineral y hormonal y las reacciones enzimáticas14. Nielsen15 indicó que el B es requerido y beneficioso para los animales y los humanos en relación con el desarrollo embrionario, el crecimiento óseo y la calcificación, la función inmune, las habilidades psicomotoras y la función cognitiva.
El cesio (Cs) está presente en los tejidos humanos en un rango que oscila de 0.01 a los 0.05 mg/kg−1, encontrándonos sus concentraciones más elevadas en el hígado y el corazón8.
El litio (Li) se encuentra en los tejidos humanos en un rango de < 0.02 a 0.08 mg/kg−1, estando más concentrado en la piel8. Estudios clínicos evidencian que el Li causa desensibilización de los receptors α-2, mostrando que su principal lugar de acción se centra en los mecanismos de comunicación intercelular. Así mismo, ejerce una inhibición directa de la adenilato ciclasa, y altera procesos mediados por el adenosín monofosfato cíclico y mecanismos de transporte iónico11.
El rubidio (Rb) está presente en los tejidos humanos en un rango entre 8 y 30 mg/kg−1, con un valor más bajo en la piel y el más alto en el hígado8. Existen algunas evidencias de que el Rb está involucrado en funciones cerebrales, pero no se han encontrado, hasta el momento, funciones específicas16.
Los tejidos humanos contienen estaño (Sn) en un rango de < 0.2-0.85 mg/kg−1, estando las concentraciones más bajas en el cerebro y las más elevadas en el hígado y los riñones8. Altas concentraciones de Sn en las comidas pueden causar irritación gástrica, afectar a la reproducción y disminuir la fuerza muscular17.
Por su parte, el estroncio (Sr) está presente en los tejidos humanos en unas concentraciones que van de 0.09 a 0.24 mg/kg−1, siendo su concentración más elevada en los riñones y la más baja en el cerebro8. Las funciones bioquímicas no son bien conocidas, pero D’Haese et al.18) han indicado que son necesarias pequeñas cantidades de Sr para un apropiado proceso de calcificación de huesos y dientes.
Por todo lo anterior, el objetivo del presente estudio fue conocer las concentraciones de los macroelementos Mg y P, y de los elementos traza As, B, Li, Rb, Sn y Sr en orina de sujetos sedentarios y atletas de alto nivel deportivo, en modalidades de fondo, que viven en Extremadura (España).
Método
Sujetos
Veintiún atletas varones de larga y media distancia de categoría nacional fueron seleccionados antes de iniciar su periodo anual de entrenamiento. Seguían un programa de entrenamiento sistemático con una media anual de 120 km por semana. El grupo control estaba formado por 26 estudiantes varones que no realizaban ejercicio físico de forma regular. Los dos grupos vivían en la misma área geográfica (Extremadura, España).
Todos los participantes fueron informados del propósito del estudio y dieron su consentimiento para participar en el mismo, cumpliendo con las normas éticas de la Declaración de Helsinki. Todos ellos completaron un cuestionario en relación con sus hábitos nutricionales con el fin de asegurar que no ingerían ninguna vitamina ni mineral u otras suplementaciones, que garantizara que llevaban dietas similares (se preguntó el tipo y la frecuencia con que se ingerían los alimentos).
Procedimiento
Las medidas antropométricas fueron realizadas por el mismo operador, especialista en las técnicas cineantropométricas, siguiendo las recomendaciones del Grupo Español de Cineantropometría19. Todas las medidas se realizaron por la mañana y siempre a la misma hora. La altura del cuerpo se midió con una precisión de 0.1 cm utilizando un estadiómetro montado en la pared (Seca 220), y el peso corporal se midió utilizando una báscula electrónica (Seca 769). El índice de masa corporal se calculó dividiendo el peso en kg por la altura en metros al cuadrado.
La frecuencia cardíaca en reposo y la presión arterial fueron determinadas usando un esfigmógrafo automático (Omron HEM-780) después de un periodo de cinco minutos en reposo en la posición de decúbito supino.
Los sujetos fueron sometidos a una prueba de esfuerzo incremental máxima hasta la extenuación voluntaria sobre tapiz rodante (marca PowerJog) para establecer diferencias entre ambos grupos, en la que se determinó el consumo máximo de oxígeno, la ventilación pulmonar, el cociente respiratorio y la frecuencia cardíaca máxima. Los sujetos realizaron un calentamiento de diez minutos de carrera continua a 8 km/h, comenzando la prueba a 10 km/h. La velocidad se iba incrementando progresivamente en 1 km/h cada dos minutos, hasta el momento en el que los participantes no podían mantener la velocidad requerida. La respuesta fisiológica en parámetros ergoespirométricos era controlada mediante un analizador de gases (MGC, modelo n.o 762014-102) y un pulsómetro (Polar Vantage NV™). Los datos obtenidos fueron analizados con el software Polar Precision Performance de Polar tras la transmisión de los datos con el interfaz (Polar Advantage Interface, Kempele, Finlandia), propio de la marca finlandesa.
Se tomó la primera orina de la mañana, que fue depositada en tubos de 10 mL, previamente lavados con ácido nítrico diluido, y congelados a -20°C hasta el análisis. Antes de este, las muestras se descongelaron y se homogeneizaron por agitación.
Los elementos Mg, P, As, B, Cs, Li, Rb, Sn y Sr se analizaron por ICP-MS de acuerdo con el tratamiento hecho en muestras de sangre por Sarmiento-González et al.20. La descomposición de la matriz orgánica se realizó calentándola 10 h a 90°C tras la adición de 0.8 mL de NO3H y 0.4 mL de H2O2 a 2 mL de orina. Después, las muestras se secaron en un termo bloque a 200°C. La reconstitución de las muestras se realizó añadiéndole 0.5 mL de ácido nítrico, 10 μL de In (10 mg/L) como patrón interno y agua destilada suprapura hasta 10 mL. Los blancos de reactivos, los patrones de elementos y el material de referencia certificado (Seronorm™, lote 0511545, Billingstad, Noruega) se prepararon de la misma manera y se usaron para las pruebas de precisión. Antes del análisis, los materiales de control se diluyeron de acuerdo con la recomendación del fabricante. Las soluciones digeridas se analizaron por ICP-MS en un ELAN® 9000 (Perkin Elmer, Waltham, MA, EE. UU.).
La creatinina se midió en todas las muestras de orina para tener en cuenta la posible dilución de las muestras21, mediante el kit de creatinina de Sigma (555-A) usando un espectrofotómetro UNICAM 5625.
Análisis estadístico
El análisis estadístico se realizó con el programa SPSS® 19.0. Los resultados se expresaron como media ± desviación estándar. La normalidad de la distribución de las variables se comprobó mediante el test de Shapiro-Wilks. Para comprobar la significación de las diferencias en la concentración urinaria de los elementos estudiados entre el grupo control y los atletas se usó el test t-Student. Un valor de p < 0.05 se consideró estadísticamente significativo.
Resultados
Hábitos dietéticos
Los hábitos dietéticos fueron similares en ambos grupos. Ninguno de los participantes seguía ninguna dieta especial. Declararon una ingesta similar de leche, pescado, carne, frutas y verduras.
Características antropométricas, cardiovasculares y ergoespirométricas
La tabla 1 describe los datos antropométricos y cardiovasculares de los participantes. Al comparar los resultados entre los grupos observamos que los atletas presentaron valores significativamente inferiores (p < 0.001) de índice de masa corporal, grasa corporal (p < 0.001) y frecuencia cardíaca de reposo (p < 0.001).
Tabla 1 Características antropométricas, cardiovasculares y ergoespirométricas de los grupos del estudio.
| Control (n = 26) | Atletas (n = 21) | |
|---|---|---|
| Edad (años) | 22.65 ± 3.65 | 21.62 ± 4.27 |
| Altura (m) | 1.77 ± 0.05 | 1.75 ± 0.06 |
| Peso (kg) | 76.94 ± 11.07 | 64.68 ± 7.25** |
| IMC (kg/m2) | 21.81 ± 3.14 | 18.25 ± 1.73** |
| Suma 6 pliegues (mm) | 85.33 ± 31.74 | 47.57 ± 10.68** |
| % muscular | 45.04 ± 3.24 | 49.19 ± 1.46 |
| % óseo | 16.5 ± 3.37 | 18.4 ± 1.47 |
| % graso | 14.27 ± 3.45 | 8.4 ± 1.11** |
| PAS (mmHg) | 125.36 ± 8.65 | 124.71 ± 6.90 |
| PAD (mmHg) | 84.64 ± 6.64 | 80.62 ± 6.77 |
| FC reposo (ppm) | 72.79 ± 14.72 | 53.76 ± 11.91** |
| FCmáx (ppm) | 190.34 ± 8.65 | 192.71 ± 7.61 |
| VO2máx (mL/kg/min) | 43.93 ± 7.28 | 66.95 ± 9.70** |
| VE (L/min) | 102.89 ± 11.77 | 136.04 ± 22.58* |
| RER | 1.08 ± 0.25 | 1.04 ± 0.04* |
FC: frecuencia cardíaca; FCmáx: frecuencia cardíaca máxima; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RER: cociente respiratorio; VE: ventilación pulmonar; VO2máx: consumo máximo de oxígeno.
Test t-Student. Datos expresados como media ± desviación estándar.
*p < 0.05.
**p < 0.001 en comparación grupo control vs. atletas.
Así mismo, se pueden observar los datos ergoespirométricos del grupo control y del grupo de atletas. Tanto la frecuencia cardíaca máxima como el consumo máximo de oxígeno (p < 0.001) y la ventilación pulmonar (p < 0.05) fueron mayores en el grupo de atletas respecto al grupo control. Con relación al cociente respiratorio, fue más elevado en el grupo control (p < 0.05).
Concentración urinaria de los metales
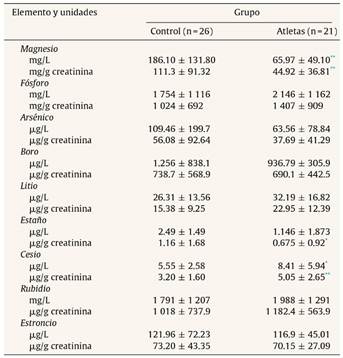
La tabla 2 muestra las concentraciones urinarias de cada elemento, sin corrección y con corrección para la creatinina, en los atletas y el grupo control. Los resultados muestran la falta de diferencias significativas en las concentraciones urinarias de ambos grupos para los elementos P, As, B, Li, Rb y Sr. Las concentraciones urinarias de Mg (p < 0.001 y p < 0.001, sin corrección y con corrección para la creatinina, respectivamente) y Sn (p < 0.05) eran menores en los atletas que en el grupo control. Sin embargo, las concentraciones urinarias de Cs (p < 0.05 y p < 0.001, sin corrección y con corrección para la creatinina, respectivamente) eran superiores en los deportistas respecto al grupo control.
Discusión
En nuestro estudio podemos ver que la realización de un entrenamiento aeróbico puede producir cambios en la eliminación de algunos elementos traza. Así, los resultados obtenidos muestran que todos los elementos estudiados presentaban valores dentro de los considerados como normales en otros estudio de similares características, expresados como en nuestro estudio en μg/L, y utilizando una técnica similar22-24.
Algunos estudios han informado que la concentración de Mg en suero o plasma se reducía después del ejercicio3,4,6. Los resultados presentaron concentraciones significativamente menores en el caso de los atletas (p < 0.001). Esta menor eliminación de Mg en los atletas podría formar parte de un proceso adaptativo en estos para evitar pérdidas de un elemento de gran importancia para el rendimiento del deportista como es el Mg3.
Por otra parte, se observó también una menor eliminación urinaria para el Sn. El hombre está expuesto al Sn por su ingesta, inhalación y absorción por la dermis. Sin embargo, la principal fuente de ingestión es a través de la alimentación, especialmente en las comidas enlatadas, con la excepción de las áreas industriales, donde la concentración en el agua y en el aire es más elevada25. Los resultados obtenidos no muestran concentraciones elevadas que podrían poner en peligro la salud de los sujetos. Sin embargo, esta menor eliminación en los atletas haría a estos sujetos más susceptibles a una posible intoxicación por Sn.
El estudio pone de manifiesto una significativamente mayor eliminación de Cs en los deportistas respecto a los controles. El Cs exhibe una reacción antagónica contra el potasio con respecto a la disponibilidad biológica17, y el potasio ejerce importantes funciones celulares tanto en reposo como en el ejercicio. Por tanto, si se produjera un aumento en las concentraciones de Cs podría producir una dificultad en la función del potasio en la célula y, con ello, una disminución en el rendimiento deportivo, por ello una mayor eliminación de Cs evitaría esta mala situación metabólica para el deportista, mejorando su rendimiento.
Los pocos estudios en la bibliografía de estos elementos en relación con la actividad física, un control nutricional más minucioso y el número de participantes son las principales limitaciones del estudio. En cualquier caso, el conocimiento de estos resultados podrían tener implicaciones importantes para la salud y el rendimiento del deportista.
Por todo lo anterior podemos concluir en nuestro estudio que los niveles encontrados en los elementos analizados se encuentran dentro de rangos normales, no existiendo, por tanto, riesgo para la salud, y que la realización de entrenamiento físico sistemático provoca una menor eliminación de Mg y Sn y un incremento en la eliminación de Cs que evitaría la toxicidad por su acumulación, no perjudicando su rendimiento.