Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Osteoporosis y Metabolismo Mineral
versión On-line ISSN 2173-2345versión impresa ISSN 1889-836X
Rev Osteoporos Metab Miner vol.5 no.2 Madrid abr./jun. 2013
https://dx.doi.org/10.4321/S1889-836X2013000200006
Fracturas vertebrales como debut de síndrome de Cushing diagnosticado tras un embarazo
Vertebral fractures as a debut to Cushing's syndrome diagnosed after a pregnancy
Gutiérrez Medina S.1, Medrano Izquierdo P.2, Díaz Curiel M.3
1 Servicio de Endocrinología y Nutrición - Hospital Universitario Fundación Jiménez Díaz - Madrid
2 Servicio de Urgencias - Hospital Severo Ochoa - Leganés - Madrid
3 Servicio de Medicina Interna/Enfermedades Metabólicas Óseas - Hospital Universitario Fundación Jiménez Díaz - Madrid
Dirección para correspondencia
RESUMEN
Se describe el caso de una paciente de 34 años con enfermedad de Cushing diagnosticada a raíz de presentar múltiples fracturas vertebrales patológicas tras el parto. El debut fulminante con fracturas agudas en cinco cuerpos vertebrales, las características fenotípicas de la paciente y sus antecedentes médicos orientaron hacia el diagnóstico de síndrome de Cushing, entidad poco habitual coincidente con un embarazo. Tras la resección del adenoma hipofisario y el inicio de tratamiento con teriparatida la paciente experimentó una notable mejoría clínica y densitométrica. Este caso demuestra la importancia de sospechar un trastorno del metabolismo óseo ante la presencia de fracturas patológicas en pacientes jóvenes, más aún en ciertas etapas, como embarazo o lactancia.
Palabras clave: síndrome de Cushing, osteoporosis, embarazo, lactancia.
SUMMARY
The case is described of a 34 year old patient with Cushing's disease diagnosed as a result of having multiple pathological vertebral fractures after giving birth. The sudden appearance of acute fractures in five vertebral bodies, the phenotype characteristics of the patient and her medical history pointed to a diagnosis of Cushing's syndrome, a condition which rarely coincides with pregnancy. After a resection of the hypophysary adenoma and the start of treatment with teriparatide, the patient experienced notable clinical and densitometric improvement. This case demonstrates the importance of suspecting a bone metabolism disorder in the presence of pathological fractures in young patients, even more in certain states, such as pregnancy or lactation.
Key words: Cushing's syndrome, osteoporosis, pregnancy, lactation.
Introducción
El síndrome de Cushing comprende los síntomas y signos asociados con una exposición prolongada a unos niveles inapropiadamente elevados de glucocorticoides. Excluidos los casos debidos al uso crónico de glucocorticoides, la gran mayoría (60-70%) se debe a un adenoma hipofisario; es lo que se conoce como enfermedad de Cushing. Otras causas son: tumores o anomalías en las glándulas suprarrenales y secreción ectópica de ACTH.
La osteoporosis es muy frecuente en los pacientes con síndrome de Cushing. El deterioro funcional y estructural del hueso es causa importante de morbilidad y discapacidad en estos pacientes, los cuales tienen un mayor riesgo de fracturas, fundamentalmente a nivel vertebral.
Por otra parte, el embarazo y la lactancia determinan múltiples cambios en la mujer, muchos de los cuales afectan al hueso.
Sin embargo, la combinación de síndrome de Cushing y embarazo es muy poco frecuente debido a que el hipercortisolismo habitualmente cursa con amenorrea e infertilidad.
Caso Clínico
Paciente mujer de 34 años, natural de España, derivada a la consulta de enfermedades metabólicas óseas por presentar varias fracturas vertebrales después del parto.
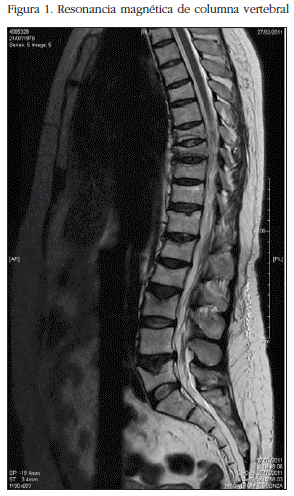
La paciente negaba antecedentes familiares de fracturas. Afirmaba ingesta diaria adecuada de derivados lácteos y escasa actividad física habitual. Como antecedentes médicos de interés, había presentado una fractura traumática transversal de rótula 3 años antes con complicación de pseudoartrosis. La paciente además estaba diagnosticada de síndrome de ovario poliquístico por amenorrea persistente desde los 14 años, y recibió tratamiento con acetato de ciproterona y etinilestradiol de forma continuada, suspendiendo el tratamiento para intentar embarazo. Tras suspender los anovulatorios la paciente mantuvo la amenorrea previa sin conseguir gestación, por lo que finalmente requirió técnicas de reproducción asistida (fecundación in vitro). Tuvo embarazo sin complicaciones (no diabetes gestacional, no hipertensión ni preeclampsia). Mantuvo lactancia natural durante 5 meses. La paciente afirmaba aumento de peso en los últimos años, y de forma importante después del parto. Un mes después del parto comenzó con dolor en región lumbar persistente. Tras dos meses con lumbalgia resistente a tratamiento se realizó resonancia magnética de columna, que evidenció fracturas de varios cuerpos vertebrales tanto dorsales como lumbares, observándose disminución de altura de los cuerpos vertebrales T6, T8, T9, T11, T12, L1, L2, L3 y L5 con signos agudos a nivel de T8, T9, T10, L1 y L3 (Figura 1). La exploración física revelaba rubicundez facial, acúmulo de grasa supraclavicular y retrocervical con discreta atrofia cutánea. El peso era de 75,8 kg, la talla de 1,61 metros, con un índice de masa corporal de 29,2 kg/m2. La tensión arterial era 150/95 mm Hg, confirmada en varias ocasiones.
En la analítica general destacaban los siguientes valores: hemoglobina, 13,4 g/dl; velocidad de sedimentación en la primera hora, 10 mm/h (normal, <25); 25-OH-vitamina D, 8,39 ng/ml (normal, 20-50); calcio sérico, 8,6 mg/dl; parathormona intacta (PTH), 26 pg/ml (normal, 10-65); fosfatasa alcalina, 93 UI/l (normal, 38-126); telopéptido carboxiterminal del colágeno (CTX), 0,595 ng/ml (normal, 0,064-0,548), propéptido aminoterminal del procolágeno (P1NP), 38,7 ng/ml (normal, 10,4-62); cortisol urinario en 24 horas, 616,00 y 779,9 µg (normal, <200); creatinina en orina, 41,6 mg/dl; ACTH, 81,97 pg/ml (normal, 4,7-48,8); TSH, 0,45 µUI/ml (normal, 0,465-468); y espectro electroforético, sin alteraciones.
La densitometría ósea (absorciometría dual de rayos X, DXA) era compatible con osteoporosis en columna lumbar y osteopenia en cuello de fémur: columna lumbar (L2-L4), 0,709 g/cm2 (T-score = -3,26) y cuello de fémur, 0,683 g/cm2 (T-score = -1,44).
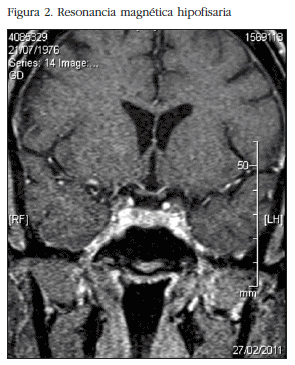
Ante la evidencia de hipercortisolismo ACTH dependiente, y tras el descenso de más del 50% del cortisol plasmático tras el test de supresión fuerte con dexamentasona, se diagnosticó enfermedad de Cushing. En la resonancia magnética (RM) cerebral se evidenció una imagen nodular de 4 mm en adenohipófisis derecha, en el margen superior y anterior (Figura 2). Inició tratamiento con fluconazol previo a la cirugía que mejoró las cifras tensionales y provocó un pequeño sangrado menstrual espontáneo. Fue sometida a intervención quirúrgica vía transesfenoidal para la resección del microadenoma a los 8 meses del parto.
Se recomendó posteriormente un tratamiento con suplementos de calcio y vitamina D (1.500 mg al día de carbonato cálcico y 400 mg al día de colecalciferol), teriparatida subcutánea diaria e hidroaltesona a dosis sustitutivas de 30 mg al día, así como recomendaciones de dieta rica en lácteos y ejercicio físico habitual. Tras la cirugía del adenoma hipofisario la paciente comenzó a tener menstruaciones espontáneas sin tratamiento, se normalizaron las cifras de tensión arterial, desapareció progresivamente el fenotipo cushingoide que presentaba, y experimentó una notable reducción de peso.
Al año del inicio del tratamiento con teriparatida mostró una mejoría notable de la DXA en ambas localizaciones: columna lumbar (L2-L4), 0,837 g/cm2 (T-score = -2,03) y cuello de fémur 0,714 g/cm2 (T-score = -1,14), así como una evolución analítica favorable: fosfatasa alcalina, 69 UI/l; 25-OH-vitamina D, 21,9 ng/ml; PTH, 31,4 pg/ml; CTX, 1,830 ng/ml; y P1NP, 286,9 ng/ml.
Discusión
El síndrome de Cushing se define como el conjunto de signos y síntomas derivados de la exposición prolongada a niveles inapropiadamente elevados de glucocorticoides.
Harvey Cushing, en 1932, fue el primero en postular que el síndrome caracterizado por obesidad, plétora, diabetes, hipertensión, hirsutismo, amenorrea y osteoporosis, podía estar causado por adenomas hipofisarios [1].
El síndrome de Cushing es infrecuente durante el embarazo porque el exceso de corticoides y andrógenos suprimen la secreción de gonadotropinas, lo que conlleva una disfunción ovárica y endometrial. La causa más frecuente de síndrome de Cushing durante el embarazo es el adenoma adrenal; sin embargo, se han publicado casos de adenoma hipofisario [2]. Por otra parte, el síndrome de Cushing durante el embarazo conlleva una elevada morbilidad materna, hasta en un 70% de los casos [3], siendo las complicaciones más frecuentes la hipertensión arterial y la diabetes mellitus. Menos frecuentes son la osteoporosis, las fracturas, la enfermedad psiquiátrica y la insuficiencia cardíaca. Por tanto, es común infradiagnosticar esta patología durante la gestación y confundirla con otras entidades como pre-eclampsia o diabetes gestacional [4].
La fisiopatología de la Osteoporosis Inducida por Esteroides (OIE) es compleja, puesto que existen múltiples factores implicados y muchos de ellos no han sido aclarados completamente [5]. Existe un descenso de la formación ósea por la apoptosis de osteoblastos y osteocitos [6], así como un aumento de la resorción ósea por la activación de osteoclastos [7], con una vida útil más prolongada. La formación de nuevo colágeno es inhibida y la degradación del colágeno preexistente es acelerada [8]. Los esteroides también tienen efectos sobre el remodelado óseo a nivel de la unidad básica de remodelado, dando lugar a una reducción del espesor medio trabecular y a un menor grado de aposición ósea. Además, los esteroides disminuyen los niveles de factor de crecimiento de la insulina (IGF-1), hormona del crecimiento (GH) y hormonas sexuales. Con respecto al metabolismo del calcio, disminuyen la absorción intestinal y aumentan la excreción renal de calcio [8].
Los pacientes con enfermedad de Cushing pueden tener un descenso en las cifras de fosfatasa alcalina y osteocalcina, lo que indica el efecto inhibitorio de la función osteoblástica [9], así como una elevación de los parámetros de resorción ósea.
Las fracturas óseas están presentes en el 19-50% de los pacientes con síndrome de Cushing, incluyendo enfermedad de Cushing [10] y concretamente, las fracturas vertebrales en el 16-20% [11]. En la OIE las zonas de mayor afectación son las de alto contenido en hueso trabecular. Esto implica un aumento de fracturas vertebrales, en costillas y pelvis.
La OIE ocurre en dos fases, una temprana más rápida, en la cual la densidad mineral ósea (DMO) es reducida por la resorción ósea excesiva, y una más lenta y progresiva, en la cual la DMO disminuye por el daño en la formación ósea. Sin embargo, la OIE es reversible, siendo la recuperación de la DMO gradual.
Se ha publicado que la recuperación completa de la DMO en pacientes curados de enfermedad de Cushing puede llevar más de diez años [10]. El tratamiento con bifosfonatos y el fragmento activo de la Hormona Paratiroidea Humana (PTH 1-34) o teriparatida, pueden acelerar la recuperación de la DMO en estos pacientes.
Los fármacos aprobados en España para el tratamiento de la OIE son el risedronato, el zoledronato y, en casos de alto riesgo de fractura, la teriparatida. Los bifosfonatos tienen efecto antirresortivo al inhibir la activación o reclutamiento de los osteoclastos. El risedronato constituye el fármaco de primera elección en el tratamiento de esta enfermedad, al ser de uso oral. El zoledronato se administra de forma intravenosa, una vez al año, lo que supone mayor comodidad para los pacientes y mayor adherencia al tratamiento. La PTH 1-34 o teriparatida es obtenida por tecnología del ADN recombinante, tiene una acción anabolizante, puesto que estimula la formación de hueso por efecto directo en los osteoblastos aumentando indirectamente la absorción intestinal de calcio y aumentando en el riñón la reabsorción tubular de calcio y la excreción de fosfato. También se relaciona con una mejora en la densidad mineral y en la calidad del hueso [12]. Está aprobada en el tratamiento de la osteoporosis establecida en mujeres postmenopáusicas (fractura por fragilidad capilar y DMO con un valor T-score menor de -2,5) y en el tratamiento de la osteoporosis esteroidea, demostrando un aumento de la DMO y una reducción del riesgo de fractura en estos pacientes [13]. Su uso está limitado a un máximo de 18 meses, pudiendo ser a continuación sustituído por un fármaco antirresortivo.
Por otra parte, el embarazo es un estado de hiperestrogenismo que suele inhibir la resorción ósea [14]; no obstante, se ha descrito en ocasiones pérdida de masa ósea y fracturas. Las fracturas osteoporóticas asociadas al embarazo se caracterizan por la presencia de dolor lumbar y en cadera en el tercer trimestre de gestación. Se han publicado fracturas púbicas y femorales subcapitales en embarazadas con osteoporosis [14]. Sin embargo, es frecuente la rápida resolución clínica y radiológica después del parto [15]. En el presente caso, la paciente sufrió múltiples fracturas vertebrales varios meses después del parto, lo que no es compatible con la osteoporosis transitoria del embarazo.
La lactancia materna también puede afectar a los huesos de la madre. Algunos estudios han demostrado que las mujeres pueden perder del 1 al 3% de su mása ósea durante la lactancia, por la creciente necesidad del recién nacido por el calcio, por la reducción en la producción de estrógenos y por el aumento de los niveles de proteínas relacionadas con la hormona paratiroidea (PTHrP) [16]. No obstante, la pérdida de masa ósea que tiene lugar durante la lactancia suele recuperarse en los seis primeros meses postparto.
En la paciente confluyen determinadas características que hacen interesante el caso. En primer lugar la aparición de un embarazo sin complicaciones en una paciente con un síndrome de Cushing es un hecho poco habitual. Aunque este punto puede ser discutible por la ausencia de niveles de cortisol previos al embarazo, sin embargo, la aparición de ganancia de peso previa a éste, los defectos de consolidación de la fractura de rótula, la esterilidad o la amenorrea recuperada tras la cirugía, nos hacen pensar que el síndrome de Cushing estaba presente antes del embarazo. En segundo lugar, la presencia de un debut fulminante con múltiples fracturas vertebrales agudas también es infrecuente en personas jóvenes. Quizá este punto se explique por el efecto desmineralizante del embarazo y la lactancia [16] que tiene lugar sobre un hueso previamente afectado por OIE. Y en tercer y último lugar, es interesante la buena respuesta a la teriparatida en el caso de una OIE.
Existen múltiples causas de osteoporosis secundarias en pacientes jóvenes, muchas de ellas relacionadas con endocrinopatías. Por ello, es fundamental sospechar e incluir el síndrome de Cushing en el diagnóstico diferencial ante la presencia de múltiples fracturas patológicas en pacientes jóvenes, incluso en ciertas etapas, como el embarazo y la lactancia.
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Arnaldo G, Angeli A, Atkinson AB, Bertagna X, Cavagnini F, Chrousos GP, et al. Diagnosis and complications of Cushing's syndrome: A consensus statement. J Clin Endocrinol Metab 2003;88:5593-602. [ Links ]
2. Yoshihara A, Okubo Y, Tanabe A, Sata A, Nishimaki M, Kawamata T, et al. A juvenile case of Cushing's Disease incidentally discovered with multiple bone fractures. Intern Med 2007;46:583-7. [ Links ]
3. Goñi Iriarte MJ. Síndrome de Cushing: situaciones especiales. Endocrinol Nutr 2009;56:251-61. [ Links ]
4. Choi WJ, Sik Jung T, Young Paik W. Cushing's syndrome in pregnancy with a severe maternal complication: A case report. J Obstet Gynecol Res 2011;37:163-7. [ Links ]
5. Adachi JD, Papaioannou A. Corticosteroid-induced osteoporosis. Drug Safety 2001;24:607-24. [ Links ]
6. Manolagas SC, Weinstein RS. New developments in the pathogenesis and treatment of steroid-induced osteoporosis. J Bone Miner Res 1999;14:1061-6. [ Links ]
7. Bressot C, Meunier PJ, Chapuy MC, Lejeune E, Edouard C, Darby AJ. Histomorphometric profile pathophysiology, and reversibility of glucocorticoid-induced osteoporosis. Metab Bone Dis Relat Res 1979;1:303-11. [ Links ]
8. Canalis E. Mechanisms of glucocorticoid action in bone: implications to glucocorticoid induced osteoporosis. J Clin Endocrinol Metab 1996;81:3441-6. [ Links ]
9. Canalis E, Delany AM. Mechanisms of glucocorticoid action in bone. Ann NY Acad Sci 2002;966:73-81. [ Links ]
10. Mancini T, Doga M, Mazziotti G, Giustina A. Cushing's syndrome and bone. Pituitary 2004;7:243-6. [ Links ]
11. Khanine V, Fournier JJ, Requeda E, Luton JP, Simon F, Crouzet J. Osteoporotic fractures at presentation of Cushing's disease: two case reports and a literature review. Joint Bone Spine 2000:67;341-5. [ Links ]
12. Weinstein RS, Jilka RL, Almeida M, Roberson PK, Manolagas SC. Intermittent parathyroid hormone administration counteracts the adverse effects of glucocorticoids on osteoblast and osteocyte viability, bone formation, and strength in mice. Endocrinology 2010;151:2641-9. [ Links ]
13. Carpinteri R, Porcelli T, Mejia C, Patelli I, Bilezikian JD, Canalis E, et al. Glucocorticoid-induced osteoporosis and parathyroid hormone. J Endocrinol Invest 2010;33:16-21. [ Links ]
14. Smith R, Athanasou NA, Ostlere SJ, Vipond SE. Pregnancy-associated osteoporosis. Q J Med 1995;88:865-78. [ Links ]
15. Tajika T, Shinozaki T, Watanabe H, Yangawa T, Takagishi K. Case report of a Cushing's syndrome patient with multiple pathologic fractures during pregnancy. J Orthop Sci 2002;7:498-500. [ Links ]
16. Hirata G, Chaki O. Bone loss in lactating women and post-pregnancy osteoporosis. Clin Calcium 2011;21:1347-52. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Sonsoles Gutiérrez Medina
Hospital Universitario Fundación Jiménez Díaz
Servicio de Endocrinología y Nutrición
Avda. Reyes Católicos, 2
28040 Madrid (España)
Correo electrónico:
sgutierrezme@fjd.es
Fecha de recepción: 22/03/2012
Fecha de aceptación: 25/06/2012











 texto en
texto en