Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Osteoporosis y Metabolismo Mineral
versión On-line ISSN 2173-2345versión impresa ISSN 1889-836X
Rev Osteoporos Metab Miner vol.5 no.4 Madrid nov./dic. 2013
https://dx.doi.org/10.4321/S1889-836X2013000400002
ORIGINALES
Esclerostina y Dkk-1 séricos en pacientes que inician tratamiento con glucocorticoides. Resultados preliminares
Blood sclerostin and Dkk-1 in patients who start treatment with glucocorticoids. Preliminary results
Gifre L.1, Ruiz-Gaspà S.2, Monegal A.1, Nomdedeu B.3, Guañabens N.1,2, Peris P.1,2
1 Servicio de Reumatología - Unidad de Patología Metabólica Ósea - Hospital Clínico de Barcelona
2 CIBERehd - Hospital Clínico de Barcelona
3 Servicio de Hematología - Hospital Clínico de Barcelona
Trabajo becado por la SEIOMM para asistir al 34 Congreso de la ASBMR (Minneapolis, Minnesota 2012).
Este trabajo ha sido financiado por becas del Hospital Clínic Barcelona y de la Societat Catalana de Reumatologia.
Dirección para correspondencia
RESUMEN
Fundamento y objetivos: La vía Wnt y sus inhibidores (esclerostina y Dkk-1) tienen un papel primordial en la regulación de la masa ósea y la osteoblastogénesis. El objetivo de este estudio fue analizar el efecto del tratamiento con glucocorticoides (GCC) sobre los inhibidores de la vía Wnt y su relación con la masa ósea y los parámetros de recambio óseo.
Métodos: Estudio transversal que incluyó 15 pacientes (9 mujeres y 6 hombres) con una edad media de 51±21 años al inicio del tratamiento con GCC (≥7,5 mg/día, ≤6 meses). En todos ellos se determinó: esclerostina, Dkk-1 séricos y marcadores séricos del recambio óseo (propéptido N-terminal del procolágeno I [PINP], osteocalcina [OC] y telopéptido carboxiterminal del colágeno tipo I [CTX]), y se les realizó una densitometría ósea en columna lumbar y fémur (DXA). Los resultados se compararon con un grupo control.
Resultados: La dosis media de glucocorticoides fue de 58±21 mg/día, en la mayoría de los pacientes indicado por una púrpura trombocitopénica idiopática (73%). Los pacientes tratados con glucocorticoides tenían una disminución de los parámetros de formación ósea comparado con el grupo control (OC: 7,4±2,8 vs. 24,4±6,2 ng/ml, p<0,01) y una disminución del Dkk-1 sérico (29,6±23,6 vs. 48,3±15,6 pmol/L, p=0,02). No se observaron diferencias significativas en los valores esclerostina sérica, aunque ésta se correlacionó positivamente con la dosis de GCC recibida y la densidad mineral ósea lumbar.
Conclusión: Contrariamente a lo que sucede en estudios experimentales, el inicio del tratamiento con glucocorticoides se asocia a una disminución de los valores séricos de Dkk-1. Estos resultados indican la necesidad de analizar estos inhibidores y su relación con el remodelado y la masa ósea en este proceso a largo plazo.
Palabras clave: esclerostina, Dkk-1, glucocorticoides.
SUMMARY
Background and objectives: The Wnt pathway and its inhibitors (sclerostin and Dkk-1) have a primary role in the regulation of bone mass and osteoblastogenesis. The objective of this study was to analyse the effect of treatment with glucocorticoids (GCC) on the inhibitors of the Wnt pathway and their relationship with bone mass and the parameters for bone turnover.
Methods: A transverse study including 15 patients (9 women and 6 men) with an mean age of 51±21 years at the start of treatment with GCC (≥7.5 mg/day, ≤6 months). Levels of sclerostin, blood Dkk-1 and blood markers for bone turnover (procollagen 1 N-terminal propeptide [P1NP], osteocalcin [OC], and carboxy-terminal telopeptide of collagen type 1 [CTX]) were determined, and bone densitometry (DXA) in the lumbar spine was carried out, in all patients. The results were compared with a control group.
Results: The mean dose of glucocorticoids was 58±21 mg/day, in the majority of patients (73%) indicated by idiopathic thrombocytopenic purpura. The patients treated with glucocorticoids had a reduction in the parameters for bone formation compared with a control group (OC: 7.4±2.8 vs 24.4±6.2 ng/ml, p<0.01) and a reduction in blood Dkk-1 (29.6±23.6 vs 48.3±15.6 pmol/L, p=0.02). No significant differences were observed in values for blood sclerostin, although this correlated positively with the dose of GCC received and lumbar bone mineral density.
Conclusion: Contrary to what is seen in experimental studies, the start of treatment with glucocorticoids is associated with a reduction in blood levels of Dkk-1. These results indicate the necessity of analysing these inhibitors and their relationship with remodelling and bone mass during this process over the long term.
Key words: sclerostin, Dkk-1, glucocorticoids.
Introducción
El tratamiento con glucocorticoides (GCC) se asocia a una marcada pérdida de masa ósea y al desarrollo de fracturas en las fases iniciales del tratamiento, siendo además, una de las causas mas frecuentes de osteoporosis secundaria [1]. Los GCC actúan especialmente sobre los osteoblastos y osteocitos, disminuyendo la replicación, diferenciación y función de los osteoblastos e induciendo la apoptosis de los osteoblastos y osteocitos. Estas alteraciones conducen a la larga a una disminución de la formación y de la calidad ósea, lo que constituye el hallazgo más característico de la osteoporosis inducida por GCC [2-4].
La vía Wnt, una vía de señalización celular, tiene un papel fundamental en la modulación de la actividad osteoblástica. Esta vía esta integrada por varios componentes que incluyen ligandos, receptores de membrana, efectores intracelulares y antagonistas. Los antagonistas de la vía Wnt, entre los que destacan la esclerostina y el Dkk-1, se unen a los receptores de membrana (fundamentalmente LRP-5 y -6) e inhiben la activación de dicha vía y, consecuentemente, la actividad osteoblástica.
Estudios experimentales recientes, tanto in vitro como in vivo, indican que el tratamiento con GCC disminuye la diferenciación de los osteoblastos a través de la vía Wnt, mediante un aumento de sus inhibidores, esclerostina y Dkk-1 [5-7]. Sin embargo, actualmente apenas existen datos clínicos sobre el efecto del tratamiento con GCC en dichos inhibidores.
Por ello, el objetivo de este estudio ha sido analizar los valores séricos de esclerostina y Dkk-1 en pacientes con inicio reciente de tratamiento con GCC y valorar su relación con los marcadores de remodelado óseo y la densidad mineral ósea (DMO).
Pacientes y métodos
Población del estudio
Estudio transversal que incluyó pacientes que iniciaban (<3 meses) tratamiento con dosis superiores o iguales a 7,5 mg/día de prednisona o equivalente. Los pacientes fueron remitidos por el Servicio de Hematología del Hospital Clínico de Barcelona (agosto 2010 a enero 2012) y reclutados de forma consecutiva.
Todos los pacientes cumplieron los siguientes criterios de inclusión: edad superior a 18 años y valores normales de creatinina, función hepática, calcio y fósforo. Se excluyeron los pacientes que seguían tratamiento con GCC durante más de 6 meses, aquellos con enfermedades o procesos que afectaran el metabolismo óseo (enfermedad ósea de Paget, artritis reumatoide, hiperparatiroidismo, hipercortisolismo, síndrome malabsortivo, tumores malignos, trasplante, embarazo o lactancia reciente) y/o que siguieran tratamiento con fármacos que interfirieran el metabolismo óseo (bisfosfonatos, ranelato de estroncio, moduladores selectivos del receptor estrogénico, calcitonina, terapia estrogénica, denosumab, osteoformadores, tiazidas o anticonvulsivantes).
En todos los pacientes se valoraron los factores de riesgo de osteoporosis incluyendo: antecedentes familiares de fractura de fémur, historia personal de fracturas, consumo de tabaco y alcohol, edad de la menopausia, ingesta de calcio por dieta (mg/día) y antecedentes de litiasis renal. Además, se recogió la causa del tratamiento con GCC, dosis y la pauta de tratamiento con GCC (dosis acumulada [mg] y duración [días]).
Los resultados se compararon con un grupo control sano de edad y sexo similar.
El estudio se realizó con la aprobación del Comité de Ética del hospital y se ajustó a las directrices pertinentes para la investigación en humanos. Todos los pacientes firmaron el consentimiento informado para su inclusión.
Determinaciones analíticas
En todos los pacientes se realizó una extracción sanguínea entre las 8 y 10 horas de la mañana, tras ayuno nocturno. Se realizó un perfil de bioquímica que incluía calcio, fosfato, creatinina y fosfatasa alcalina total (FA), determinados por técnicas estándar.
Se determinaron los siguientes marcadores bioquímicos de formación: osteocalcina (OC, radioinmunoensayo, Elsa-Osteo-Cis, Gif-sur-Yvette, Francia) y propéptido aminoterminal del procolágeno tipo I (PINP, método automatizado Cobas e411, Roche), y de resorción ósea: telopéptido carboxiterminal del colágeno tipo I (CTX, método automatizado Cobas e411, Roche).
Los valores séricos de esclerostina y Dkk-1 fueron medidos mediante ELISA (Biomedica, Austria), con un coeficiente de intravariación de 4-6% y 7-8% respectivamente, y un coeficiente de intervariación de 5-7% y 9-12%.
Densidad mineral ósea
La DMO de columna lumbar y fémur fue determinada en todos los pacientes mediante absorciometría dual de rayos X (DXA; Lunar Prodigy, Radiation Corporation Madison, WI). Las categorías densitométricas de riesgo (DMO normal, osteopenia y/o osteoporosis) fueron definidas según los criterios de la OMS [8].
Análisis estadístico
Los resultados se han expresado mediante la media ± desviación estándar de la media (DE). Las diferencias entre medias de las variables continuas se analizaron mediante la prueba no paramétrica de la U de Mann-Whitney, y las diferencias entre proporciones mediante la prueba de Fisher. Para valorar asociación entre variables se utilizó el coeficiente de correlación de Pearson. Los valores p<0,05 fueron considerados estadísticamente significativo. El análisis estadístico de los datos se realizó mediante el programa SPSS (versión 18.0, Chicago, EE.UU.).
Resultados
Las características clínicas de los pacientes incluidos en el estudio se muestran la Tabla 1.
Se incluyeron 15 pacientes (9 mujeres [4 postmenopáusicas] y 6 varones), con una edad media de 51±21 años. La dosis media de GCC utilizada fue de 58±21 mg/día (rango: 20-100 mg/día) y la duración media del tratamiento de 42±24 días (rango: 4-90 días). El 73% de los pacientes recibía tratamiento con GCC por una púrpura trombocitopénica idiopática, el 20% por una anemia hemolítica y el 3% por ambas causas (síndrome de Evans). El 27% tenía antecedentes familiares de fractura de fémur y el 20% tenía una osteoporosis densitométrica. La ingesta de calcio por la dieta era de 593±305 mg al día y sólo un paciente refería tabaquismo activo.
Los pacientes que seguían tratamiento con GCC mostraron una disminución significativa de los marcadores de formación respecto al grupo control (PINP: 18±9 vs. 47±9 ng/ml, p<0,01; OC: 7,4±2,8 vs. 24,4±6,2 ng/ml, p<0,01). No se observaron diferencias significativas en los valores del marcador de resorción respecto al grupo control (CTX: 0,60±0,27 vs. 0,45±0,16 ng/ml, p=0,21).
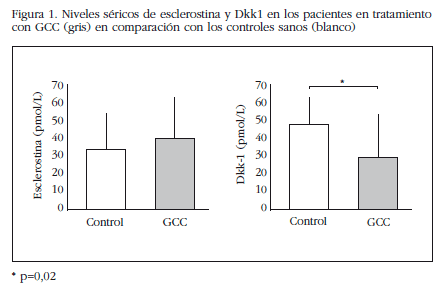
Los pacientes tratados con GCC presentaron una disminución de los valores séricos Dkk-1 comparado con el grupo control (29,6±23,6 vs. 48,3±15,6 pmol/L, p=0,02), mientras que las concentraciones de esclerostina fueron similares en ambos grupos (39,6±23,3 vs. 33,8±20,3, p=0,6) (Figura 1).
En el grupo de pacientes tratados con GCC, los valores de esclerostina se correlacionaron de forma positiva con la dosis acumulada de GCC (r=0,573 p=0,026) y la DMO lumbar (r=0,550, p=0,034) (Figura 2). Los valores de Dkk-1 no se relacionaron con ninguno de los parámetros analizados. No se observó ninguna relación entre los valores de los marcadores del remodelado óseo y los valores séricos de esclerostina y/o Dkk-1. En el grupo control, los valores de esclerostina se correlacionaron de forma positiva con la edad (r=0,661, p=0,02) (Tabla 2).
Discusión
Contrariamente a lo que sucede en estudios experimentales, el inicio del tratamiento con GCC en pacientes con procesos hematológicos, se asocia a una disminución de los valores séricos de Dkk-1. Este efecto, sin embargo, difiere en función del antagonista analizado, ya que no se observan cambios significativos en las concentraciones de esclerostina en el momento de la valoración.
Los pacientes incluidos en este estudio presentaron valores séricos bajos de Dkk-1 tras iniciar tratamiento con GCC a dosis medias-altas. Estos hallazgos contrastan con los resultados de estudios experimentales previos. Así, en cultivos de osteoblastos y osteocitos (células MLO-Y4), el tratamiento con dexametasona produce un aumento del Dkk-1 [9], que se asocia con la dosis y el tiempo de tratamiento recibido [7], con resultados similares en modelos de experimentación animal, en los que se ha observado un aumento de la expresión de Dkk-1 en el tejido óseo tras iniciar tratamiento con GCC [7] y una atenuación del efecto deletéreo de los GCC en el hueso al bloquear el efecto del Dkk-1 en el ratón [5]. Si bien, las causas de estas diferencias no están aclaradas, la pauta de tratamiento con GCC, incluyendo la dosis y el tiempo de tratamiento podría explicar, en parte, estos resultados [6]. Tampoco puede descartarse un efecto contrarregulador de este antagonista de la vía Wnt en situaciones de exposición prolongada a los GCC, o bien que sus valores séricos puedan indicar, no sólo la función celular de osteoblastos y osteocitos, sino también el número de células, que como es bien conocido disminuye (debido a un aumento de la apoptosis) con el tratamiento corticoideo.
Sin embargo, merece la pena comentar que recientemente, de forma preliminar, también se ha indicado una disminución de los valores séricos de Dkk-1 a los tres meses de iniciar tratamiento con GCC [10], y del mismo modo, estudios recientes han descrito una respuesta paradójica del Dkk-1, similar a la observada en nuestro estudio, en otras situaciones clínicas. En este sentido, contrariamente a lo esperado, se han observado valores disminuidos de Dkk-1 en pacientes inmovilizados [11] y un aumento de los valores séricos de Dkk-1 en pacientes con hiperparatiroidismo primario [12]. Asimismo, también se ha descrito una respuesta paradójica del Dkk-1 tras el tratamiento con teriparatida [13] y denosumab [14]. Estos autores han sugerido una relación entre el remodelado óseo y los valores de Dkk-1, de forma que a menor remodelado óseo menores serían los valores de Dkk-1. De todos modos, es importante recordar que podrían existir factores que influyeran en los valores séricos del Dkk-1, como la enfermedad de base y el tratamiento concomitante, entre otros, y que deberán tenerse en cuenta al analizar las concentraciones de este antagonista. Asimismo, la relación entre los valores séricos y su expresión tisular es controvertida [7].
En nuestro estudio, los valores séricos de esclerostina tras el inicio del tratamiento con GCC fueron similares a los valores del grupo control. Sin embargo, se observó una correlación positiva entre los valores de esclerostina y la dosis acumulada de GCC, sugiriendo un efecto GCC-dependiente sobre este antagonista de la vía Wnt. Estudios en ratones tratados con GCC han descrito un aumento de la expresión de esclerostina tras tratamiento [3]. Sin embargo, en pacientes que inician tratamiento con GCC (primeras 96 horas) se ha descrito una disminución de los valores de esclerostina [15], un hallazgo que no se ha observado en mujeres postmenopáusicas tratadas con GCC [10] ni en pacientes con hipercortisolismo por síndrome de Cushing [16], en los que se ha descrito un aumento de los valores de esclerostina.
Los valores circulantes de esclerostina en la población general se han asociado con la edad, el sexo, el status estrogénico (postmenopausia) y la cantidad de masa ósea total [17-19], por lo que deberán tenerse en cuenta estos factores cuando se analicen sus concentraciones. En este sentido, en los sujetos sanos incluidos en nuestro estudio observamos una correlación positiva de los valores esclerostina con la edad; un hallazgo que no se observó en el grupo de pacientes tratados con GCC, posiblemente debido al efecto directo de los GCC sobre la vía Wnt. En este grupo de pacientes se observó, sin embargo, una correlación positiva entre los valores séricos de esclerostina y la DMO lumbar, una relación que también se ha observado en otros estudios y que se ha atribuido a la mayor producción de esclerostina por los osteocitos, debido a una mayor cantidad de hueso [18-20].
La relación entre los marcadores de remodelado óseo y los antagonistas de la vía Wnt es incierta y varían en distintas situaciones clínicas. Así, García-Martin et al. [21,22] en un grupo de pacientes con diabetes mellitus tipo 2, describieron una correlación inversa entre los valores de esclerostina y los marcadores de formación (FA ósea) y resorción ósea (sCTX y TRAP5b). Datos similares han sido descritos en población general [18] y en pacientes inmovilizados tras accidente vascular cerebral [23], aunque en otras situaciones, como en pacientes con insuficiencia renal crónica, no se han observado correlaciones significativas [20,24,25]. En nuestro estudio, aunque se observó una disminución significativa de los marcadores de formación ósea (PINP y OC) tras el tratamiento con GCC, éstos no se relacionaron con los valores séricos de esclerostina ni Dkk-1.
Las principales limitaciones de este estudio son el reducido número de pacientes incluidos y la falta de seguimiento en estos pacientes.
En conclusión, el efecto del tratamiento con GCC en los valores séricos de los antagonistas de la vía Wnt difiere en función del antagonista evaluado. Mientras que los niveles de Dkk-1 disminuyen al inicio del tratamiento, los valores de esclerostina no muestran cambios significativos. Todo ello sugiere la necesidad de realizar estudios prospectivos que incluyan un mayor número de pacientes con mayor seguimiento que analicen el efecto de los GCC sobre los antagonistas de la vía Wnt.
Conflicto de intereses: Los autores declaran no existir conflicto de intereses.
Bibliografía
1. van Staa TP, Leufkens HG, Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis. Osteoporos Int 2002;13:777-87. [ Links ]
2. Hernández MV, Guanabens N, Alvarez L, Monegal A, Peris P, Riba J, et al. Immunocytochemical evidence on the effects of glucocorticoids on type I collagen synthesis in human osteoblastic cells. Calcif Tissue Int 2004;74:284-93. [ Links ]
3. Yao W, Cheng Z, Busse C, Pham A, Nakamura MC, Lane NE. Glucocorticoid excess in mice results in early activation of osteoclastogenesis and adipogenesis and prolonged suppression of osteogenesis: a longitudinal study of gene expression in bone tissue from glucocorticoid-treated mice. Arthritis Rheum 2008;58:1674-86. [ Links ]
4. Canalis E, Mazziotti G, Giustina A, Bilezikian JP. Glucocorticoid-induced osteoporosis: pathophysiology and therapy. Osteoporos Int 2007;18:1319-28. [ Links ]
5. Wang FS, Ko JY, Yeh DW, Ke HC, Wu HL. Modulation of Dickkopf-1 attenuates glucocorticoid induction of osteoblast apoptosis, adipocytic differentiation, and bone mass loss. Endocrinology 2008;149:1793-801. [ Links ]
6. Mak W, Shao X, Dunstan CR, Seibel MJ, Zhou H. Biphasic glucocorticoid-dependent regulation of Wnt expression and its inhibitors in mature osteoblastic cells. Calcif Tissue Int 2009;85:538-45. [ Links ]
7. Thiele S, Ziegler N, Tsourdi E, De Bosscher K, Tuckermann JP, Hofbauer LC, et al. Selective glucocorticoid receptor modulation maintains bone mineral density in mice. J Bone Miner Res 2012;27:2242-50. [ Links ]
8. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser 1994;843:1-129. [ Links ]
9. Ohnaka K, Taniguchi H, Kawate H, Nawata H, Takayanagi R. Glucocorticoid enhances the expression of dickkopf-1 in human osteoblasts: novel mechanism of glucocorticoid-induced osteoporosis. Biochem Biophys Res Commun 2004;318:259-64. [ Links ]
10. Gossiel F LN, Eastell R. The Effect of Glucocorticoid Therapy on Regulators of Bone Formation in Postmenopausal Women Treated with Teriparatide or Alendronate. ASBMR Annual Meeting 2011:S80. [ Links ]
11. Frings-Meuthen P, Boehme G, Liphardt AM, Baecker N, Heer M, Rittweger J. Sclerostin and DKK1 levels during 14 and 21 days of bed rest in healthy young men. J Musculoskelet Neuronal Interact 2013;13:45-52. [ Links ]
12. Viapiana O, Fracassi E, Troplini S, Idolazzi L, Rossini M, Adami S, et al. Sclerostin and DKK1 in primary hyperparathyroidism. Calcif Tissue Int 2013;92:324-9. [ Links ]
13. Gatti D, Viapiana O, Idolazzi L, Fracassi E, Rossini M, Adami S. The waning of teriparatide effect on bone formation markers in postmenopausal osteoporosis is associated with increasing serum levels of DKK1. J Clin Endocrinol Metab 2011;96:1555-9. [ Links ]
14. Gatti D, Viapiana O, Fracassi E, Idolazzi L, Dartizio C, Povino MR, et al. Sclerostin and DKK1 in postmenopausal osteoporosis treated with denosumab. J Bone Miner Res 2012;27:2259-63. [ Links ]
15. Brabnikova Maresova K, Pavelka K, Stepan JJ. Acute effects of glucocorticoids on serum markers of osteoclasts, osteoblasts, and osteocytes. Calcif Tissue Int 2013;92:354-61. [ Links ]
16. Belaya ZE, Rozhinskaya LY, Melnichenko GA, Solodovnikov AG, Dragunova NV, Iljin AV, et al. Serum extracellular secreted antagonists of the canonical Wnt/beta-catenin signaling pathway in patients with Cushing's syndrome. Osteoporos Int 2013;24:2191-9. [ Links ]
17. Modder UI, Clowes JA, Hoey K, Peterson JM, McCready L, Oursler MJ, et al. Regulation of circulating sclerostin levels by sex steroids in women and in men. J Bone Miner Res 2010;26:27-34. [ Links ]
18. Modder UI, Hoey KA, Amin S, McCready LK, Achenbach SJ, Riggs BL, et al. Relation of age, gender, and bone mass to circulating sclerostin levels in women and men. J Bone Miner Res 2011;26:373-9. [ Links ]
19. Mirza FS, Padhi ID, Raisz LG, Lorenzo JA. Serum sclerostin levels negatively correlate with parathyroid hormone levels and free estrogen index in postmenopausal women. J Clin Endocrinol Metab 2010;95:1991-7. [ Links ]
20. Polyzos SA, Anastasilakis AD, Bratengeier C, Woloszczuk W, Papatheodorou A, Terpos E. Serum sclerostin levels positively correlate with lumbar spinal bone mineral density in postmenopausal women--the six-month effect of risedronate and teriparatide. Osteoporos Int 2012;23:1171-6. [ Links ]
21. García-Martin A, Rozas-Moreno P, Reyes-Garcia R, Morales-Santana S, Garcia-Fontana B, Garcia-Salcedo JA, et al. Circulating levels of sclerostin are increased in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab 2012;97:234-41. [ Links ]
22. García-Martín A, Reyes-García R, Rozas-Moreno P, Varsavsky M, Luque-Fernández I, Avilés-Pérez M, et al. Variables que influyen en las concentraciones de esclerostina en los pacientes con diabetes mellitus tipo 2 y su asociación con el metabolismo óseo. Rev Osteoporos Metab Miner 2012;4:109-115. [ Links ]
23. Gaudio A, Pennisi P, Bratengeier C, Torrisi V, Lindner B, Mangiafico RA, et al. Increased sclerostin serum levels associated with bone formation and resorption markers in patients with immobilization-induced bone loss. J Clin Endocrinol Metab 2010;95:2248-53. [ Links ]
24. Cejka D, Jager-Lansky A, Kieweg H, Weber M, Bieglmayer C, Haider DG, et al. Sclerostin serum levels correlate positively with bone mineral density and microarchitecture in haemodialysis patients. Nephrol Dial Transplant 2012;27:226-30. [ Links ]
25. van Lierop AH, Witteveen JE, Hamdy NA, Papapoulos SE. Patients with primary hyperparathyroidism have lower circulating sclerostin levels than euparathyroid controls. Eur J Endocrinol 2010;163:833-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Laia Gifre
Servicio de Reumatología
Hospital Clínic
c/Villarroel, 170
08036 Barcelona (España)
Correo electrónico: lgifre@clinic.ub.es
Fecha de recepción: 17/07/2013
Fecha de aceptación: 19/11/2013











 texto en
texto en