Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de Osteoporosis y Metabolismo Mineral
versão On-line ISSN 2173-2345versão impressa ISSN 1889-836X
Rev Osteoporos Metab Miner vol.6 no.2 Madrid Abr./Jun. 2014
https://dx.doi.org/10.4321/S1889-836X2014000200003
ORIGINALES
Riesgo de fractura osteoporótica mayor y de cadera en pacientes con accidente cerebrovascular en fase aguda. Estudio prospectivo multicéntrico
Risk of major osteoporotic or hip fracture in patients with cerebrovascular accident in the acute phase. Multicentre prospective study
Olmo J.A.1, Román P.2, León M.L.2, Mena P.1, Ignatowitz U.1, Fuentes M.3, Almagro M.M.3, Martínez E.4, Torres J.5 y Canteras M.6
1 Servicio de Rehabilitación - Hospital de Torrevieja (Alicante)
2 Servicio de Rehabilitación - Hospital General de Ciudad Real
3 Servicio de Rehabilitación - Hospital Virgen de las Nieves - Granada
4 Servicio de Rehabilitación - Hospital Ramón y Cajal - Madrid
5 Servicio de Rehabilitación - Hospital del Vinalopó - Elche (Alicante)
6 Catedrático de Bioestadística - Facultad de Medicina de Murcia
Dirección para correspondencia
RESUMEN
Objetivos: Los pacientes hemipléjicos son considerados una población de riesgo para padecer fracturas osteoporóticas. El objetivo de este trabajo es conocer el riesgo absoluto de fractura por fragilidad en pacientes con accidente cerebrovascular (ACV) y el estado osteometabólico en pacientes con ictus en fase aguda, así como comprobar si existen diferencias basales con un grupo control de pacientes sin patología cerebrovascular.
Pacientes y método: Estudio prospectivo multicéntrico realizado en cinco hospitales españoles. Se establecieron dos grupos: a) pacientes con ictus de menos de tres meses de evolución, y b) un grupo control de una población sin enfermedad cerebrovascular. Se analizaron antecedentes de fracturas por fragilidad, número de caídas en el año anterior, densidad mineral ósea (DMO) de cadera, índice FRAX®, determinaciones bioquímicas y marcadores óseos: calcio, fósforo, fosfatasa alcalina, vitamina D, parathormona (PTH), y telopéptido carboxiterminal del colágeno I (CTX).
Resultados: Se han estudiado un total de 82 pacientes: 50 pacientes con ACV y 32 controles. El 12% de los pacientes con ACV presentaron riesgo elevado de sufrir una fractura de cadera y el 8% riesgo elevado de una fractura mayor osteoporótica. En el grupo control el riesgo fue mayor. Los pacientes hemipléjicos presentaron una DMO en cadera menor que el grupo control, aunque las diferencias de ambas variables no fueron estadísticamente significativas.
Los niveles de CTX estaban elevados en pacientes con ACV, siendo la única determinación con diferencias significativas entre ambos grupos estudiados.
Conclusiones: Los pacientes con ACV presentaron valores de marcadores de reabsorción ósea (CTX) significativamente elevados y una DMO de cadera menor que el grupo control.
Palabras clave: accidente cerebrovascular, DMO, fractura por fragilidad.
SUMMARY
Objetives: Hemiplegic patients are considered to be a population at risk of suffering osteoporotic fractures. The aim of this work is to understand the absolute risk of fragility fracture in patients with cerebrovascular accident (CVA) and the osteometabolic state of patients with ictus in the acute phase, as well as confirming if there are baseline differences compared to a control group without cerebrovascular pathology.
Patients and method: Multicentre prospective study carried out in five Spanish hospitals. Two groups were established: a) patients with ictus of less than three months development, and b) a control group from a population without cerebrovascular disease. History of fragility fractures, number of falls in the previous year, bone mineral density (BMD) in the hip, FRAX® index, determinations of biochemistry and bone markers - calcium, phosphorus, alkaline phosphatase, vitamin D, parathormone (PTH), and carboxy-terminal telopeptide of collagen type I (CTX) - were analysed.
Results: A total of 82 patients were studied: 50 patients with CVA and 32 controls. 12% of those patients with CVA had an increased risk of suffering a hip fracture, and 8% an increased risk of a major osteoporotic fracture. In the control group the risk was greater. The hemiplegic patients had BMD in the hip lower than those in the control group, although the differences in both variables were not statistically significant.
The levels of CTX were higher in patients with CVA, this being the sole determination which showed a statistical difference between the two groups studied.
Conclusions: The patients with CVA had values of markers for bone resorption (CTX) significantly higher and a BMD in the hip lower than those in the control group.
Key words: cerebrovascular accident, BMD, fragility fracture.
Introducción
Como es universalmente aceptado, la importancia de la osteoporosis radica en el riesgo de provocar fracturas. Concretamente son las fracturas de cadera las que tienen mayor trascendencia debido a las repercusiones funcionales, económicas y a la tasa de mortalidad. La fractura de cadera se considera un acontecimiento multifactorial, otorgándosele al estudio y jerarquización de los diversos factores una gran relevancia.
La importancia del ictus en el riesgo de fractura de cadera se empezó a plantear en 1997, tras el estudio realizado en la población japonesa por Suzuki y cols. [1] Estudios posteriores [2-5] han reforzado esos hallazgos dirigidos a considerar a los pacientes hemipléjicos una población de riesgo, y a recomendar la determinación sistemática de la densidad mineral ósea (DMO) y el uso de bifosfonatos durante el periodo de rehabilitación [6].
Las teorías etiopatogénicas que han intentado explicar este desenlace son diversas, y van desde un incremento de las caídas, consecuencia de la alteración de la marcha [1], a una disminución acelerada de la masa ósea provocada por la inmovilidad [7]; este planteamiento se ve reforzado por algunos estudios que encuentran diferencias significativas de la masa ósea entre el lado parético y el sano, así como relaciones de los niveles de DMO con la actividad funcional residual [7-9].
Algunos autores han planteado que el incremento del riesgo de fractura radica en el déficit de vitamina D [10] que suelen padecer los pacientes aquejados de hemiplejia, déficit atribuible a carencias alimentarias y baja exposición solar. El impacto sobre la calidad ósea y un mayor riesgo de caídas por debilidad muscular podría explicar el aumento de las fracturas [11].
También se han apuntado alteraciones genéticas, ya que puede haber mayor presencia en los pacientes con ictus de un polimorfismo en el gen OPG-1181c/C, que controla la síntesis de osteoprotegerina; aunque esta alteración sólo se ha relacionado con ictus de etiología hemorrágica [12].
Teorías más recientes señalan la alteración del remodelado óseo, muy incrementado durante el primer al año post-ictus, como causa del deterioro de la calidad ósea [13-15].
Pero también es posible que los pacientes que sufren un accidente cerebrovascular (ACV) lleguen a este desenlace con niveles más bajos de DMO y por tanto mayor riesgo de sufrir fracturas osteoporóticas [16].
La explicación de esta situación podría encontrase en la relación, todavía no suficientemente aclarada, entre dislipemias, arteriosclerosis y osteoporosis, con posibles mecanismos etiopatogénicos comunes [17].
El objetivo del presente estudio fue conocer el riesgo absoluto de fractura mayor osteoporótica y de cadera utilizando la herramienta FRAX® en pacientes con ACV; como objetivos secundarios, intentamos evaluar la existencia de diferencias basales en los parámetros osteometabólicos y de DMO entre pacientes con ictus y un grupo control sin patología cerebrovascular.
Pacientes y método
Se ha realizado un estudio prospectivo multicéntrico comparativo, por emparejamiento no 1:1 de 50 pacientes con ACV frente a 32 controles, en el que han participado los servicios de Rehabilitación de cinco hospitales españoles. La inclusión de pacientes se inició en marzo de 2011, finalizando en junio de 2013.
El estudio fue autorizado por el Comité Ético de Investigación Científica de los hospitales participantes. Por limitaciones presupuestarias para realizar densitometrías óseas, en un centro no se pudo realizar el estudio del grupo control.
Todos los pacientes, tanto del grupo de estudio como del control, firmaron un consentimiento informado.
Criterios de inclusión y exclusión
a) Grupo de pacientes con ACV: los criterios de inclusión fueron:
- Pacientes remitidos a la consulta de rehabilitación con el diagnostico de ACV de menos de 3 meses de evolución, ya sea de etiología isquémica o hemorrágica.
- Edad comprendida entre 60-80 años.
Como criterios de exclusión se establecieron:
- Pacientes que antes de sufrir el ictus estuvieran encamados, por cualquier patología, durante más de 24 semanas.
- Pacientes sin capacidad de deambulación antes del ictus.
- ACV previos con secuelas funcionales.
- Pacientes diagnosticados de osteoporosis secundaria a: hiper o hipoparatiroidismo, hiper o hipotiroidismo, hipogonadismo en el varón, tratamiento con corticoides orales de más de 3 meses, alcoholismo crónico con presencia de alteraciones hepáticas.
b) Grupo control:
Se estableció con pacientes que acudieron a la consulta de Rehabilitación por cualquier patología y no sufriesen una enfermedad vascular (ACV, patología cardiaca isquémica, isquemia arterial de miembros inferiores).
La selección se hizo siguiendo un sistema pareado de edad y sexo.
El resto de criterios de exclusión fueron coincidentes a los del grupo ACV: encamamiento, incapacidad para la deambulación, osteoporosis secundaria.
Variables estudiadas del grupo de ACV
- Edad y sexo.
- Etiología del ACV isquémico o hemorrágico.
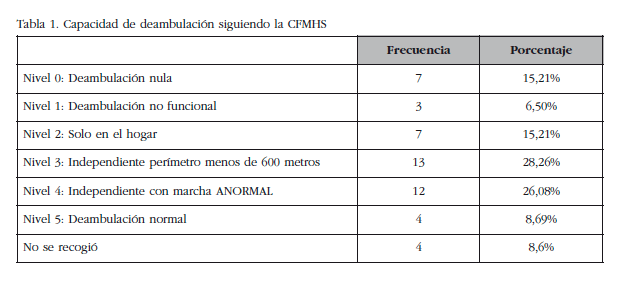
- Capacidad para la deambulación siguiendo la Clasificación Funcional de la Marcha del Hospital de Sagunto (CFMHS), que estratifica de la siguiente forma esta actividad:
Nivel 0: Deambulación imposible o nula.
Nivel 1: Deambulación no funcional.
Nivel 2: Deambulación solo en el interior de locales y del domicilio.
Nivel 3: Deambulación alrededor de la casa con perímetros inferiores a 600 metros.
Nivel 4: Deambulación independiente por la comunidad, pero con marcha anormal (cojera de cualquier tipo).
Nivel 5: Deambulación normal sin claudicación ni limitaciones.
- Antecedentes de fracturas por fragilidad en los 10 años previos al ACV y localización.
- Número de caídas en el año anterior al ictus.
- DMO de cadera.
- T-score: considerándose osteopenia entre -1 a -2,5 y osteoporosis cuando T <-2,5.
- Índice de FRAX®: se consideró riesgo de fractura cuando los valores del porcentaje de fractura mayor osteoporótica era ≥10 y el de fractura de cadera ≥3.
- Determinaciones analíticas:
* Bioquímica: glucosa, colesterol y triglicéridos.
* Marcadores óseos: fosfatasa alcalina total, 25-hidroxivitamina D, PTH, calcio, fósforo y telopéptido carboxiterminal del colágeno I (CTX) en sangre.
En el grupo control se recogieron los mismos datos, a excepción de los relacionados con la hemiplejia y la situación funcional.
Análisis estadístico:
Se realizó un análisis estadístico inicial calculando las frecuencias y porcentajes de las variables categóricas. El estudio estadístico comparativo se ha realizado utilizando tablas de contingencia con análisis de residuos.
Para las variables cuantitativas se han calculado la medias y desviación estándar, utilizándose el test de la t-Student para realizar el análisis comparativo. El nivel de significación estadística se estableció en p<0,05 para todas las variables analizadas.
Resultados
Se han estudiado un total de 82 pacientes: 50 pacientes con ACV y 32 que constituyeron el grupo control.
Respecto al sexo, en el grupo ACV hubo 24 varones (48%) y 26 mujeres (52%), no existiendo diferencias significativas con el grupo control, que estuvo formado por 14 varones (43,75%) y 18 mujeres (56,25%).
Tampoco se encontraron diferencias significativas en la edad media de ambos grupos, ACV: 70,32 años (DE±5,8); y grupo control: 72,44 años (DE±6,6).
Los procesos isquémicos determinaron la etiología en 39 pacientes (91%) y se diagnosticó hemorragia cerebral en 4 (9%); no se comunicó la causa en 7 pacientes.
La mayoría de los pacientes del estudio presentaron una capacidad de deambulación en estadio 3 o 4 de la CFMHS (Tabla 1).
Los pacientes con ACV sufrieron mayor número de caídas en el año anterior al estudio; por el contrario los del grupo control tenían un mayor historial de fracturas por fragilidad (Tabla 2).
T-score en cadera: El 66% de los pacientes con ACV y el 50,15% del grupo control presentaban una T-score en niveles de osteopenia o de osteoporosis, no existiendo diferencias significativas entre ambos grupos (Tabla 2).
DMO de cadera: Los pacientes hemipléjicos presentaron un nivel medio de masa ósea en cadera menor que el grupo control, pero las diferencias no fueron significativas (Tabla 4).
Índice FRAX®: En el grupo control fue mayor el número de pacientes con riesgo elevado de sufrir una fractura por fragilidad que el grupo ACV, aunque las diferencias no fueron estadísticamente significativas (Tabla 2).
Determinaciones bioquímicas: Los niveles de colesterol fueron más altos en el grupo control, no así la glucemia y triglicéridos, las diferencias no fueron en ningún caso significativas (Tabla 3).
Marcadores analíticos de metabolismo óseo: Niveles de vitamina D: En el grupo ACV 32 pacientes (68%) presentaban niveles por debajo de 30 ng/ml, catalogándose de insuficiencia o deficiencia de vitamina D. En el grupo control 22 pacientes (71%) eran insuficientes o deficientes en esta vitamina. Las diferencias entre los grupos no eran significativas.
Tampoco se han encontrado diferencias significativas en los valores de calcio, fósforo y PTH.
Los niveles de CTX estaban significativamente elevados en pacientes con ACV (Tabla 4).
Discusión
En el presente estudio se pretendió mostrar la situación basal en relación al riesgo de fractura osteoporótica de pacientes que han sufrido un ACV reciente, asumiendo que la mayoría de hallazgos van a estar más relacionados con sus antecedentes patológicos y estilo de vida, que con el impacto que sobre el sistema óseo puede provocar, con el paso del tiempo, un ictus con repercusiones motoras.
Como cabía esperar, en la mayoría de pacientes el ictus fue de etiología isquémica, siendo la tasa obtenida del 91% la más alta de lo encontrado en los servicios de Neurología [18], aunque es posible que la superior mortalidad del ictus hemorrágico provoque una mayor proporción de ACV isquémicos en los servicios de rehabilitación.
Para la valoración de la situación funcional hemos utilizado la CFMHS, que es una escala validada [19] y de amplia difusión en los servicios de Rehabilitación; la hemos preferido a otras más conocidas, como la de Barthel, por centrarse en la capacidad de deambulación del paciente, actividad de la vida diaria más relevante en la evolución de la salud ósea.
En relación a los resultados obtenidos con esta escala de deambulación, nos parece importante remarcar que el 62% de los pacientes con ictus presentaban una marcha autónoma, aunque fuese con limitaciones, situación que puede sorprender en ACV en fase aguda; tal vez pueda existir un sesgo de selección por las dificultades que para el estudio (traslados, pruebas, etc.) pudieran tener los pacientes con afectaciones motoras más graves.
Hemos seleccionado el índice FRAX® por ser una herramienta de creciente difusión, a pesar de reconocérsele algunas limitaciones. Se estableció la línea de corte en 10 para la fractura mayor osteoporótica, y de 3 para establecer el riesgo elevado de fractura de cadera, por ser los valores mínimo de corte que, cuando se inició el estudio, era aconsejado y utilizado por otros autores españoles [20,21]; aunque cada vez es mayor la evidencia de que el FRAX® infravalora en la población española el riesgo de fracturas, en especial la fractura mayor osteoporótica, siendo más sensible la predicción de fractura de cadera [22], pero debemos destacar que ésta es la más relevante para nuestro estudio.
Utilizando esta cifras corte, encontramos que el 12% de los pacientes tenían riesgo elevado de padecer una fractura de cadera, y el 8% de sufrir una fractura mayor osteoporótica en los próximos diez años; no hemos encontrado trabajos semejantes en pacientes con ictus que nos permita comparar nuestros resultados.
En cuanto a los valores de DMO del cuello femoral, el 58% de los pacientes con ictus presentaban osteopenia y el 8% osteoporosis, en el estudio publicado por Hye Won [16], realizado en pacientes de las mismas características que los nuestros (ACV en fase aguda), encontraron cifras de osteopenia y osteoporosis de columna del 39% y 43% respectivamente, aunque hemos de recordar que, según los estudios realizados por Díez Curiel, la disminución de la DMO es más frecuente en columna que en cadera [23].
Puede sorprender que el grupo control, pese a ser homogéneo en edad y sexo con los pacientes con ACV, presente un riesgo más elevado de sufrir fractura mayor osteoporótica o de cadera, situación que se puede correlacionar con un mayor número de fracturas por fragilidad en los 10 años previos al estudio, este hallazgo puede hacer sospechar un sesgo de selección y por tanto una limitación de nuestros resultados, que ha favorecido la inclusión de pacientes con osteoporosis en el grupo control. Aunque no podemos olvidar que la prevalencia de osteoporosis en una consulta general de rehabilitación es muy alta, como describe Serralta [24] que encuentra esta patología en el 53% de sus pacientes.
La relación entre dislipemias y metabolismo óseo ha sido comunicada por diversos autores, aunque sin hallazgos concluyentes [17]; en nuestro estudio no hemos encontrado diferencias significativas con el grupo control en ninguno de los parámetros bioquímicos. En términos absolutos, las cifras de colesterol son más bajas en los pacientes con ACV. Estos resultados tienen que ser tomados con precaución, ya que no hemos recogido los posibles tratamientos hipolipemiantes, lo que es una limitación del estudio, en especial por la importancia que parecen tener las estatinas en el metabolismo óseo y en la disminución del riesgo de fracturas [17].
Es de destacar el importante número de pacientes con insuficiencia o deficiencia de vitamina D en ambos grupos, hallazgo que apunta una vez más a la prevalencia del déficit de este sistema hormonal en España, que se presenta en el 30% de la población general, llegando a afectar al 87% de los ancianos institucionalizados [25,26].
Lo más relevante de los hallazgos analíticos es el incremento de los marcadores de resorción ósea CTX en el grupo con ictus. Este hallazgo ha sido recogido en otros estudios que, como el nuestro, se han realizado en pacientes con ictus en fase aguda [15] y se correlacionan con mayores pérdidas de masa ósea en cadera [13].
Para estos autores existe una correlación entre los niveles elevados de CTX y el grado de afectación motora; en este caso sería el factor mecanostato el más influyente en el aumento de la reabsorción ósea de estos pacientes; pero el metabolismo óseo es un proceso complejo donde intervienen factores locales y endocrino-metabólico con un posible efecto final en el RANK-RANKL-OPG, que sería el agente final del proceso de remodelado óseo [27].
Es posible que, de la misma forma que se han comunicado alteraciones de este sistema en la enfermedad de Paget, cáncer de próstata o artritis reumatoide, entre otras [27], encuentren alguna alteración especifica de estas citocinas en los pacientes con ACV.
En conclusión, si queremos disminuir el riesgo de los pacientes con ACV para padecer una fractura de cadera en los años siguientes al ictus, se deberá planificar un programa de terapia física con carga y deambulación, para favorecer el factor mecanostato, sin olvidar la necesidad de un tratamiento antirresortivo, al menos en pacientes donde se detecte riesgo de fractura.
Conflicto de interés: Los autores declaran que no existen conflictos de intereses.
Bibliografía
1. Suzuki T, Yoshida H, Hashimoto T, Yoshimura N, Fujiwara S, Fukunaga M, et al. Case control study of risk factors for hip fractures in the Japanese elderly by a Mediterranean Osteoporosis study (MEDOS) questionnaire. Bone 1997;21:461-7. [ Links ]
2. Kang H, Chung SD, Xirasgar S, Jaw FS, Herng-Ching L. Increased risk of stroke in the year afther a hip fracture a population-based follow-up sudy. Stroke 2011;142:336-41. [ Links ]
3. Trimpou P, Landin-Wilhelmse K, Oden A, Rosengren A, Wilhelmsen L. Male risk factors for hip fracture-a 30-years follow-up study in 7.495 men. Osteoporos Int 2010;21:409-16. [ Links ]
4. Huang PJ, Lee SH. Case control study of risk factors for hip fracture in the elderly. Hu Li Za Zhi 2012;59:45-54. [ Links ]
5. Fisher A, Srikusalanukul W, Davis M, Smith P. Poststroke hip fracture: prevalence, clinical characteristics, mineral-bone metabolism, outcomes, and gaps in prevention. Stroke Res Treat 2013; doi: 10.1155/2013/641943. Epub 2013 Sep 25. [ Links ]
6. Powels S, Lalmohamed A, Leufken B, de Boer A, Cooper C, Van Staa T, et al. Risk of hip/femur fracture after stroke: a population-based case control study. Stroke 2009;40:3281-5. [ Links ]
7. Dermirag D, Ozdemi F, Kokino S, Berkarda S. The relations between mineral density and immobilization duration in hemiplegic limbs. Ann Nucl Med 2005;19:695-9. [ Links ]
8. Takaoto S, Masuyama T, Nakajima M, Sekiya K, Kosaka H, Morimoto T, et al. Alterations of bone mineral density of the femurs in hemiplegia. Calcif Tissue Int 1995;56:259-62. [ Links ]
9. Beaupre GS, Lew HL, Bone density changes after stroke. Am J Phys Rehabil 2006;85:464-72. [ Links ]
10. Yoshiro S. Abnormal bone and calcium metabolism in patients after stroke. Arch Phys Med Rehabil 2000;81:117-21. [ Links ]
11. Bischoff-Ferrari HA, Dawson-Hughes B, Willett WC, Staehelin HB, Bazemore MG, Zee RY, et al. Effects of vitamin D on falls: a meta-analysis. JAMA 2004;291:1999-6. [ Links ]
12. Strand M, Söderström I, Wiklud PG, Hallmans G, Weinehall L, Södeerberg S, et al. Polymorphism at the osteprotegerin and interleukin-6 genes in relations t first-ever stroke. Cerebrovascular Dis 2007;24:418-25. [ Links ]
13. Paker N, Bugdayci D, Tekdos D, Caglayan D, Kaya B. Relationship between bone turnover and bone density at the proximal femur stroke patients. J Stroke Cerebrovasc Dis 2009;18:139-43. [ Links ]
14. Ryan DJ, Browne JG, Healty M, Casey Habirson JA. Biochemical indices of bone turnover in stroke patients are comparable to that of hip fracture patients. Bone 2009;44(Sup 2):S253-S338. [ Links ]
15. Haddaway MJ, Bainbridge NJ, Powell DE, Davie MW. Bone resorption in stroke and institutionalized subjects. Calcif Tissue Int 2009;84:118-25. [ Links ]
16. Kim HW, Kang E, Im S, Ko YJ, Im SA, Lee JI. Prevalence of pre-stoke low bone mineral density and vertebral fracture I first stoke patients. Bone 2008;43:183-6. [ Links ]
17. Yezerska I, Hernández JL, Olmos JM, González J. Dislipemias y metabolismo óseo. ¿Un vínculo común de la osteoporosis y aterosclerosis? Rev Osteoporos Metab Miner 2011;1:41-50. [ Links ]
18. Ustrell-Roiga X, Serena-Lealb J. Diagnóstico y tratamiento de las enfermedades cerebrovasculares. Rev Esp Cardiol 2007;60:753-69. [ Links ]
19. Viosca E, Lafuente R, Martínez JL, Almagro P, Gracia A, González C. Walking recovery after an acute stroke: Assessment with a new functional classification and the Barthel index. Arch Phys Med Rehabil 2005;86:1239-44. [ Links ]
20. Mesa Ramos M. Métodos Diagnósticos en Osteoporosis. En: ARC en Osteoporosis 2011. Revisión de Abstractas. Madrid Ed Luzan 5 SA; 2011; p.38. [ Links ]
21. Olmo Fernández-Delgado JA. ¿Podría el índice de FRAX® modificar el tratamiento de la osteoporosis? Rev Osteoporos Metab Miner 2012;4:23-6. [ Links ]
22. Kanterewicz E, Sierra G, Puigoriol E, Tebé C, Peris P. Riesgo de fractura en la cohorte FRODOS. Estudio comparativo de la aplicación del modelo FRAX® español, francés, inglés y sueco. Rev Osteoporos Metab Miner 2014;6:14-9. [ Links ]
23. Diaz Curiel M, Carrasco de la Peña JL, Honorato Perez J, Perez Cano R, Rapado A, Ruiz-Martínez I. Study of bone mineral density in lumbar spine and femoral neck in a Spanish population. Osteoporosis Int 1997;7:59-64. [ Links ]
24. Serralta-Dávila I, Girbes-Borras I. Motivos de consulta e rehabilitación con factores de riesgo clínico de osteoporosis. Rehabilitación 2008;42:73-9. [ Links ]
25. Quesada Gómez JM, Sosa Henríquez M. Nutrición y osteoporosis. Calcio y vitamina D. Rev Osteporos Metab Miner 2011;4:165-82. [ Links ]
26. Groba Marco MV, Mirallave Pescador A, González Rodríguez E, García Santana E, González Padilla E, Saavedra Santana P, et al. Factores relacionados con la insuficiencia de de vitamina D en estudiantes de Medicina de Gran Canaria. Rev Osteporos Metab Miner 2010;2:11-8. [ Links ]
27. Neyro Bilbao JL, Cano Sánchez A, Palacios Gil-Antuñano S. Regulación del metabolismo óseo a través del sistema RANK-RANKL-OPG. Rev Osteoporos Metab Miner 2011;3:105-12. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan A. Olmo Fernández-Delgado
Avda. Río Segura, 8
30002 Murcia (España)
Correo electrónico: juanolmofernandez@hotmail.com
Fecha de recepción: 08/12/2013
Fecha de aceptación: 26/05/2014











 texto em
texto em