Introducción
El hiperparatiroidismo secundario (HPTS) es una complicación frecuente de la enfermedad renal crónica (ERC) caracterizada por hiperplasia de las glándulas paratiroides y aumentos en la síntesis y secreción de hormona paratiroidea (PTH). Las elevaciones de los niveles séricos de PTH causan alteraciones en el remodelado óseo y en la homeostasis fosfo-cálcica que incrementan tanto la propensión a fracturas como a calcificación vascular, procesos que agravan la morbi-mortalidad del enfermo renal 1.
En el curso de la ERC, los estímulos más importantes para el desarrollo de HPTS son los descensos en los niveles circulantes de calcio, de vitamina D nutricional y de su forma hormonal, el calcitriol, como así también las elevaciones en el fósforo sérico, aún cuando se alcancen niveles inferiores al límite superior del rango normal 2.
Es importante destacar que el grado de hiperplasia paratiroidea en la ERC se asocia también con una disminución proporcional de la expresión paratiroidea de los receptores de calcio y vitamina D (CaSR y VDR) 3. Estas reducciones atenúan la capacidad de la glándula de suprimir tanto las tasas de proliferación celular como las de secreción de PTH en respuesta a los cambios en los niveles circulantes de calcio y vitamina D, inducidos por el tratamiento dirigido a corregir la hipocalcemia o la deficiencia de vitamina D. Un agravante adicional a la disfunción paratiroidea de la ERC es la disminución temprana de la molécula anti-envejecimiento, α-Klotho, en la membrana de las células paratiroides 4. Esta reducción conduce a una ineficaz supresión de la síntesis y secreción de PTH por la hormona fosfatúrica FGF23, ya que α-Klotho actúa como co-receptor obligado para las señales celulares del complejo de FGF23 con su receptor específico FGFR 5,6.
Hoy sabemos que, además de los defectos en el control transcripcional tanto del gen de la PTH como del CaSR y del α-Klotho debidos a la deficiencia de calcitriol, o a la disminución de los niveles de su receptor, el VDR, en la glándula paratiroides hiperplásica 3,4, podrían también contribuir a la disfunción paratiroidea del enfermo renal modificaciones epigenéticas, como la hipermetilación de los genes de CaSR, VDR o α-Klotho en sus regiones promotoras. El interés en la epigénetica del HPTS en la ERC surgió de la evidencia del rol crítico de la hipermetilación de genes supresores de tumores en procesos de proliferación celular exacerbada 7,8, tal y como ocurre en el HPTS nodular. Esta forma de HPTS es similar en su desarrollo a un tumor benigno endocrino, con un impacto adverso muy grave tanto en la progresión del HPTS, del daño renal y vascular, como también en la supervivencia del enfermo renal por el desarrollo de resistencias al tratamiento 9,10.
Por el contrario, existen evidencias del impacto significativo de aumentos leves de la metilación del gen α-Klotho inducidas por el envejecimiento en el cerebro y por toxinas urémicas en el riñón, tanto en la expresión de α-Klotho en la membrana celular como también en sus funciones anti-oxidantes y anti-inflamatorias 11,12 que no se han estudiado en la glándula paratiroides.
Otra modificación epigénetica de gran interés para el control del HPTS es la hipometilación global del gen de la PTH, demostrada exclusivamente en el tejido paratiroideo 13. Aun cuando el grado de hipometilación global del gen de PTH es similar en glándulas con función normal y glándulas hiperfuncionantes 13, este hallazgo sugiere que un proceso de metilación diferencial de este gen en sus regiones promotoras podría contribuir a la severidad del HPTS.
Debido a que la retención de fósforo por el riñón enfermo es el mayor factor de riesgo para exacerbar directamente el grado de hiperplasia paratiroidea, de estabilización del ARN mensajero de PTH, de la secreción de PTH a la circulación y de los aumentos de FGF23 en la ERC, por mecanismos no transcripcionales, el objetivo de este trabajo fue evaluar en un modelo murino de ERC, la posible contribución de alteraciones epigenéticas inducidas por elevaciones en el fósforo sérico a la severidad de la disfunción paratiroidea. Para ello, comparamos el grado de metilación de los promotores de los genes de CaSR, VDR, Klotho y PTH en ratas urémicas alimentadas con dietas con contenido en fósforo normal o elevado y su asociación con la gravedad del HPTS.
Material y métodos
Estudio experimental
Para el estudio se utilizaron ratas Wistar macho de 4 meses de edad procedentes del animalario de la Universidad de Oviedo, sometidas a una nefrectomía (NX) de 7/8 consistente en la eliminación de tres cuartas partes del riñón izquierdo y con resección total del riñón derecho 14.
Inmediatamente después de la nefrectomía, un grupo de animales urémicos continuó con la dieta de mantenimiento para roedores que posee contenido normal (N) en fósforo (P) (0,6%; grupo NX-NP), mientras que el otro grupo de animales nefrectomizados recibió una dieta con elevado (E) contenido en fósforo (0,9%; grupo NX-EP) durante 20 semanas.
En el momento del sacrificio, realizado bajo anestesia con CO2 y por exanguinación, se recogió suero para determinar marcadores generales del grado de ERC y de alteraciones en el metabolismo óseo y mineral y también las glándulas paratiroides de cada grupo experimental (14 glándulas de 7 ratas por grupo) almacenadas a -80ºC hasta su utilización.
Análisis de la metilación de los promotores de los genes a estudio mediante pirosecuenciación de bisulfito
Para la extracción del material genómico de las glándulas paratiroides de rata se utilizó el método del fenol-cloroformo. El ADN extraído de las glándulas paratiroides se trató con bisulfito sódico siguiendo las instrucciones del kit de bisulfitación EZ DNA Methylation-Gold™ Kit D5005” (Zymo Research, Orange, EE.UU.). A continuación se realizó una reacción en cadena de la polimerasa (PCR) específica, con cebadores biotinilados, seguida luego por el protocolo de pirosecuenciación (PyroMark QUIAGEN® Q24), consistente en desnaturalizar las dobles cadenas de los productos de PCR para obtener cadenas simples, una de ellas marcada con biotina. La cadena biotinilada se utilizó como molde para la unión del cebador de secuenciación. Con el programa informático Pyromark 2.0.6 se analizó el patrón de metilación de la región de los promotores de los genes de PTH, VDR, CaSR y Klotho comprendida entre el inicio de la transcripción hacia el extremo 5’ utilizando las parejas de cebadores que se indican en la tabla 1.
Resultados
Datos bioquímicos
Los datos bioquímicos de ambos grupos experimentales se presentan en la tabla 2. Como era de esperar, los animales alimentados con la dieta con elevado contenido en fósforo (NX-EP) tuvieron un mayor deterioro de la función renal medida como urea y creatinina séricas, con respecto a los valores de estos parámetros en el grupo de ratas urémicas alimentadas con la dieta con contenido de fósforo normal (NX-NP).
Si bien no se encontraron diferencias significativas en los niveles de calcio sérico entre ambos grupos experimentales, la combinación de una menor función renal y de un elevado fósforo de la dieta condujo a aumentos marcados en los niveles circulantes de fósforo y FGF23 en el orden de 2 y 3 veces superiores a los valores de estos parámetros en los animales urémicos alimentados con fósforo normal. Consecuentemente, el grado de HPTS fue también superior en los animales urémicos con fósforo elevado en la dieta, mostrando niveles séricos 40 veces superiores de PTH.
Metilación de las regiones promotoras de los genes a estudio
La figura 1 muestra los porcentajes de metilación de los sitios CpG en el ADN paratiroideo comprendido en las regiones promotoras de los genes del CaSR, VDR y Klotho. El escaso porcentaje de metilación, inferior al 5% en ambos grupos experimentales, impide toda comparación de posibles alteraciones epigenéticas diferenciales atribuibles al elevado fósforo de la dieta comparado con una ingesta de fósforo normal.

Figura 1 Grado de metilación de los sitios CpGs que preceden el inicio de la transcripción del promotor de los genes de A) CaSR (-172 a -3); B) VDR (-533 a -189) y C) ?-Klotho (-217 a -96) en glándulas paratiroides provenientes de ratas nefrectomizadas (NX) alimentadas con una dieta con contenido en fósforo normal PN (NX-PN) o elevado (NX-PE) durante 20 semanas. En la parte inferior de cada gen se representa gráficamente la zona analizada del promotor y el número de sitios CpG existentes en dicho fragmento
A diferencia de estos genes que disminuyen con la progresión del HPTS, la figura 2 muestra que en las dos CpGs del área estudiada del promotor del gen de la PTH se encontró que en las glándulas paratiroides de las ratas urémicas alimentadas con fósforo normal existe un porcentaje de ADN paratiroideo metilado superior al 40%. Más importante aún, para el mismo grado basal de daño renal y de duración de la uremia (20 semanas), el elevado fósforo en la dieta se asoció a una disminución significativa del 80% en la metilación de esa región del promotor de PTH. Esta disminución está en consonancia con incrementos en los niveles de PTH en el suero de estos animales 40 veces por encima de la PTH sérica de animales con el mismo grado basal de uremia alimentados con dieta con fósforo normal.
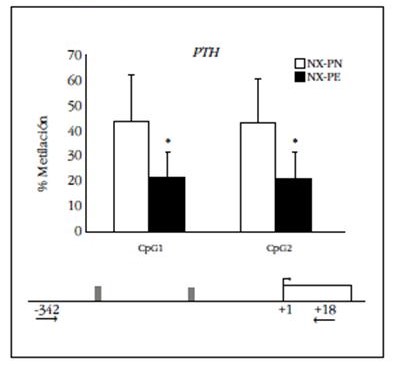
Figura 2 Grado de metilación en los sitios CpGs de la región -342 a +18 del promotor de PTH que precede el inicio de la transcripción en glándulas paratiroides provenientes de ratas nefrectomizadas (NX) alimentadas con una dieta con contenido en fósforo normal (NX-PN) o elevado (NX-PE) durante 20 semanas. (*p<0,05 respecto al NX-PN). En la parte inferior del gen se representa gráficamente la zona analizada del promotor y el número de sitios CpG existentes en dicho fragmento
Discusión
Este estudio demuestra por vez primera una posible asociación epigenética entre la hiperfosfatemia de la ERC y la severidad del HPTS: la hipometilación del gen de la PTH. Además, nuestros resultados corroboran los hallazgos de otros investigadores en cuanto a que los descensos en el contenido paratiroideo de CaSR y de VDR no pueden atribuirse a un proceso epigenético de silenciamiento por hipermetilación de estos genes, ambos críticos para el tratamiento efectivo del HPTS. Nuestros hallazgos también cuestionan la contribución de la hipermetilación del promotor de α-Klotho en los descensos del α-Klotho de membrana que ocurre con la progresión del HPTS.
En general, la hipermetilación de islas CpG en regiones promotoras da lugar al silenciamiento de la transcripción de los genes. Nuestros resultados indican un grado de metilación inferior al 5% en el CaSR y el VDR, ambos reguladores decisivos tanto de la función paratiroidea normal como del desarrollo de resistencia al tratamiento. Además, el elevado fósforo de la dieta, que condujo a aumentos significativos tanto en el grado de daño renal como del HPTS de estos animales nefrectomizados, no indujo cambios significativos en el grado de metilación del CaSR o del VDR, tal y como demostraron también otros investigadores en modelos murinos 15, pero tampoco utilizando medidas del grado de metilación global de estos dos genes en glándulas paratiroides humanas provenientes de sujetos normales o con grado variable de HPTS y primario, y en las que la contribución de la hiperfosfatemia no era el objetivo principal del análisis epigenético 16,17.
Con respecto al grado de metilación del gen anti-envejecimiento α-Klotho, su grado de metilación fue también inferior al 10%, y no se observaron diferencias significativas en el porcentaje de metilación de las CpGs inducidas por el elevado fósforo en la dieta, al menos en la zona del promotor estudiada en las glándulas paratiroides proveniente de ambos grupos experimentales de ratas urémicas. Estos hallazgos no son sorprendentes, ya que en las células del túbulo renal distal, que es donde el gen Klotho se expresa mayoritariamente en un riñón normal, parece existir un mecanismo que activamente protege al promotor de Klotho de la metilación de secuencias CpGs 18. En otros tejidos, con baja expresión de α-Klotho, como en cerebro, mama, estómago, colon, músculo esquelético o piel, también parece existir un mecanismo similar de protección de los niveles de α-Klotho previniendo su metilación. Es importante destacar también que varios autores han observado que un exiguo grado de metilación parece ser suficiente para causar diferencias significativas en el grado de expresión del gen. De hecho, King y cols. han demostrado en cerebro de monos envejecidos que un pequeño incremento del 0,4% en la metilación de las islas CpG da lugar a descensos de un 20% en la expresión del gen, corroborando que el grado de metilación de secuencias CpGs pueda estar implicado en la regulación a la baja del gen Klotho asociada al envejecimiento 13.
Otros autores han referido también diferencias pequeñas (del 1 al 4,5%) en el grado de metilación a nivel renal en ratones nefrectomizados 13, similares a los valores de metilación paratiroides obtenidos en este estudio (del 2 al 5%). De todos modos, el elevado fósforo de la dieta no condujo a incrementos significativos en el grado de metilación de este gen en el tejido paratiroideo.
Sin duda, el hallazgo más importante de este estudio ha sido la identificación, por vez primera, de una asociación entre la hiperfosfatemia y una disminución de la metilación del promotor de PTH en la secuencia de 350 nucleótidos que precede al inicio de la transcripción. Si bien estudios de hace casi dos décadas, utilizando técnicas que precedieron el desarrollo de la pirosecuenciación, demostraron una hipometilación global del gen de la PTH exclusiva del tejido paratiroideo, pero sin diferencias significativas entre glándulas con función normal o hiperfuncionantes, el resultado de este estudio agrega una posible modificación epigenética a los conocidos mecanismos post-transcripcionales inducidos por el elevado fósforo para aumentar marcadamente la síntesis y secreción de PTH, como son la estabilización de ARN mensajero de PTH o la inducción de las vías de secreción 19,20,21. Es importante destacar que la significativa hipometilación del gen de la PTH inducida por el elevado fósforo de la dieta podría contribuir en parte a las marcadas elevaciones en los niveles séricos de PTH en este modelo murino de enfermedad renal experimental avanzada. Sin embargo, no podemos descartar con estos resultados que, en realidad, sea el fósforo normal o bajo de la dieta la causa de la mayor metilación del gen de PTH en el curso de las 20 semanas de uremia estudiadas en este trabajo. De hecho, la restricción de fósforo en la dieta no afecta el contenido intra-glandular de PTH, sino la capacidad de la célula paratiroides para su secreción a la circulación 22.
Una limitación importante de este estudio es que no se ha estudiado el impacto de la metilación de estas dos CpGs en la transcripción del gen de PTH. Por tanto, solo podemos postular un mecanismo potencial a ser analizado con mayor profundidad en el futuro con el objeto de identificar una relación causa-efecto entre el desarrollo de hipometilación del gen de PTH y sus mecanismos moleculares de control, que permitirían la incorporación de nuevas estrategias terapéuticas para el control del HPTS en la ERC.
En conclusión, estos hallazgos sugieren que el desarrollo de alteraciones epigenéticas como la significativa hipometilación del gen de la PTH, que se alcanza en estadios avanzados de disfunción de la glándula paratiroides en la enfermedad renal experimental, podrían contribuir al incremento tanto de la síntesis como la secreción de PTH. El diseño de estudios que permitan obtener evidencias concluyentes del impacto que la hipometilación tenga sobre la síntesis de PTH y que conduzcan a la identificación de los mecanismos moleculares responsables de esta modificación epigenética inducida por el elevado fósforo de la dieta, constituye el primer paso obligatorio para el diseño de estrategias terapéuticas innovadoras para el tratamiento efectivo del HPTS desde estadios tempranos de la ERC.











 texto en
texto en 




