Introducción
La calcificación vascular (CV) es una de las alteraciones más frecuentes en el envejecimiento, pero especialmente en pacientes con enfermedad renal crónica (ERC). El aumento de las especies reactivas de oxígeno en respuesta a sobrecargas de fósforo (P) que ocurre durante la CV, contribuye a la desdiferenciación fenotípica de las células de músculo liso vascular (CMLV) de un fenotipo propiamente muscular (contráctil) a un fenotipo osteoblástico 1,2,3,4. En concreto, se sabe que el peróxido de hidrogeno, uno de las especies reactivas de oxígeno más comunes, es capaz de inducir la expresión del factor de transcripción osteoblástico Cbfa1/RUNX2 e inducir la calcificación 5,6.
Los microARNs (miRs) son pequeños ARNs (~22 nucleótidos) no codificantes de cadena simple que median el silenciamiento postranscripcional de genes al unirse por complementariedad de bases a la región 3’ UTR de los ARNm diana. Los miRs están implicados en procesos biológicos cruciales, incluyendo proliferación celular, diferenciación y desarrollo de tejidos 7,8. Estudios recientes han demostrado que varios miRs son importantes reguladores de la diferenciación de las CMLV a células semejantes a osteoblastos y, por tanto, de la calcificación vascular 9,10,11,12.
El miR-377 aparece como un importante regulador del envejecimiento al regular, entre otros, al enzima superóxido dismutasa 2 (SOD-2) 13,14. La SOD es el principal antioxidante del organismo, que cataliza la conversión de radical superóxido a peróxido de hidrógeno. La SOD-2 corresponde a la forma mitocondrial del enzima. Numerosos trabajos han estudiado el papel del estrés oxidativo como inductor de la CV, por lo que en el presente estudio nos planteamos analizar en un modelo in vivo el posible papel del miR-377 como regulador de la mineralización de la aorta.
Materiales y métodos
Modelo de calcificación vascular
El protocolo fue aprobado por el Comité Ético de Experimentación Animal de la Universidad de Oviedo.
El estudio se realizó con ratas Wistar macho (n=10) de 4 meses de edad (350-400 g) que fueron sometidas a una insuficiencia renal crónica (IRC) (7/8) en un solo acto quirúrgico, previa anestesia con isoflurano por vía inhalatoria. Se realizó nefrectomía completa del riñón derecho y a continuación nefrectomía subtotal del riñón izquierdo, mediante incisión lateral y del polo superior. Con este procedimiento se conserva aproximadamente la cuarta parte de la masa renal. Las ratas con IRC se dividieron en dos grupos: uno, PN, alimentado con dieta para roedores estándar con un contenido normal de P (0,6%) y 0,6% de calcio (Ca), y un contenido de proteína del 20% (Panlab, Barcelona, España); y el otro, PA, alimentado con una dieta con alto contenido en P (0,9%), 0,6% de Ca, y un contenido de proteína del 20% (Panlab, Barcelona, España). El estudio duró 20 semanas con el objeto de inducir calcificaciones vasculares. Se incluyó igualmente un grupo Sham (n=5) que fue seguido hasta la semana 20. Veinticuatro horas antes del sacrificio, las ratas se alojaron en jaulas metabólicas para obtener muestras de orina recibiendo en cada caso la misma dieta y agua ad libitum. Se sacrificaron usando como anestesia CO2, y se extrajeron muestras de suero para su análisis. De cada rata se extrajo la aorta abdominal descendente hasta la bifurcación de las ilíacas y se dividió en tres porciones: el primer fragmento más próximo al cayado de la aorta para determinar el contenido de Ca, el segundo fragmento se utilizó para la extracción de ARN y proteínas, y el tercer fragmento se incluyó en parafina para estudios futuros.
En el momento del sacrificio se extrajeron las dos tibias. La izquierda se conservó en alcohol para medir la densidad mineral ósea (DMO). La tibia restante se congeló a -80ºC.
Marcadores bioquímicos
El Ca, el P y la creatinina séricos y la creatinina en orina se midieron usando un analizador automático multicanal Hitachi 717 (Boehringer Mannheim, Berlín, Alemania). La parathormona (PTH) sérica fue medida por ELISA (Immutopics, San Juan Capristano, EE.UU.) siguiendo los protocolos del fabricante. El factor de crecimiento fibroblástico 23 (FGF23) se determinó por un kit de ELISA (Kainos Laboratories, Japón).
Densitometría ósea
La DMO se midió en la tibia a tres niveles: octavo proximal, séptimo/octavo distales y tibia total, con un densitómetro radiológico digital de doble energía Hologic QDR-1000 (Hologic, Bedford, EE.UU.) equipado con un programa específico para animales pequeños.
Análisis de calcificación aórtica
La calcificación de la aorta abdominal de las ratas fue analizada mediante el contenido total de Ca. Para determinar el contenido total de Ca, un fragmento de la aorta abdominal (el más próximo al cayado de la aorta) se homogeneizó con un Ultraturrax (OmniHT) en HCl 0,6 N. Después de agitar a 4°C durante 24 horas las muestras se centrifugaron. El contenido de Ca se determinó en el sobrenadante por el método de la o-cresolftaleína complexona (Sigma-Aldrich, San Luis, EE.UU.), y el pellet se resuspendió en tampón de lisis (125 mM Tris y 2% de SDS, pH 6,8) para la extracción de proteínas y cuantificación por el método de Lowry (Bio-Rad, Hércules, EE.UU.). El contenido de Ca se normalizó expresándose como µg de Ca por mg de proteína.
Estudio de expresión génica
La extracción de ARN se realizó mediante el método del tiocianato de guanidinio-fenol-cloroformo. El ADN copia (ADNc) se sintetizó usando Taqman MicroRNA Reverse Transcription Kit (Applied Biosystems, Foster City, EE.UU.). La expresión génica del miR-377 se analizó por PCR a tiempo real (qPCR) en el equipo Stratagene Mx3005P QPCR System (Agilent Technologies, Santa Clara, EE.UU.). Para la PCR se utilizó un ensayo “assay on-demand” diseñado por Applied Biosystems que emplean oligos específicos y sondas Taqman fluorescentes. Para la cuantificación y normalización se utilizó la expresión del ARN nuclear U6.
Western Blot
Después de la transferencia, las membranas se incubaron durante 12 horas con anticuerpos anti SOD-2 (1:1000, Cell Signaling Technology, Danvers, EE.UU.), y anti-GAPDH (1:5000, Santa Cruz Biotechnology, Dallas, EE.UU.). La unión del anticuerpo secundario se detectó con el kit de detección para Western Blot ECL Advance (Amersham Bioscience, Buckinghamshire, Reino Unido) y con el sistema de modelo de imágenes VersaDoc 4000 (Bio-Rad).
Análisis estadístico
Para el análisis estadístico de los resultados se empleó el programa SPSS 17.0. En el caso de variables con distribución normal la comparación de los grupos de tratamiento se realizó por medio del análisis de la varianza (ANOVA) con el test de Bonferroni. En el caso de variables con distribución no normal, se utilizó el test de Kruskal-Wallis.
Resultados
La nefrectomía disminuyó el aclaramiento de creatinina, efecto que no se agravó en los animales que recibieron la dieta con alto contenido en P (Tabla 1). Hubo un discreto, pero no significativo, aumento del P sérico en los animales nefrectomizados que se hizo más notorio en los que recibieron la dieta con alto P. Sin embargo, pequeños aumentos en P sérico se asociaron con aumentos más significativos en los niveles séricos de FGF23. Los niveles séricos de FGF23 aumentaron el doble con la nefrectomía, mientras el aumento en P sérico fue inferior al 50%. De forma similar, en los animales que recibieron la dieta alta en P (IRC+PA) los niveles de FGF23 aumentaron el doble respecto a los de la dieta normal (IRC+PN), siendo el aumento en el P sérico inferior al 25%.
Tabla 1 Marcadores bioquímicos y del metabolismo óseo en los distintos grupos de tratamiento. Valores de DMO en los tres segmentos tibiales analizados en los distintos grupos de tratamiento
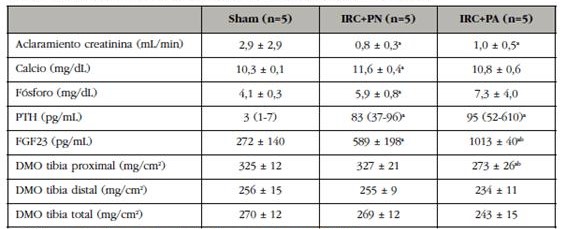
ap<0,05 respecto a al grupo Sham; bp<0,05 respecto al grupo IRC+PN.
La nefrectomía no tuvo efecto alguno sobre los cambios de DMO en tibia, si bien en el grupo IRC+PA la DMO en tibia proximal disminuyó significativamente respecto al grupo IRC+PN y respecto al grupo Sham (Tabla 1).
En el grupo IRC+PN, el contenido de Ca en la aorta se incrementó 3 veces con respecto al grupo Sham. El aumento con respecto al grupo Sham se incrementó hasta 17 veces en el grupo IRC+PA. La expresión del miR-377 disminuyó un 65% con la nefrectomía, sin observarse ningún efecto adicional con la dieta con alto P. De hecho, el aclaramiento de creatinina fue el parámetro bioquímico que se asoció de forma más marcada con la expresión de este miR (r=0,83; p=0,001). Por el contrario, el P sérico no se asoció con la expresión del miR-377 (r=-0,302; p=0,34).
La expresión proteica de la SOD-2 aumentó claramente con la nefrectomía (más de 3 veces), efecto que se hizo más marcado en los animales nefrectomizados con la dieta con alto contenido en P (más de 6 veces).
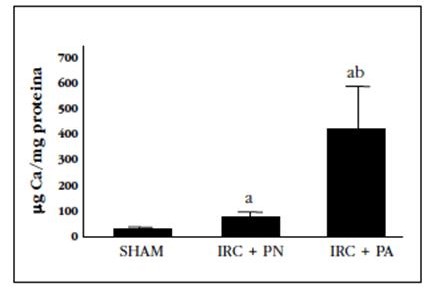
Figura 1 Contenido de Ca en las aortas de ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en P (0,6%) (IRC+PN) y alto contenido en P (0,9%) (IRC+PA), sacrificadas a las 20 semanas. Los datos representan la media ± desviación estándar. ap<0,05 respecto al grupo Sham; bp<0,05 respecto al grupo IRC+PN

Figura 2 Niveles relativos de miR-377 en las aortas de ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en P (0,6%) (IRC+PN) y alto contenido en P (0,9%) (IRC+PA), sacrificadas a las 20 semanas. Los datos representan la media ± desviación estándar. ap<0,05 respecto al grupo Sham

Figura 3 Expresión proteica de SOD-2 en las aortas de ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en P (0,6%) (IRC+PN) y alto contenido en P (0,9%) (IRC+PA), sacrificadas a las 20 semanas. A) Imagen de un Western blot representativo de una aorta de cada grupo; B) representación gráfica de la expresión proteica de la SOD-2 en los distintos grupos como media ± desviación estándar. ap<0,05 respecto al grupo Sham; bp<0,05 respecto al grupo IRC+PN
Discusión
En este estudio se ha observado un descenso en la expresión aórtica del miR-377 con la nefrectomía paralelo al aumento de la expresión proteica de SOD-2 como un posible mecanismo compensador para eliminar radicales libres superóxido producidos como consecuencia del estrés oxidativo generado por la nefrectomía.
Hasta la fecha, varios cientos de miRs han sido identificados en el genoma humano proponiéndose que al menos el 50% de los genes que codifican para proteínas son regulados por miRs 15,16.
El aumento en la expresión proteica de SOD-2, como un posible efecto compensador para frenar el estrés oxidativo y la apoptosis celular en la mitocondria 4,5,17, lo hemos observado en otros trabajos in vitro de nuestro grupo exponiendo CMLV a medios calcificantes. De hecho, en un reciente artículo hemos observado por técnicas de proteómica mediante geles bidimensionales que, ante la presencia de un estímulo calcificante con altas dosis de calcitriol, la expresión de esta proteína aumenta 3 veces respecto a las células cultivadas con un medio control 18. Otro estudio in vitro en CMLV sometidas a un estímulo calcificante por exceso de Ca y P muestra un aumento de la expresión proteica de SOD-2 mediante Western blot 6.
Sin embargo, a diferencia de lo que ocurre en nuestros trabajos, en la mayoría de estudios de la literatura se observan descensos de la SOD-2 en presencia de un aumento del estrés oxidativo. De hecho, en un reciente estudio en ratas con IRC se ha encontrado que la administración de una dieta con alto contenido en P suplementada con calcitriol induce el descenso de la expresión proteica de SOD-2 a nivel aórtico19. Otros estudios en otros modelos tisulares (podocitos renales y células mesangiales) han encontrado que, ante estímulos que inducen estrés oxidativo, se produce un descenso en la SOD-2 con aumentos del miR-377 (20), aumentos que también se han implicado con el incremento de la senescencia celular 14,21.
A la SOD-2 se la conoce también como superóxido dismutasa mitocondrial o manganeso superóxido dismutasa (MnSOD) y es la responsable de la reducción de especies reactivas de oxígeno tóxicas en la mitocondria.
El hecho de que en nuestro caso se observe un aumento de SOD-2, en un intento de la célula de defenderse al estrés oxidativo, acompañado por un descenso de la expresión del miR-377, tal vez pueda deberse a diferentes condiciones experimentales a las del resto de estudios, así como a la duración temporal del daño renal, que en nuestro caso siempre es a muy largo plazo. Lo que sí concuerda con todos los estudios publicados es el efecto opuesto entre el miR-377 y la SOD-2 14,20,21. Es decir, aumentos en la SOD-2 conllevan descensos en la expresión del miR-377 y viceversa, por lo que se deduce la posible utilidad del miR-377 como biomarcador de estrés oxidativo y de daño vascular.
A pesar de utilizar una dieta con alto contenido en P, los niveles séricos de P fueron muy similares en los grupos de animales nefrectomizados con dieta normal o con alto P. Una posible explicación es que la nefrectomía 7/8 no haya sido lo suficientemente agresiva y que pueda hablarse de un menor grado de nefrectomía como una 5/6 o menor. Eso indicaría el mantenimiento de una función renal residual que evitaría el agravamiento del daño renal producido por el P 22. Sin embargo, es de destacar los aumentos de FGF23 con la nefrectomía y también en los animales que recibieron la dieta con alto P. Se sabe que el FGF23 es el primer parámetro bioquímico que se eleva tras instaurarse la IRC 23. El FGF23 comienza a aumentar en el plasma de los pacientes con ERC desde situaciones muy precoces, y continúa aumentando de una manera constante a medida que va descendiendo el filtrado glomerular 24. Durante las fases iniciales de la ERC, una sobrecarga de P estimularía la síntesis de FGF23 a nivel de los osteocitos, y actuaría en las nefronas restantes aumentando la excreción fraccional de fosfato para mantener la normofosfatemia 25. De hecho, en nuestro caso, aumentos inferiores al 25% en P sérico se acompañaron de variaciones de FGF23 muy superiores como un mecanismo compensador del aumento de P con el objeto de frenar su exceso.
El hecho de que la disfunción renal obtenida mediante la nefrectomía haya sido inferior a la inicialmente prevista queda reflejado en los resultados de la DMO en tibia. No hubo diferencias en la DMO entre los animales Sham y los nefrectomizados, a pesar del tiempo de evolución de la IRC (20 semanas) 26. En los animales nefrectomizados que recibieron la dieta con alto contenido en P hubo un descenso de la DMO en tibia proximal respecto a los animales nefrectomizados con dieta normal en P y respecto al grupo Sham. Sin embargo, otros estudios de nuestro grupo, con el mismo tiempo de seguimiento, muestran un efecto más negativo sobre el hueso cortical (DMO en tibia distal) que sobre el trabecular (DMO en tibia proximal) cuando la dieta administrada es rica en P 27. Este efecto se acompaña de un hiperparatiroidismo secundario severo que afecta fundamentalmente al hueso cortical, resultado que no se observó en el presente estudio.
A pesar del menor grado de disfunción renal observado, sí pudimos observar una relación entre el aumento de la CV y el descenso de la DMO, como ha sido descrito previamente por nuestro grupo 28. El grupo de animales con IRC y dieta alta en P fue en el que aumentó de forma más clara el contenido de calcio en la aorta, lo que se acompañó de las mayores pérdidas de DMO en tibia proximal.
De los resultados de este estudio se deduce que la nefrectomía, independientemente de los niveles séricos de P, es capaz de modificar la expresión del miR-377. El alto contenido en P en la dieta indujo el aumento de la expresión proteica de SOD-2, probablemente como un mecanismo protector para evitar un mayor daño vascular como consecuencia del estrés oxidativo. Estos resultados deberían alertar sobre la conveniencia de mantener niveles séricos de P cuando el deterioro renal se acentúa evitando de este modo la progresión del daño vascular. La utilización del miR-377 como biomarcador de daño vascular por estrés oxidativo necesita de estudios mecanísticos, pero abre una posible vía preventiva y terapéutica al desarrollo y progresión de las lesiones vasculares en la ERC.











 texto en
texto en 


