Introducción
La metástasis a hueso es una complicación frecuente en fases avanzadas de pacientes con cáncer de próstata, uno de los cánceres con mayor mortalidad y morbilidad en países desarrollados1. Evitar las distintas etapas necesarias para que la célula tumoral abandone el tumor primario, migre y se establezca en el microambiente óseo es una de las principales estrategias para prevenir la diseminación de las metástasis óseas2. La invasión de células de tumor primario a nichos esqueléticos se asocia con la activación de células óseas que liberan factores de crecimiento y citoquinas, que a su vez promueven el crecimiento del tumor en las metástasis. Como resultado se genera el denominado “ciclo vicioso” de las metástasis óseas, que varía la fisiología del hueso y altera el remodelado óseo3,4. En el caso de las metástasis óseas causadas por cáncer de próstata se originan lesiones osteolíticas y osteoblásticas como resultado de la activación de osteoclastos y de osteoblastos respectivamente5. En procesos de metástasis ósea, se ha observado que las células tumorales son capaces de secretar factores como el factor de necrosis tumoral alfa (TNF-α), interleucina 11 (IL-11), metaloproteasa de matriz 1 (MMP1), Jagged1 y proteína relacionada con la parathormona (PTHrP), que activan directa o indirectamente osteoclastos, dando lugar a metástasis osteoclásticas6. La degradación de matriz por osteoclastos libera factor de crecimiento transformante β (TGF-β) y factor de crecimiento similar a la insulina (IGF-1) que promueven la supervivencia de células tumorales7. En contraste, la secreción por parte de células tumorales de otros factores como el factor de crecimiento fibroblástico (FGF) y proteínas morfogenéticas óseas (BMPs) pueden estimular la diferenciación de osteoblastos resultando en lesiones osteoblásticas8.
Por otro lado, algunos estudios han descrito la importancia de segundos mensajeros y vías de señalización intracelular en la modulación de la proliferación, malignidad y capacidad metastásica de células tumorales. De este modo moléculas como el calcio, el adenosín monofosfato cíclico (AMP cíclico) o las quinasas reguladas por señales extracelulares 1/2 (ERK 1/2), han sido propuestos como mediadores y posibles dianas terapéuticas en la progresión tumoral y la metástasis ósea9-11.
A pesar de la existencia de diversas observaciones analizando los factores secretados por células tumorales que afectan a células óseas, existe escasa información sobre los factores secretados por osteoblastos y osteocitos que actúan sobre células tumorogénicas de próstata. En concreto, es poco conocido el efecto de factores secretados por células óseas sobre vías de señalización y segundos mensajeros relevantes en la mediación de procesos de progresión tumoral y metástasis a hueso en células tumorales de próstata.
En este estudio hemos usado técnicas de fluorescencia en células vivas para analizar si factores secretados por células óseas pueden modificar vías de señalización y segundos mensajeros en células de adenocarcinoma de próstata. Nuestras observaciones muestran que factores secretados por osteoblastos y osteocitos pueden inducir proliferación de células tumorales de próstata asociada a acumulación de AMP cíclico y calcio intracelulares y a la activación de la quinasa ERK. Estos resultados sugieren el papel clave de los factores óseos en mecanismos intracelulares relevantes para la progresión tumoral y la metástasis ósea.
Materiales y métodos
Cultivos celulares
Las células humanas de carcinoma prostático derivadas de metástasis óseas (PC-3, ATCC: CRL-1435) se cultivaron en RPMI 1640, suplementado con 10% de suero fetal bovino (SFB). La línea celular preosteoblástica murina MC3T3-E1 (ATCC: CRL-2593) y osteocítica murina MLO-Y4 (generosamente donada por Lynda Bonewald) se cultivaron en DMEM con 10% de SFB o α-MEM con 2,5% de suero fetal de carnero (SCF) y 2,5% SFB, respectivamente. Todas las células fueron cultivadas en medios que contenían penicilina (100 unidades/mL) y estreptomicina (100 µg/mL) en un incubador humidificado a 37ºC y 5% CO2 atmosférico. Los medios condicionados fueron obtenidos de las células PC-3, MLO-Y4 o MC3T3-E1 cultivadas en α-MEM en ausencia de suero durante 24 h.
Transfecciones
Para transfecciones transitorias, las células PC-3 se cultivaron en cubreobjetos de cristal de 25 mm de diámetro durante 12 h previa a la transfección con FuGENE 6 (Roche Applied Science), que se realizó en medio de cultivo completo. Tras 24 h los cubreobjetos fueron transferidos en una cámara Attofluor (Invitrogen, Carlsbad, CA) con solución HEPES/albumina de suero bovino (ASB) (pH=7,4) (solución HEPES al 0,1% (p/v) ASB) para los experimentos de fluorescencia a tiempo real.
Ensayo de proliferación celular
El número de células viables PC-3 estimuladas con medios condicionados de células MC3T3-E1, MLO-Y4 o de las propias PC-3 fue evaluada por el ensayo de exclusión por azul de tripano como previamente ha sido descrito12.
Medida del calcio intracelular
La acumulación de calcio intracelular fue cuantificada con el sensor sensible a calcio Fluo- 4/AM (Invitrogen, Carlsbard, CA) siguiendo el protocolo del fabricante como ha sido descrito previamente13. Brevemente, las células PC-3 fueron cultivadas en placas de cultivo MatTek con 2 µM Fluo-4/AM en la solución salina equilibrada Hanks’ (Invitrogen) a 22°C durante 45 min. Las células fueron lavadas tres veces en la solución Hanks’ e incubada a 22°C durante 30 min. Las cuantificaciones de calcio intracelular fueron realizadas con el microscopio de fluorescencia invertido Nikon A1s. Los niveles de fluorescencia fueron medidos a intervalos de 1 s hasta 20 min. Al menos 30-40 células se evaluaron bajo cada condición. Se utilizaron los reactivos ionomicina (aumenta la entrada de iones de calcio en las células) 10 µM y EGTA (quelante de calcio) 10 mM para obtener el máximo y el mínimo de estimulación en cada célula analizada.
Transferencia de Energía por Resonancia Fluorescente (FRET): evaluación de AMP cíclico intracelular y fosforilación de ERK
Las células PC-3 fueron transfectadas transitoriamente con el biosensor de AMP cíclico EPAC14 o con el biosensor de fosforilación de ERK, ERK-NES15. La generación de AMP cíclico y la activación por fosforilación de ERK se evaluaron por Transferencia de Energía por Resonancia Fluorescente (FRET) como se describió previamente16. Las células se cultivaron en placas de cultivo Ibidi de 35 mm de diámetro y mantenidas en solución tampón FRET (137 mM NaCl, 5 mM KCl, 1 mM CaCl2, 1 mM MgCl2, 20 mM HEPES, 0,1% albúmina de suero bovino, pH 7,4) donde se transfectaron transitoriamente con constructos constituidos por las proteínas de fusión: proteína fluorescente cian (CFP)-EPAC–proteína fluorescente amarillo (YFP) o por CFP-ERK-NES–YFP y que es activada por la unión directa de AMP cíclico o por fosforilación, respectivamente, experimentando cambios conformacionales que dan como resultado variaciones en las respuestas de FRET. Las cuantificaciones fueron realizadas en un microscopio Leica equipado con objetivo 40x de aceite de inmersión realizándose registros secuenciales de los canales de fluorescencia CFP e YFP. Las intensidades de la emisión de fluorescencia fueron determinadas a 535/15 nm (YFP) y 480/20 nm (CFP) con un paso largo dicroico (DCLP) de 505 nm. La señal de FRET se monitorizó como el índice de emisión de YFP (FYFP) y CFP (FCFP). Los resultados se muestran como la media normalizada (nFRET) ± error estándar.
Resultados
Factores solubles de MC3T3-E1 y MLOY-4 inducen incremento de proliferación en las células de adenocarcinoma prostático humanas PC-3
Estudios previos sugieren que el entorno óseo favorece la estimulación de células de cáncer de próstata promoviendo el establecimiento de metástasis esqueléticas17. Para evaluar los efectos de factores secretados por células óseas sobre células de carcinoma de próstata, primero se analizaron las acciones de medios condicionados de osteoblastos MC3T3-E1 y osteocitos MLO-Y4 sobre la proliferación de células de cáncer de próstata PC-3. Se observó que tanto los medios condicionados de osteoblastos MC3T3-E1 como los de MLO-Y4 indujeron un aumento en la proliferación de células PC-3 tras 3 días de estimulación en comparación con medios condicionados control (de las propias células PC-3) (Figura 1).
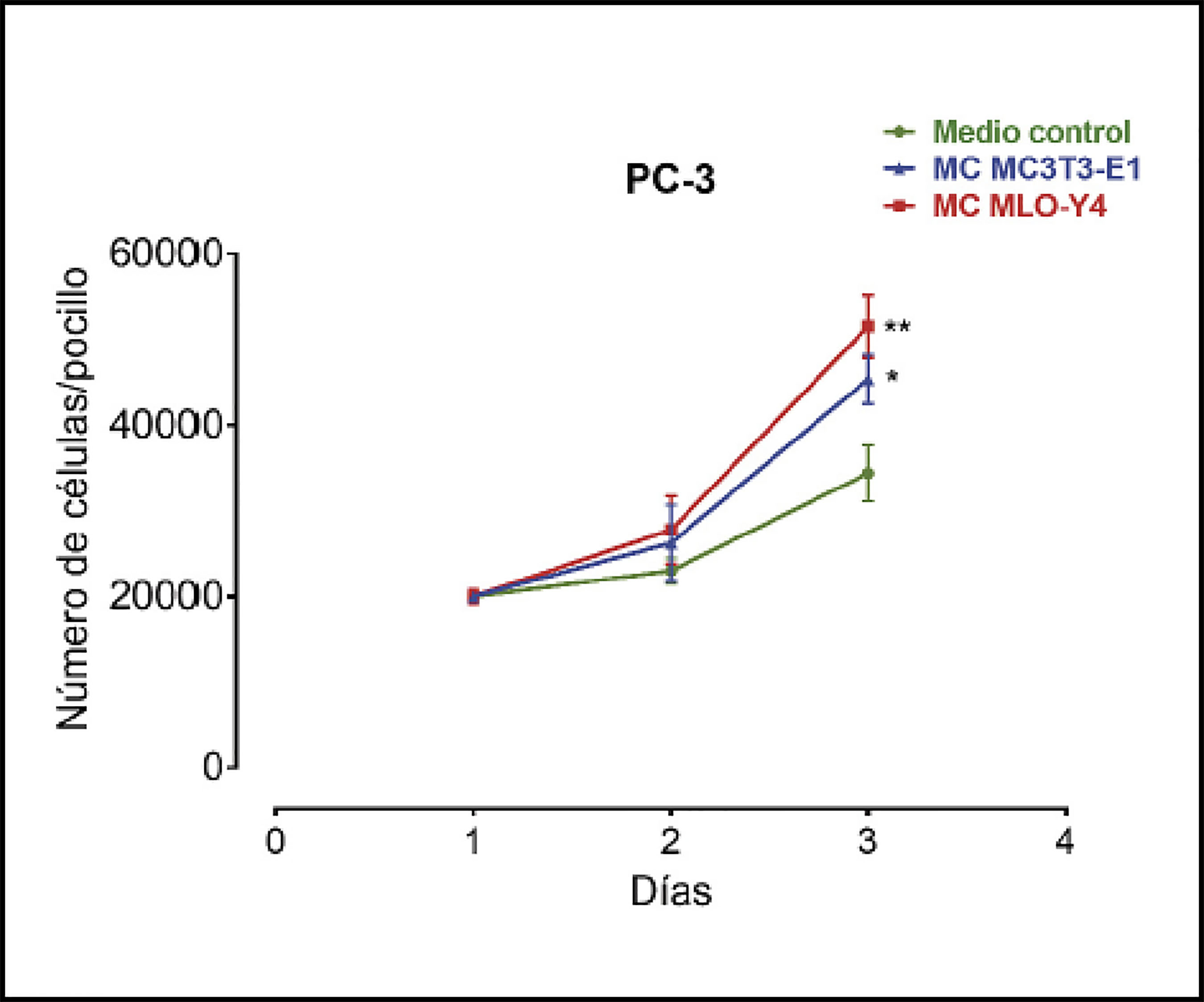
Figura 1 Factores secretados por osteoblastos MC3T3-E1 y osteocitos MLO-Y4 aumentan la proliferación de células de carcinoma de próstata PC-3. Las células PC-3 se incubaron durante 1-3 días con medios condicionados (MC) obtenidos de MC3T3-E1 o MLO-Y4 y se evaluó el número de células mediante ensayo de azul de tripano. Los datos mostrados son medias ± error estándar de 3 experimentos independientes *p<0,05; **p<0,01 vs. Medio condicionado (MC) Control
Factores solubles óseos osteoblásticos y osteocíticos inducen la formación de AMP cíclico y liberación de calcio intracelular en las células de adenocarcinoma prostático humanas PC-3
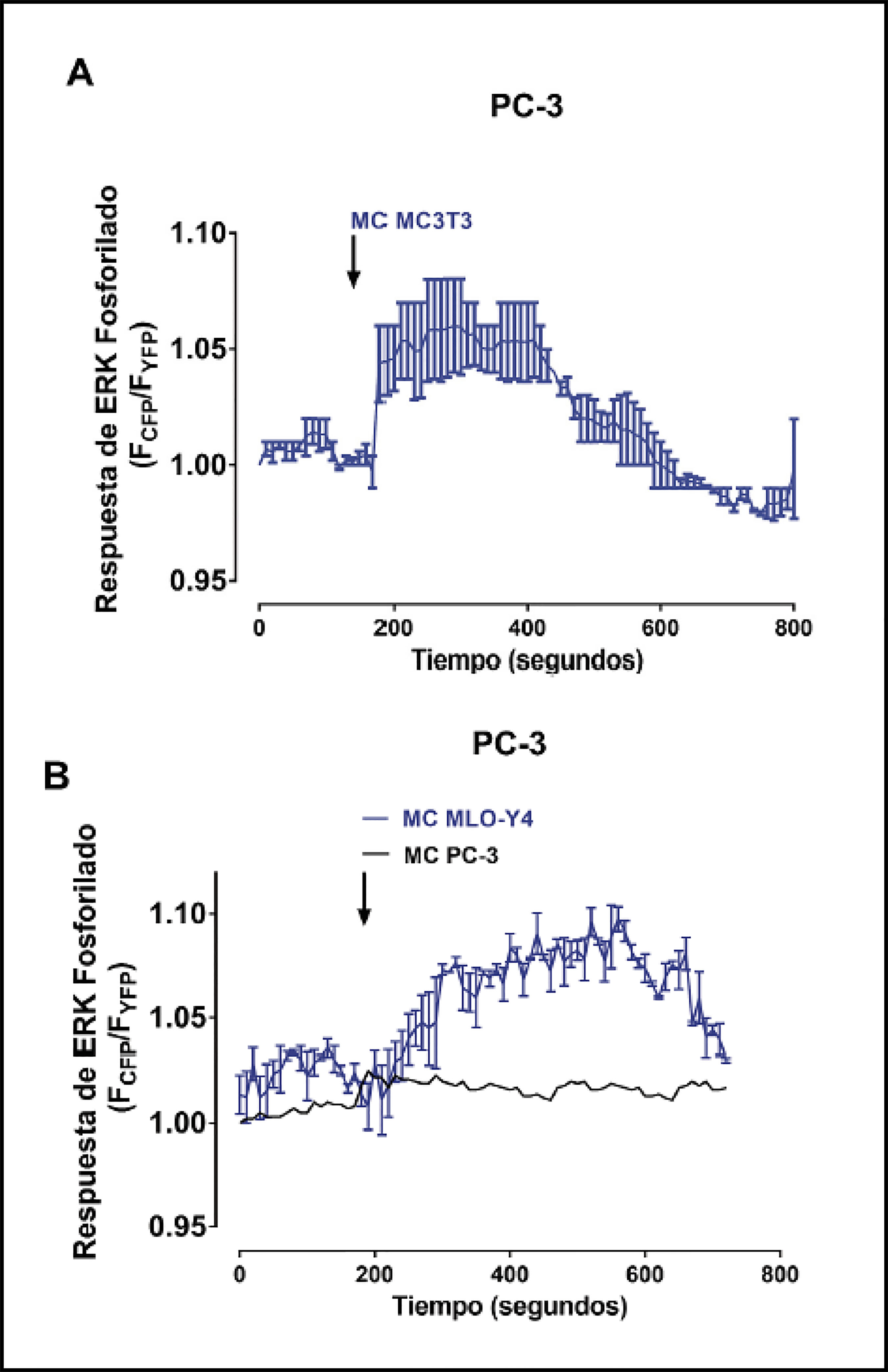
Seguidamente se estudiaron los efectos de los medios condicionados de células óseas en la activación de segundos mensajeros y vías de señalización relacionadas con la progresión tumoral, metástasis y la activación de respuestas osteogénicas9-11,18 mediante técnicas de fluorescencia en células vivas. Los medios condicionados de osteoblastos MC3T3-E1 y de osteocitos MLO-Y4 causaron un aumento rápido y transitorio en la concentración de calcio intracelular en las células de cáncer de próstata PC3 comparado con la estimulación con medio condicionado por las propias células PC-3 (Figura 2A-C). De manera similar, la generación de AMP cíclico detectada mediante FRET fue estimulada por medios condicionados de osteoblastos y de osteocitos (Figura 3 A-C). Los niveles de AMC cíclico no variaron al estimular las células PC-3 con medios condicionados de PC-3 (datos no mostrados).
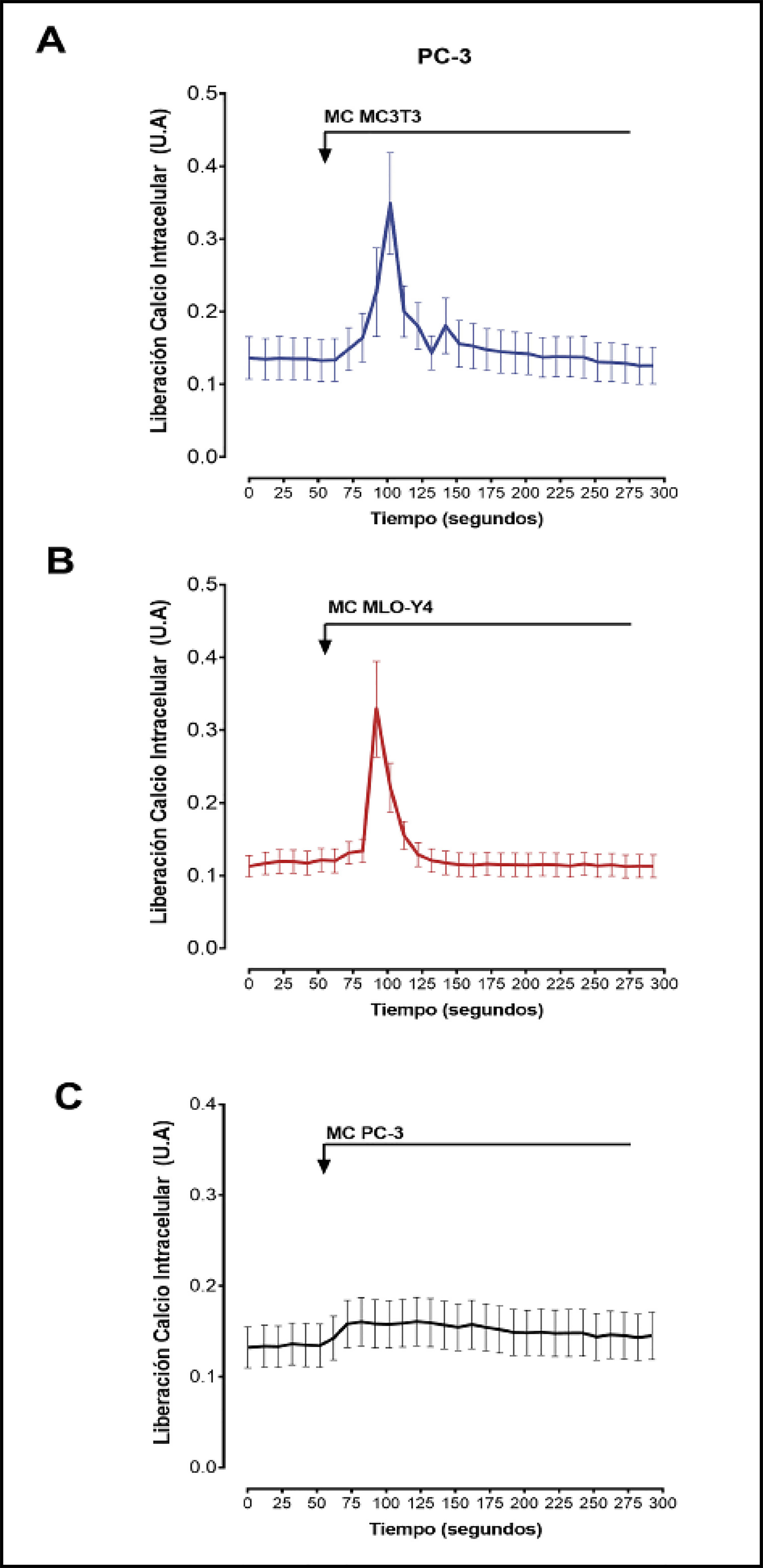
Figura 2 Factores secretados por MC3T3-E1 y MLO-Y4 aumentan la señalización de calcio intracelular de PC-3. Se analizaron los efectos de factores secretados de medios condicionados obtenidos durante 24 horas de MC3T3-E1 (A), MLO-Y4 (B) o de PC-3 (C) en la liberación de calcio intracelular de PC-3. La evaluación de los niveles de calcio intracelular se realizó mediante fluorescencia confocal en células vivas con el indicador Fluo-4AM según se ha descrito en el texto. Las flechas indican el momento de estimulación con medios condicionados. Los datos mostrados son medias ± error estándar de 3 experimentos independientes

Figura 3 Factores secretados por MC3T3-E1 y MLO-Y4 aumentan la señalización de AMP cíclico de PC-3. (A) Se analizaron los efectos de factores secretados de medios condicionados obtenidos durante 24 horas de MC3T3-E1 y MLO-Y4 en la activación de AMP cíclico de PC3. La evaluación de AMP cíclico se realizó mediante fluorescencia confocal en células vivas con el sensor CFPEPACYFP según se ha descrito en el texto. Las flechas indican el momento de la estimulación con medios condicionados. Se utilizó forscolina para obtener el máximo de estimulación de AMP cíclico. Los datos mostrados son medias ± error estándar de 3 experimentos independientes. (B y C) Imágenes representativas de los cambios en fluorescencia de las proteínas fluorescentes CFP e YFP del sensor de AMP cíclico EPAC en células PC-3 tras la estimulación con medio condicionado de células MC3T3-E1 o MLO-Y4
Activación de la vía de señalización ERK 1/2 en las células de adenocarcinoma prostático humanas PC-3 tras la estimulación de factores solubles óseos
La fosforilación de la quinasa ERK 1/2, una proteína directamente implicada en la proliferación de las células tumorales de próstata19, también fue inducida por medios condicionados de osteoblastos MC3T3-E1 y osteocitos MLO-Y4 (Figura 4A y B). El medio condicionado de células PC-3 por el contrario, no causó cambios en la fosforilación de ERK 1/2 de las células PC-3 (Figura 4B).
Estos resultados en su conjunto muestran que los factores secretados por parte de células óseas modulan moléculas de señalización claves en procesos celulares como la proliferación de células tumorales de próstata.
Discusión
Nuestros resultados muestran que las células de adenocarcinoma prostáticas metastásicas aumentan su proliferación con factores secretados tanto por células osteoblásticas como osteocíticas. En el caso de las metástasis óseas, se ha hipotetizado que las células tumorales se establecen en zonas específicas de hueso como en el nicho endosteal, el nicho de células madre hematopoyéticas y el nicho vascular20. Estos nichos son microambientes complejos en los que se secretan factores que promueven las funciones fisiológicas de las células que los componen. Se ha demostrado que al aumentar el número de estos nichos experimentalmente también se incrementa el número de células tumorales diseminadas de tumores primarios21. Estas observaciones sugieren que los mismos factores que mantienen el correcto funcionamiento de las células de los nichos óseos son capaces a su vez de promover el establecimiento y crecimiento de células tumorales en las metástasis óseas. Desde este punto de vista, los osteoblastos y osteocitos localizados cerca de la superficie formarían parte del nicho endosteal y pueden generar factores promotores del crecimiento de células tumorales de próstata en este nicho.
Existen varios mecanismos que regulan el ciclo mitótico de células metastásicas en el hueso, incluyendo procesos reguladores del sistema inmune, de la angiogénesis, de la matriz extracelular, diversos factores y hormonas y procesos intracelulares22. Entre estos mecanismos se observó que el balance en la activación entre 2 quinasas proteicas activadas por mitógenos (MAP quinasas), p38 y ERK 1/2 afecta de manera clave a la mitosis de células tumorales metastásicas23. Cuando ERK 1/2 se encuentra activado en comparación con p38, la proliferación celular se favorece, y por el contrario la activación de p38 frente a ERK 1/2 induce un estado quiescente celular23. Nosotros hemos observado que los pre-osteoblastos y osteocitos pueden enviar factores solubles que activan a la quinasa ERK 1/2 en células PC-3 fomentando de este modo la proliferación de células tumorales.
Además, hemos observado que factores secretados al medio condicionado por pre-osteoblastos y osteocitos también causaron aumento transitorio en la concentración de calcio intracelular y en la generación de AMP cíclico. Ambos segundos mensajeros pueden regular procesos de proliferación y metástasis tumoral y han sido propuestos como posibles dianas terapéuticas en varios cánceres9,10,24. El AMP cíclico puede tener efectos positivos o negativos en el crecimiento y supervivencia de células tumorales dependiendo del tipo celular10. En tumores de origen epitelial como es el caso del cáncer de próstata, el AMP cíclico parece jugar un papel promotor de la oncogénesis mediante la activación de la proteína quinasa A y otras proteínas activadas a continuación (por ejemplo EPAC y CREB)25,26.
Por otro lado, se ha demostrado que el aumento de la concentración de calcio intracelular de origen extracelular es un factor inductor de la proliferación de líneas celulares prostáticas de metástasis ósea (PC-3 y C4-2B), pero no afecta a la proliferación de líneas celulares prostáticas no metastásicas como las células LNCaP9. El aumento de la concentración de calcio de origen extracelular causa en PC-3 un aumento en la expresión de ciclina D1 (una proteína reguladora del ciclo celular necesaria en la proliferación), en la activación de Akt (proteína requerida para la proliferación y progresión tumoral)27,28, y aumenta la capacidad de unión de células tumorales a sustrato9. Además, alteraciones en la expresión génica de diversos canales iónicos de calcio, como los TRP y Orai, se han asociado con aumentos de la entrada de calcio en las células tumorales de próstata que facilitan la proliferación y resistencia a apoptosis de dichas células29,30.
Estos estudios en su conjunto muestran la función relevante de la activación de la quinasa ERK 1/2, del calcio y del AMP cíclico en la progresión del cáncer de próstata. Aunque la modulación de estas vías de señalización por parte de factores secretados por células óseas no ha sido descrita previamente, algunos estudios han demostrado la capacidad de las células residentes del hueso para modular la actividad de las células tumorales en los nichos metastásicos. Se ha observado que los osteocitos estimulados mecánicamente por incremento de la presión ocasionada por tumores metastásicos inducen crecimiento e invasividad de tumores de próstata mediante la secreción de la quimiocina (C-C) ligando 5(CCL5)31. Curiosamente, la estimulación de células de distintos tipos de cáncer por CCL5 es capaz de aumentar la capacidad invasiva y migratoria de células tumorales mediante mecanismos dependientes de la movilización intracelular de calcio32 o de activación de la quinasa ERK33,34. Estas observaciones sugieren que CCL5 u otros factores similares del secretoma de células óseas podrían ser los responsables de los cambios en vías de señalización de células tumorales que hemos observado en el presente estudio. Por otra parte, publicaciones previas también han demostrado el papel clave de las células óseas para promover la activación de células tumorales y favorecer los procesos metastásicos basados en el contacto directo célula ósea-célula tumoral mediante la activación de la vía de señalización Notch-Jagged35. Es posible que factores secretados por células óseas puedan mediar procesos de reclutamiento y crecimiento iniciales del tumor metastásico, en los que no haya contacto directo entre el tumor y las células óseas, mientras que vías de señalización como Notch-Jagged puede que regulen las interacciones del tumor en fases metastásicas más avanzadas (en las que el tumor sí entre en contacto directo con las células del hueso).
En base a estas investigaciones y a nuestros resultados proponemos que las células osteobásticas y osteocíticas regulan la proliferación y la activación de mediadores moleculares de la progresión tumoral en células metastásicas de cáncer de próstata mediante la secreción de factores solubles. Sugerimos, además, que la modulación de los mediadores intracelulares calcio, AMP cíclico y ERK 1/2 por factores secretados por células óseas pueden ser clave en el establecimiento de metástasis óseas por parte de células tumorales de próstata.











 text in
text in