INTRODUCCIÓN
El envejecimiento se asocia con una pérdida de masa y fuerza muscular, así como con una disminución en la densidad mineral ósea (DMO), lo que puede condicionar una movilidad reducida, mayor riesgo de caídas y aparición de fracturas1,2. En los últimos años se ha hecho especial hincapié en mantener un estado adecuado de vitamina D para optimizar la fuerza muscular y la DMO con objeto de reducir caídas y fracturas3-5. Si bien, un reciente meta-análisis cuestiona la utilidad de los suplementos de vitamina D para reducir el riesgo de caídas, disminución de DMO y fracturas6, existen suficientes argumentos que evidencian la importancia de la vitamina D sobre la salud muscular y ósea. La vitamina D estimula la absorción de calcio del intestino y mantiene los niveles séricos de calcio que se requieren para una mineralización ósea normal y para el mantenimiento de la función muscular7. Varios estudios in vivo sugieren el papel de la vitamina D en la regulación de la masa muscular y su función. Estudios observacionales demuestran que la deficiencia de vitamina D en personas de edad avanzada está asociada con una masa y fuerza muscular reducidas8-10, un rendimiento físico más bajo8,11, y un mayor riesgo de caídas12. Además, un meta-análisis de 17 ensayos clínicos mostró que la suplementación con vitamina D en sujetos con niveles basales de calcidiol inferiores a 10 ng/mL tuvo un efecto positivo en la fuerza muscular de la cadera13. Los estudios descritos anteriormente sugieren que la vitamina D puede afectar la masa muscular y su función; sin embargo, no está claro si la vitamina D desempeña un papel directo o indirecto. En los últimos años se le ha dado cada vez más importancia a la conversión local de calcidiol a calcitriol, el metabolito de la vitamina D más activo, que se sintetiza principalmente en el riñón a través de su precursor el calcidiol7. Esta síntesis local se ha demostrado en otros varios tipos de células, como en osteoblastos14-17, células de la próstata18 y monocitos19, lo que refuerza la importancia de alcanzar unos niveles adecuados de calcidiol en el organismo.
Por tanto, el objetivo de este trabajo fue analizar en una población no seleccionada el efecto de los niveles de calcidiol (25-OHD) sobre la fuerza muscular en ambas manos, las actividades de la vida cotidiana relacionadas con la capacidad funcional del individuo y sobre los cambios en la DMO.
MATERIAL Y MÉTODOS
El protocolo inicial del estudio se diseñó para conocer la prevalencia de fractura vertebral. Para ello, se seleccionaron al azar del registro municipal de Oviedo 624 hombres y mujeres mayores de 50 años. El protocolo consistió en que todos los sujetos completaron un cuestionario sobre factores de riesgo relacionados con la osteoporosis. Este cuestionario que fue diseñado para el estudio EVOS, traducido a varios idiomas, y tuvo un adecuado índice de reproducibilidad20,21. Asimismo a toda la cohorte se le realizó dos radiografías laterales (el estudio radiográfico no se completó solo en 2 casos), la recogida de mediciones antropométricas como altura y peso para determinar el índice de masa corporal (IMC), y un estudio densitométrico. Todos los sujetos tenían suficiente capacidad ambulatoria para subir dos pisos sin ascensor, y el 99% vivía en su propio domicilio.
Después del estudio de prevalencia, esta cohorte se siguió de forma prospectiva durante 4 años mediante 2 cuestionarios postales para averiguar la incidencia de fractura osteoporótica no vertebral. En el cuarto año del período de seguimiento (entre el segundo y el tercer cuestionario postal), se invitó a los participantes que habían contestado al menos uno de los dos cuestionarios anteriores a repetir las mismas pruebas realizadas en el estudio de prevalencia, a lo que se le sumó medidas de fuerza muscular de agarre en ambas manos con un dinamómetro que posee un escala que va desde el mínimo 0 al máximo de 300 mm de Hg, una encuesta con 12 ítems sobre la dificultad o no para realizar actividades de la vida cotidiana, así como un estudio bioquímico de marcadores generales y del metabolismo óseo y mineral. En este segundo estudio transversal participaron 404 sujetos (212 mujeres y 192 hombres), de los que 322 estuvieron de acuerdo en realizar el estudio bioquímico. Un total de 32 sujetos (9,9%) se excluyeron del análisis por haber recibido tratamiento osteoporótico, incluyendo tratamiento con vitamina D. De un total de 290 sujetos dispusimos de todos los datos en ambos cortes transversales.
Evaluación densitométrica
La DMO se midió con un densitómetro Hologic® QDR-1000 DXA (Hologic Inc., Waltham, Massachusetts, EE.UU.). En todos los casos, se analizaron la columna lumbar anteroposterior (L2-L4) y la densidad del fémur derecho. Para la evaluación de la DMO lumbar, se excluyeron 4 sujetos con artrosis degenerativa marcada. Los coeficientes de variación (CV) fueron 1,2% y 1,9%, respectivamente22. El control de calidad diario a largo plazo fue seguido por un phantom de la columna lumbar, con CV=0,0 ± 0,1%20. En el cuarto año del período de seguimiento, la DMO también se determinó en las mismas áreas que se midieron en el primer estudio transversal, utilizando la tasa de cambio en la DMO entre ambos estudios transversales como un método para evaluar la evolución de la DMO a lo largo del tiempo.
Análisis bioquímico
En el cuarto año de seguimiento y a lo largo de 1 año, se tomó una muestra de sangre y orina en ayunas de cada sujeto: el 33% de las muestras de sangre se tomaron en primavera, el 12% en verano, el 32% en otoño y el 23% en invierno. Una vez separado el suero, se mantuvo congelado junto con la orina a -80ºC hasta que se realizaron los análisis. Los niveles séricos de calcio, creatinina, fosfatasa alcalina total y fosfatasa ácido tartrato resistente se determinaron utilizando un autoanalizador (Hitachi Mod. 717, Ratigen, Alemania). Los niveles séricos de calcidiol (25OHD) se determinaron mediante extracción previa con acetonitrilo (IDS, Ltd., Bolton, Reino Unido), cuyos coeficientes de variación (CV) intra e interensayo fueron, respectivamente, del 5,2% y del 8,2%.
Los niveles de 1,25-dihidroxivitamina D se midieron a través de radio-inmunoensayo (IDS, Ltd.); los CV intra e interensayo fueron 6,5% y 9%, respectivamente. Los niveles intactos de PTH se midieron utilizando métodos de radio-inmunoensayo (Instituto Nichols, San Juan de Capistrano, California, EE.UU.); los valores de CV intra e interensayo fueron 2,6% y 5,8%, respectivamente.
Todos los estudios realizados siguieron los principios enunciados en la declaración de Helsinki y fueron formalmente aprobados por el Comité de Ensayos Clínicos del Principado de Asturias.
Análisis estadístico
El análisis de los datos se llevó a cabo utilizando la versión 17.0 de SPSS para Windows. Las variables cuantitativas se analizaron mediante t de Student. Las variables cualitativas de analizaron mediante chi cuadrado.
Para analizar a nivel multivariante el efecto de los niveles de calcidiol sobre la fuerza muscular, la fuerza muscular de agarre en ambas manos se categorizó como 0 para valores iguales a 300 mm de Hg (máxima presión del dinamómetro) y 1 para valores <300 mm de Hg. El análisis de regresión logística se ajustó por edad, sexo, IMC y estacionalidad (estación del año en el que se hubiera realizado la extracción de sangre).
Para estudiar la asociación entre la realización de las actividades de la vida cotidiana con los niveles séricos de calcidiol se realizó un análisis de regresión logística tras ajuste por edad, sexo, IMC y estacionalidad.
Cuando se encontraron asociaciones estadísticamente significativas entre los niveles de calcidiol con la tasa de cambio en la DMO en el análisis univariado, se realizó una regresión lineal ajustada por edad, sexo, IMC y estacionalidad.
RESULTADOS
En la tabla 1 se muestran características sociodemográficas, antropométricas, variables clínicas y marcadores bioquímicos de la cohorte analizada en función de los niveles séricos de calcidiol. En los que tenían niveles de calcidiol =20 ng/mL había una predominancia de hombres, presentaban menor edad, valores superiores de DMO en todos los segmentos esqueléticos analizados, menor frecuencia de fracturas previas, mayores niveles de calcitriol y menores niveles de PTH y fosfatasa alcalina total.
Tabla 1. Características demográficas, antropométricas, variables clínicas y marcadores bioquímicos en función de los niveles séricos de calcidiol

Valores de calcidiol =20 ng/mL (28,6% de la cohorte) se asociaron con mayor fuerza muscular de agarre en ambas manos respecto a niveles <20 ng/mL (Figura 1). Tras ajustar por la edad, el sexo, el IMC y la estacionalidad, solo en la mano izquierda se asociaron niveles de calcidiol <20 ng/mL independientemente con descensos en la fuerza muscular de agarre (OR=2,35: IC 95%: 1,03-5,38). Por contra, en la mano derecha se perdió esa asociación (OR=1,91; IC 95%: 0,92-3,98).
Las actividades de la vida cotidiana en función de los niveles de calcidiol se reflejan en la tabla 2. De las 12 actividades analizadas, la incapacidad o dificultad para “inclinarse para coger un objeto del suelo” se asoció significativamente con niveles más bajos de calcidiol (p=0,009, tabla 2). Asimismo, se asoció con niveles menores de calcidiol la dificultad o la incapacidad para: “incorporarse de la cama”; “coger un libro u objeto de una estantería alta”; “inclinarse desde una silla para coger un objeto del suelo”; “quitarse las medias o calcetines” y “correr 100 metros sin parar” (Tabla 2). Solamente “inclinarse para coger un objeto del suelo” e “incorporarse de la cama” se asociaron significativamente con los niveles de calcidiol tras el ajuste multivariante por la edad, el sexo, el IMC y la estacionalidad. Así, incrementos de 10 ng/mL de calcidiol se asociaron con una disminución del 30% y 58%, respectivamente, en la dificultad o imposibilidad para “inclinarse para coger un objeto del suelo” o para “incorporarse de la cama”.
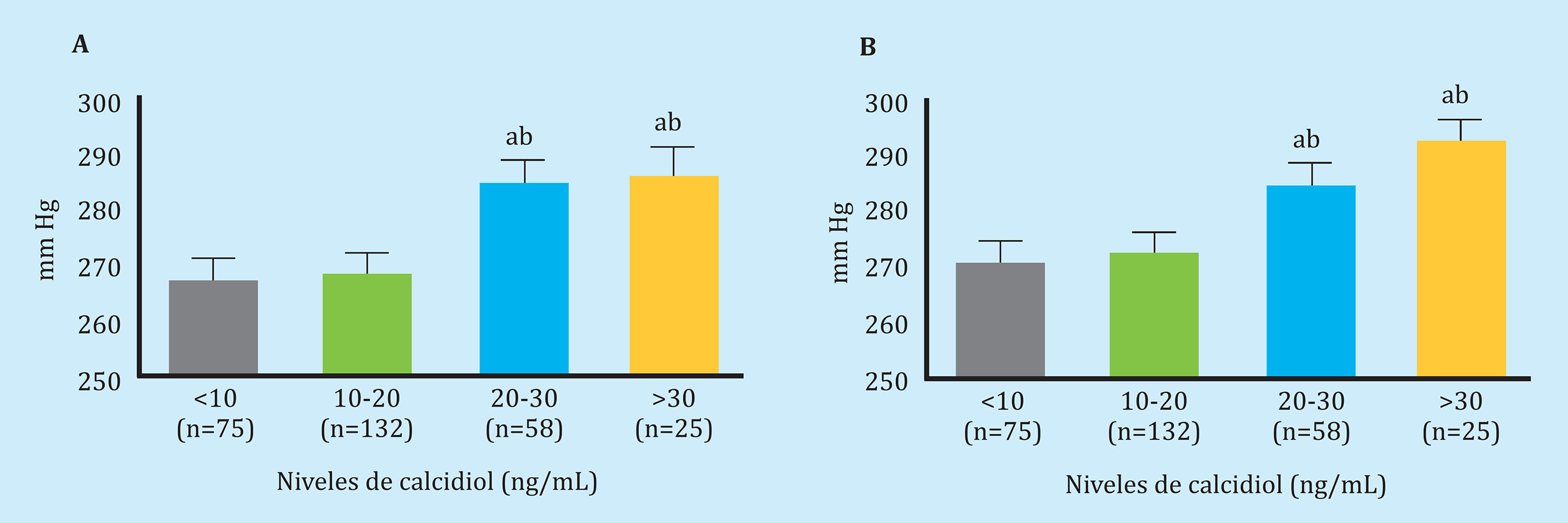
Figura 1. Medidas de fuerza de agarre (mm de Hg) en la mano A) izquierda; B) derecha en función de los niveles séricos de calcidiol. *p<0,05 respecto a calcidiol <10 ng/mL y a calcidiol entre 10-20 ng/mL
Tabla 2. Niveles de calcidiol (ng/mL) en función de la dificultad o no para realizar determinadas actividades de la vida cotidiana

La estratificación de los niveles de calcidiol mostró que, en el ajuste multivariante, la presencia de deficiencia de calcidiol (<10 ng/mL), no solo incrementó significativamente la incapacidad o dificultad para “incorporarse de la cama: (OR=2,14; IC 95%: 1,21-3,77)” sino también para “coger un libro u objeto de una estantería alta: (OR=2,02; IC 95%: 1,09-3,73)”, “inclinarse desde una silla para coger un objeto del suelo: (OR=1,78; IC 95%: 1,03-3,07)” y “permanecer sentado en una silla dura durante 1 hora: (OR=1,78; IC 95%: 1,03-3,07)”.
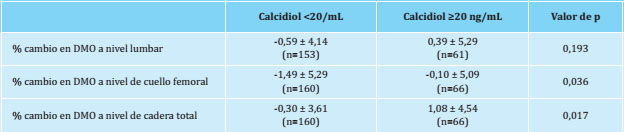
El porcentaje de cambio en DMO a nivel de columna lumbar, cuello femoral y cadera total en función de los niveles séricos de calcidiol se reflejan en la tabla 3. La presencia de niveles de calcidiol <20 ng/mL se asoció con mayores pérdidas de DMO tanto a nivel de cuello femoral como de cadera total, no habiendo diferencias significativas a nivel lumbar. Tras un análisis multivariante, los cambios en DMO a nivel de cuello femoral y de cadera total se asociaron independientemente con niveles de calcidiol <20 ng/mL (coeficiente beta tipificado=0,130, p=0,041 y coeficiente beta tipificado=0,142, p=0,033, respectivamente).
DISCUSIÓN
En este estudio se ha observado que niveles bajos de calcidiol (<20 ng/mL) contribuyen a una menor fuerza muscular de agarre en las manos, a más dificultades para realizar determinadas actividades de la vida diaria, así como a mayores pérdidas de DMO en la cadera.
Existen evidencias tanto básicas como clínicas que apoyan la participación de la vitamina D en la función del músculo esquelético23. En un trabajo reciente en personas con lesiones en la médula espinal que requieren rehabilitación, los niveles bajos de calcidiol fueron predictores independientes de la disminución de la función física24. La menor fuerza muscular de agarre en relación con los bajos niveles de calcidiol encontrados en nuestro estudio ha sido también reportada por otros autores25. Así, en un estudio longitudinal de adultos holandeses, con edades comprendidas entre 55 y 85 años, los niveles séricos de calcidiol inferiores a 10 ng/mL se asociaron con una pérdida del 40% en la fuerza muscular de agarre en comparación con los valores basales26.
En nuestro estudio se ha objetivado que algunas actividades de la vida diaria se vieron comprometidas por los bajos niveles de calcidiol, siendo más marcado este efecto en presencia de deficiencia de calcidiol (<10 ng/mL). Las actividades que se vieron más afectadas fueron las que tenían más que ver con la capacidad funcional del organismo que las dependientes de una mayor fuerza muscular como “transportar un objeto de 10 kg durante 10 metros” o “levantar una caja con 6 botellas llenas y colocarlas en una mesa”. Otros estudios recientes también han asociado niveles bajos de vitamina D con la mayor dificultad para realizar actividades de la vida diaria. Así, en un estudio reciente de Arbex Borim y cols. se observó que la reducción de fuerza muscular o dinapenia combinado con bajos niveles de calcidiol fueron un factor de riesgo que condicionó el desarrollo de las actividades de la vida cotidiana en una muestra de 4.630 mayores de 50 años libres de discapacidad al inicio del estudio, seguidos durante 2 años27. De forma similar, Wicherts y cols., analizando un estudio de hombres y mujeres entre 65 y 88 años, encontraron que aquellos con niveles de calcidiol por debajo de 20 ng/mL presentaban un peor estado y rendimiento físico tanto a nivel basal como a 3 años de seguimiento en comparación con aquellos con niveles superiores a 30 ng/mL11. Otro estudio prospectivo holandés mostró que los niveles de vitamina D se asociaron con limitaciones funcionales en el estratode edad entre 55 a 65 años y en mayores de 65 años28. Sin embargo, hay autores que no han encontrado asociación entre niveles de calcidiol por debajo de 10 ng/mL y una menor flexión de la cadera, fuerza de extensión de la rodilla, fuerza de agarre, velocidad en la marcha o discapacidad en actividades relacionadas con movilidad de las extremidades superiores. Este último estudio se realizó en 628 mujeres mayores de 65 años seguidas durante 3 años y que presentaban una discapacidad entre moderada a severa al inicio del estudio. Es posible que la existencia de muy pocos participantes con valores bajos de calcidiol limitase la posibilidad de obtener diferencias29.
Más contradictoria es la asociación entre niveles de calcidiol y DMO puesta de manifiesto en un reciente metaanálisis6. Existen evidencias epidemiológicas que indican que los niveles de calcidiol más elevados se asocian con una mayor DMO tanto en la población joven como la envejecida, manteniendo una relación lineal hasta niveles de 30 ng/mL, asociación que no parece tan clara y sólida en poblaciones negras o hispanas de América del Norte30. Nuestros datos indican una asociación directa entre niveles de calcidiol <20 ng/mL y DMO a nivel de cuello femoral y cadera total. Un metaanálisis de 2014 concluyó que había muy poca evidencia de que la vitamina D influyese sobre la DMO, dado que no se observó relación consistente entre la suplementación con vitamina D y la DMO en la mayoría de los sitios anatómicos analizados (columna lumbar, cadera total, trocánter, cuerpo entero o antebrazo), si bien se observó una asociación positiva en cuello femoral al igual que lo observado en nuestro estudio31. De igual forma, un artículo reciente muestra que pacientes con fractura de cadera presentan niveles inferiores de calcidiol, menor masa ósea, disminución de la calidad ósea y aumento en el riesgo de fractura32. Es importante resaltar que en nuestro estudio se eliminaron todos aquellos sujetos que estaban recibiendo tratamiento para la osteoporosis, incluyendo los suplementos con vitamina D, hecho que no permite valorar el posible efecto de la suplementación con vitamina D sobre la masa ósea.
Nuestro estudio tiene limitaciones, pero también fortale zas. Respecto a las primeras, el hecho de disponer de una única determinación bioquímica (tras 4 años de seguimiento) sin conocer los valores en el inicio del estudio limita las aso- ciaciones encontradas. Por otro lado, el cuestionario sobre dificultades para realizar actividades de la vida diaria no fue autoadministrado sino administrado por un entrevistador, lo que podría haber sesgado las respuestas de los participantes, especialmente en aquellas preguntas que hacían referencia a las dificultades para el propio aseo personal. Como fortalezas, la cohorte analizada participó en el estudio EVOS-EPOS, siendo de los pocos grupos que finalizaron y completaron todas las directrices del estudio. Los porcentajes de participación de más del 80% en los cuatro seguimientos postales realizados durante 8 años avala la representatividad de la muestra analizada. Además de los artículos publicados con datos de la cohorte completa del estudio EVOS-EPOS, la cohorte del municipio de Oviedo, que ha sido utilizada para este estudio, ha contribuido de forma individual a la publicación de varios artículos originales en revistas de alto impacto33-39.
A modo de resumen, los niveles de calcidiol por encima de 20 ng/mL se asocian con una mayor fuerza muscular de agarre en las manos, mejor desempeño en actividades de la vida cotidiana como “inclinarse para coger un objeto del suelo” e “incorporarse de la cama” y con una mayor DMO en cadera total y cuello femoral, sugiriendo que mantener niveles de calcidiol superiores a 20 ng/mL favorecerían una adecuada función músculo-esquelética.











 text in
text in