INTRODUCCIÓN
La aparición de la enfermedad metastásica constituye una grave amenaza en la tasa de supervivencia de pacientes que desarrollan un tumor. Se ha observado, que ciertos tipos de tumores presentan una elevada tendencia a colonizar órganos específicos. Desde la hipótesis formulada por Paget (“seed-and-soil”)1, pocos estudios han descifrado los mecanismos reguladores del organotropismo metastásico. Estudios iniciales, se centraron en la función de las propiedades intrínsecas de la célula tumoral, como la expresión de genes y vías de regulación de la colonización, en dirección al organotropismo2-4.
El hueso es un órgano frecuentemente infiltrado por la diseminación metastásica de tumores sólidos5,6, siendo la aparición de la enfermedad metastásica una grave amenaza en la tasa de supervivencia de pacientes que desarrollan un tumor. El 65-80% con cáncer de próstata o mama metastásico presenta complicaciones esqueléticas5. El estudio de las metástasis óseas se ha centrado principalmente en la interacción de la célula tumoral con el hueso, una vez ha sido establecida la metástasis, ignorando los estadios subclínicos del proceso que ocurre previamente. El establecimiento de células tumorales en el microambiente óseo altera el balance del proceso de remodelado óseo entre la formación ósea, inducida por osteoblastos, y la resorción, mediada por osteoclastos. Como consecuencia, las vías de supervivencia y proliferación de células tumorales están favorecidas, induciéndose la formación de “un ciclo vicioso de las metástasis óseas”7.
Los tumores provocan dos tipos diferentes (aunque no excluyentes) de lesiones esqueléticas. La forma más común, representada por el cáncer de mama es la lesión osteolítica asociada a una alteración del remodelado óseo con incremento en la actividad osteoclástica y la consiguiente osteolisis8-11. Por otro lado, existe un segundo tipo de lesiones denominadas osteoblásticas caracterizadas por un elevado remodelado óseo con un incremento en la actividad de los osteoblastos con aumento del osteoide y de la tasa de mineralización. Estas áreas de hueso formado de novo en las zonas de metástasis se denominan lesiones osteoescleróticas, que suelen ser débiles e inestables, con tendencia a la rotura. Este tipo de lesiones es característico del cáncer de próstata. No obstante, actualmente se reconoce la existencia de un componente resortivo mediado por los osteoclastos como paso previo para el establecimiento de lesiones osteoblásticas12,13.
Recientes estudios han descrito cambios pro-metastásicos en órganos donde más tarde aparecerán metástasis. Tales cambios inducen la formación de nichos pre-metastásicos que favorecen la implantación de células tumorales en órganos diana14,15.
La complejidad celular del hueso (osteocitos, osteoblastos, osteoclastos, células de recubrimiento óseo, células endoteliales y tejido hematopoyético), así como las funciones que realizan en el mismo regulando el metabolismo y remodelado óseo, plantea la posibilidad de que la formación del nicho pre-metastásico óseo sea consecuencia de una red compleja de modificaciones y alteraciones combinadas o secuenciales de todas estas células16.
A pesar de la existencia de algunas observaciones analizando el efecto de los factores secretados por células tumorales que afectan a la viabilidad de células óseas17, se desconoce la existencia de mecanismos comunes o cambios acontecidos en las células óseas inducidos por los tumores sólidos con un alto organotropismo hacia el hueso como órgano diana metastásico.
En este estudio, hemos analizado los cambios en el perfil transcripcional de citoquinas relacionadas con el metabolismo óseo en células osteoblásticas y osteocíticas, inducidos por factores solubles tumorales de células de tumor de mama, próstata y melanoma. Nuestras observaciones muestran que estos factores modifican significativamente el perfil transcripcional de los osteocitos. Estos resultados sugieren un papel relevante de los osteocitos como la célula inductora inicial en la formación del nicho pre-metastásico óseo.
MATERIAL Y MÉTODO
Cultivos celulares
Las líneas celulares pre-osteoblástica murina MC3T3-E1 (ATCC: CRL-2593) y osteocítica murina MLO-Y4 (generosamente donada por Lynda Bonewald) se cultivaron en DMEM con 10% de suero fetal bovino (SFB) o α-MEM con 2,5% de suero fetal de carnero (SCF) y 2,5% SFB, respectivamente. Todas las células fueron cultivadas en medios que contenían penicilina (100 unidades/mL) y estreptomicina (100 μg/mL) en el incubador humidificado a 37ºC y 5% CO2 atmosférico.
La línea continua osteoblástica humana hFOB 1.19 (ATCC® CRL-11372TM) se cultivó en una mezcla 1:1 de Ham´s F12 y DMEM con 2,5 mM de L-glutamina, 0,3 mg/mL de G418 y 10% SFB en el incubador humidificado a 34ºC y 5% CO2 atmosférico.
Utilizamos las líneas de adenocarcinoma prostática de ratón TRAMPC-1 (ATCC® CRL-2730 TM), melanoma murina B16 (ATCC® CRL-6323) y cáncer de mama humana (ATCC® MDA-MB-231 HTB-26) para la obtención del secretoma tumoral. Estas células se cultivaron en medio de cultivo DMEM suplementado con penicilina (100 U/ml), estreptomicina (100 μg/ml), glutamina al 1% y SFB al 10%. Cuando el cultivo alcanzó confluencia se lavaron con una solución fosfatada (PBS). A continuación, se obtuvieron los secretomas tumorales y medios condicionados óseos utilizados para la estimulación de células tumorales previamente activadas con factores solubles óseos.
Para la obtención de los medios condicionados tanto de células tumorales como células óseas, las líneas celulares se cultivaron hasta confluencia con medio de cultivo α-MEM suplementado con penicilina y estreptomicina al 0% de SFB, tras 24 horas de incubación, se recogieron los medios y se eliminaron los restos celulares y células muertas por centrifugación (5.000 rpm, 10 minutos).
Con el fin de evitar cualquier tipo de reactividad biológica cruzada de las citocinas de una especie en células de otra especie18 y reproducir de la manera más fiel posible la comunicación de células tumorales con células óseas, nuestros modelos experimentales in vitro se diseñaron atendiendo principalmente al criterio de especie. De esta forma, se evaluaron los efectos del secretoma tumoral de la línea humana de cáncer de mama sobre la línea osteoblástica humana. Actualmente no existe una línea continua osteocítica bien caracterizada. Los efectos de los secretomas de líneas tumorales de próstata y melanoma de ratón se estudiaron sobre las líneas murinas óseas (osteoblástica, MC3T3, y osteocíticas, MLOY4). En la figura 1 se encuentra representado el protocolo empleado en la obtención de medios condicionados y su estimulación en las distintas estirpes celulares al 25%.
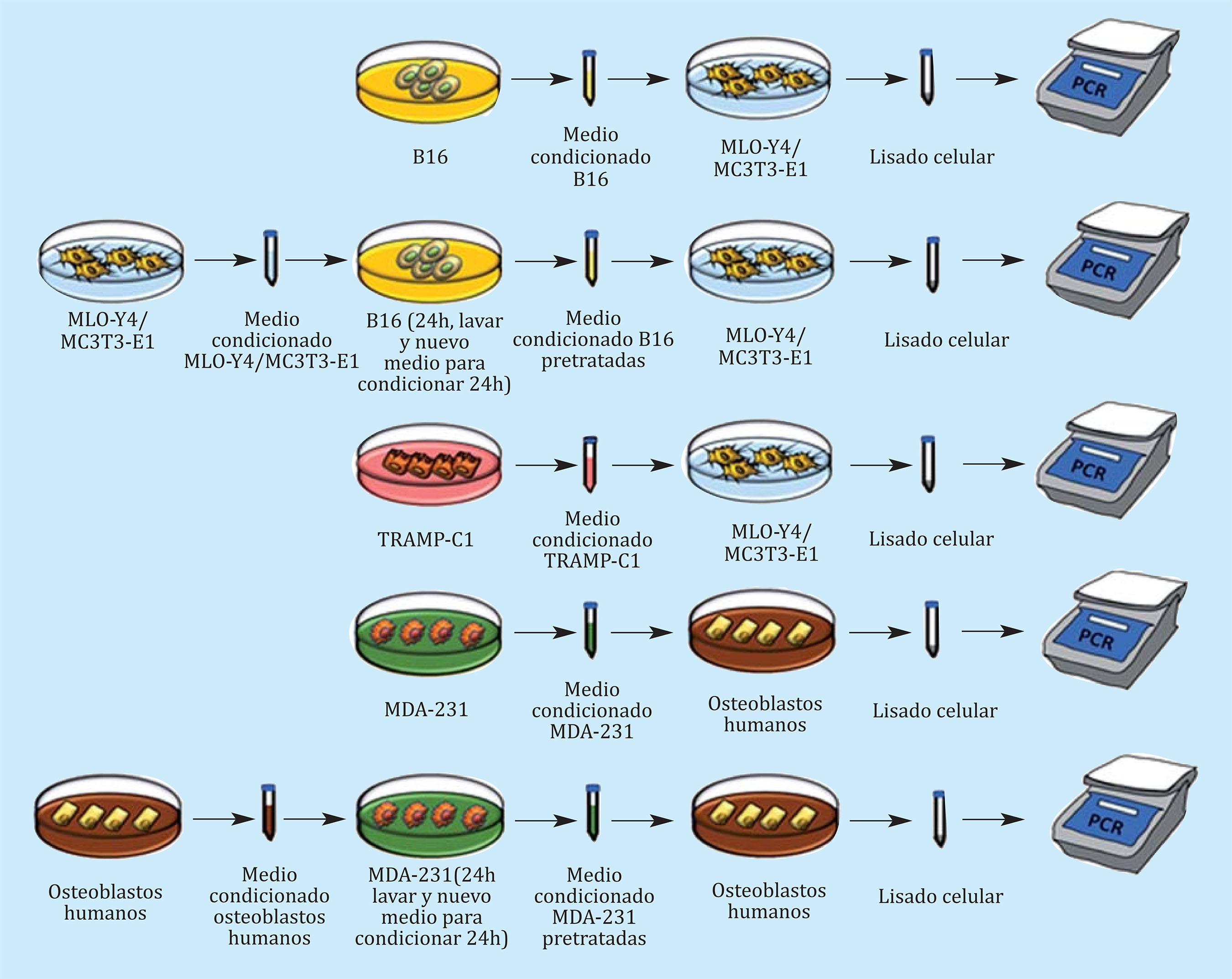
Figura 1 Representación gráfica del protocolo de trabajo empleado para la obtención de medios condicionados (MC) pre-tratados o no. Los MC no pre-tratados de MLO-Y4, MC3T3-E1, osteoblastos humanos, B16, TRAMP-C1 o MDA-231 se obtuvieron tras 24 h de cultivo en β-MEM al 0% de SFB y se usaron para estimular las diferentes líneas celulares. Los MC pre-tratados se obtuvieron tras cultivar 24 h las B16 o MDA-231 con MC de MLO-Y4, MC3T3-E1 u osteoblastos humanos seguido de un lavado con PBS y 24 h de cultivo con β-MEM al 0% de SFB. Finalmente, se obtuvo un lisado celular que se analizó por PCR
Ensayo de viabilidad celular
El número de células viables óseas MC3T3, MLOY4 y hFOBs estimuladas o no con secretoma tumoral al 25% fue evaluado por el ensayo de exclusión por azul de trypan como previamente ha sido descrito19.
Estudios de expresión génica por PCR a tiempo real
El ARN total se extrajo de cultivos celulares por el método de Trizol. La síntesis de cADN se realizó utilizando la transcriptasa reversa del virus de mieloblastosis aviar (Promega) y cebadores aleatorios hexaméricos (random hexamer primers). La PCR en tiempo real se llevó a cabo en el sistema ABI PRISM 7500 (Applied Biosystems) utilizando Sybr premix ex Taq (Takara, Otsu, Japan) y cebadores específicos de cada gen (Tabla 1). Todos los resultados fueron expresados en número de copias de ARNm calculadas para cada muestra utilizando el valor del ciclo umbral (cycle threshold, Ct). La expresión génica relativa se representa como: 2-ΔΔCt, donde ΔΔCt = ΔCtgen diana - ΔCt18S/GAPDH. El cambio del número de veces con respecto al tratamiento se define como la expresión comparada con el control, calculándose como 2-ΔΔCt, donde ΔΔCt = ΔCtratamiento - ΔCcontrol. La especificidad del amplicon fue confirmada como la presencia de una única amplificación tras el análisis de la curva de fusión (melting curve). Los resultados mostrados corresponden a la media realizada de al menos 3 experimentos independientes por triplicado.
RESULTADOS
La comunicación mediante factores solubles entre melanocitos tumorogénicos y células óseas regula la expresión de genes de remodelado óseo en osteocitos
Con objeto de estudiar la comunicación existente entre las células tumorales y las células óseas en la formación de nichos pre-metastásicos óseos, se estimularon células óseas de ratón o humano con los secretomas de distintas células tumorales con organotropismo a tejido óseo, que habían sido previamente estimuladas o no con secretomas de osteocitos u osteoblastos (Figura 1).
En primer lugar, corroboramos que los medios condicionados tumorales de las TRAMPC-1 o B16, es decir secretoma tumoral, no afectan a la viabilidad de las células ósteoblásticas, MC3T3, y osteocítica, MLOY4 tras 24 h de estimulación (Figura 2). Sin embargo, la estimulación de osteocitos MLO-Y4 con secretomas obtenidos de medios condicionados de células de melanoma B16 indujo sobreexpresión del gen OPG con un aumento neto en la relación OPG/RANK-L, sin afectar significativamente a la expresión génica de RANK-L, ni al factor de transcripción Runx2 (Figura 3A-D). Por el contrario, los secretomas de células de melanoma B16, que previamente habían sido expuestas a medios condicionados de células MLO-Y4, ocasionaron un aumento en la expresión de RANK-L y un descenso en la relación OPG/RANK-L. No se observaron modificaciones en la expresión de OPG o de Runx2 respecto a los medios condicionados sin pre-estimulación (Figura 3A-D). Estos datos sugieren que las células tumorogénicas de melanoma, que han sido expuestas a secretoma de osteocitos, secretan factores solubles que ocasionan una respuesta de aumento de genes de remodelado óseo, particularmente incrementando la expresión del factor osteoclastogénico RANK-L en osteocitos.
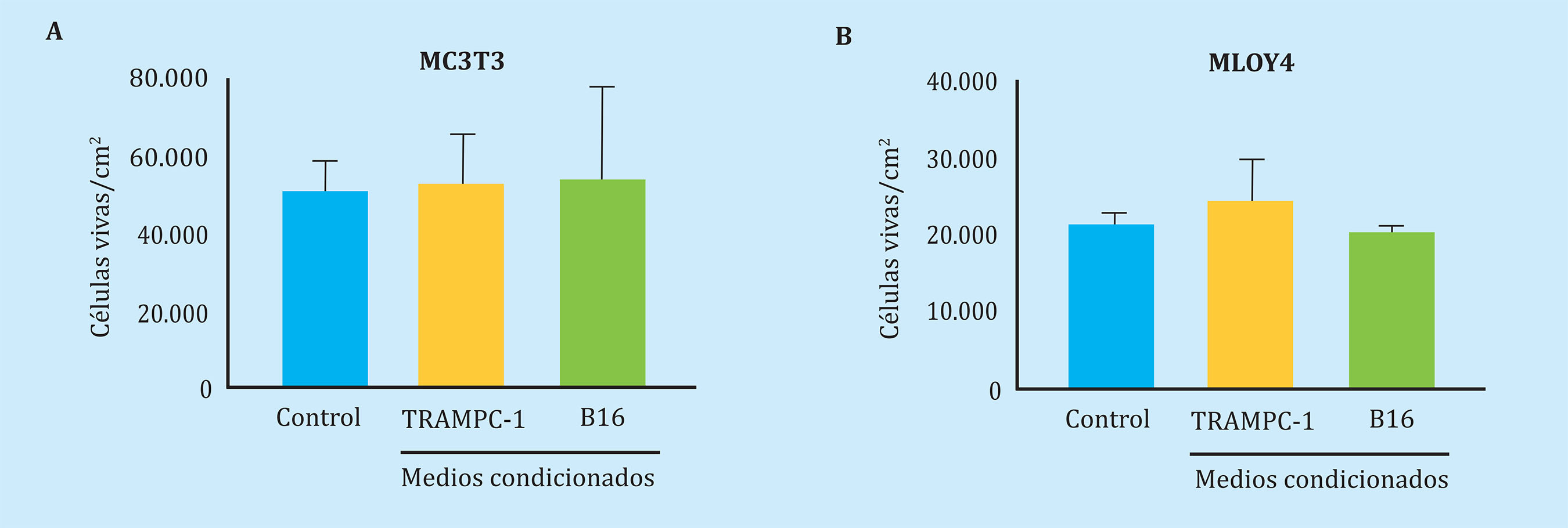
Figura 2 Los factores solubles secretados por melanocitos tumorogénicos de ratón (B16) o células tumorales prostáticas de ratón (TRAMPC-1) no afectan a la viabilidad de células óseas murinas pre-osteoblásticas (MC3T3-E1) u osteocíticas (MLO-Y4) Los datos están representados como la media ± SEM de 2 experimentos por triplicado
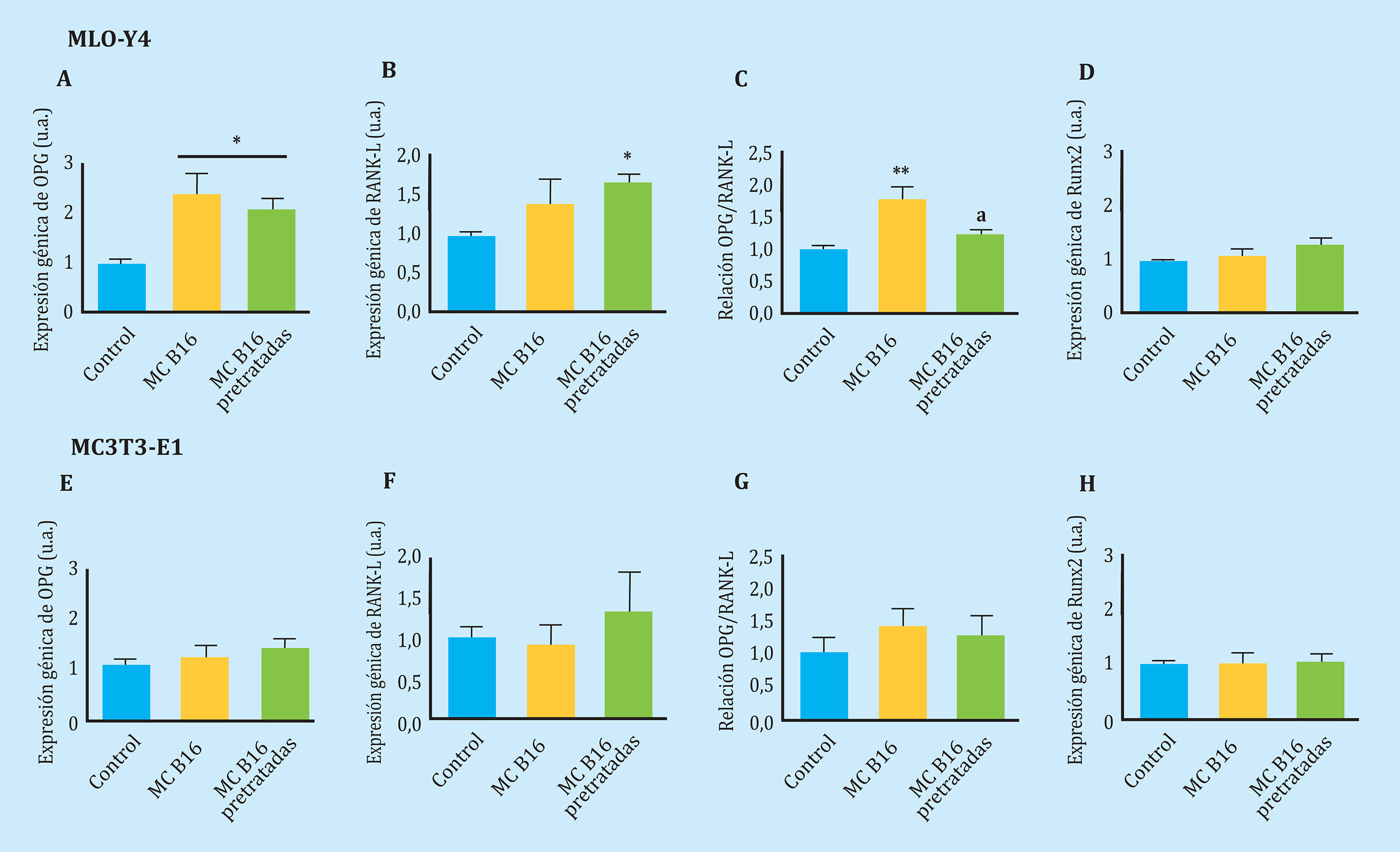
Figura 3 Los factores solubles secretados por melanocitos tumorogénicos (B16) modifican la expresión de genes de remodelado óseo en osteocitos (MLO-Y4) pero no en pre-osteoblastos (MC3T3-E1). La expresión de OPG (A,E), RANK-L (B,F), ratio OPG/RANK-L (C,G) y Runx2 (D,H) se evaluó mediante PCR a tiempo real tras estimular 24 h MLO-Y4 y MC3T3-E1 con medio condicionado de B16 pre-tratadas o no. Los datos están representados como la media ± SEM de tres experimentos independientes por triplicado. *p<0,05 vs. control, **p<0,01 vs. control
Curiosamente, estos efectos no se reprodujeron en células osteoblásticas MC3T3-E1, en las que los medios condicionados de células B16 no ocasionaron sobreestimulaciones génicas (Figura 3E-H).
La comunicación mediante factores solubles entre células tumorogénicas de mama y células óseas regula la expresión de genes de remodelado en osteblastos
A continuación, analizamos los efectos de células de otro tipo de tumor que metastatiza a hueso, como es el de mama5, sobre la expresión génica de células óseas. En este caso, analizamos los efectos del secretoma de la línea tumoral humana de cáncer de mama MDA-MB-231 sobre osteoblastos humanos (Figura 1). Observamos que los medios condicionados de células MDA-MB-231 causaron un incremento en la expresión de RANK-L y una disminución de la relación OPG/RANK-L, sin afectar a la expresión de OPG o de Runx2 en osteoblastos humanos (Figura 3A-D). Los efectos sobre la expresión génica de osteoblastos fueron similares utilizando los secretomas de MDA-MB-231, tanto pre-tratados como no pre-tratados con medios condicionados de osteoblastos humanos (Figura 4A-C).
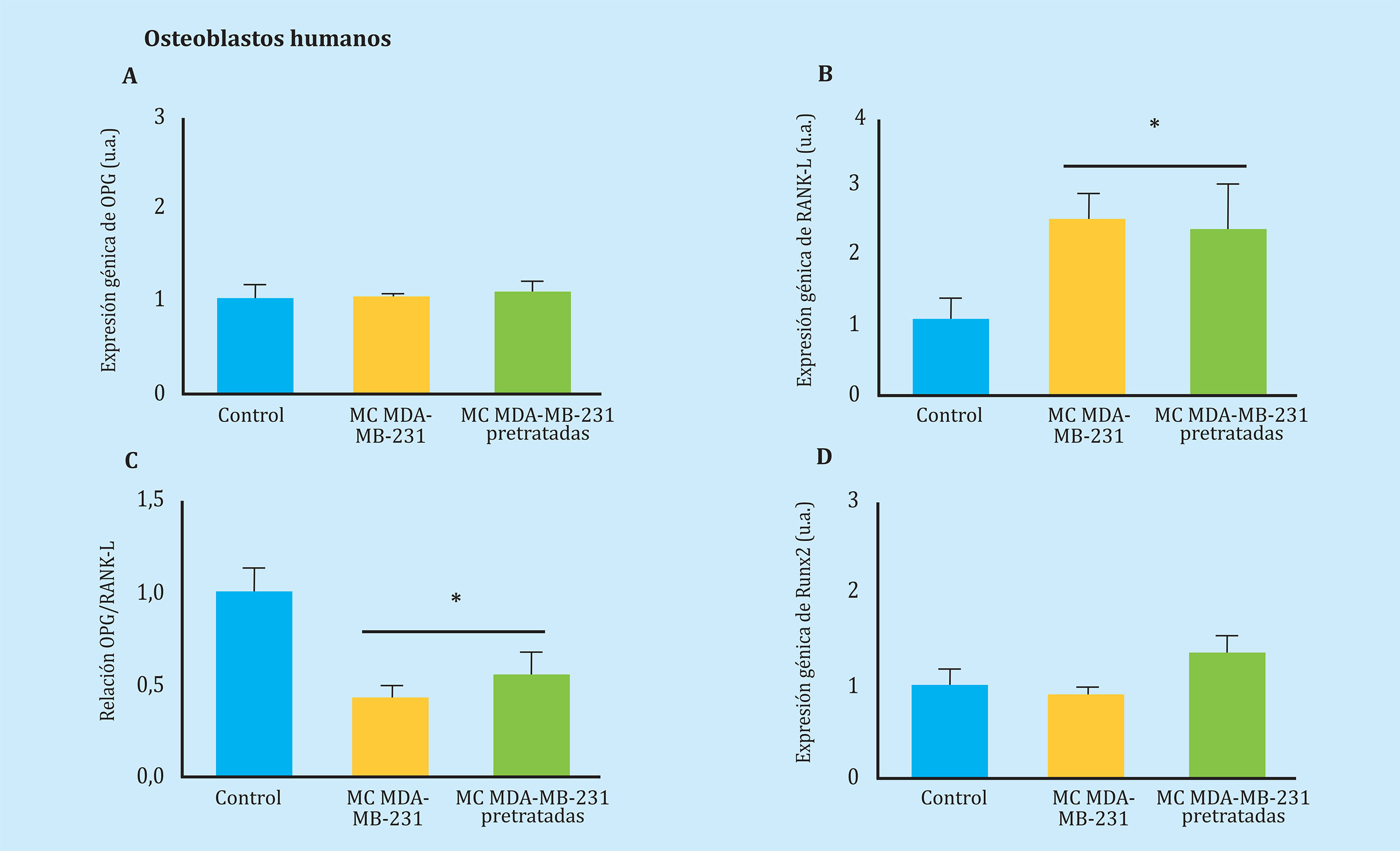
Figura 4 Los factores solubles secretados por células tumorales de cáncer de mama (MDA-MB-231) modifican la expresión de genes de remodelado óseo en osteoblastos humanos (hFOB 1.19). La expresión de OPG (A), RANK-L (B), ratio OPG/RANK-L (C) y Runx2 (D) se evaluó mediante PCR a tiempo real tras estimular 24 h los osteoblastos humanos con medio condicionado de MDA pre-tratadas o no. Los datos están representados como la media ± SEM de tres experimentos independientes por triplicado. *p<0,05 vs. control
La comunicación mediante factores solubles entre células tumorogénicas de próstata y células óseas regula la expresión de genes de remodelado y osteogénicos en osteocitos
Seguidamente, quisimos comprobar si las células de tumor de próstata, potencialmente capacitadas para metastatizar a hueso20,21, también establecían comunicación con células óseas mediante factores solubles (Figura 1). En este caso, observamos que los secretomas de células de adenocarcinoma de próstata de ratón TRAMP-C1 indujeron sobreexpresión de los genes OPG y RANK-L, causando un aumento en la relación OPG/RANK-L, además de sobreexpresar el factor de transcripción osteogénico Runx2 en osteocitos MLO-Y4 (Figura 5A-D). Dada la sobreexpresión génica de Runx2 en estas células, quisimos comprobar si la proteína osteocalcina, una proteína asociada a formación ósea y regulada por Runx222, también sufría cambios en estas condiciones. De modo similar a Runx2, la expresión de osteocalcina aumentó tras estimulación con el secretoma de las células TRAMP-C1 en osteocitos MLO-Y4 (Figura 5E).
De manera similar a los datos observados con los secretomas de células de melanoma B16, los medios condicionados de células TRAMP-C1 no afectaron a la expresión génica de los marcadores previamente mencionados en osteoblastos MC3T3-E1 (Figura 5F-J).
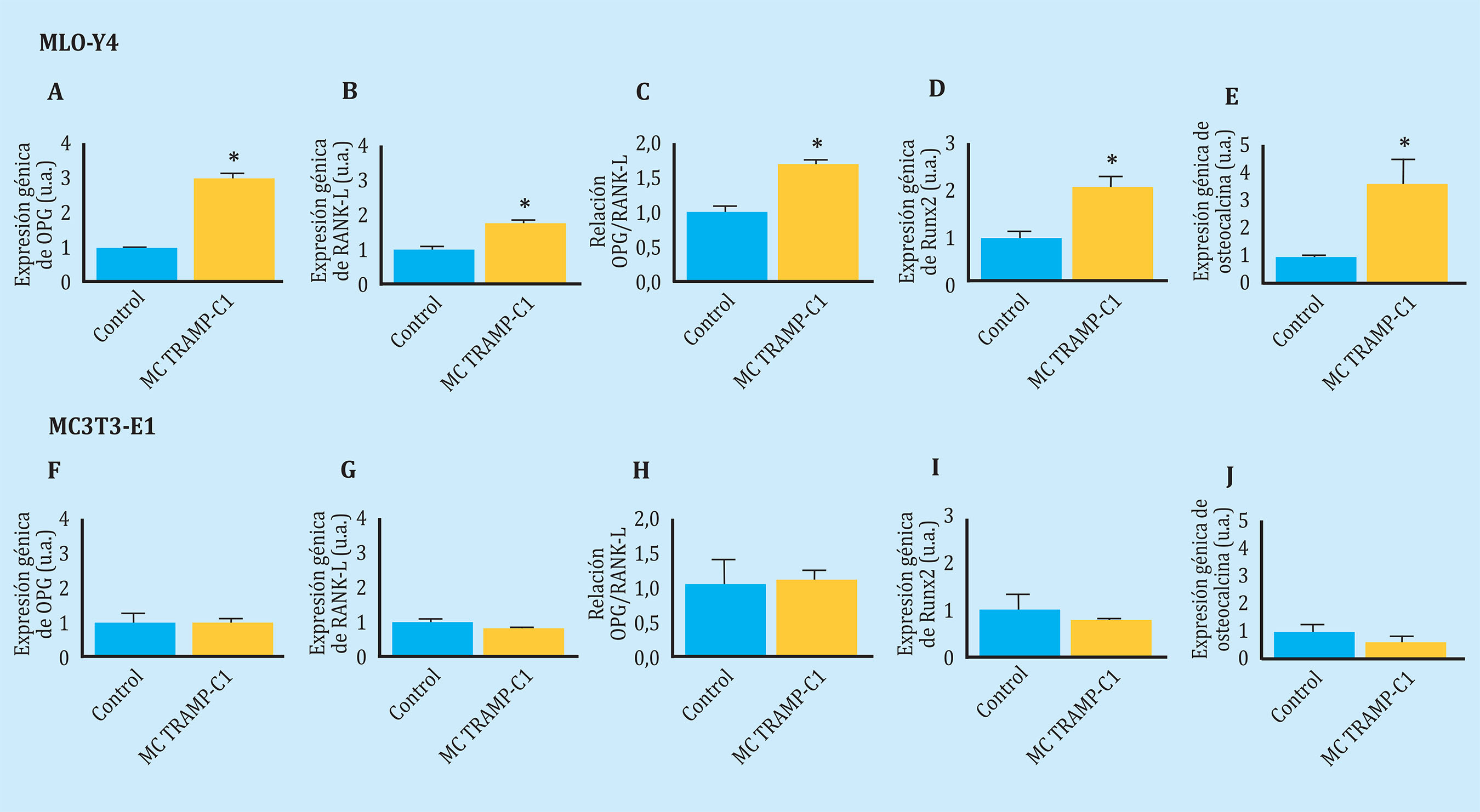
Figura 5 Los factores solubles secretados por células tumorales prostáticas (TRAMP-C1) modifican la expresión de genes de remodelado óseo en osteocitos (MLO-Y4) pero no en pre-osteoblastos (MC3T3-E1). La expresión de OPG (A,F), RANK-L (B,G), ratio OPG/RANK-L (C,H), Runx2 (D,I) y osteocalcina (E,J) se evaluó mediante PCR a tiempo real tras estimular 24 h MLO-Y4 y MC3T3-E1 con medio condicionado de TRAMP-C1. Los datos están representados como la media ± SEM de tres experimentos independientes por triplicado. *p<0,05 vs. control
DISCUSIÓN
La formación de un microambiente que favorezca la implantación de células tumorales circulantes fue descrita por Kapplan. Sus resultados demostraron la formación de un nicho pre-metastásico, en el cual se observaron una serie de cambios moleculares y celulares en el pulmón previo al establecimiento del melanoma metastásico15,23.
Posteriormente, otros investigadores describieron una serie de eventos secuenciales que podría implicar la formación de un nicho pre-metastásico en el hígado, sugiriendo la implicación de exosomas derivados de lesiones pancreáticas malignas como desencadenantes del proceso14. En este sentido, poco ha sido descrito sobre la formación del nicho pre-metastásico óseo y se desconoce las respuestas de las distintas subpoblaciones óseas a la estimulación por secretomas de distintos tumores con alta frecuencia metastásica a hueso. En el presente artículo, mostramos por primera vez como el secretoma de tumores sólidos, con alto potencial organotrópico en la formación de metástasis óseas, modifica la expresión génica de genes relacionados con el metabolismo óseo en células de linaje osteogénico, pudiendo ser el proceso desencadenante en la inducción de un microambiente favorable para el asentamiento de células tumorales.
Recientemente, se ha sugerido que las células del tumor primario producen factores solubles tumorales que disparan la formación del nicho pre-metastásico inmaduro24. Nuestros resultados confirman que los secretomas tumorales de las células de tumor primario (como melanoma y de próstata), o las células tumorales de mama derivadas de procesos metastásicos no óseos, modifican principalmente el equilibrio entre los niveles de expresión de OPG y RANKL. Este desequilibrio desacoplaría la relación entre formación ósea osteoblástica y la resorción ósea osteoclástica, generando la liberación de factores de crecimiento y citoquinas e iniciándose de este modo un “ciclo vicioso previo” de retroalimentación que fomente la formación de las futuras zonas metastásicas en hueso10. En este sentido, nuestros resultados sugieren al osteocito como la célula más susceptible a los factores solubles tumorales. En nuestro modelo experimental in vitro, en el que tratamos tanto células osteocíticas como células osteoblásticas de ratón con medios condicionados de células murinas de tumor primario de melanoma y de próstata, observamos cambios significativos en la expresión génica de la línea osteocítica sin observar cambios significativos en la línea osteoblástica. Estas observaciones nos hacen concluir que, aunque ambos tipos de tumor generarán en un futuro distintos tipos de metástasis, siendo las derivadas de melanoma con un carácter más osteolítico25 y las de adenocarcinoma prostático preferentemente osteoblástico, las etapas iniciales, en las cuales se producen alteraciones en la fisiología de las células óseas, son comunes. Estas observaciones sugieren que las modificaciones que se originen en el nicho pre-metastásico no predisponen al tipo concreto de lesiones esqueléticas que se desarrollarán en la enfermedad metastásica.
De manera destacada, sugerimos al osteocito como principal célula diana de los factores solubles tumorales. Dado que no existe ningún modelo de célula osteocítica humana de linaje continuo, no pudimos corroborar los resultados obtenidos por el secretoma de melanoma y cáncer de próstata en comparación con el secretoma de cáncer de mama en estas células. El estudio de los cambios inducidos por el secretoma de células de cáncer de mama sobre células óseas se limitó a los efectos en la línea continua osteoblástica humana hFOBs. Los resultados obtenidos sugieren que las células del cáncer de mama son capaces de afectar a los osteoblastos mediante factores solubles y que modulan principalmente la expresión génica de RANK-L sin necesidad de mantener comunicación cruzada con estas células, confirmando la alteración del eje OPG/RANKL, al igual que los cambios inducidos por los otros secretomas tumorales estudiados. Dado que los osteocitos son las células mayoritarias en hueso, con una vida media de 25 años, con carácter multifuncional y papel de director-coordinador del entorno óseo26,27, su modulación, ya sea farmacológica o como diana terapéutica, podría ser clave para evitar la formación del nicho pre-metastásico y con ello la metástasis ósea. Se ha propuesto que son los osteocitos, y no el resto de células del linaje osteogénico, la principal fuente que requieren los osteoclastos para su formación y activación en el remodelado del hueso trabecular28,29, pudiendo ser también las únicas responsables de iniciar el ciclo vicioso del proceso metastásico óseo. Pocos estudios han establecido un papel claro del osteocito y su relación con el cáncer. En este sentido, Delgado-Calle y cols. demostraron que los osteocitos podrían ser reguladores de la proliferación de las células de cáncer de tipo mieloma por interacción directa con ellas a través de sus prolongaciones citoplasmáticas, las cuales son capaces de alcanzar las superficies periósticas y endocorticales, así como la superficie de médula ósea30. Esta interacción directa resultaría en la activación de la vía de señalización de Notch en las células de mieloma. Esta vía media la comunicación célula a célula, y participa en el control y activación de programas de proliferación celular y muerte. Su inhibición farmacológica, utilizando un inhibidor de dicha vía, evitó la proliferación del mieloma inducida por osteocitos30. Además de regular y coordinar al resto de estirpes celulares en el entorno óseo, los osteocitos podrían secretar factores que alcancen a células lejanas, como, por ejemplo, células de tumor primario, y las modifiquen. Esta comunicación se ha sugerido en el caso del adenocarcinoma prostático, donde células osteocíticas y osteoblásticas regulaban sus propiedades osteomiméticas21. Además, esta comunicación podría modular vías de señalización claves en las células prostáticas tumorales, como los mediadores intracelulares calcio, AMP cíclico y ERK ½31, pudiendo potenciar la progresión tumoral del cáncer de próstata al hueso. Todos estos resultados, junto con los resultados mostrados en el presente artículo, sugieren que en la comunicación cruzada entre el tumor primario y células óseas la composición de los factores implicados en el secretoma puede ir variando. Durante la evolución del tumor, los factores solubles tumorales podrían alcanzar el entorno óseo e inducir cambios en sus células. Estas células también podrían enviar factores solubles al tumor primario, que generarán cambios en las células tumorales induciéndolas un mayor fenotipo osteomimético. El secretoma de estas células tumorales osteomiméticas (en las figuras presentadas como medios condicionados pre-tratados), al alcanzar de nuevo el entorno óseo, podría afectar en el mismo sentido o inducir distintas variaciones del microambiente cambiante hacia la formación del nicho. En este sentido, en el análisis proteómico del secretoma de dos líneas continuas tumorales prostáticas con origen distinto, DU145 (procedentes de metástasis cerebrales) y PC-3 (procedentes de metástasis óseas) se encontraron 211 proteínas de secreción diferencialmente expresadas, lo que supuso un 37,6% del total de proteínas analizadas, indicando que las proteínas de secreción fueron considerablemente diferentes entre ambas líneas celulares32. En base a estas investigaciones y a nuestros resultados proponemos que los secretomas tumorales modifican el entorno óseo, siendo más sensible la línea osteocítica (Figura 6). Los resultados mostrados abren un amplio campo de estudio en el conocimiento de la comunicación entre las células tumorales primarias y las células del futuro órgano metastásico, en este caso, el microambiente óseo. No obstante, se debería profundizar en su conocimiento, debido a las limitaciones del presente estudio. Como se ha comentado previamente se han evitado efectos inespecíficos como resultado de emplear cultivos celulares de especies distintas, y se ha empleado un modelo celular in vitro basado en líneas celulares ampliamente utilizadas como referente para el estudio del metabolismo y la fisiología ósea, en el caso de las MC3T3, MLOY-4 y hFOBs; así como en el estudio del cáncer, en el caso de las células tumorales próstaticas, de melanoma o mama. Con respecto a la línea tumoral de mama ( MDA-MB-231 HTB-26), una de las limitaciones que tiene su uso en modelos in vitro es su origen metastásico33 pudiéndose ver alterado su comportamiento como tumor primario y con ello la comunicación organotrófica metastásica. Por este motivo, se han estudiado las otras dos líneas tumorales con organotropismo metastásico óseo cuyo origen proviene de tumores primarios. Sin embargo, sería recomendable confirmar los resultados obtenidos en el presente trabajo en un modelo de experimentación in vivo donde se pueda estudiar y confirmar los cambios acontecidos en el microambiente óseo previo al establecimiento de la metástasis, cuantificando en el suero/plasma las citoquinas óseas alteradas y determinando la temporalidad de la comunicación del hueso y el tumor primario así como el nivel de cambio en el tejido óseo. El conocimiento más detallado de los cambios moleculares que implican la formación del nicho pre-metastásico óseo, así como de los factores del secretoma que lo inducen, podría aportar nuevas dianas terapéuticas o protocolos de actuación, mejorando así su pronóstico. Estas actuaciones disminuirían los eventos esqueléticos metastásicos que desarrollan los pacientes con tumores sólidos como el de próstata o el de mama, incrementando así su calidad de vida.

Figura 6 Los secretomas tumorales modifican el entorno óseo, siendo los osteocitos las células más sensibles a estos cambios. Los factores solubles secretados por los tumores de próstata y melanoma son los que afectan principalmente al osteocito, incrementando la expresión génica de diferentes factores relacionados con el remodelado óseo. A su vez, los osteocitos secretan factores que modifican e inducen un mayor fenotipo osteomimético en las propias células tumorales











 text in
text in 



