INTRODUCCIÓN
Los moduladores selectivos de los receptores estrogénicos (SERMs) son agentes sintéticos no esteroideos que tienen actividades como agonistas o antagonistas estrogénicos en diversos tejidos1. El mecanismo de acción de los SERMs es a través de los dos tipos de receptores estrogénicos (α y β). Los SERMs poseen propiedades agonistas o antagonistas dependiendo del tipo de tejido2,3. En general tienen actividad agonista en el hígado, tubo digestivo, esqueleto y corazón, y antagonista en la mama. En el útero, unos SERMs se comportan como agonistas y otros como antagonistas1. Existen un gran número de proteínas co-reguladoras que modulan la acción de los SERMs sobre la expresión génica y contribuyen a la farmacología tejido-específica de los mismos1.
El tamoxifeno es un SERM que se utiliza como antiestrógeno mamario para el tratamiento y prevención del cáncer de mama con actividad agonista estrogénica en el útero. El raloxifeno se ha utilizado en la prevención y tratamiento de la osteoporosis y previene el cáncer de mama, pero tiene una cierta actividad estrogénica4. El bazedoxifeno es un SERM de 3ª generación con efectos agonistas sobre el hueso y efectos favorables adicionales sobre los lípidos, el útero y el tejido mamario5,6.
Debido a su acción agonista estrogénica sobre el hueso, el raloxifeno y el bazedoxifeno se han utilizado y se utilizan en el tratamiento de la osteoporosis. El bazedoxifeno tiene la ventaja de una mayor seguridad endometrial, de tal modo que se utiliza también ampliamente junto con estrógenos equinos conjugados para el tratamiento de la endometriosis7-9.
En este trabajo nos hemos centrado en los efectos producidos por el bazedoxifeno sobre el hueso. Pero nos parece también interesante señalar que el bazedoxifeno se ha descubierto como efectivo agente terapéutico en el cáncer humano colono-rectal10. También en el tratamiento del cáncer de mama11, del cáncer gastrointestinal12 y del adenocarcinoma gástrico13.
Centrándonos en los efectos sobre el hueso, Keating y cols.14 observaron que el bazedoxifeno reducía la incidencia de nuevas fracturas vertebrales en pacientes con osteoporosis y también la incidencia de fracturas no vertebrales en pacientes de alto riesgo. Por otra parte, es un medicamento muy bien tolerado, sin efectos nocivos sobre el endometrio o el tejido mamario7.
El objetivo de nuestro trabajo fue estudiar en detalle los efectos del bazedoxifeno sobre la calidad ósea utilizando un modelo experimental de ratas ovariectomizadas y un tratamiento a largo plazo (8 meses). Se estudió la densitometría ósea lumbar y femoral, los parámetros microtomográficos trabeculares y corticales, los marcadores bioquímicos de remodelado de formación y resorción, y los parámetros biomecánicos del hueso.
MATERIALES Y MÉTODOS
Se utilizaron 45 ratas Wistar hembras de 6 meses de edad del animalario de la Fundación Jiménez Díaz que fueron mantenidas en condiciones estables de temperatura de 22ºC, ciclos de 12 horas de luz y oscuridad y con acceso libre a comida y agua. La comida se administró mediante una dieta completa para ratas y ratones (Panlab®, Barcelona, España). El peso medio de las ratas al comienzo del estudio fue de 333,6±32 g (media ± desviación estándar).
Las ratas se dividieron al azar en 3 grupos:
Grupo SHAM (n=15): ratas en las que se simuló la ovariectomía;
Grupo OVX (n=15): ratas ovariectomizadas;
Grupo OVX + BZD (n=15): ratas ovariectomizadas a las que se les administró 0,33 mg/kg/día de bazedoxifeno mediante sonda oral durante 8 meses.
El tratamiento comenzó el día posterior a la ovariectomía y se mantuvo durante 8 meses. Todos los tratamientos se realizaron de acuerdo con los estándares comunitarios europeos sobre el cuidado y uso de los animales de laboratorio y fueron aprobados por el Comité de Ética del Instituto de Investigación Sanitaria de la Fundación Jiménez Díaz.
El fármaco que se administró como bazedoxifeno fue Conbriza® (Pfizer). Fue donado amablemente por Laboratorios Pfizer. La dosis se calculó en base al tratamiento indicado para la osteoporosis en humanos, 20 mg/día por vía oral. De este modo, la dosis de bazedoxifeno empleada en nuestras ratas fue 0,33 mg/kg/día mediante sonda oral. El vehículo utilizado fue 0,3 ml de agua en cada animal.
Las ratas fueron anestesiadas para la cirugía mediante inyección intramuscular de 0,7 ml de una mezcla 1:2 de 2 g/ml de hidrocloruro de xilacina (Rompun®) y 50 mg/ml de ketamina (Ketolar®). Una vez anestesiadas, fueron inmovilizadas de las cuatro extremidades y se rasuró la zona a intervenir. La posición final del animal fue decúbito supino, apoyado sobre el dorso o espalda. La cirugía de ovariectomía bilateral se realizó a través de una incisión abdominal. Para la extirpación de los ovarios se identificaron los cuernos uterinos, fijados al ovario por un extremo y al útero por otro. Se establecieron las ligaduras a ambos lados del ovario, seccionando y extirpando los mismos. Una vez extirpados los ovarios se suturó la incisión realizada. Transcurridos los 8 meses de tratamiento, se pesaron las ratas y se sacrificaron mediante exsanguinación por punción cardiaca bajo anestesia con isofluorano (Forane®). Mediante punción cardiaca se obtuvieron las muestras de sangre, que fueron centrifugadas a 3.000 r.p.m. durante 15 minutos para obtener el suero. Dicho suero se separó en alícuotas y se congeló a -80ºC hasta la posterior determinación de los parámetros de remodelado óseo.
Las ratas fueron congeladas -20ºC, tras la extracción de su sangre, hasta la medición de la densidad mineral ósea. El día previo a la realización de dicha medición las ratas se metieron en una nevera a 4ºC para su descongelación. Una vez descongeladas, se amputaron los fémures derechos e izquierdos con la ayuda de pinzas y bisturí. Una vez extraídos y limpios, se realizó la densitometría mineral ósea de los fémures izquierdos y columnas vertebrales a nivel de L2, L3 y L4.
Densitometría ósea
Se procedió a la determinación de la densidad mineral ósea (DMO) del fémur izquierdo y de la columna vertebral a nivel de L2, L3 y L4, por densitometría de doble energía de rayos X (DXA). Para ello se utilizó un aparato denominado Piximus (Hologic®, QDR-1000 TM), que es un densitómetro específico para animales y muestras pequeñas.
El escaneo de la DMO se realizó en todo el fémur y en las tres vertebras completas (L2, L3, L4) y los resultados se expresaron como la media de los valores obtenidos. Los coeficientes de variación de esta técnica intra e interensayo fueron <0,53% y <1,2%, respectivamente.
Tras esta medición, los fémures se envolvieron en gasas empapadas con suero fisiológico y se mantuvieron congelados a -20ºC hasta la realización de la microtomografía computarizada. Los fémures derechos se guardaron del mismo modo para la realización del test biomecánico. Se ha comprobado que en estas circunstancias el hueso no muestra variaciones significativas en sus propiedades mecánicas durante al menos 7 u 8 meses. De igual modo, no se han observado variaciones cuando las muestras se someten hasta en 5 ocasiones a periodos cortos de congelación-descongelación15.
Marcadores bioquímicos de remodelado óseo
Las muestras de sangre se descongelaron para determinar los marcadores bioquímicos de remodelado óseo.
Marcadores bioquímicos de formación ósea:
- Osteocalcina (BGP): se utilizó un inmunoensayo colorimétrico (ELISA) comercial específico para la determinación de los niveles de osteocalcina en ratas (Rat-MID™ Osteocalcin, IDS, Reino Unido). La sensibilidad del ensayo fue de 50 ng/ml, y los coeficientes de variación intra e interensayo <5,0% y <6,6%, respectivamente.
-
- Própeptido aminoterminal del procolágeno I (PINP): se utilizó un enzimoinmunoensayo (ELISA) comercial específico para determinar las concentraciones de PINP en ratas (Rat/Mouse PINP, IDS, Reino Unido). La sensibilidad del método fue de 0,7 ng/ml, y los coeficientes de variación intra e interensayo <5% y <8,2%, respectivamente.
Marcador bioquímico de resorción ósea:
- Telopéptido carboxiterminal del colágeno tipo I (CTX): se utilizó un ELISA específico para ratas (RatLaps CTX-I ELISA, IDS, Reino Unido). La sensibilidad del ensayo fue de 2,0 ng/ml y los coeficientes de variación intra e interensayo del método fueron <5,6% y <10,5%, respectivamente.
Microtomografía
Los fémures izquierdos de las ratas se enviaron a la Universidad de Oviedo para el estudio de la microarquitectura ósea a partir de las imágenes de microtomografía computarizada (micro-CT) adquiridas en las muestras de hueso. Dicho análisis se realizó en la metáfisis distal del fémur y en un anillo de hueso cortical de la diáfisis del mismo.
Todas las muestras se escanearon en un microtomógrafo de rayos X de sobremesa modelo SkyScan 1174 (Bruker, Kontich, Bélgica). Las muestras se colocaron con el eje largo perpendicular al suelo del portamuestras y a la fuente de rayos X. Las imágenes se obtuvieron en las siguientes condiciones: voltaje de la fuente de rayos X: 50 KV; intensidad de la fuente de rayos X: 800 μA; utilización de filtro de aluminio de 1 mm; resolución: 17,1 μm; paso de rotación de la muestra: 0,4°; rotación total: 180°; frame averaging: 2; tiempo de exposición: 11.000 ms; tiempo aproximado de escaneado por muestra: 3 horas y 50 minutos. Se obtuvieron 930 tomogramas en formato TIFF de cada muestra.
La corrección de campo plano se llevó a cabo al principio de cada escaneo. Los tomogramas obtenidos del escaneado de las muestras se reconstruyeron mediante el algoritmo de Feldkamp modificado en la aplicación NRecon versión 1.6.9.16 (Bruker microCT, Kontich, Bélgica). Los parámetros óptimos seleccionados fueron: ring artefact reduction: 8; beam hardening correction: 30´; smoothing: 1.
Los parámetros de escaneo y de reconstrucción utilizados fueron los mismos para todas las muestras. Tras la reconstrucción, se seleccionaron mediante la aplicación CTAn versión 1.14.4.1 (Bruker, Kontich, Bélgica) dos volúmenes de interés (VOI) distintos en los que realizar la determinación de las propiedades microestructurales y de la densidad mineral ósea. En el caso del hueso trabecular, se seleccionó un VOI comenzando a 1 mm del cartílago de crecimiento de la metáfisis distal del fémur (tomado como sección de referencia) y ocupando 3,4 mm en dirección proximal (un total de 200 imágenes), excluyendo para el análisis el hueso cortical. Para el análisis de hueso cortical, se vuelve a tomar como referencia el cartílago de crecimiento de la metáfisis distal, comenzando el VOI a 14 mm del mismo y abarcando 2,5 mm (150 imágenes). El análisis estructural de los VOI se lleva a cabo con el software proporcionado con el equipo (CTAn versión 1.14.4.1). Una vez obtenidos los resultados de los parámetros microestructurales, se utilizó el programa CTVol 2.2.3.0 (Bruker, Kontich, Bélgica) para visualizar los modelos tridimensionales creados con CTAn mediante el algoritmo Marching cubes 33.
Para el hueso trabecular se determinaron los parámetros morfométricos estándares de hueso esponjoso mediante un análisis en 3D de las trabéculas.
A continuación, se detallan los parámetros estudiados para el hueso trabecular.
Relaciones de superficies y volumen:
La fracción volumétrica ósea (BV/TV) refleja a la perfección la pérdida o ganancia de hueso en los distintos grupos. Se obtiene a partir de los índices morfométricos básicos volumen de hueso (bone volume, BV) y volumen de interés total (total volume of interest, TV). Se expresa comúnmente en porcentaje. La superficie total del hueso trabecular (BS), se mide mediante triangulación de la superficie del objeto. Su relación con el volumen de interés analizado se conoce como densidad de la superfi-
Rev Osteoporos Metab Miner. 2020;12(1):20-27
cie ósea (BS/TV). Se expresa en mm-1, al ser el cociente entre una unidad de superficie y una unidad de volumen. La superficie específica ósea (BS/BV) expresa la relación entre la superficie total del hueso trabecular con el volumen ocupado únicamente por hueso mineralizado. Al igual que la variable anterior se expresa en mm-1.
Índices métricos directos:
El grosor trabecular (Tb.Th) se calcula a partir de un método que ocupa con esferas la estructura analizada por transformación de la distancia. Se expresa habitualmente en mm o μm. La separación trabecular (Tb.Sp) se calcula del mismo modo, pero esta vez ocupando las cavidades medulares. Se expresa en mm o μm. El número trabecular (Tb.N) implica el número de veces que se atraviesan las trabéculas por unidad de longitud por una vía arbitraria a través del volumen de interés. El método consiste en lanzar una línea que atraviese la región de interés y contar cuántas veces atraviesa trabéculas. Se expresa en mm-1.
Índices no métricos directos:
El factor de patrón trabecular (Tb.Pf) describe cuantitativamente la conectividad trabecular. Es un índice de conectividad inverso (a mayor valor de Tb.Pf menos conectadas están las trabéculas) basado en el cálculo de un índice de convexidad o concavidad relativa de la superficie ósea total, en el cual la concavidad de las superficies trabeculares implica conectividad, mientras que la convexidad indica estructuras desconectadas y aisladas. A mayor valor del Tb.Pf la red trabecular muestra una peor conectividad, que lleva implícita una disminución de la resistencia mecánica. Se expresa en mm-116. El índice de modelo estructural (SMI) indica la prevalencia relativa de trabéculas en forma de placa (plate-like) o en forma de tubo (rod-like), indicando mayor presencia de placas cuanto más se acerca el valor a cero17. Se define en un intervalo de valores de 0 a 3, donde 0 es una estructura en forma de placa ideal y 3 un cilindro. El grado de anisotropía (DA) es una medida de la simetría del objeto o de la presencia/ausencia de estructuras alineadas en una determinada dirección. Se trata de una variable adimensional. Cero es la isotropía total y 1 la anisotropía total. Las distintas variables se midieron directamente utilizando métodos descritos en la literatura18,19.
En la región cortical se realizaron dos análisis distintos. El primero (separación endostio-periostio) nos permitió calcular el volumen total, el volumen de hueso y el volumen medular. En el segundo reportamos la porosidad del hueso cortical.
Separación endostio-periostio: El volumen total de la sección transversal dentro del periostio (VIP) es el valor medio del volumen ocupado por hueso y médula ósea en las secciones transversales analizadas. Se expresa en mm3. Un valor bajo de VIP nos indica que hay menos formación ósea y más reabsorción, y al contrario si nos encontramos con un valor alto. El volumen de hueso cortical (Ct.BV) es el valor medio del volumen ocupado por hueso en las secciones transversales analizadas. Se expresa en mm3. El volumen medular (Md.V) es el valor medio del volumen ocupado por la médula ósea en las secciones transversales analizadas. Se expresa en mm3. Este valor nos indica lo contrario que VIP.
Parámetros de porosidad estudiados: El volumen del hueso cortical excluyendo los poros (Ct.BV); el ratio entre la superficie cortical y el volumen del hueso cortical sin poros (Ct.BS/BV); y la porosidad del hueso cortical (Ct.B.Po).
Biomecánica
Los fémures derechos de las ratas permanecieron congelados a -80ºC y se descongelaron con anterioridad al ensayo mecánico para una correcta preparación. El ensayo se realizó en una máquina universal de ensayos. Se configuró un ensayo de flexión a 3 puntos, con una distancia entre soportes de 17,6 mm y un diámetro de indentador de 5,6 mm. La fuerza se aplicó en la dirección perpendicular al eje del hueso, en la región de la diáfisis, con una velocidad de aplicación de 10 mm/min (0,17 mm/s). Se obtuvo una curva carga-desplazamiento para cada muestra y se calculó el diámetro de la diáfisis a partir del promedio de 6 medidas diferentes, para minimizar el efecto de la variabilidad.
Parámetros biomecánicos analizados:
A partir de la curva resultante de cada experimento se han determinado diferentes parámetros indicadores de las características mecánicas de las muestras20: la fuerza máxima de flexión en el momento del fallo mecánico; el desplazamiento en el momento del fallo mecánico; la rigidez extrínseca; la energía de rotura; la tensión máxima; la deformación máxima; y el módulo de Young.
Análisis estadístico
Los resultados se han expresado como media ± desviación estándar (DE) de los diferentes parámetros. Los grupos de tratamiento han sido comparados mediante el test de Mann-Whitney para muestras no emparejadas (Medcal, Bélgica). Las diferencias se han considerado significativas a partir de un valor de p<0,05.
Resultados:
La figura 1 muestra los resultados obtenidos en la densidad mineral ósea femoral (DMOF) y lumbar (DMOL) de las ratas estudiadas. La ovariectomía produjo un descenso significativo de la densidad ósea en fémur y columna. El tratamiento con bazedoxifeno recuperó parcialmente la densidad lumbar, pero no la femoral.
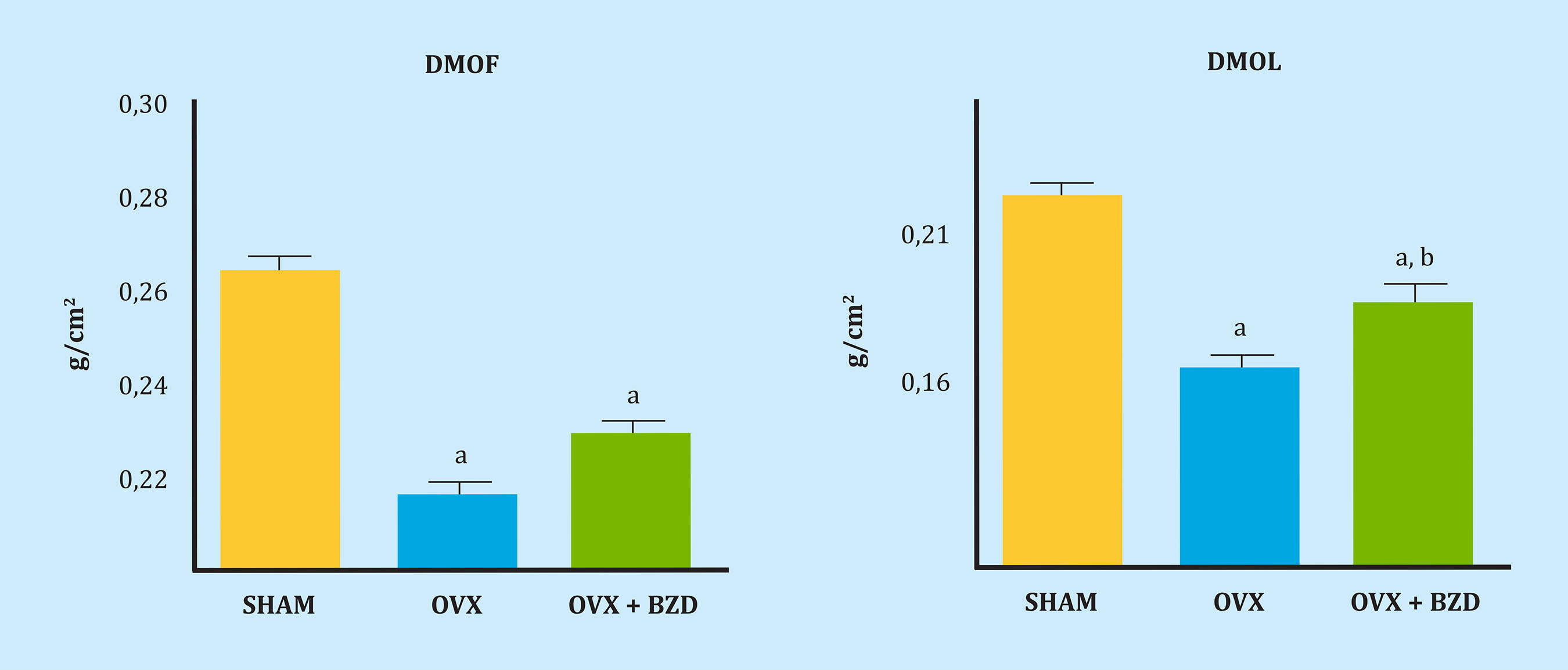
DMOF. a: OVX vs. SHAM, p<0,01; OVX+BZD vs. SHAM, p<0,01; DMOL. a: OVX vs. SHAM, p<0,01; OVX+BZD vs. SHAM, p<0,05, b: OVX+BZD vs. OVX, p<0,05.
Figura 1. Densidad mineral ósea femoral (DMOF) y densidad mineral ósea lumbar (DMOL) en los 3 grupos de ratas SHAM (control), ovariectomizadas (OVX) y ovariectomizadas tratadas con bazedoxifeno (OVX+BZD)
La figura 2 muestra los niveles de los marcadores bioquímicos de remodelado óseo en los grupos de ratas estudiados. Como era de esperar, los marcadores de formación y resorción ósea (BGP, PINP y CTX) experimentaron un aumento significativo tras la ovariectomía. El tratamiento con bazedoxifeno recuperó los niveles basales de BGP y de PINP, sin variaciones significativas en los niveles de CTX.

BGP. a: OVX vs. SHAM, p<0,01, b: OVX+BZD vs. OVX, p<0,01; PINP. a: OVX vs. SHAM, p<0,01, b: OVX+BZD vs. OVX: p<0,01; CTX. a: OVX vs. SHAM p<0,01; OVX+BZD vs. SHAM p<0,01.
Figura 2. Marcadores bioquímicos de remodelado óseo: osteocalcina (BGP), propéptido aminterminal del procolágeno I (PINP) y telopéptido carboxiterminal del colágenoI (CTX) en los 3 grupos de ratas SHAM (control), ovariectomizadas (OVX) y ovariectomizadas tratadas con bazedoxifeno (OVX+BZD)
La figura 3 muestra una serie de parámetros microestructurales cuantitativos estudiados. La fracción volumétrica ósea (BV/TV) y la densidad de superficie ósea (BS/TV) disminuyeron tras la ovariectomía, recuperándose parcialmente tras el tratamiento con bazedoxifeno. El bazedoxifeno recuperó también parcialmente el aumento en la separación trabecular (Tb.Sp) producido por la ovariectomía, así como la disminución en el número de trabéculas (Tb.N), sin ejercer acciones sobre el espesor trabecular (Tb.Th).

BV/TV. a: OVX vs. SHAM p<0,01; OVX+BZD vs. SHAM, p<0,05, b: OVX+BZD vs. OVX, p<0,05; BS/TV. a: OVX vs. SHAM p<0,01; OVX+BZD vs. SHAM, p<0,05, b: OVX+BZD vs. OVX, p<0,05; Tb.Th. a: OVX+BZD vs. SHAM, p<0,05; Tb.Sp. a: OVX vs. SHAM p<0,01; OVX+BZD vs. SHAM, p<0,05, b: OVX+BZD vs. OVX, p<0,05; Tb.N. a: OVX vs. SHAM p<0,01; OVX+BZD vs. SHAM, p<0,05, b: OVX+BZD vs. OVX, p<0,05.
Figura 3. Fracción volumétrica ósea (BV/TV), densidad de superficie ósea (BS/TV), espesor trabecular (Tb.Th), separación trabecular (Tb.Sp) y número de trabéculas (Tb.N) en los 3 grupos de ratas SHAM (control), ovariectomizadas (OVX) y ovariectomizadas tratadas con bazedoxifeno (OVX+BZD)
La figura 4 muestra las variables no métricas Tb.Pf y SMI y las cuantitativas Conn.Dn y DA en los grupos de ratas estudiados. El factor de patrón trabecular Tb.Pf aumentó significativamente en las ratas ovariectomizadas, indicando una importante pérdida de conectividad trabecular tras la ovariectomía. El tratamiento con bazedoxifeno corrigió parcialmente esta pérdida. La ovariectomía aumentó también significativamente el índice de modelo estructural SMI, indicando una prevalencia de trabéculas en forma de tubo en comparación con las ratas control, con prevalencia de trabéculas en forma de placa. El tratamiento con bazedoxifeno corrigió también parcialmente esta variación. El grado de anisotropía disminuyó significativamente tras la ovariectomía, aumentando tras el tratamiento con bazedoxifeno a valores superiores a los de las ratas controles.

Tb.Pf. a: OVX vs. SHAM, p<0,01; OVX+BZD vs. SHAM, p<0,05, b: OVX+BZD vs. OVX, p<0,05; SMI. a: OVX vs. SHAM, p<0,01; OVX+BZD vs. SHAM, p<0.05, b: OVX+BZD vs. OVX, p<0,0; DA. a: OVX vs. SHAM, p<0,05; OVX+BZD vs. SHAM, p<0,01, b: OVX+BZD vs. OVX, p<0,01.
Figura 4. Factor de patrón trabecular (Tb.Pf), índice de modelo estructural (SMI) y grado de anisotropía (DA). En los 3 grupos de ratas SHAM (control), ovariectomizadas (OVX) y ovariectomizadas tratadas con bazedoxifeno (OVX+BZD)
La figura 5 muestra los resultados del volumen de hueso + médula ósea (VIP), hueso cortical (Ct.BV) y volumen medular (Md.V) en la cortical. El volumen de hueso + médula no pareció variar significativamente tras la ovariectomía, pero fue menor en las ratas ovariectomizadas tratadas con bazedoxifeno, lo que parece indicar una influencia de la falta de ovarios no resuelta por este fármaco. El volumen de hueso cortical (Ct.BV) disminuyó significativamente tras la ovariectomía, no ejerciendo acción positiva el bazedoxifeno. El volumen de médula ósea (Md.V) aumentó tras la ovariectomía, permaneciendo constante tras el tratamiento con bazedoxifeno.

CtBv. a: OVX vs. SHAM, p<0,05; OVX+BZD vs. SHAM, p<0,05; Md.V. a: OVX vs. SHAM, p<0,01.
Figura 5. Volumen de hueso + médula ósea (VIP), hueso cortical (Ct.BV) y volumen medular (Md.V) en la cortical. En los 3 grupos de ratas SHAM (control), ovariectomizadas (OVX) y ovariectomizadas tratadas con bazedoxifeno (OVX+BZD)
El volumen de hueso cortical disminuyó tras la ovariectomía (p<0,05), no ejerciendo ninguna acción el bazedoxifeno. La superficie relativa cortical aumentó tras la ovariectomía (p<0,05), normalizándose tras el tratamiento con bazedoxifeno. La porosidad (Ct.B.Po) disminuyó significativamente tras la ovariectomía (p<0,001), no produciendo variaciones el tratamiento con bazedoxifeno.
El desplazamiento máximo, la rigidez, el trabajo de rotura, la tensión máxima y el módulo de Young no variaron con la ovariectomía ni con el trabajo de rotura. La fuerza máxima de flexión en el momento del fracaso mecánico disminuyó con la ovariectomía (p<0,05), como era de esperar, sin ejercer efecto el bazedoxifeno. La deformación máxima antes de la rotura disminuyó con la ovariectomía (p<0,05), recuperándose con el tratamiento con bazedoxifeno.
Con respecto a los pesos de las ratas, al final del experimento el grupo SHAM pesaba 380±25 g, el grupo OVX 475±30 g (OVX vs. SHAM, p<0,01) y el grupo tratado con bazedoxifeno 425±15 g (BZD vs. SHAM, p<0,05; BZD vs. OVX, p<0,05). La ovariectomía hizo ganar peso a las ratas y el tratamiento con bazedoxifeno amortiguó parcialmente dicha ganancia.
DISCUSIÓN
De acuerdo con nuestros resultados, el tratamiento con bazedoxifeno recuperó parcialmente la densidad ósea lumbar, pero no la femoral.
Coincidiendo con ello, Barrionuevo y cols.21 realizaron un estudio incluyendo 107 ensayos clínicos en que se podía concluir que existía una reducción significativa de las fracturas vertebrales con el bazedoxifeno. Del mismo modo, Jin y cols.22, estudiando 41 artículos de ensayos clínicos desde 2015 hasta 2019, concluyeron que el bazedoxifeno previene las fracturas vertebrales. Peng y cols.23 realizando una revisión sistemática de estudios desarrollados durante 3 y 7 años, y Palacios y cols.24, en un estudio realizado durante 7 años, observaron que la incidencia de nuevas fracturas vertebrales fue menor en mujeres tratadas con bazedoxifeno que en el grupo placebo.
Con respecto a los marcadores bioquímicos de remodelado óseo, nuestros resultados muestran un descenso del mismo en los niveles de BGP y PINP tras el tratamiento con bazedoxifeno, aunque sin cambios en el PINP. Coincidiendo con nuestros resultados, Bueno y cols.25 observaron en un estudio realizado en 7.492 pacientes que el bazedoxifeno redujo el remodelado óseo en mujeres postmenopáusicas latinas afectadas de osteoporosis. A este respecto es importante señalar que, no solo la disminución de la densidad mineral ósea, sino también el aumento de remodelado óseo está asociado a un incremento en el riesgo de fractura26, y que los cambios en los niveles de osteocalcina a los 6 meses de tratamiento predijeron los cambios observados a los 2 años en la densidad mineral ósea27.
En cuanto a la calidad ósea, de acuerdo a los parámetros de la microtomografía, nuestros resultados mostraron efectos positivos del tratamiento con bazedoxifeno sobre los parámetros trabeculares BV/TV, BS/TV, Tb.Th, Tb.Sp.Tb.N. Tb.Pf, SMI, DA y Md.V y sobre el cortical Ct.BS/BV, aunque no en todos los casos se recuperaron los valores basales de las ratas control, pero sí mejoran con respecto a las ovariectomizadas.
Saito y cols.28 estudiaron monos adultos hembras ovariectomizadas a las que se suministró 0,2 o 0,5 mg/kg de bazedoxifeno durante 18 meses. Los niveles de cross-links inmaduros y maduros, BV/TV, y Tb.Th fueron mayores en el grupo tratado con bazedoxifeno que en el ovariectomizado. Sin embargo, el SMI fue menor en el grupo tratado con bazedoxifeno que en el grupo ovariectomizado. El tratamiento con bazedoxifeno previno el deterioro de los niveles de cross-links enzimáticos inmaduros, en los productos avanzados de glicosilación y en propiedades estructurales como el BV/TV, Tb.Th y Tb.Pf, que controlan significativamente la fuerza ósea del tejido trabecular.
Con respecto a los parámetros biomecánicos, en nuestro trabajo observamos que el bazedoxifeno ejerció también una acción positiva con respecto a las ratas ovariectomizadas sobre la deformación máxima a la que es sometido el fémur al realizar sobre el mismo una fuerza.
Por último, el bazedoxifeno produjo una acción positiva sobre el aumento de peso que experimentaron las ratas tras la ovariectomía, siendo menor que el experimentado por las ratas ovariectomizadas, aunque incrementado con respecto a las controles.
La mayoría de estudios sobre los efectos del bazedoxifeno lo hacen sobre las fracturas vertebrales, como los que hemos comentado anteriormente14,22-24. Algunos autores como Reginster y cols.29 confirman que el bazedoxifeno es también capaz de reducir el riesgo de fracturas no vertebrales en mujeres con alto riesgo de padecer osteoporosis. Autores como Yavropoulou y cols.5 observaron tras el tratamiento con bazedoxifeno un aumento de la BMD lumbar pero no de la BMD de cadera, pero, al igual que Reginster29, sí observaron una disminución del riesgo de fracturas no vertebrales en el caso de mujeres postmenopáusicas de alto riesgo.
En relación al efecto comparativo ejercido por el bazedoxifeno y otros fármacos, en un meta-análisis realizado sobre 48.000 pacientes, Liu y cols.30 observaron que el alendronato y el risendronato ejercían un efecto positivo mayor que el bazedoxifeno sobre la osteoporosis, pero con más efectos adversos. Gatti y cols.31 afirman que el bazedoxifeno es tan efectivo como el raloxifeno en prevenir la pérdida ósea en mujeres con osteoporosis y en reducir la incidencia de nuevas fracturas vertebrales. Otros autores como Ellis y cols.32 consideran que el bazedoxifeno. es comparable a los bifosfonatos para prevenir las fracturas vertebrales entre las mujeres con osteoporosis postmenopáusica de alto riesgo.
En un trabajo realizado por nuestro grupo33 administramos ácido zoledrónico a ratas ovariectomizadas y conseguimos efectos muy superiores de aumento de la DMO lumbar y femoral sobre las ratas no tratadas que en el caso del bazedoxifeno. Las condiciones de edad de las ratas y tiempo de ovariectomía eran totalmente similares a las de este trabajo, por lo que los resultados pueden ser comparados. Autores como Yavropoulou y cols.5 afirman que el bazedoxifeno no parece ofrecer ventajas significativas sobre otros agentes antirresortivos, pero considerando la necesidad de tratamientos de larga duración para la osteoporosis, es un fármaco que tiene un puesto en el esquema terapéutico a largo plazo para combatir esta enfermedad. Autores como Gatti y cols.31 sugieren que, debido a su particular perfil, el bazedoxifeno se puede considerar como una terapia de segunda línea para mujeres entre 65 y 70 años donde los bifosfonatos estén contraindicados o sean mal tolerados. Estos autores piensan que el bazedoxifeno puede también tener su puesto como terapia en primer lugar en mujeres postmenopaúsicas más jóvenes para el manejo de su menopausia y la prevención de la osteoporosis, y que se podría prescribir solo o con estrógenos conjugados.











 texto en
texto en 


