INTRODUCCIÓN
El pseudohipoparatiroidismo (PHP) es un grupo heterogéneo de trastornos que tienen en común la resistencia a la hormona paratiroidea (PTH).
A nivel mundial, se estima que la prevalencia es 0,79/100.0001, aunque depende del tipo de PHP analizado, y oscila entre 6,7 a 3,3 casos por millón de habitantes en Italia2 y Japón3, respectivamente.
Entre 2000 y 2019 en la literatura mundial se han descrito aproximadamente 325 casos4, la mayoría de ellos en los países desarrollados, en los cuales, además, han sido documentados con estudios genéticos los subtipos de PHP. El subtipo 1a es el más común y representa el 70% de los casos1. En América Latina se han reportado 47 casos entre 2000 y 20205-10, siendo el subtipo más frecuentemente descrito el 1b, seguido del 1a ó 1c. En algunos casos por no disponer del estudio genético no es posible determinar con precisión a qué subtipo corresponden10.
Describimos a continuación el caso clínico de un varón de 18 años con aspecto fenotípico de osteodistrofia hereditaria de Albright (AHO).
PRESENTACIÓN DEL CASO
Un varón de 18 años acudió a la consulta de Endocrinología remitido por el Servicio de Neurología por crisis convulsivas asociadas a hipocalcemia persistente. Refería una historia de crisis convulsivas tónico-clónicas generalizadas desde los 15 años, por lo que había sido hospitalizado previamente, evidenciándose hipocalcemia que fue tratada con calcio intravenoso y anticonvulsivantes para controlar la emergencia, y suplementos de calcio oral al egreso hospitalario. No se realizaron más estudios para determinar la causa de la hipocalcemia.
Sus padres y familiares en primer grado no presentan historial médico de importancia. El paciente es hijo de matrimonio no consanguíneo. Nacido pretérmino por ruptura prematura de membranas a las 35 semanas de gestación, con hipoxia neonatal e hipotonía. Presentó un desarrollo motor y del lenguaje tardío, requiriendo de terapia del lenguaje desde los 5 hasta los 7 años y fisioterapia desde los 2 años, además de retraso en el aprendizaje escolar y siempre con sobrepeso. A los 12 años fue diagnosticado de hipotiroidismo primario y desde entonces toma 150 µg de levotiroxina sódica.
El paciente es el menor de 3 hermanos que no presentan antecedentes médicos de trascendencia.
Al examen físico presenta un fenotipo característico: obeso, estatura baja, cara redonda, frente prominente, puente nasal bajo, cuello corto, braquidactilia y piezas dentales incompletas (Figura 1). El peso era de 68,8 kg, y la talla, 153 cm (< percentil 3); el índice de masa corporal era 34 (> percentil 97). Las manos y los pies eran pequeños, con notable diferencia en el primer dedo de las 2 manos, correspondiente con braquidactilia tipo E2. En la figura 2 se observa en la radiografía el acortamiento marcado de los metacarpianos y de la falange distal de los pulgares (Figura 2). Además, se detecta radiológicamente calcificaciones subcutáneas en tórax posterior y dorso de pies.

Figura 2. Fotografía y radiografía de las manos. Acortamiento marcado de los metacarpianos y falange distal de los pulgares
El estadio puberal fue Tanner V: longitud del pene, 15 cm (normal >15 cm); volumen testicular, 30 ml bilateralmente (normal >20 ml).
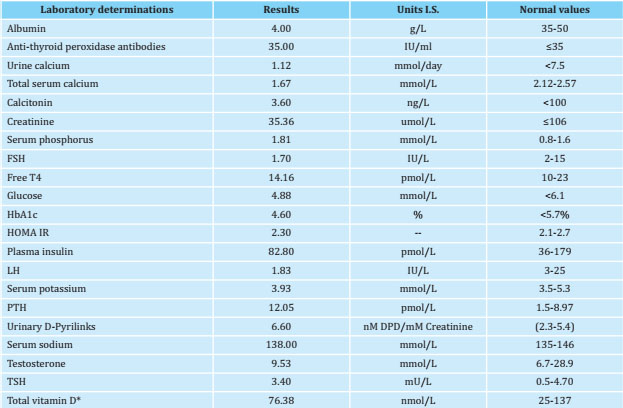
Los signos de Chvostek y Trousseau fueron positivos, con niveles de calcio total: 1,67 mmol/L (valores normales -VN-: 2,12-2,57 mmol/L); fosforo sérico: 1,81 mmol/L (VN: 0,8-1,6 mmol/L); hormona paratiroidea (PTH): 12,05 pmol/L (VN: 1,5-8,97 pmol/L), y vitamina D total (25- OH-D): 76,38 nmol/L (VN: 25-137 nmol/L).
En la evaluación bioquímica se estableció que la causa de las crisis convulsivas, parestesias y signos de Chvostek y Trousseau se debían a la hipocalcemia. Fue tratado con infusión intravenosa de calcio y fue referido a la consulta de Endocrinología para una evaluación integral.
En la densitometría ósea, realizada por absorciometría de rayos X de energía dual (DXA) con un equipo DEXXUM-T (OsteoSys – Seúl, Corea), presentó disminución de la masa ósea para su edad y sexo en región lumbar (L1-L4), con preservación de la masa ósea en cuello de fémur (columna lumbar: 1,044 g/cm2, Z-score: -2,6; y cuello de fémur: 1,146 g/cm2, Z-score: 0,3).
La tomografía computadorizada del cráneo reveló calcificaciones corticales y subcorticales, periventriculares, núcleos de la base y en cerebelo. En el estudio de resonancia magnética nuclear con medio de contraste se observó calcificaciones periventriculares.
Los resultados de las determinaciones hormonales y bioquímicas actuales se presentan en la tabla 1. La vitamina D total (25 hidroxivitamina D) se determinó por electroquimioluminiscencia (valor óptimo: 25-137 nmol/L). La PTH se determinó por quimioluminiscencia (valor normal: 1,58,97 pmol/L). No se realizó la determinación de 1,25 dihidroxivitamina D y AMPc inducida por PTH debido a la no disponibilidad de las pruebas en el hospital y por restricciones financieras.
El hemograma completo, los niveles de glucosa en sangre y las pruebas de la función hepática y renal fueron normales. El estudio bioquímico y hormonal de su madre presenta valores normales: calcio 2,35 mmol/L, fosforo: 1,13 mmol/L, TSH: 3,5 mU/L, T4 libre: 14,1 pmol/L, PTH: 2,58 pmol/L.
En el seguimiento, se monitorizaron los niveles séricos de calcio y el cociente calcio/creatinina urinarios para lograr niveles séricos de calcio adecuados.
Actualmente el paciente se mantiene en tratamiento con suplementos de carbonato de calcio por vía oral, 3 g/día; calcitriol por vía oral, 1,5 mg/día; vitamina D3, 2.000 UI/día, y levotiroxina, 150 µg/día. Acude a controles en la consulta externa cada 3 meses con mediciones de calcio y fosforo séricos, PTH, vitamina D y hormonas tiroideas. Además, acude regularmente al Servicio de Neurología para control de sus crisis convulsivas y al Departamento de Psicología para soporte al paciente y su familia. El Servicio de Nutrición ofrece el asesoramiento dietético, y por sus alteraciones dentales está en tratamiento odontológico permanente.
DISCUSIÓN
El PHP es un síndrome clínicamente dismórfico que se caracteriza por defectos esqueléticos y del desarrollo11, que incluyen estatura baja, cara redondeada, cuartos metacarpianos cortos y otros huesos de las manos y los pies, obesidad, hipoplasia dental, calcificaciones u osificaciones de tejidos blandos12,13. Sin embargo, algunos casos pueden presentar características fenotípicas poco usuales12,13. Las características bioquímicas de los pacientes con PHP son la hipocalcemia, la hiperfosfatemia y los niveles elevados de PTH12.
En el presente caso se consideró el diagnóstico de pseudohipoparatiroidismo dados los resultados de laboratorio compatibles con resistencia a la PTH (hipocalcemia, hiperfosfatemia y PTH elevada), acompañados de las características fenotípicas de osteodistrofia hereditaria de Albright14 (AHO), lo cual nos orientó hacia un PHP tipo 1a ó 1c.
La hipocalcemia es consecuencia de la pérdida de la acción resortiva ósea de la PTH, lo que resulta en una movilización defectuosa de calcio a partir del hueso y una menor absorción de calcio en el intestino12.
La braquidactilia, descrita como acortamiento de los metacarpianos/metatarsianos III-V y de la falange distal del primer dedo, constituye una de las características más específicas del fenotipo Albright14. De las características fenotípicas de AHO resaltamos la braquidactilia tipo E del PHP; y este paciente presenta acortamiento significativo en el metacarpo y falange distal del dedo pulgar en ambas manos que podría considerarse una braquidactilia tipo E214,15.
Existe asociación del PHP con resistencia variable a múltiples hormonas que actúan a través de la proteína Gsα. La resistencia a la TSH es la alteración hormonal que más comúnmente se ha asociado e incluso puede ser diagnosticada antes de la aparición de trastornos del metabolismo fosfocálcico16. En este caso la ausencia de anticuerpos antitiroideos apoya el diagnóstico de resistencia a la TSH11.
La disfunción reproductiva se ha asociado con PHP 1a; sin embargo, los efectos del hipogonadismo son menos evidentes en los hombres16. Los caracteres sexuales secundarios normales y la determinación de hormonas sexuales descartan la posibilidad de alteración en el eje gonadal en nuestro paciente.
Existen discrepancias sobre los efectos de PHP en el esqueleto8,17,18. Algunos estudios han reportado que la densidad ósea está reducida en pacientes con PHP17. Sin embargo, Long et al. analizaron la densidad mineral ósea en 22 sujetos con PHP 1a y encontraron que la masa ósea era normal o aumenta en todas las regiones óseas estudiadas18. Por el contrario, en este caso la densidad mineral ósea medida en la región lumbar presenta valores disminuidos comparados a los controles emparejados por edad y sexo, con preservación de la masa ósea en cuello de fémur.
En la literatura internacional, entre 2000 y 2019 se han descrito aproximadamente 325 casos de PHP4,16,17. Una serie de 60 casos de PHP se publicó en Dinamarca en 2016, pero sólo en 30 (50%) de ellos se realizó una prueba genética para PHP, de los cuales en 14 se identificó una mutación en el gen GNAS1. En aquellos que no pudieron ser confirmados genéticamente (76%) se aceptó como diagnóstico los criterios bioquímicos y hormonales característicos, excluyendo a los casos con evidencia confirmada de insuficiencia renal, deficiencia de vitamina D, o cualquier otra causa conocida de hiperparatiroidismo secundario17. En 2013, en una serie de 72 casos con PHP atendidos en el Sistema Nacional de Salud español, se pudo hacer la confirmación genética en 63 de los casos (88%)16.
En América Latina, después de una búsqueda en la literatura entre 1957 y 2020, encontramos 32 publicaciones, en las que se reportan 56 casos de PHP. Solo en 6 de estas publicaciones se realizó estudios genéticos para confirmar el diagnóstico. En la mayoría de los casos el diagnóstico se basó en el perfil bioquímico/hormonal y fenotípico.
No existen casos reportados previamente en nuestro país, lo que posiblemente se deba a un subdiagnóstico; sin embargo, los datos publicados a nivel mundial describen las características fenotípicas asociadas a la alteración bioquímica compatible con los hallazgos de nuestro paciente. En nuestro caso, no se pudo confirmar el diagnóstico clínico de PHP mediante un estudio genético, pero en la literatura es aceptado que las evidencias clínicas y bioquímicas pueden ser suficiente para hacer el diagnóstico de PHP4,11.
En concordancia con los criterios internacionales12,15, nuestro objetivo en el tratamiento a largo plazo ha sido reducir el nivel sérico de PTH al nivel superior del rango de referencia con 1-25 dihidroxivitamina D y calcio oral, para mejorar la reabsorción de calcio en el túbulo renal distal, prevenir la hipercalciuria y evitar alteraciones en la mineralización ósea18.
CONCLUSIONES
En los países de América Latina en los que no están disponibles los estudios genéticos, debemos tener presente que, ante un paciente con hipocalcemia severa y persistente asociada a PTH elevada con función renal normal y un fenotipo característico, tiene que surgir la sospecha diagnóstica de un PHP, aun a pesar de la falta de la confirmación genética.











 texto en
texto en