INTRODUCCIÓN
Aterosclerosis, arteriosclerosis, calcificación vascular y osteoporosis son trastornos frecuentes relacionados con la edad asociados con una elevada morbilidad y mortalidad1,2. Debido al aumento de la esperanza de vida en la población española, es esperable que en las próximas décadas estas alteraciones sean cada vez más frecuentes.
Si bien recientemente se ha trabajado en el desarrollo de técnicas no invasivas para la detección precoz de calcificaciones vasculares, como la velocidad de la onda de pulso y la ecografía carotidea sin contraste, los parámetros bioquímicos séricos siguen siendo la opción más utilizada para el seguimiento de pacientes con alteraciones metabólicas óseas3-5.
Disponer de herramientas no invasivas de fácil acceso como los marcadores bioquímicos, permiten adoptar medidas terapéuticas con objeto de mitigar el efecto deletéreo de la pérdida de masa ósea. Teniendo en cuenta que osteoporosis y calcificación vascular comparten mecanismos etiopatogénicos6,7, algunos parámetros bioquímicos utilizados para el estudio del metabolismo óseo podrían servir como posibles marcadores de calcificación vascular. Por tanto, el objetivo de este estudio fue valorar la asociación de algunos marcadores bioquímicos del metabolismo óseo con la aparición y progresión de calcificaciones aórticas.
MATERIAL Y MÉTODOS
Este estudio se realizó con datos pertenecientes a un proyecto europeo diseñado para conocer la prevalencia de fractura vertebral (European Vertebral Osteoporosis Study -EVOS)8, en el que participó el Servicio de Metabolismo Óseo y Mineral del Hospital Universitario Central de Asturias.
Se seleccionaron aleatoriamente del registro municipal de Oviedo 308 hombres y 316 mujeres mayores de 50 años. El protocolo al que hace referencia este estudio consistió en la cumplimentación de un cuestionario sobre factores de riesgo relacionados con osteoporosis, dos radiografías laterales dorso-lumbares y una densitometría ósea (DXA) (el estudio radiográfico no se completó solo en 2 casos), y la recogida de mediciones antropométricas como altura y peso para determinar el índice de masa corporal (IMC). Todos los sujetos tenían suficiente capacidad ambulatoria para subir dos pisos sin ascensor y el 99% vivía en su propio domicilio.
A los 4 años se les invitó a repetir el estudio radiológico, la densitometría ósea, las mediciones antropométricas, un cuestionario sobre factores de riesgo de osteoporosis y un estudio bioquímico. En el segundo control participaron 402 sujetos (213 mujeres y 189 hombres), de los que 335 estuvieron de acuerdo en realizar el estudio bioquímico. Un total de 67 sujetos (16,7%) se excluyeron del análisis por haber recibido tratamiento para la osteoporosis o cuya función renal estuviera deteriorada con creatininas séricas superiores a 0,8 mg/dL en mujeres y 1,1 mg/dL en hombres, respectivamente. Se dispuso de todos los datos al inicio y a los 4 años en 262 sujetos.
Evaluación de la progresión de calcificación vascular
La calcificación aórtica abdominal fue evaluada por 2 investigadores independientes, y se definió y clasificó en grado 0 (ausente), grado 1 (leve-moderada) y grado 2 (severa). Calcificaciones aisladas puntiformes, una calcificación lineal visible en menos de 2 cuerpos vertebrales o una placa densa calcificada fueron definidas como calcificación leve-moderada9. La presencia de una calcificación lineal visible a lo largo de al menos dos cuerpos vertebrales y/o la presencia de dos o más placas densas calcificadas se definió como calcificación severa. El grado de concordancia intra e inter observador en el análisis de las radiografías fue del 92% y 90%, respectivamente, con un coeficiente Kappa de 0,78 y 0,73, datos que indican una buena reproducibilidad9.
La progresión de la calcificación aórtica se determinó comparando las radiografías realizadas en el inicio con las realizadas a 4 años. Se definió como “progresión global” de calcificación aórtica cuando coexistió aumento de magnitud de la calcificación aórtica basal a la par que aparición de nuevas calcificaciones comparando las radiografías del inicio con las realizadas 4 años más tarde.
Evaluación densitométrica
La densidad mineral ósea (DMO) se midió con un densitómetro Hologic® QDR-1000 DXA (Hologic Inc., Waltham, Massachusetts, EE.UU.). En todos los casos, se analizaron la columna lumbar antero-posterior (L2-L4) y la extremidad proximal del fémur derecho. Para la evaluación de la DMO lumbar, se excluyeron 4 sujetos con artrosis degenerativa marcada. Los coeficientes de variación (CV) fueron de 1,2% y 1,9%, respectivamente9. El control de precisión y calidad fue realizado diariamente con un phantom de columna lumbar, con el que se obtuvo un CV de 0,0±0,1%. En el cuarto año se determinó la DMO en las mismas áreas utilizadas en el primer estudio, y el porcentaje de cambio entre ambas mediciones fue utilizado para evaluar los cambios en DMO.
Análisis bioquímico
En el estudio basal no se realizó estudio bioquímico. A los 4 años, se tomó una muestra de sangre y orina en ayunas a cada sujeto participante en el estudio. Una vez separado el suero, este último y la orina se mantuvieron congeladas a -80ºC hasta su cuantificación. Se midió calcio, creatinina, fósforo, fosfatasa alcalina total y fosfatasa ácido tartrato resistente sérica utilizando un autoanalizador (Hitachi Mod. 717, Ratigen, Alemania). Los niveles séricos de calcidiol (25OHD) se determinaron mediante extracción previa con acetonitrilo (IDS, Ltd., Bolton, Reino Unido), cuyos coeficientes de variación (CV) intra e interensayo fueron, respectivamente, del 5,2% y del 8,2%.
Los niveles de 1,25-dihidroxivitamina D se midieron por radio-inmunoensayo (IDS, Ltd.); los CV intra e interensayo fueron 6,5% y 9%, respectivamente. Los niveles de PTH intacta y osteocalcina total se midieron por radio-inmunoensayo (Instituto Nichols, San Juan de Capistrano, California, EE.UU.); los valores de CV intra e interensayo fueron 2,6% y 5,8% para PTH y 4,5% y 5,1% para osteocalcina, respectivamente.
Todos los estudios realizados siguieron los principios enunciados en la declaración de Helsinki y fueron formalmente aprobados por el Comité de Ensayos Clínicos del Principado de Asturias.
Análisis estadístico
El análisis de los datos se llevó a cabo utilizando la versión 17.0 de SPSS para Windows. Las variables cuantitativas se analizaron mediante t de Student y las cualitativas por chicuadrado.
Se realizó análisis a nivel multivariante utilizando regresión logística ajustando por edad, sexo e IMC, en aquellos marcadores séricos o urinarios en los que el análisis univariante se asoció significativamente con progresión y/o aparición de nueva calcificación aórtica abdominal.
Se realizaron correlaciones de Pearson entre aquellos parámetros bioquímicos que, a nivel multivariante, mostraran una asociación significativa con el porcentaje de cambio en DMO entre ambos estudios transversales.
RESULTADOS
La edad media de los que tuvieron “progresión global” de calcificación aórtica (progresión de las calcificaciones vasculares ya existentes más las nuevas calcificaciones vasculares) fue superior a la edad de aquellos en los que no se observó esta situación (Tablas 1 y 2), pero no hubo diferencias de edad en los que solo tuvieron como cambio la aparición de una nueva calcificación aórtica en el control a los 4 años (Tabla 3). El IMC fue similar en aquellos con calcificación aórtica, tanto en los que la calcificación progresó, como en aquellos con nuevas calcificaciones o considerando ambas variaciones en conjunto (Tablas 1-3).
Tabla 1. Variables clínicas, antropométricas y marcadores bioquímicos del metabolismo óseo y mineral en presencia o ausencia de “progresión global” de calcificación vascular (CV)
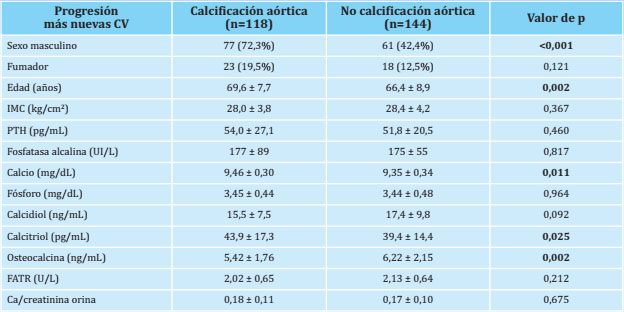
Las variables están expresadas en número (porcentaje) y en media ± deviación estándar; IMC: índice de masa corporal; PTH: parathormona; FATR: fosfatasa ácida tartrato-resistente.
Tabla 2. Variables clínicas, antropométricas y marcadores bioquímicos del metabolismo óseo y mineral en presencia o ausencia de progresión de calcificaciones vasculares (CV)
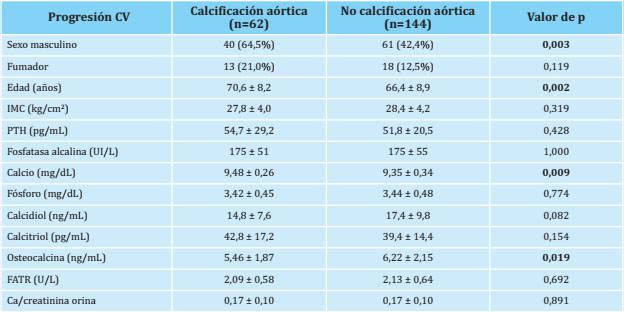
Las variables están expresadas en número (porcentaje) y en media ± deviación estándar; IMC: índice de masa corporal; PTH: parathormona; FATR: fosfatasa ácida tartrato-resistente.
Tabla 3. Variables clínicas, antropométricas y marcadores bioquímicos del metabolismo óseo y mineral en presencia o ausencia de nuevas calcificaciones vasculares (CV)

Las variables están expresadas en número (porcentaje) y en media ± deviación estándar; IMC: índice de masa corporal; PTH: parathormona; FATR: fosfatasa ácida tartrato-resistente.
El sexo masculino fue significativamente más frecuente en aquellos en los que se observó progresión de las calcificaciones aórticas ya existentes y/o nuevas calcificaciones aórticas. Por el contrario, no hubo diferencias en el hábito tabáquico (Tablas 1-3).
Respecto a los marcadores bioquímicos del metabolismo óseo, los niveles séricos de calcio y calcitriol fueron significativamente superiores y los de osteocalcina significativamente inferiores en aquellos sujetos en los que se observó “progresión global” de la calcificación aórtica (calcificaciones nuevas más progresión de la calcificación vascular) (Tabla 1).
El análisis de regresión logística ajustado por edad, sexo e IMC mostró que el único marcador bioquímico que se asoció de forma independiente con “progresión global” de calcificación aórtica fue la osteocalcina, mostrando que incrementos de 1 ng/mL se asociaron con una disminución de un 18% en la progresión de calcificación aórtica (odds ratio (OR)=0,82; intervalo de confianza del 95% (IC 95%): 0,71-0,95) (Tabla 4). La edad y el sexo masculino también se asociaron significativamente con progresión de calcificación vascular (OR=1,05; IC 95%: 1,01-1,08 y OR=2,06; IC 95%: 1,20-3,54, respectivamente) (Tabla 4).
Tabla 4. Análisis multivariante de las variables independientes asociadas significativamente en el análisis univariante con la progresión y/o presencia de nuevas calcificaciones aórticas. Se representa el odd ratio (OR) y el intervalo de confianza del 95 (IC 95%)

En negrita se muestran los valores significativos.
En el análisis univariante, los niveles séricos de osteocalcina fueron significativamente inferiores y los de calcio significativamente superiores en aquellos sujetos en los que la calcificación aórtica había progresado (Tabla 2). El análisis de regresión logística ajustado por edad, sexo e IMC confirmó que la osteocalcina fue el único parámetro que mostró una asociación significativa: incrementos de 1 ng/mL se asociaron con un aumento del 16% de progresión de las calcificaciones aórticas (OR=0,84; IC 95%: 0,70 -0,99) (Tabla 4). El sexo (OR=1,95; IC 95%: 1,01-3,76) y también la edad (OR=1,06; IC 95%: 1,02-1,10) se asociaron en este modelo multivariante (Tabla 4).
Cuando se analizaron solo aquellos sujetos que presentaron una nueva calcificación aórtica, se observó que los niveles séricos de osteocalcina fueron significativamente inferiores y los de calcitriol significativamente superiores (Tabla 3). El análisis de regresión logística ajustado por edad, sexo e IMC confirmó que únicamente la osteocalcina mostró una asociación significativa: incrementos de 1 ng/mL se asociaron con un 20% de aparición de nuevas calcificaciones aórticas (OR=0,80; IC 95%: 0,67-0,97) (Tabla 4). El sexo masculino (OR=2,30; IC 95%: 1,15-4,59), pero no la edad, se asoció en este modelo multivariante (Tabla 4).
La categorización de los niveles séricos de osteocalcina en terciles arrojó que el tercil más bajo (osteocalcina <4,84 ng/mL) fue el que mostró una mayor proporción de nuevas calcificaciones aorticas (22; 42,3%). El segundo tercil (osteocalcina entre 4,84 y 6,40 ng/mL) mostró la misma tendencia, pero en una proporción inferior (18; 34,6%), mientras que el tercer tercil (osteocalcina >6,4 ng/mL) mostró la menor proporción (12; 23,1%). Un análisis de regresión logística ajustado por edad, sexo e IMC mostró que los sujetos del primer tercil se asociaron a una mayor de proporción (2,45 veces) de nuevas calcificaciones aórticas: (OR=2,45; IC 95%: 1,03-3,56). No hubo diferencias con aquellos del segundo tercil (OR=1,48; IC 95%: 0,611-3,56).
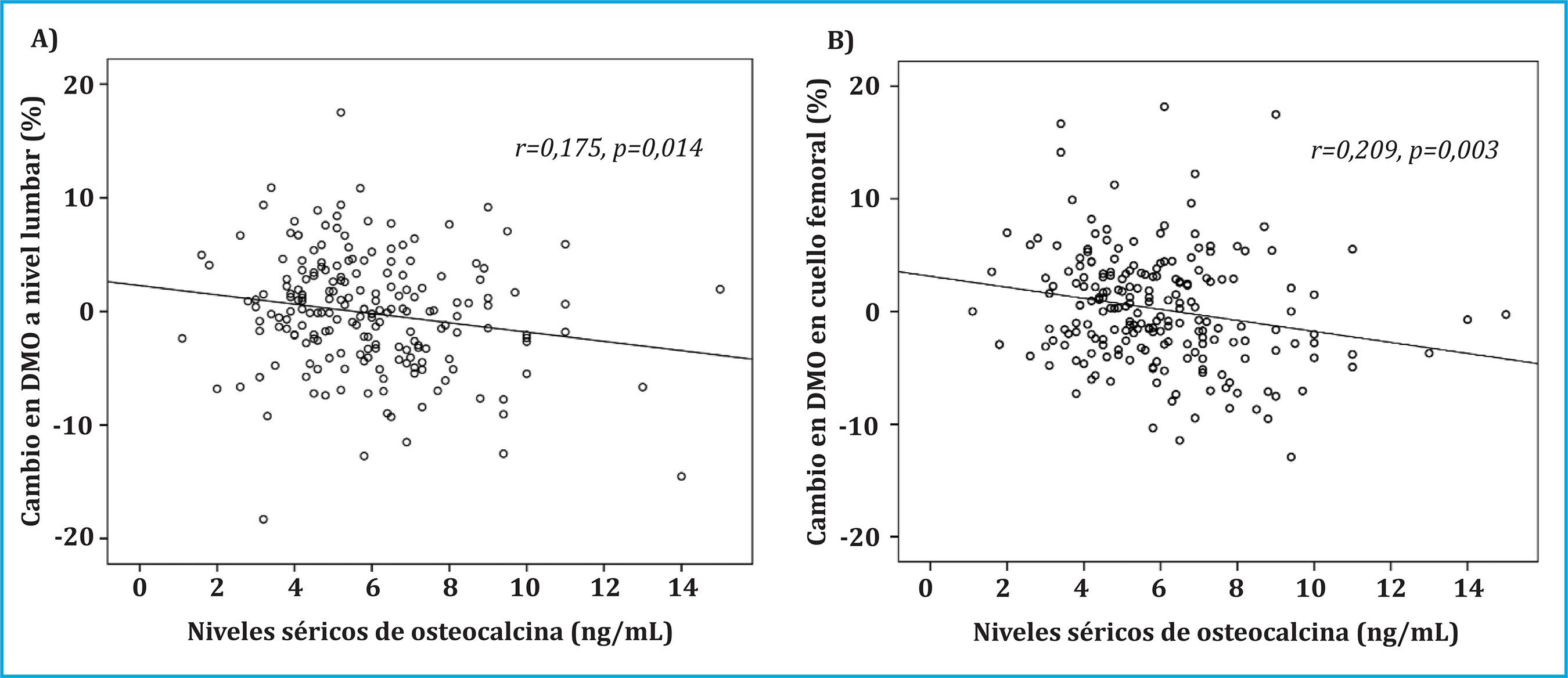
Las correlaciones bivariadas entre el porcentaje de cambio en la DMO a nivel lumbar y cuello femoral y los niveles séricos de osteocalcina mostraron una correlación negativa y significativa. Valores más elevados de osteocalcina se asociaron con una menor pérdida de DMO, mientras que valores menores de osteocalcina se asociaron con mayores pérdidas de masa ósea (Figura 1A y 1B).
DISCUSIÓN
Los resultados de este estudio confirman que, de los marcadores bioquímicos analizados, la osteocalcina fue el único marcador que se asoció con la aparición y progresión de calcificaciones aórticas de forma independiente de la edad, sexo e IMC. Un aumento de 1 ng/mL de osteocalcina disminuyó la “progresión global” de calcificación aórtica en un 18%, una protección equivalente a tener entre 3-4 años menos de edad.
La osteocalcina, una proteína de la matriz dependiente de la vitamina K, es el componente no colágeno más abundante en la matriz mineralizada del hueso. No solo es producida por el hueso, sino también por las células del músculo liso vascular que muestran un fenotipo similar a osteoblastos10. Inhibe la precipitación del fosfato cálcico y muestra una fuerte afinidad por la hidroxiapatita11. Inicialmente se había pensado que la osteocalcina inhibía el crecimiento de cristales de hidroxiapatita12 y limitaba la formación de hueso13.
Estudios experimentales, han mostrado que la osteocalcina descarboxilada puede regular al alza la síntesis de óxido nítrico en células endoteliales humanas con un efecto protector contra la disfunción endotelial. Estos hallazgos apoyan la idea que la osteocalcina descarboxilada es la forma biológicamente activa de la proteína, con una función protectora sobre la vasculatura independiente de su papel metabólico, si bien se requieren más estudios para confirmar este hecho14.
La osteocalcina se ha detectado en mayor grado en placas calcificadas y válvulas aórticas que en vasos sanos no calcificados15,16. Se ha reportado que el nivel de ARNm de osteocalcina puede aumentar entre 8 y 14 veces en placas calcificadas de aortas comparadas con aortas sanas17. Es posible que el aumento de la osteocalcina total se produzca como resultado de que en las placas ateroscleróticas se desarrolla un fenotipo osteogénico18; sin embargo, esto requiere una mayor validación. Recientemente, se ha descrito que la osteocalcina juega un papel crucial en la calcificación arterial mediada por la señalización de Wnt/β-catenina a través del aumento en la fosforilación oxidativa, pudiendo este hallazgo tener implicaciones clínicas19.
No obstante, los estudios en pacientes no arrojan resultados concluyentes. Un meta-análisis relativamente reciente incluyó 46 estudios que examinaron la asociación entre osteocalcina y aterosclerosis20. De los estudios que analizaron la asociación entre la osteocalcina y el grosor de la íntima-media carotídea, cuatro informaron que niveles más elevados de osteocalcina se asociaron con mayor grosor de la íntima-media carotídea, cuatro informaron que niveles más elevados de osteocalcina se asociaron con un grosor de íntima-media carotídea más bajo, y tres no encontraron ninguna correlación. Sin embargo, los estudios que examinaron células mononucleares positivas para osteocalcina o tinción histológica para osteocalcina, mostraron que niveles más elevados de osteocalcina se asociaban con aumento en los marcadores de aterosclerosis y calcificación20. De este modo se sugiere que la osteocalcina podría ser un marcador del proceso de calcificación.
Nuestros resultados muestran que, en el período de 4 años entre ambos cortes transversales, tanto la presencia de nuevas calcificaciones aórticas como la progresión de las mismas se asociaron con niveles inferiores de osteocalcina de forma independiente de la edad, sexo e IMC. Es de destacar que el tercil más bajo de osteocalcina (<4,84 ng/mL) fue el que se asoció con un importante incremento de nuevas calcificaciones aórticas: 2,45 (1,033,56) comparado con sujetos con niveles séricos de osteocalcina superiores a 6,4 ng/mL.
Kim y cols. encontraron en mujeres asiáticas, resultados similares a los de nuestros estudio, con una correlación inversa entre osteocalcina y calcificación vascular medida por el índice de Agatston, incluso después de ajustar por edad21. Resultados similares también han sido mostrados en otros estudios transversales22,23 y longitudinales, como el nuestro, en los que se ha observado que los niveles elevados de osteocalcina se asocian con una menor progresión de calcificación aórtica abdominal24. Estos autores sugieren que la osteocalcina podría estar involucrada en el proceso de calcificación aórtica indirectamente por su acción sobre la insulina y la resistencia a la insulina. Recientemente, Fusaro y cols. han observado en una población en diálisis que aquellos pacientes diabéticos con mayor prevalencia de calcificación vascular tenían menores niveles séricos de osteocalcina total y descarboxilada25. De hecho, en un análisis secundario de nuestro estudio, analizando los niveles de osteocalcina en aquellos sujetos con diagnóstico de diabetes, se observó que la presencia de diabetes (n=23) se asoció con niveles de osteocalcina significativamente menores que los que no presentaban diabetes (n=241) (4,89±1,80 ng/mL respecto a 5,96±2,14 ng/mL; p=0,020).
Podría también especularse que valores bajos de osteocalcina se asocian a calcificación vascular debido a un menor remodelado óseo que podría ser un factor de riesgo de calcificación vascular26,27. Sin embargo esta posibilidad no se vería apoyada por los resultados de este estudio, dado que los sujetos que presentaban niveles más bajos de osteocalcina y mayor calcificación vascular eran los que tenían menor DMO, lo que sería más indicativo de alto que de bajo remodelado28.
Por otro lado, la utilidad de la osteocalcina como marcador sérico sigue siendo controvertida. Para poder definir si la osteocalcina puede utilizarse como herramienta de diagnóstico o de detección en la aparición de calcificación vascular queda todavía mucho camino por recorrer. Es de destacar que ningún estudio ha diferenciado entre las formas de osteocalcina cuando se habla de calcificación vascular. En consecuencia, es necesario estudiar el efecto que la osteocalcina carboxilada y la descarboxilada pudieran tener en este entorno, a la par que investigar los mecanismos que están asociados con el aumento de osteocalcina en el tejido calcificado5.
Este estudio presenta varias limitaciones. En primer lugar, la determinación de osteocalcina solo se realizó en el segundo corte transversal, lo que limita las asociaciones encontradas. En segundo lugar, se determinó la osteocalcina intacta o total sin diferenciar entre carboxilada o descarboxilada. Por otro lado, la evaluación de la calcificación vascular fue realizada por radiología simple y no por técnicas más sensibles. También es posible que algunas de las personas que acudieron al segundo control a los 4 años, lo hubieran hecho al encontrarse en peor condición física respecto a los que no acudieron al mismo, si bien no se encontraron sesgos claros de selección29.
A pesar de estas limitaciones, el estudio tiene también importantes fortalezas como fue la adecuada respuesta de los sujetos que participaron en el estudio, tanto a nivel basal (50%)30 como a los 4 años del período de seguimiento (70%). El grado de reproducibilidad entre los observadores para la valoración de la calcificación vascular avala su uso como criterio diagnóstico. Por último, a diferencia de otros trabajos, este estudio fue prospectivo, y no transversal como la mayoría de los que han podido referenciarse. Esto refuerza la validez de los resultados encontrados y su mayor grado de asociación.
Por tanto, si bien se necesitan nuevos estudios que puedan confirmar estos resultados, de este estudio se puede deducir que los niveles séricos de osteocalcina podrían ser un prometedor marcador bioquímico asociado a la aparición y/o a evolución de la calcificación aórtica.











 texto en
texto en