INTRODUCCIÓN
La osteoporosis se define como una enfermedad del esqueleto en la que se produce una disminución de la resistencia ósea que conduce a un incremento del riesgo de fractura, habitualmente por un traumatismo poco intenso1. Aunque en la práctica clínica puede observarse cualquier fractura, con la excepción de los huesos del cráneo, la más prevalente es la vertebral y la más grave la de la extremidad proximal del fémur2, dada su importante morbilidad y mortalidad3. En la aparición de las fracturas por fragilidad o fracturas osteoporóticas influyen factores genéticos, antropométricos, nutricionales y de estilos de vida4-11, pero también pueden hacerlo factores ginecológicos y obstétricos12. Entre ellos, la lactancia materna ha demostrado que ejerce una función reproductiva esencial en la mujer y protege a la madre del desarrollo de muchas enfermedades, como el cáncer o la diabetes11-14.
Sin embargo, es menos definido su efecto sobre el metabolismo mineral óseo, siendo los resultados publicados a menudo contradictorios. Algunos de estos estudios indican que una lactancia materna prolongada podría asociarse a un aumento de la densidad mineral ósea (DMO) y a una menor prevalencia de osteoporosis en mujeres postmenopáusicas12-16, mientras que otros sugieren precisamente lo contrario, que la lactancia materna prolongada es un factor de riesgo para la aparición de osteoporosis y de fracturas por fragilidad17-21. Por último, se han publicado también trabajos que no encuentran ningún efecto, ni beneficioso ni perjudicial22-24.
Por todo ello, hemos realizado el presente estudio en una población de mujeres postmenopáusicas con el fin de establecer si la lactancia materna se asocia o no a la aparición posterior de osteoporosis densitométrica y a la presencia de fracturas por fragilidad, con la particularidad de que, para ello, se empleó el método de pareamiento por puntuación de propensión o propensity score matching, método que permite realizar una comparación más precisa de las variables estudiadas en los grupos establecidos haciéndolos más homogéneos, y que describiremos más detalladamente a continuación.
MATERIAL Y MÉTODOS
Se incluyó un total de 758 mujeres, que fueron estudiadas en la Unidad Metabólica Ósea del Hospital Universitario Insular en el período entre 2016-2020. Fueron informadas de los objetivos del estudio y dieron su consentimiento informado. Todas completaron un cuestionario, previamente validado y utilizado en otros estudios clínicos similares sobre osteoporosis25,26. También se les realizó una exploración física básica que incluyó la medición de la talla y el peso para el posterior cálculo del índice de masa corporal (IMC). Posteriormente se les agrupó en mujeres que habían lactado (casos) y mujeres que no lo hicieron (controles)
Recogida de muestras y técnicas de laboratorio
Las muestras de sangre y de orina se recogieron por la mañana, entre las 8:00 y las 9:00 horas, después de una noche en ayunas. La sangre se recogió en los oportunos tubos específicos para cada determinación, con la menor compresión venosa posible, y fue centrifugada a 1.500 g durante 10 minutos; el suero fue separado en alícuotas y almacenado antes de una hora desde la extracción a -20ºC hasta que los análisis bioquímicos fueran realizados, aunque la mayor parte de los mismos se efectuaron el mismo día de la extracción. La glucosa, la urea, la creatinina, el calcio, el fósforo inorgánico, las proteínas totales, el colesterol total y sus fracciones y los triglicéridos fueron medidos utilizando técnicas colorimétricas estandarizadas y automatizadas en un autoanalizador (Kodak Ektachem Clinical Chemistry Slides). El calcio sérico fue corregido de acuerdo a las proteínas totales por medio de la siguiente fórmula:
Determinación de los valores ultrasonográficos en el calcáneo
Se estimaron los parámetros ultrasonográficos en el calcáneo del pie dominante por medio de un ultrasonógrafo Sahara® Hologic® (Bedford, Massachussetts, EE.UU.). Este aparato mide tanto la atenuación ultrasónica de banda ancha, (Broadband ultrasound attenuation, BUA), como la velocidad del sonido (Speed of sound, SOS) en la región de interés del calcáneo. Los valores de BUA y SOS se combinan en un único parámetro denominado índice cuantitativo ultrasónico (Quantitative ultrasound index, QUI), conocido también como índice de consistencia o stiffness, que se obtiene por medio de la fórmula:
Los valores de T-score se calcularon a partir de los valores publicados como normales para la población española27.
Densidad mineral ósea (DMO)
La DMO fue medida por absorciometría radiológica dual (DXA), tanto en la columna lumbar (L2-L4) como en la extremidad proximal del fémur, con un densitómetro Hologic Discovery®, (Hologic Inc, Waltham, EE.UU.), cuya precisión es del 0,75-0,16%. Las mediciones fueron realizadas por el mismo operador, por lo que no existió variación interobservador. Los valores de T-score se calcularon a partir de los valores publicados como normales para la población canaria28.
Diagnóstico de osteoporosis y de fracturas por fragilidad
Se consideró que existía osteoporosis cuando se obtuvo un valor de T-score igual o inferior a -2,5 en alguna de las 3 localizaciones anatómicas donde se determinó la densidad mineral ósea: columna lumbar L2-L4, cuello femoral o total de cadera.
Se diagnosticó la existencia de una fractura por fragilidad cuando se produjeron sin un traumatismo que la justificara o por una caída como máximo de la altura de la mujer. Las fracturas fueron confirmadas por informes médicos disponibles en su historia clínica: servicios de Urgencias, Traumatología, Rehabilitación, o tras analizar sus radiografías.
Ética
El estudio se realizó siguiendo las normas de la Declaración de Helsinki29 y fue aprobado por el Comité de Ética del Hospital Universitario Insular. A todos los pacientes se les informó de los objetivos del trabajo y se les solicitó su consentimiento informado.
Análisis estadístico
Análisis univariante
Inicialmente realizamos un análisis de las variables numéricas estudiando si las mismas seguían o no una distribución normal. Posteriormente efectuamos un estudio descriptivo. Las variables categóricas se resumieron mediante porcentajes, y las numéricas mediante medias y desviaciones estándar si seguían la normalidad, o como mediana y su rango intercuartílico (percentiles = 25th – 75th) si no lo hacían. Para estudiar las posibles asociaciones entre variables categóricas, se utilizó el test de la Chi-cuadrado (χ2) y como medida de asociación la odds ratio (OR), la cual se estimó mediante un intervalo de confianza del 95% (IC 95%). En aquellos casos en los que hubiese celdas con menos de 5 casos se aplicó la prueba exacta de Fischer.
Tabla 1. Características basales de las mujeres estudiadas
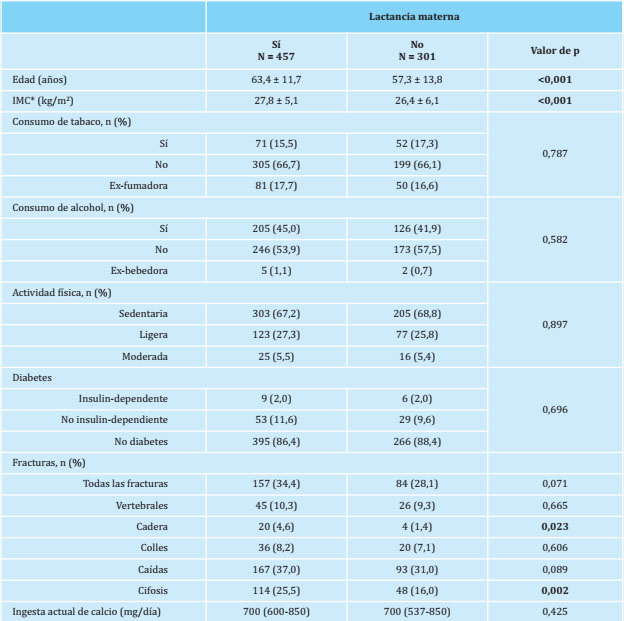
Los datos son expresados como medias ± desviaciones típicas, medianas (IQR) y frecuencias en número (%); * IMC: índice de masa corporal.
Para evaluar la asociación entre una variable cuantitativa y una variable categórica, se usó el test t de Student o ANOVA (en caso de que hubiera más de 2 categorías) para variables de distribución normal, o la prueba no paramétrica U de Mann-Whitney para las no normales. En todos los casos se consideró el nivel de significación en el 5% (p<0,05).
Propensity score matching
Para establecer la asociación entre la lactancia materna y la presencia de fracturas por fragilidad de forma más precisa y eliminar la influencia de otras variables, para cada caso de mujer lactante se seleccionó un control similar no lactante (pareamiento o matching). Este proceso se basó en el método denominado pareamiento por puntuación por propensión o propensity score matching, el cual es en nuestro caso definido por la probabilidad condicional de que la lactancia esté condicionada por aquellas variables que podrían actuar como factores de confusión. El propensity score se obtuvo para cada paciente utilizando la regresión logística, en la cual, la variable final fue la lactancia materna. Las covariables incluidas en el modelo fueron seleccionadas utilizando el algoritmo de enumeración completa y los criterios de información Akaike (Akaike Information Criterion, AIC).
Tabla 2. Valores de densidad mineral ósea obtenidos por densitometría (DXA) y ultrasonidos (QUS), valores ajustados por edad e IMC y prevalencia de osteoporosis densitométrica
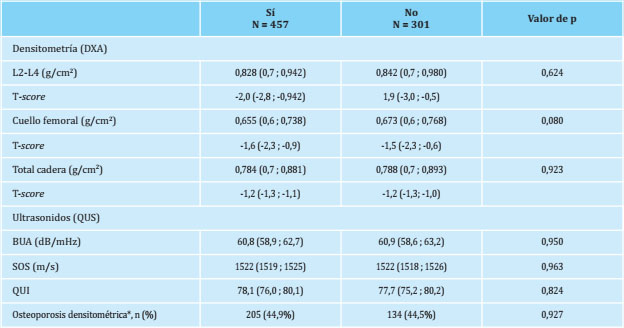
Medianas (IC 95%) ajustadas por edad e índice de masa corporal (IMC); *: presencia de una T-score inferior a -2,5 en alguna de las 3 localizaciones donde se determinó la densidad mineral ósea (DXA), expresada en número (%).
Pareamiento (Matching)
Posteriormente realizamos un análisis ajustado 1 a 1 sin reemplazo, basados en el propensity score de cada paciente. El caliper o calibrador elegido fue 0,7. Después del ajuste por el propensity score las características basales fueron comparadas por el test de McNemar para las variables binarias o con el t-test o el de Wilcoxon, según conviniera en cada caso, para las variables continuas y los datos apareados. Las variables que fueron seleccionadas por el programa para ser incluidas en el pareamiento fueron un total de 13: edad, IMC, caídas, uso de estatinas o de tiazidas, ácido úrico, colesterol total, HDLcolesterol, triglicéridos, la presencia de cifosis y los valores densitométricos en L2-L4, cuello femoral y total de cadera. Además, establecimos el éxito del ajuste del propensity score balanceando el ajuste de las covariables en los dos grupos utilizando las diferencias estandarizadas. Aquellas diferencias inferiores al 10% apoyaron la asunción de equilibrio entre los dos grupos. El nivel de significación estadística se estableció al 5% (p<0,05). Los datos fueron analizados utilizando el programa R, versión 3.6.1 (R Development Core Team, 2019).
RESULTADOS
En la tabla 1 se muestran las características basales de las mujeres incluidas en el estudio, agrupadas en lactantes o no lactantes. Aquellas que habían lactado tenían más edad (63,4 ± 11,7 años frente a 57,3 ± 13,8 años, p<0,001) y mayor IMC, (27,8 ± 5,1 kg/m2 frente 26,4 ± 6,1 kg/m2), se realizaron tras ajustar por estas dos variables. La prevalencia de fractura de cadera fue mayor entre las mujeres que habían lactado significativamente, significación que posteriormente desapareció al realizarse el ajuste por edad e IMC.
En la tabla 2 se muestran los valores de DMO obtenidos en la columna lumbar (L2-L4) y en la extremidad proximal del fémur con sus correspondientes T-scores. También se muestran los valores de índices ultrasonográficos obtenidos en el calcáneo, concretamente el coeficiente de atenuación ultrasonográfica (BUA), la velocidad del sonido (SOS) y el índice de consistencia o Stiffness (QUI). No se observaron diferencias estadísticamente significativas en ninguno de los valores obtenidos entre ambos grupos estudiados. La prevalencia de osteoporosis fue similar entre ambos grupos: 44,9% en las mujeres que habían lactado y 44,5% en las que no lo habían hecho, (p=0,927).
En la tabla 3 se muestran los valores bioquímicos que obtuvimos en ambos grupos estudiados antes de realizar el ajuste. Se observan diferencias estadísticamente significativas (p<0,05) en los valores séricos de ácido úrico, HDL-colesterol, triglicéridos y fósforo. Todas estas diferencias posteriormente desaparecieron cuando se realizó el pareamiento por el propensity score.
Tabla 3. Datos bioquímicos de las pacientes incluidas en el estudio, clasificadas en si habían lactado o no, ajustados por edad e IMC
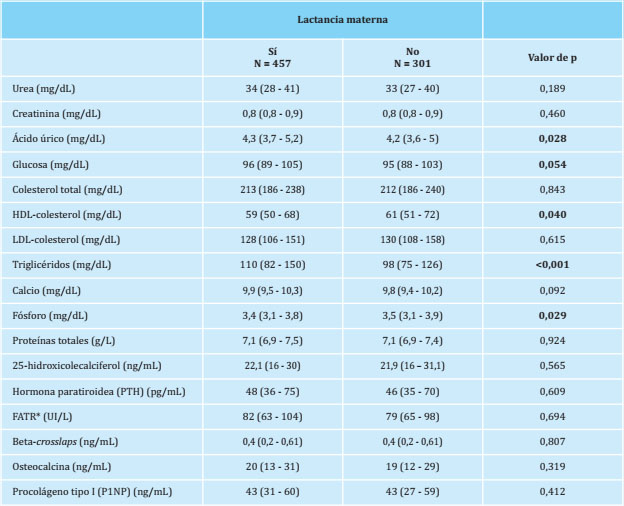
*FATR: fosfatasa ácida tartrato-resistente.
En la tabla 4 se muestran las características de las pacientes del estudio después de realizarse el pareamiento de acuerdo al propensity score de cada una de ellas. Se muestran las variables seleccionadas por el programa para efectuar dicho pareamiento, que fueron un total de 13, entre ellas todas las que previamente habían mostrado diferencias estadísticamente significativas en las comparaciones crudas. Como consecuencia de este pareamiento, el tamaño muestral se redujo sustancialmente hasta el extremo de que el número de mujeres quedó finalmente conformado por 254 mujeres en cada grupo. Como prueba de la corrección de este pareamiento, se observa que las diferencias estandarizadas son inferiores al 10%, lo que indica la homogeneidad de las variables entre ambos grupos.
Tabla 4. Características de las mujeres del estudio después del pareamiento por el propensity-score
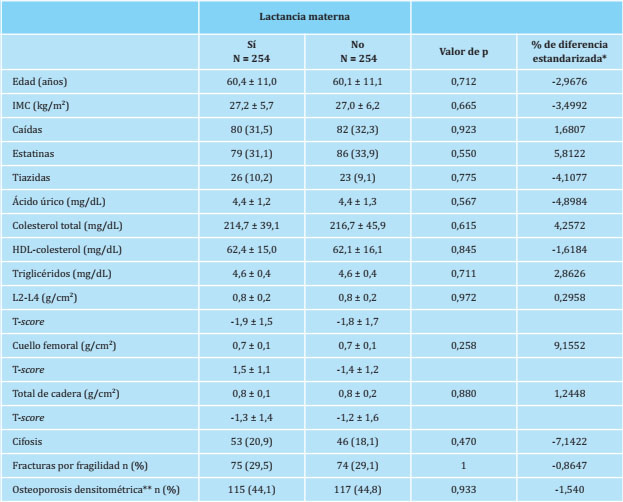
Los datos se expresan en media ± desviación típica y frecuencias: n (%); el calibrador (caliper) seleccionado fue 0,5; *: obsérvese que todas las diferencias estandarizadas fueron inferiores o iguales al 10%; **: presencia de una T-score inferior a -2,5 en alguna de las 3 localizaciones donde se determinó la densidad mineral ósea (DXA).
En la tabla 5 se muestra los datos obtenidos al aplicar la regresión logística condicional para la presencia de fracturas por fragilidad. Después del pareamiento, la lactancia materna no mostró asociación con las fracturas por fragilidad.
DISCUSIÓN
La osteoporosis es una enfermedad muy prevalente en la que las fracturas constituyen su única complicación clínica2,30. En la etiopatogenia de la osteoporosis postmenopáusica se han implicado diversos factores de riesgo, relacionados con los estilos de vida4-7,12, la genética8 e incluso con la historia ginecológica12,14.
Uno de los aspectos etiopatogénicos sobre los que no existe consenso es en el efecto que la lactancia materna, que se realiza en una etapa de la vida en la que la mujer es obviamente más joven, puede tener en el posterior desarrollo de una osteoporosis después de la menopausia. Algunos estudios sugieren que el “balance negativo de calcio” que se produciría durante la lactancia podría generar una posterior pérdida de masa ósea que se manifestaría después de la menopausia con un mayor riesgo de desarrollo de una osteoporosis densitométrica y/o de fracturas por fragilidad17-21.
De hecho, durante la lactancia, la madre suministra al feto alrededor de 300 mg diarios de calcio, cuya fuente es fundamentalmente ósea, lo que produce una pérdida de entre el 5-10% de la masa ósea materna31, bastando de 3-6 meses de lactancia para que se produzca esta pérdida32. Sin embargo, a la hora de estudiar y tratar de establecer los factores ginecológicos y/o obstétricos que pueden influir en el metabolismo mineral óseo, algunos autores valoran solo la presencia o ausencia de embarazos16, otros estudian el número de embarazos21 no faltando quien analice la edad en la que se produce elprimer embarazo20. Por otra parte, otros autores sugieren que el organismo se adapta a esta situación, pues estransitoria y con varios mecanismos homeostáticoscompensatorios restaura el equilibrio en el metabolismomineral óseo. Otros autores sugieren que cuando la lactancia se prolonga hasta un año, sería correcto informara la madre de la necesidad de que adquiera hábitos nutricionales y de actividad física que faciliten esta recuperación33,34.
Existen también notables diferencias en el método a utilizar para valorar el efecto de la lactancia sobre el metabolismo mineral óseo. En unos estudios se analizan los cambios en la DMO16,35, mientras que otros estudian el riesgo de desarrollar fracturas por fragilidad12,15,36, especialmente fracturas de cadera18,37. Curiosamente, no hemos podido encontrar en la literatura estudios que analicen el efecto de la lactancia materna sobre un aspecto muy importante del esqueleto que es la calidad ósea, hasta tal punto importante que algunos autores consideran que ésta contribuye de una manera más importante al riesgo de fractura que la cantidad medida por DMO38.
Se han realizado algunos estudios con el fin de conocer cuales son los cambios que se producen en el metabolismo mineral óseo en la mujer en el momento en que están lactando. Así, Carneiro y cols. sugirieron la hipótesis de que en estas mujeres se produce un desacoplamiento entre los osteoblastos y osteoclastos que conduce a una pérdida rápida de masa ósea39.
En una revisión realizada por Sower sobre el efecto de embarazo y lactancia sobre el metabolismo mineral óseo, se recoge una amplia variabilidad en los resultados obtenidos en las distintas publicaciones, lo cual se considera que en gran parte se debe a la heterogeneidad de la metodología empleada en estos estudios40.
Las mujeres incluidas en nuestro estudio fueron 758, de las cuales no habían lactado 301 (39,7%) y sí lo habían hecho 457 (60,3%). Todas ellas eran postmenopáusicas y en el análisis de sus características clínicas en la evaluación basal constatamos la existencia de diferencias estadísticamente significativas en la edad y en el IMC, motivo por el que los valores densitométricos y los parámetros analíticos recogidos en las tablas 2 y 3 se compararon después de ajustar por estas dos variables.
La distribución de los estilos de vida, como el consumo de tabaco, la actividad física en el tiempo libre y la prevalencia de diabetes, mostró cifras similares de prevalencia, sin obtenerse diferencias estadísticamente significativas. En un estudio realizado por Yan y cols. en mujeres chinas encontraron que las diferencias observadas en la DMO en mujeres postmenopáusicas que habían lactado y las que no lo habían hecho se debían a la edad, el IMC y el número de embarazos y no al hecho de haber o no lactado21. Dado el conocido efecto de la edad e IMC sobre la DMO9 en nuestro estudio decidimos ajustar por estas variables.
Las mujeres de ambos grupos, lactantes y no lactantes, mostraron valores similares de DMO tanto en la columna lumbar como en la extremidad proximal del fémur. Algunos estudios han descrito que las mujeres que lactan tienen valores de DMO más bajos que aquellas que no lo hacen20,24,32, pero hay otros autores que encuentran lo contrario: un efecto protector con valores mas elevados de DMO y menor riesgo de osteoporosis densitométrica18,31. Un estudio realizado en Corea en más de un millón de mujeres41 obtuvo que los parámetros que se asociaban de manera independiente con un aumento del riesgo de fractura fueron la presencia de una menarquia tardía, una menopausia precoz y, por lo tanto, un periodo reproductivo menor, pero no la lactancia materna, hallazgo que coincide con nuestros resultados.
En la bibliografía que hemos consultado no encontramos estudios que relacionasen la lactancia materna con la calidad ósea valorada por ultrasonidos en mujeres postmenopáusicas, y tan solo encontramos un estudio realizado en mujeres premenopáusicas42 que reportaron un efecto beneficioso. En nuestro estudio no se observaron diferencias estadísticamente significativas en los índices ultrasonográficos, por lo que podemos aceptar que la lactancia materna no ejerce ningún efecto, ni positivo ni negativo sobre la calidad ósea estimada por estas mediciones. Las diferencias estadísticamente significativas que hemos encontrado en los datos bioquímicos los consideramos clínicamente irrelevantes43, ya que se encuentran dentro del rango de la normalidad establecido por el laboratorio, y no tienen una repercusión clínica.
Al aplicar la técnica estadística del método propensity score matching conseguimos un mejor ajuste de las mujeres para homogeneizar ambos grupos. Las variables establecidas por el programa para ser incluidas en el ajuste se muestran en la tabla 4 y se aprecia en la misma que el porcentaje de diferencia estandarizada oscila entre -7,1422 y 9,1552. Esto indica un ajuste muy bueno, el cual se ha establecido por consenso como inferior al 10%. Si bien como consecuencia de este ajuste, el número de mujeres estudiadas disminuyó a 254 en cada grupo, gracias al mismo pudimos establecer de forma más precisa, al aplicar la regresión logística condicional, que la lactancia materna no tiene ningún efecto sobre la presencia de fracturas por fragilidad después de producirse la menopausia.
En conclusión, nuestro estudio sugiere que la lactancia materna no tiene ningún efecto, ni positivo ni negativo, sobre el metabolismo mineral óseo tras la menopausia, de acuerdo a los resultados bioquímicos obtenidos (con marcadores de remodelado óseo, vitamina D y PTH) y los densitométricos (con DXA y QUS). Finalmente, el método propensity score matching nos permitió confirmar que tampoco influía sobre la prevalencia de fracturas por fragilidad tras la menopausia.











 texto em
texto em 



