INTRODUCCIÓN
La diabetes mellitus tipo 2 (DM2) y la osteoporosis son enfermedades de alta prevalencia debido al envejecimiento de la población que se asocian a un aumento del riesgo de fracturas por fragilidad que aumentan de forma sustancial la morbilidad y mortalidad de la población1. Recientemente, la sarcopenia, definida como la debilidad muscular relacionada con el envejecimiento, ha sido reconocida como una complicación de la DM2 que con frecuencia aumenta la fragilidad de estos pacientes2,3.
El sistema músculoesquelético está estrechamente relacionado, tanto por su conexión física como por su regulación a través de múltiples elementos comunes. Aunque se ha observado que el músculo puede ejercer una influencia sobre el hueso a través del sistema neuroendocrino y las fuerzas mecánicas, su relación es compleja y no del todo bien conocida 4. Muchos estudios han evidenciado un vínculo entre sarcopenia y osteoporosis, pero los resultados son inconsistentes debido a la variabilidad en los criterios de diagnóstico y a la divergencia de los métodos de evaluación para la sarcopenia y la osteoporosis.
La mayoría de los estudios se han centrado en la evaluación de la relación entre la masa muscular y la densidad mineral ósea (DMO), mientras que sólo unos pocos han evaluado el efecto de la sarcopenia sobre la calidad ósea5,6. Sin embargo, alrededor de dos tercios de los pacientes con fracturas no tienen osteoporosis definida por los valores de DMO7. Los pacientes con DM2 presentan un incremento del riesgo de fractura a pesar de tener una DMO conservada o incluso aumentada1. Estos resultados sugirieron que la DMO por sí sola es insuficiente para evaluar la resistencia ósea y estimar el riesgo de fractura.
Trabecular bone score (TBS) es un método de valoración de la microarquitectura del hueso trabecular mediante la aplicación del software (TBS iNsight Software, Medimaps, Merignac, France). Se trata de una técnica de aplicación sencilla que permite analizar la microestructura del hueso trabecular sobre imágenes de exploraciones DXA de columna lumbar con un nuevo enfoque tecnológico sobre la variación de textura de imagen8. Los estudios realizados hasta la fecha han puesto de manifiesto que la determinación del TBS puede predecir el riesgo de fractura de manera independiente y complementaria a la DMO tanto en población general9 como en pacientes con DM210.
La sarcopenia fue definida por primera vez por Rosenberg IH en 1988 como una pérdida de masa y función muscular relacionada con el envejecimiento11. El estado previo a la sarcopenia es la "dinapenia", definida por Clark BC y Manini TM como una disminución de la fuerza muscular relacionada con el envejecimiento antes de la reducción de la masa muscular12, determinándose a través de la evaluación de la fuerza de extensión de la rodilla y la fuerza de prensión manual.
Nuestro objetivo fue investigar la relación entre los componentes de la dinapenia determinada por la fuerza de la mano, y la fragilidad ósea determinada por la DMO y la microarquitectura ósea medidas por DXA y TBS en sujetos con DM2.
MATERIAL Y MÉTODOS
Población de estudio
Se realizó un estudio observacional transversal en el que se incluyeron 60 pacientes con DM2 (60% varones y 40% mujeres postmenopáusicas) de entre 49 y 85 años, reclutados de forma consecutiva de 2016 a 2018 en el área de referencia del Hospital Universitario Clínico San Cecilio de Granada.
Los criterios de exclusión recogían la presencia de otras condiciones que alteran el metabolismo óseo como el diagnóstico de enfermedad metabólica ósea no osteoporótica, enfermedades crónicas, como la artritis reumatoide, enfermedades crónicas hepáticas y renales y enfermedades neoplásicas activas, así como terapia hormonal sustitutiva, terapia con glucocorticoides o tratamiento antiosteoporótico.
El estudio se realizó con la aprobación del Comité de Ética del Hospital Universitario Clínico San Cecilio de acuerdo con el código de ética de la Asociación Médica Mundial (Declaración de Helsinki). Se obtuvo el consentimiento informado por escrito de todos los sujetos de estudio.
Evaluación clínica
A todos los pacientes se les midió la altura, el peso y el perímetro de cintura (PC). El índice de masa corporal (IMC) se calculó como peso (kg)/altura (m2).
El porcentaje de grasa corporal total se estimó mediante una ecuación lineal antropométrica llamada masa grasa relativa (RFM) aplicando la siguiente ecuación: 64 - (20 x altura / circunferencia de la cintura) + (12 x sexo); sexo = 0 para hombres y 1 para mujeres13.
La fuerza de prensión manual (kg/cm2) se midió con un dinamómetro manual hidráulico Jamar® (5030j1; Jackson, MI) tres veces para cada mano con el paciente sentado y el brazo apoyado en una mesa sosteniendo el dinamómetro en posición vertical14, empleando el valor medio de estas medidas para representar la fuerza de la mano. Unos valores de fuerza de prensión manual <27 kg (hombres) y <16 kg (mujeres) se definieron como baja fuerza muscular15.
Para evaluar el nivel de movilidad y el riesgo de caídas, se realizó el test Time Up and Go (TUG), que determina el tiempo necesario para levantarse de una silla, caminar hasta una marca situada a 3 metros, darse la vuelta y sentarse nuevamente en la silla. Una puntuación inferior a 12 segundos se definió como bajo riesgo de caída y superior a 12 segundos, como riesgo de caída elevado16.
Los participantes completaron cuestionarios de salud específicos, que incluían su historia clínica, tratamiento farmacológico, consumo de tabaco y alcohol y nivel de actividad física.
Determinaciones bioquímicas
Se recogieron muestras de sangre de todos los pacientes por la mañana tras 8 horas de ayuno nocturno.
Los niveles séricos de albúmina, calcio, fósforo, creatinina, fosfatasa alcalina, insulina, glucosa plasmática en ayunas, albúmina y perfil de lípidos (niveles de triglicéridos y colesterol (lipoproteínas de alta y baja densidad)) se midieron mediante métodos bioquímicos estándar.
La hemoglobina glicosilada (HbA1c) se determinó mediante cromatografía líquida de alta resolución (ADAMS A1c, HA-8160; Menarini, Florencia, Italia) y se expresó como porcentaje.
Densitometría ósea y TBS
La DMO (gramos/cm2) en columna lumbar (CL), cuello femoral (CF) y cadera total (CT) se determinó mediante un densitómetro Hologic QDR 4500 (Whatman, MA) con un coeficiente de variación de 1,70%, 1,80% y 1,50% para CL, CF y CT, respectivamente. El diagnóstico de osteoporosis se realizó utilizando los criterios de la Organización Mundial de la Salud17.
El TBS se midió en CL utilizando el software TBS iNsight versión 3.0.2.0 (Medimaps, Merignac, Francia) con un coeficiente de variación de 1,82%. La clasificación de la microarquitectura ósea se basó en los siguientes rangos de TBS: TBS mayor o igual a 1,31 correspondió a microarquitectura normal, TBS entre 1,23 y 1,31 se definió como microarquitectura parcialmente degradada y TBS igual o inferior a 1,23 como microarquitectura degradada18.
Análisis estadístico
Las variables continuas se expresaron como media ± desviación estándar (DS), mientras que las variables categóricas se expresaron como frecuencias absolutas (n) y relativas (%). Se analizó la normalidad de las variables mediante la prueba de Kolmogorov-Smirnov. La diferencia entre variables continuas se determinó mediante la prueba t de Student. Se utilizó la prueba de Chi-cuadrado para comparar las variables categóricas. El coeficiente de correlación de Pearson se utilizó para evaluar las relaciones lineales. Se consideraron significativos valores de p<0,05. Se utilizó el análisis de regresión lineal múltiple para probar la asociación entre TBS y las variables que influyen en la calidad ósea, ajustado por otros posibles factores de confusión. Se consideraron significativos valores de p<0,10.
El análisis estadístico se realizó mediante programa estadístico SPSS (versión 25.0; SPSS, Chicago, IL, EE.UU.).
RESULTADOS
La tabla 1 muestra las características de los sujetos del estudio según sexo. El consumo de tabaco y alcohol, así como la enfermedad cardiovascular y el tiempo de evolución de la DM2 fue mayor en hombres que en mujeres mientras que las mujeres presentaron cifras más elevadas de colesterol total y colesterol LDL. Los varones presentaron valores más bajos de RFM y mayores de fuerza de la mano y de DMO en CL y TBS que las mujeres.
Tabla 1. Características demográficas y variables clínicas
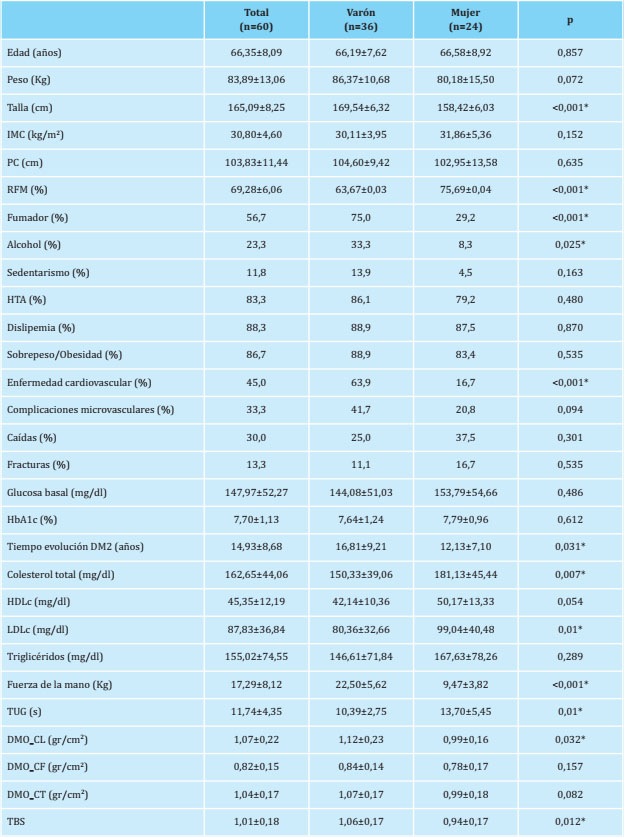
RFM: masa grasa relativa; IMC: índice de masa corporal; PC: perímetro de cintura; HbA1c: hemoglobina glucosilada ; HOMA2-IR: índice de resistencia a la insulina; HDL: lipoproteína de alta densidad; LDL: lipoproteínas de baja densidad ; TUG: test Time Up and Go;TBS: Trabecular bone score; DMO: densidad mineral ósea; CL: columna lumbar; CF: cuello femoral; CT: cadera total; DS: desviación estándar. Las variables continuas se expresan como media ± DS. Las variables categóricas se expresan como porcentajes. Se determinaron los valores de p utilizando la prueba t de Student para variables continuas y la prueba de Chi-cuadrado para variables categóricas.*Nivel de significación <0,05.
El 91,7% de las mujeres y el 77,8% de los varones presentaron baja fuerza muscular. La prevalencia de baja fuerza muscular se analizó por grupo de edad, cuartiles de IMC y PC (figura 1). Cuando se evaluó la prevalencia de dinapenia por grupo de edad, observamos un incremento progresivo con la edad (figura 1a). La prevalencia de baja fuerza de prensión manual fue mayor en el primer y cuarto cuartil de IMC. La prevalencia de baja fuerza muscular por cuartiles de PC se muestra en la figura 1c, el grupo del cuarto cuartil fue el que mostró mayor prevalencia de baja fuerza de prensión manual.
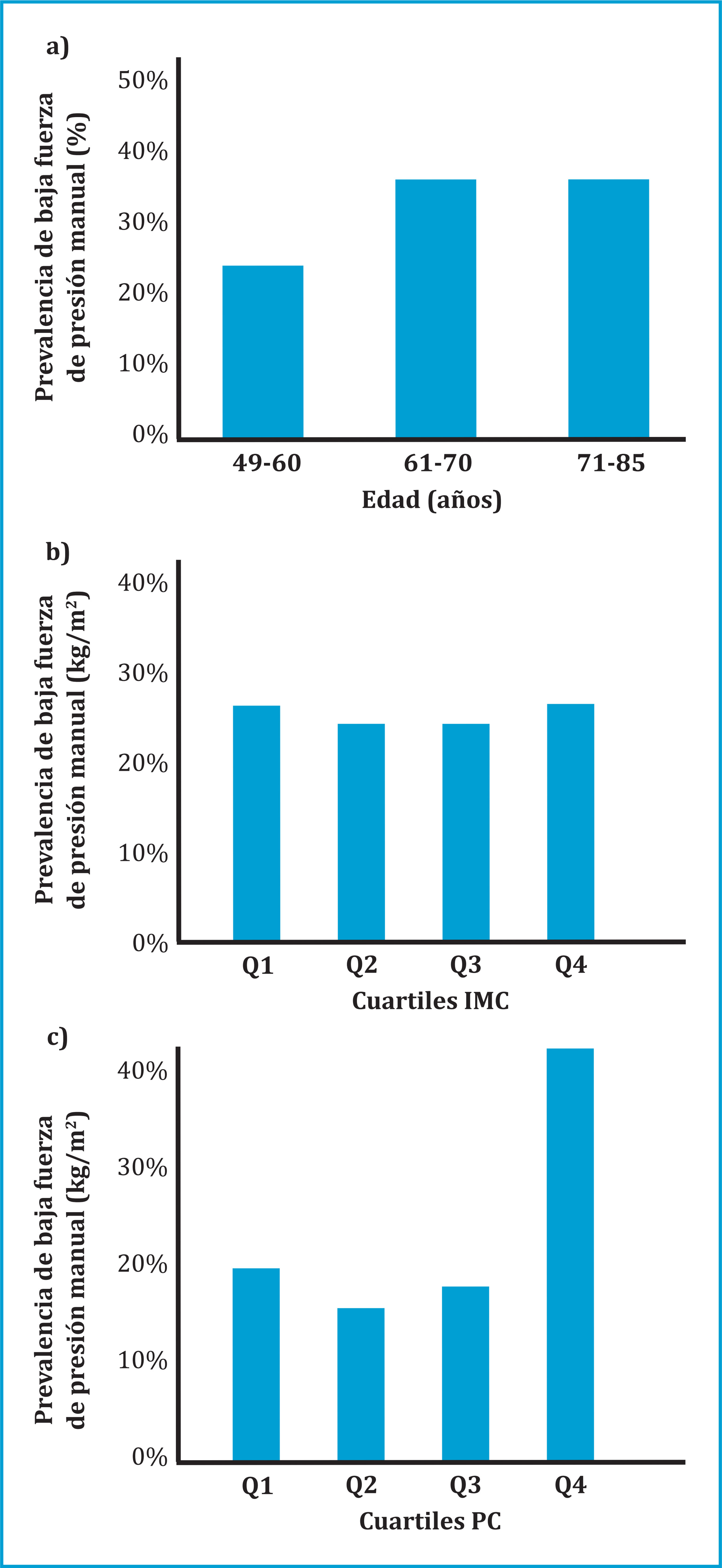
IMC: índice de masa corporal; Q1, primer cuartil, <27,9 kg/m2; Q2, segundo cuartil, 27,9-30,7 kg/m2; Q3, tercer cuartil, 30,8-33,9 kg/m2; Q4, cuarto cuartil >33,9 kg/m2. PC: perímetro de cintura; Q1, primer cuartil, <96 cm; Q2, segundo cuartil, 96-104 cm; Q3, tercer cuartil, 104,1-111,5 cm; Q4, cuarto cuartil >111,5 cm.
Figura 1. Prevalencia de baja fuerza de prensión manual: a) Evaluación de baja fuerza de prensión manual por edad; b) Evaluación de baja fuerza de prensión manual por cuartiles de IMC; c) Evaluación de baja fuerza de prensión manual por cuartiles de PC
Según los resultados obtenidos en el test TUG, el 25% de varones y 41,7% de mujeres presentaron un riesgo elevado de caídas. Los pacientes con riesgo de caídas elevado mostraron valores de fuerza de la mano significativamente menores que los que tenían bajo riesgo de caídas (13,8±7,4 vs 18,7±8,1; p=0,027).
El 81,7% de los pacientes con DM2 tenían una microarquitectura degradada (TBS ≤1,23), el 13,3% tenía microarquitectura parcialmente degradada (TBS entre 1,23 y 1,31) y el 5% presentó valores normales de TBS (TBS ≥1,31). Según los valores de DMO en CL, el 3,7% de los pacientes se clasificó en el rango de osteoporosis (T-score ≤2,5), el 37% en el de osteopenia y el 59,3% tenía una DMO en CL normal. Los sujetos con TBS normal y parcialmente degradado presentaron mayor fuerza de prensión manual que los sujetos con TBS degradado (p=0,031). Sin embargo, no hubo diferencias significativas en la fuerza de prensión manual entre los sujetos con osteopenia/osteoporosis frente a los que tenían DMO normal.
La evolución media de la DM2 fue de 14,9±8,7 años con un inadecuado control glucémico en el 73,3% de los pacientes. Los pacientes con elevado riesgo de caídas presentaban mayor tiempo de evolución de la DM2 que los que tenían bajo riesgo de caídas (18,1±8,9 vs 13,1±8,1 p=0,037). Los pacientes con un adecuado control metabólico (HbA1c <7,5%) mostraron mayor fuerza de la mano, aunque no se observaron diferencias significativas con respecto al grupo con peor control metabólico. No se observó una asociación significativa entre el tratamiento con insulina (66,7%) y el riesgo de caídas o la presencia de fracturas.
El análisis de correlación simple mostró una asociación positiva significativa del peso con la DMO en CL (r=0,372; p<0,01), CF (r=0,430; p<0,01) y CT (r=0,547; p<0,01) y negativa con TBS (r=-0,369; p<0,01). Tanto el PC como el IMC se asociaron significativamente con DMO en CT (positiva) (r=0,464; p<0,01) y (r=0,418; p<0,01), respectivamente y con TBS (negativa) (r=-0,402; p<0,01) y (r=-0,624; p<0,001). La RFM se correlacionó negativamente con TBS tanto en varones (r=-0,620; p<0,001) como en mujeres (r=-0,410; p<0,05) mientras que la fuerza de la mano se asoció positivamente con TBS (r=0,326; p<0,05). Aunque no observamos correlación significativa entre IMC, PC y RFM con la fuerza de prensión manual, si encontramos una disminución progresiva significativa de la fuerza de prensión de la mano con el aumento de los cuartiles de RFM (p<0,001) (figura 2).
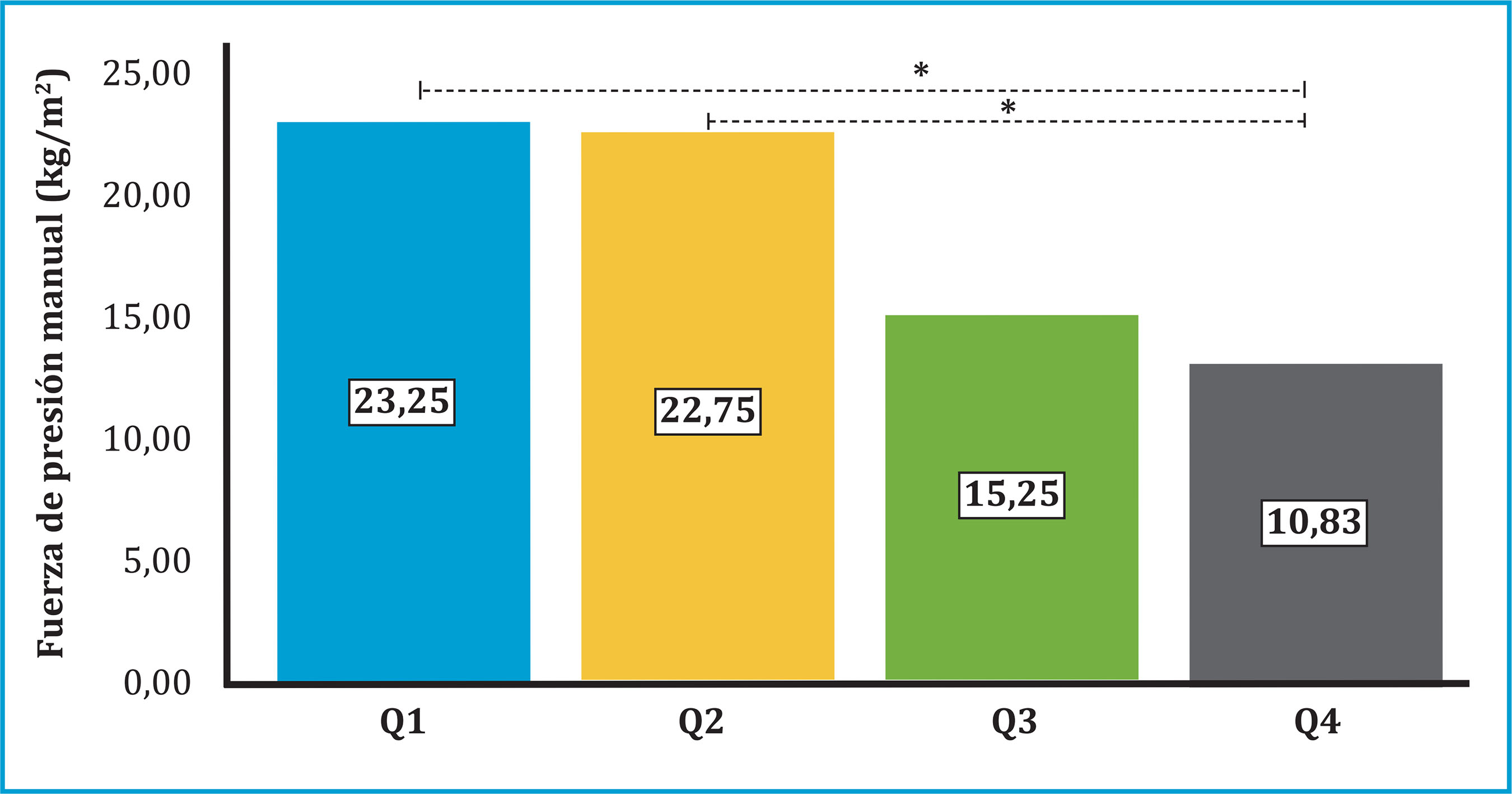
La fuerza de prensión manual (kg/cm2) se midió con un dinamómetro manual hidráulico Jamar®RFM: relative fat mass. Q1, primer cuartil, <63,6; Q2, segundo cuartil, 63,6-63,7; Q3, tercer cuartil, 63,8-75,7; Q4, cuarto cuartil >75,7. *Nivel de significación <0,01.
Figura 2. Fuerza de la mano y cuartiles de RFM
Dada la relación significativa entre la calidad ósea medida por TBS y la fuerza de prensión manual, se realizó un análisis de subgrupos de fuerza de prensión manual. Los sujetos con baja fuerza de prensión manual tenían valores significativamente menores de TBS que los que tenían mayor fuerza de la mano (0,99±0,17 vs 1,12±0,15; p=0,03). Aunque no hubo correlación significativa entre el test TUG y TBS, también se observaron valores más bajos de TBS en los sujetos que tenían riesgo de caídas elevado frente a los de bajo riesgo de caídas (0,94±0,13 vs 1,04±0,19; p=0,02) (figura 3). No hubo diferencias significativas en los valores de DMO en ambos grupos. Como se muestra en la figura 4a, los valores medios de fuerza de prensión manual mostraron una disminución progresiva según las categorías de TBS. Además, el porcentaje de pacientes que presentaban TBS degradado (TBS <1,23) mostró una tendencia decreciente con el aumento de los cuartiles de fuerza de prensión manual (figura 4b).
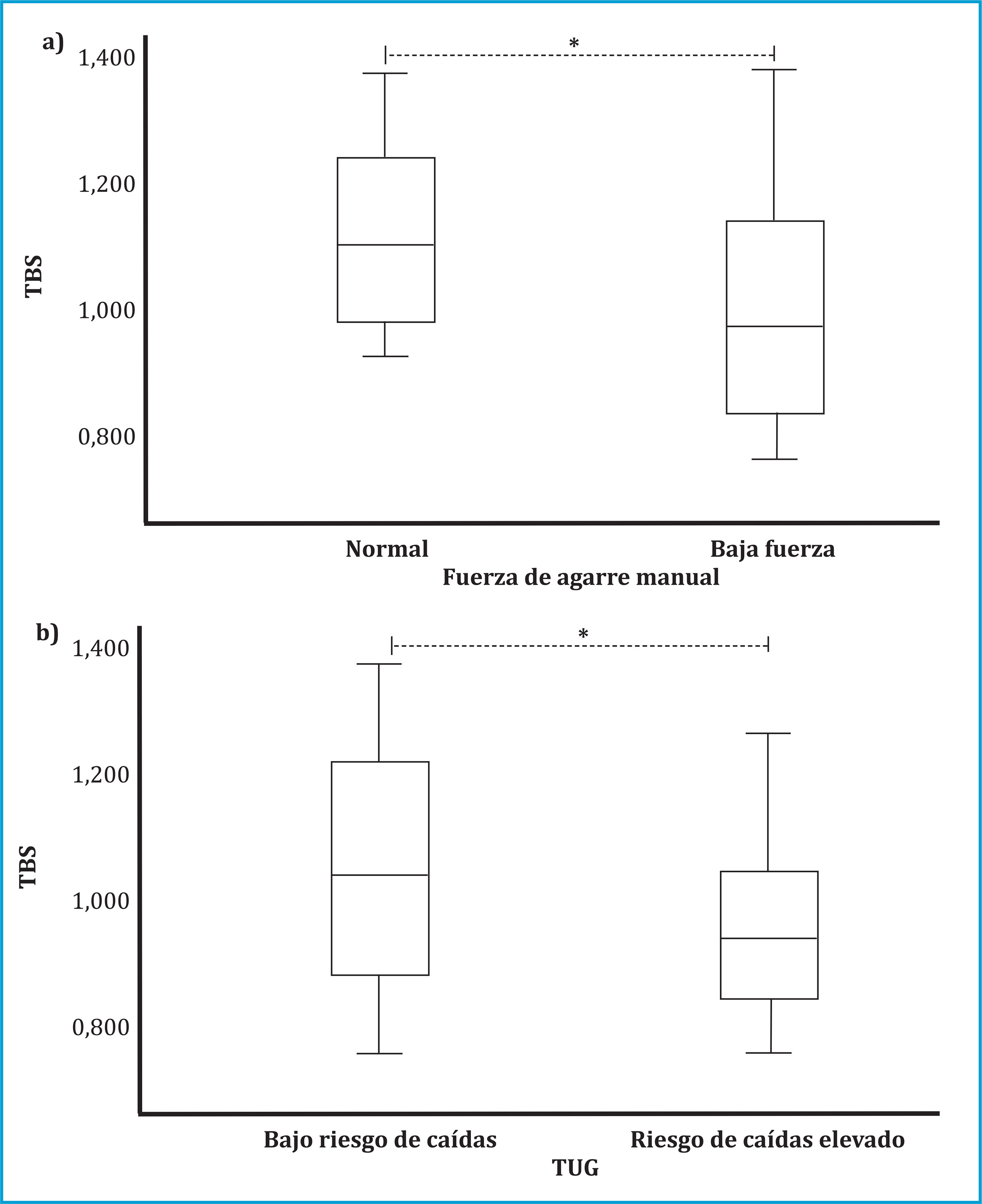
La fuerza de prensión manual (kg/cm2) se midió con un dinamómetro manual hidráulico Jamar®. Valores de fuerza de prensión manual <27 kg (hombres) y <16 kg (mujeres) se definieron como baja fuerza muscular. El riesgo de caídas se evaluó mediante el test Time Up and Go. Una puntuación inferior a 12 segundos se definió como bajo riesgo de caída y superior o igual a 12 segundos, riesgo de caída elevado. TUG: test Time Up and Go; TBS: Trabecular bone score. Se determinaron los valores de p utilizando la prueba t de Student. *Nivel de significación <0,05.
Figura 3. Efecto de la fuerza de la mano y el riesgo de caídas sobre el TBS
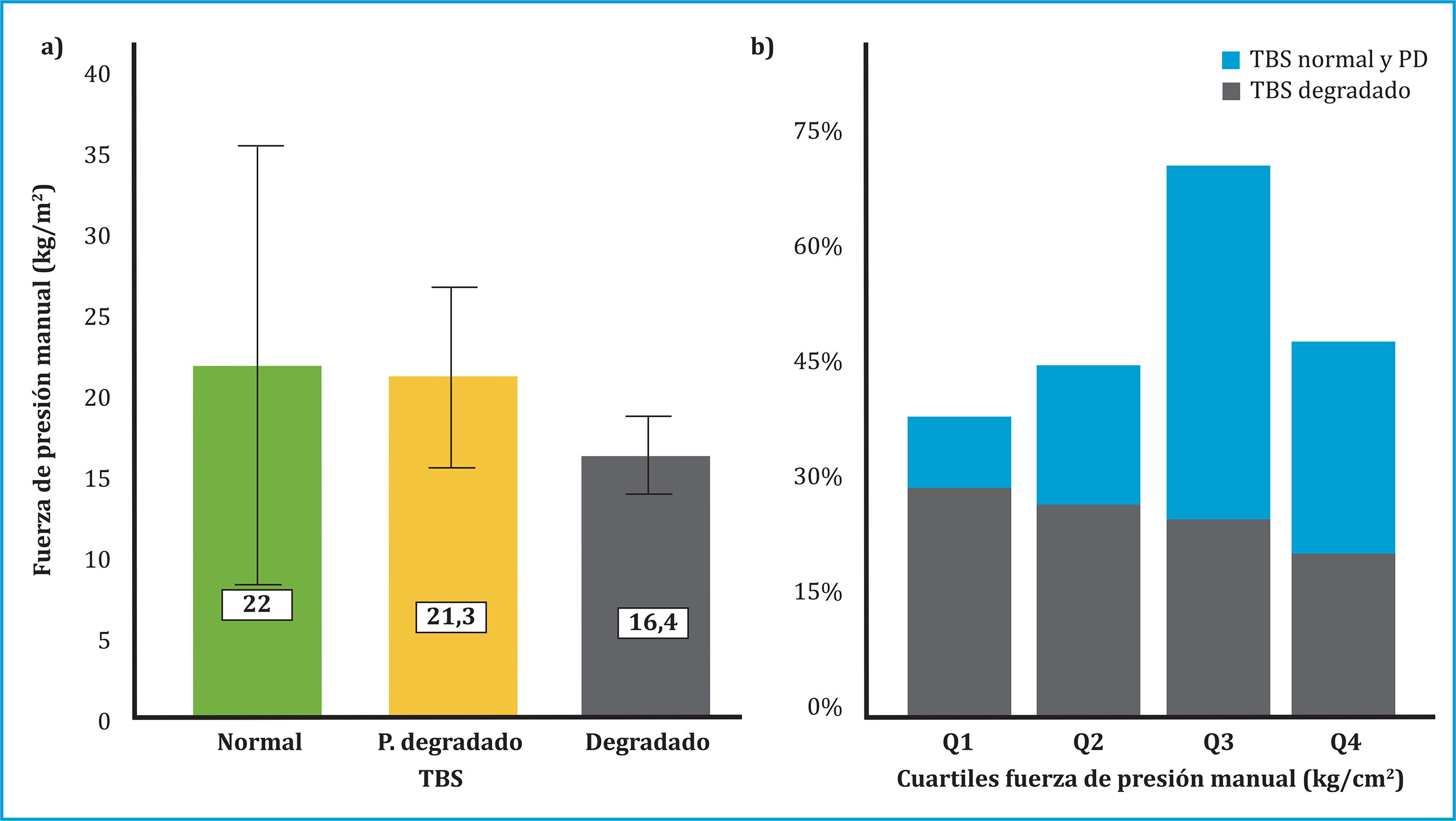
La fuerza de prensión manual (kg/cm2) se midió con un dinamómetro manual hidráulico Jamar®. TBS: Trabecular bone score; PD: parcialmente degradado. La clasificación de la microarquitectura ósea se basó en los siguientes rangos de TBS: TBS ≥1,31 correspondió a microarquitectura normal, TBS entre 1,23 y 1,31 se definió como microarquitectura parcialmente degradada y TBS ≤1,23 como microarquitectura degradada. Q1, primer cuartil, <9,5 kg/cm2; Q2, segundo cuartil, 9,5-19,7 kg/cm2; Q3, tercer cuartil, 19,8-23,5 kg/cm2; Q4, cuarto cuartil >23,5 kg/cm2.
Figura 4. a) Valores medios de fuerza de presión manual según las categorías de TBS. b) Prevalencia de microarquitectura ósea degradada (TBS ≤1,23) según los cuartiles de fuerza de presión manual
Para determinar las variables que influyen en el TBS (variable dependiente) se realizó un análisis de regresión lineal múltiple ajustando por el efecto de la edad, PC, fuerza de prensión manual, niveles de 25(OH) vitamina D y DMO en CL. Nuestros resultados mostraron que el PC (B=-0,491, [-0,013 -/- 0,004], p=0,001) afectan negativamente los valores de TBS mientras que la fuerza de prensión manual (B=0,284, [0,000-0,013], p=0,038) ejerce un efecto positivo sobre la microarquitectura ósea determinada por TBS.
DISCUSIÓN
La pérdida de masa y fuerza muscular, denominada sarcopenia y dinapenia respectivamente, se ha reconocido recientemente como una complicación asociada a la diabetes mellitus3. Mori, et al. observaron que la tasa de prevalencia de dinapenia fue mayor que la sarcopenia en pacientes con DM219. El Grupo de trabajo europeo sobre la sarcopenia en las personas mayores (EWGSOP)15 y el Grupo de Trabajo Asiático de Sarcopenia (AWGS)20 consideran la fuerza de prensión de la mano como un método simple que predice de forma fiable el deterioro de la fuerza muscular. La prevalencia de sarcopenia en la DM2 varía entre el 5% y el 50% en los diferentes estudios realizados hasta la fecha21. En un meta-análisis publicado recientemente, se observó que los pacientes con DM2 tenían menor fuerza muscular que los pacientes no diabéticos, a pesar de no haber diferencia en la masa muscular22, en nuestro estudio la prevalencia de baja fuerza muscular fue del 83,3%.
Al analizar la prevalencia de baja fuerza de prensión de la mano, observamos una disminución progresiva con el aumento de la edad. No es sorprendente que el aumento de la edad represente un factor de riesgo de baja fuerza muscular en la DM2, así como en la población general, debido a la disminución relacionada con la edad en la masa y fuerza muscular. No obstante, sería interesante conocer si el factor edad podría ser más determinante para el desarrollo de dinapenia y sarcopenia en individuos con DM2 en comparación con aquellos no diabéticos. Al respecto, Tamura, et al. no mostraron diferencias en el riesgo de sarcopenia según las categorías de edad entre los individuos con y sin DM223. Del mismo modo, Çeliker, et al. y Trierweiler, et al. observaron una mayor prevalencia de sarcopenia en los individuos con DM2 en comparación con los que no tenían DM2, mientras que no se observaron diferencias significativas en términos de edad24,25.
En estudios previos, un IMC demasiado bajo o demasiado alto y un porcentaje alto de grasa corporal se han asociado con una mayor mortalidad26. Según los resultados del análisis de composición corporal, la prevalencia de baja fuerza muscular fue mayor en el primer y cuarto cuartil de IMC. Sin embargo, la evaluación de la masa grasa relativa, mostró una disminución progresiva significativa de la fuerza de prensión manual con el aumento de los cuartiles de RFM. Este hallazgo sugiere que los pacientes diabéticos con un alto porcentaje de grasa corporal y un IMC bajo o demasiado alto tienen un mayor riesgo de desarrollar dinapenia. Además, nuestros resultados mostraron una asociación inversa entre PC y TBS sugiriendo un papel predictor de PC independientemente de la edad, fuerza de prensión manual, niveles de 25(OH) vitamina D y DMO en CL. Estos resultados, apoyan el papel de la masa grasa central en la microarquitectura ósea determinada por TBS27,28. Por lo tanto, la evaluación de la obesidad en pacientes diabéticos no debe centrarse únicamente en el IMC; sino que debe considerarse en combinación con la masa grasa corporal.
Aunque la asociación entre sarcopenia, riesgo de caídas y riesgo de fracturas se ha estudiado en la población general, existen pocos estudios que hayan examinado el impacto clínico de la sarcopenia y la fragilidad ósea en pacientes con DM2. Nuestro estudio analizó la relación entre la fuerza de la mano y la fragilidad ósea medida por la DMO determinada por DXA y la microarquitectura ósea estimada por TBS en pacientes con DM2.
Existen resultados inconsistentes respecto a la relación entre la fuerza de prensión manual y la DMO. El grupo de Aydin concluyó que la fuerza de prensión manual no era un buen predictor de DMO en varones29 mientras que el grupo de Pereira si observó una correlación significativa entre la fuerza de prensión manual y la DMO30. En nuestro estudio no observamos asociación entre la fuerza de prensión manual y la DMO.
La mayoría de estudios que han evaluado la relación entre la sarcopenia y la calidad ósea, han utilizado datos derivados de técnicas invasivas como la tomografia computarizada cuantitativa (QCT), presentando una limitación en la práctica clínica habitual por su baja disponibilidad31,32. TBS es una técnica no invasiva para evaluar la calidad ósea que puede predecir el riesgo de fractura de manera independiente y complementaria a la DMO en los pacientes con DM210. En nuestro estudio, observamos una relación positiva entre la fuerza de prensión manual y los valores de TBS. Los sujetos con menor fuerza de prensión manual tenían valores más bajos de TBS y se observó una tendencia decreciente de la prevalencia de TBS degradado (TBS <1,23) con el aumento de los cuartiles de fuerza de prensión manual. En concordancia, nuestros resultados mostraron una asociación positiva entre TBS y fuerza de prensión manual independiente del efecto de la edad, PC, niveles de 25(OH) vitamina D y DMO en CL en el análisis multivariable. Estos hallazgos sugieren que la medición de la fuerza de prensión manual podría ser una estrategia de fácil implementación para estimar el estado de la microarquitectura ósea en la práctica clínica.
Nuestros resultados están en concordancia con el estudio realizado por el grupo de Hanmei, que mostró que el TBS se correlacionó positivamente con la fuerza de prensión de la mano en las mujeres33 y con el estudio STRAMBO, que mostró que el tamaño del hueso y no la DMO, parecía correlacionarse principalmente con la masa muscular, mientras que la microarquitectura ósea se correlacionaba principalmente con la fuerza muscular32. Nuestros resultados confirman datos previos y sugieren que la fuerza muscular tiene mayor influencia sobre la calidad ósea que sobre la DMO y puede reflejar un deterioro de la microarquitectura ósea de forma más fiable que del estado óseo medido por DMO. Por tanto, la baja fuerza muscular podría ser un buen predictor de la fragilidad ósea medida por TBS en los pacientes con DM2.
Tanto la sarcopenia como la dinapenia incrementan el riesgo de caídas en los pacientes con DM219. El test TUG evalúa el nivel de movilidad y el riesgo de caídas y es un indicador de sarcopenia severa15. El hecho de que los valores de TBS y la fuerza de la mano sean menores en los pacientes con mayor riesgo de caídas sugiere que el mayor riesgo de fracturas por fragilidad en estos pacientes podría estar relacionado con la coexistencia de sarcopenia severa y deterioro de la microarquitectura ósea trabecular a pesar de una DMO aumentada.
La etiología del efecto de la DM2 en el sistema músculoesquelético es multifactorial y no del todo bien conocida34. Estudios previos sugieren que una mayor duración de la diabetes y una hiperglucemia mantenida afecta a la debilidad muscular en pacientes con DM235. En nuestro estudio, los pacientes con elevado riesgo de caídas tenían una mayor evolución de la DM2 que los que tenían bajo riesgo de caídas. Sin embargo, no observamos diferencias significativas en el tiempo de evolución de la enfermedad entre los sujetos con fuerza muscular normal o disminuida. En algunos estudios han reportado una mayor pre valencia de sarcopenia asociada a una mayor duración de la diabetes36; sin embargo, otros estudios no han encontrado relación entre la prevalencia de sarcopenia y el tiempo de evolución de la DM222.
Un estudio reciente ha demostrado que la hiperglucemia en sí misma reduce la masa muscular a través del aumento de KLF15 en los miocitos37. Por otra parte, Kalyani, et al. observaron que la HbA1c se asocia con la debilidad de la fuerza muscular independiente de la masa muscular35. En concordancia, nuestros resultados mostraron que los pacientes con adecuado control metabólico (HbA1c <7,5%) presentaban mayor fuerza muscular de la mano, aunque no se observaron diferencias significativas entre ambos grupos probablemente por el limitado número de pacientes incluidos en el estudio. No obstante, existen estudios previos que no han encontrado relación entre el control metabólico y la fuerza muscular38, por tanto la prevención del desarrollo de dinapenia y sarcopenia no se puede centrar exclusivamente en el control metabólico, especialmente en los pacientes de edad avanzada, en los que hay que tener en cuenta otros factores como la presencia de complicaciones micro y macrovasculares, la composición corporal, el estado nutricional y la esperanza de vida, que condicionan la morbimortalidad.
Nuestro estudio tiene ciertas limitaciones. Primero, el diseño transversal del estudio permitió investigar la asociación entre las variables de estudio, pero no la causalidad. En segundo lugar, el tamaño de la muestra fue relativamente pequeño; sin embargo, nuestros participantes son representativos de los pacientes con DM2 en la práctica clínica diaria. En tercer lugar, no evaluamos la masa muscular que es un factor determinante de la sarcopenia, aunque cuando los componentes de la sarcopenia se han examinado individualmente en otros estudios, sólo la fuerza muscular baja se asoció con la incidencia recurrente de caídas, independiente de la masa muscular o la velocidad de la marcha39.
A pesar de estas limitaciones, hasta donde sabemos, el presente estudio es el primero en investigar la asociación entre la fuerza de prensión manual y el TBS en pacientes con DM2.
En conclusión, nuestro estudio sugiere que los pacientes con DM2 tienen una elevada prevalencia de disminución de fuerza muscular relacionada con la edad. Los resultados del análisis de composición corporal destacan la importancia de evaluar la masa grasa en lugar de evaluar el IMC en los pacientes diabéticos con riesgo de sarcopenia. Un IMC bajo o demasiado alto y un porcentaje alto de grasa corporal tienden a aumentar el riesgo de desarrollar dinapenia. El TBS en los pacientes con DM2 suele ser bajo a pesar de una DMO aumentada. La fuerza muscular se asoció significativamente con un deterioro de la microarquitectura ósea. La disminución de la fuerza de prensión manual y el test TUG pueden constituir una herramienta de fácil aplicación en la práctica clínica habitual para identificar a los pacientes con DM2 con riesgo de caídas y fracturas osteoporóticas.











 texto en
texto en 


