Introducción
El principal reservorio de calcio del organismo es el hueso, donde se almacena alrededor del 99% del calcio total en forma de hidroxiapatita. Así, el contenido de calcio presente en los fluidos extracelulares sólo representa una pequeña fracción del calcio total.
En individuos sanos, la concentración de calcio en sangre varía entre 8,6 y 10,4 mg/dl, estando alrededor del 40% unido a proteínas y el 6% a sales de fosfato, citrato o bicarbonato. La actividad metabólica del calcio se atribuye al calcio iónico, que representa el 54% del calcio total en sangre, y está regulado de forma muy precisa de manera que los valores plasmáticos se mantienen en un rango de entre 4,4 y 5,4 mg/dl (1,1-1,35 mM)1.
Con respecto a la salud ósea, los beneficios de una dieta rica en calcio sobre la homeostasis del hueso están siendo discutidos2 . Así, por ejemplo, el suplemento de calcio ha sido comúnmente recomendado para el mantenimiento de la salud ósea y la prevención de la osteoporosis; sin embargo, estudios de metaanálisis han mostrado que no siempre este suplemento de calcio tiene un efecto positivo. En una población general de adultos, se ha observado que ni el suplemento con vitamina D, calcio ni la combinación de ambos se asocian con una disminución del riesgo de fractura3, aumentando con ello la controversia acerca de la efectividad de estos suplementos. En el mismo sentido, en un estudio longitudinal prospectivo realizado en Suecia en el que se estudió la incidencia de fracturas y osteoporosis en mujeres adultas durante 19 años a las que se estimó la ingesta de calcio mediante cuestionario concluyó que una mayor ingesta del mismo no se asociada con una reducción del riesgo de fractura u osteoporosis4.
En modelos animales, la mayoría de los estudios sobre los efectos óseos asociados al calcio están desarrollados en modelos en los que se reducen los niveles de vitamina D, bien a través de dietas deficientes en vitamina D o bien en animales knockout para el receptor de vitamina D (VDR). En ratas wistar macho alimentadas con una dieta deficiente en vitamina D desde estadios prenatales, se ha demostrado que una dieta deficiente en vitamina D disminuye la densidad mineral ósea, la longitud del fémur y provoca alteraciones histológicas como acumulación de osteoide, aumento de actividad osteoblástica o disminución de actividad osteoclástica. Cuando estas ratas con una dieta deficiente en vitamina D fueron alimentadas con un suplemento de calcio en la dieta, se recuperó parcialmente la densidad mineral ósea, y la longitud de la tibia, disminuyó el volumen de osteoide y la actividad osteoblástica, mientras que aumentó el número de osteoclastos, lo que produjo una disminución del volumen óseo trabecular5. En otro estudio similar, animales alimentados con dieta deficiente en vitamina D disminuyeron el contenido de calcio en el hueso, que fue reestablecido con la infusión de calcio y fósforo indicando que los efectos de la vitamina D sobre el hueso deben ser principalmente indirectos y derivados de su función sobre la regulación del metabolismo mineral6.
Por otro lado, en ratones knockout para el receptor de vitamina D y para 25-hidroxivitamina D 1-α-hidroxilasa, los cuales son hipocalcémicos, se observó un incremento de la formación ósea, del volumen óseo y del número de osteoblastos, que se asoció con el consecuente incremento de los niveles de hormona paratiroidea (PTH) aunque los animales fueran alimentados con una dieta sin lactosa de alto contenido en calcio; sin embargo, el número de osteoclastos no se asoció a los niveles de PTH en estos animales y permaneció similar al de los ratones con fenotipo silvestre y niveles de PTH normales. Cuando los animales se alimentaron con una dieta de rescate (2% calcio, 1,25% fósforo, 20% lactosa, y 2,2 unidades/g de vitamina D) se consiguió prevenir la hipocalcemia, el hiperparatiroidismo y, consecuentemente, el número de osteoblastos, la tasa de aposición mineral y el volumen óseo fueron reducidos7.
En base a estas premisas, el objetivo de este estudio fue investigar el efecto de una dieta con alto contenido en calcio sobre la histomorfometría ósea en rata, así como sobre la osteogénesis de células UMR-106.
Materiales y métodos
Los procedimientos experimentales llevados a cabo en este estudio fueron aprobados por el Comité de Ética de la Investigación y Bienestar Animal de IMIBIC/Universidad de Córdoba de acuerdo a lo dispuesto en la Directiva 2010/63/EU del Parlamento Europeo y al Consejo de Europa del 22 de septiembre de 2010, las guías institucionales para el cuidado y el uso de animales de laboratorio y la Declaración de Helsinki, autorización de protocolo número 14/03/2018/026.
Diseño experimental
Se usaron ratas wistar macho con aproximadamente 3 meses de edad para evitar interacciones relacionadas con el sexo ya que en rata existe un dimorfismo sexual en el fenotipo óseo que parece ser multifactorial8. Los animales fueron alimentados con dietas de contenido normal (0,6% Ca; n=6) ó alto contenido de calcio (1,2% Ca; n=9) y ambas dietas tuvieron un contenido de fósforo de 0,2%. Tras 20 días, las ratas fueron introducidas en jaulas metabólicas para recoger la orina de 24 horas. Al día siguiente los animales fueron sacrificados mediante punción de la aorta abdominal y exsanguinados bajo anestesia general con sevoflurano. La sangre fue procesada para separar el plasma y el fémur derecho se puso en etanol 70% para su posterior inclusión en metilmetacrilato.
Bioquímica en sangre y orina
Las muestras de sangre fueron recogidas en tubos heparinizados (BD Vacutainer, Franklin Lakes, NJ, EEUU) y centrifugadas a 2000 x g, durante 10 minutos a 4ºC para separar el plasma que fue guardado a -80ºC hasta la realización de las determinaciones bioquímicas. Las muestras de orina de 24h se centrifugaron a 2000 x g, durante 10 minutos a 4ºC para descartar el sedimento y las alícuotas se guardaron a -20ºC hasta su análisis. Para la determinación del contenido de fósforo, calcio total y creatinina se usaron kits colorimétricos (BioSystems SA, Barcelona, España). La fracción de excreción de fósforo, expresada como porcentaje, fue calculada según la fórmula: (fósforo orina x creatinina plasma x 100)/(fósforo plasma x creatinina orina). La cuantificación de calcio iónico se realizó en plasma justo después del sacrificio y antes de su congelación en un analizador de iones (Spotlyte Ca2+/pH (Menarini Diagnostics, Barcelona, España). Se determinaron mediante ELISA los contenidos circulantes de PTH bioactiva (Immutopics, San Clemente, CA, EEUU) y FGF23 intacto (Kainos Laboratories, Tokio, Japón). La concentración de calcitriol se midió mediante radioinmunoensayo (Immunodiagnosticsystems, Boldon, UK). Todos los kits se usaron de acuerdo a las indicaciones del fabricante.
Inclusión en metilmetacrilato y análisis de histomorfometría ósea
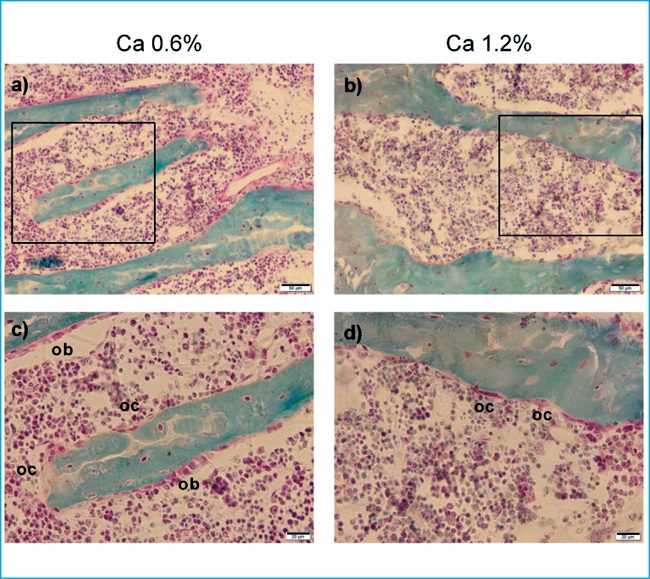
Tras el sacrificio, se extrajo el fémur derecho de cada animal y se incluyó en etanol al 70%. Posteriormente, los fémures fueron deshidratados en alcohol, aclarados con xileno, e incrustados en 75% de metacrilato de metilo, 25% de ftalato de dibutilo y peróxido de benzoilo al 2,5% p/v. El análisis de histomorfometría fue realizado en secciones de 5 µm sin decalcificar que fueron teñidas con el método de Villanueva AR de tricrómico de Goldner modificado9. Brevemente, los cortes de hueso se fijaron con etanol al 50% con presión durante 24h a 37ºC, luego se rehidrataron y tiñeron con hematoxilina-cloruro férrico 1:1, posteriormente se aclararon con ácido clorhídrico al 1% y se azulearon con carbonato de litio saturado. Después de lavar con agua, los cortes se tiñeron con colorante tricrómico Goldner durante 20 minutos y luego se aclararon con ácido acético 1%. Posteriormente, las muestras se tiñeron con una solución alcohólica de azafrán 1% p/v durante 5 minutos, se deshidrataron con etanol y se montaron. El tejido calcificado se tiñó de verde y las áreas teñidas de rojo se consideraron osteoide. Los parámetros histomorfométricos óseos se evaluaron a 200x en un microscopio óptico Leica DM4000B (Leica Microsystems Wetzlar, Germany) con una cámara Olympus DP72 (Olympus, Tokyo, Japan) utilizando el Software OsteoMeasure (OsteoMetrics, Decatur, IL, EEUU). El análisis se realizó en la parte distal del hueso dentro de la esponjosa secundaria (a 1 mm separado de la placa de crecimiento y a una distancia de 0,25 mm aproximadamente desde el hueso endocortical). Los parámetros de histomorfometría ósea se calcularon según las recomendaciones de la American Society for Bone and Mineral Research(ASBMR)10.
Experimentos in vitro
El efecto de elevadas concentraciones de calcio sobre la osteogénesis de células UMR-106 fue también evaluado. Las células se cultivaron con DMEM (Sigma-Aldrich) suplementado con FBS 10% (Lonza), ultraglutamina 2 mM (Lonza), piruvato sódico 1 mM (Lonza), HEPES 20 mM (Sigma-Aldrich), penicilina 100U/ml y estreptomicina 100 mg/ml. Una vez que las células alcanzaron un 90% aproximadamente de confluencia el medio de cultivo fue cambiado a DMEM libre de calcio (Gibco, Grand Island, NY) suplementado como se indica anteriormente y además se utilizó una solución de cloruro cálcico 0,1 M (Sigma-Aldrich) para incrementar la concentración de calcio en el medio de cultivo hasta 1,25 mM (concentración normal en sangre) y 1,8 mM (equivalente a una hipercalcemia). Después de 48h, las células fueron lisadas y procesadas para aislamiento de ARN total. Se realizaron 3 experimentos independientes con 4 réplicas por cada grupo.
Aislamiento de ARN y RT-PCR
El ARN total fue extraído con Trizol (Sigma-Aldrich) y la concentración final se cuantificó mediante espectrofotometría (ND-1000, Nanodrop Technologies). Las muestras de ARN se trataron posteriormente con DNAsa (Sigma-Aldrich) y la PCR a tiempo real se realizó con 50 ng de ARN tratado con DNAsa con el kit SensiFAST SYBR No-ROX One-Step (Bioline). Los cebadores usados fueron: Runx2 (Sentido 5’CGG-GAA-TGA-TGA-GAA-CTA-CTC3’ Antisentido 5’CGG-TCA-GAG-AAC-AAA-CTA-GGT3’), Osterix (Sentido 5’GTA-CGG-CAA-GGC-TTC-GCA-TCT-GA3’ Antisentido 5’TCA-AGT-GGT-CGC-TTC-GGG-TAA-AG3’), Osteocalcina (Sentido 5’TCT-GAG-TCT-GAC-AAA-GCC-TTC-ATG3’ Antisentido 5’TGG-GTA-GGG-GGC-T GG-GGC-TCC3’) y gliceraldehído-3-fosfato deshidrogenasa (GAPDH) (Sentido 5’AGG-GCT-GCC-TTC-TCT-TGT-GAC3’ Antisentido 5’TGG-GTA-GAA-TCA-TAC-TGG-AAC-ATG-TAG3’). La amplificación de la RT-PCR se llevó a cabo en un Lighcycler 480 (Roche Molecular Biochemicals). La expresión de los genes diana fue normalizada mediante el método 2(–ΔΔCt) usando GAPDH como constitutivo.
Análisis estadístico
Los valores se muestran como media ± error estándar. Las diferencias entre los dos grupos fueron estudiadas mediante el test no paramétrico U de Mann-Whitney. Los grupos fueron considerados significativamente diferentes para una p<0,05. Los análisis estadísticos y la edición de las gráficas se realizaron con el programa GraphPad (GraphPad Software, La Jolla, CA, EEUU).
Resultados
Bioquímica en sangre y orina
El grupo de animales alimentado con una dieta rica en calcio mostró niveles plasmáticos de calcio y fósforo similares a los del grupo alimentado con calcio normal (figura 1 a y b respectivamente). Sin embargo, la dieta con alto contenido de calcio produjo tanto una disminución de la concentración plasmática de PTH intacta (figura 1 c) como de calcitriol (figura 1 d). Los niveles de FGF23 intacto permanecieron similares en ambos grupos (figura 1 e). Como se esperaba, el análisis de orina de 24h mostró un incremento de la calciuria y una disminución de la fosfaturia en las ratas alimentadas con dieta rica en calcio (figura 1 f y g respectivamente).
Histomorfometría ósea
El volumen de hueso trabecular y el volumen de osteoide de las ratas alimentadas con dieta rica en calcio permanecieron similares respecto al de las ratas alimentadas con una dieta normal de calcio (figura 2 a y b), mientras que se observó una reducción significativa de la superficie de osteoide (figura 2 c) en el grupo de animales alimentados con dieta rica en calcio, que fue consistente con una disminución de la superficie de hueso cubierta por osteoblastos (figura 2 d). Tanto la superficie de re-sorción como la superficie de hueso cubierta por osteoclastos fueron similares en ambos grupos (figura 2 e y f respectivamente). A nivel de micro-arquitectura trabecular no se observaron diferencias respecto al grosor trabecular, separación trabecular y número de trabéculas (figura 2 g, h, i).

Figura 2. Análisis de histomorfometría ósea. Las barras representan media ± error estándar. U de Mann-Whitney test. * p<0,01 vs 0,6% Ca
Efecto del calcio sobre la osteogénesis de UMR-106
Para estudiar in vitro el efecto directo del calcio sobre los osteoblastos utilizamos la línea de células osteoblásticas de rata UMR-106. El medio de cultivo de estas células fue suplementado con calcio hasta alcanzar una concentración de 1,8 mM y se comparó con células cultivadas con medios de cultivo con contenido normal de calcio (1,25 mM). Tras 48h de tratamiento, se observó que los altos niveles de calcio no modificaron la expresión de genes osteogénicos como Runx2, Osterix u Osteocalcina (figura 4 a, b y c respectivamente).

Figura 4. Expresión de genes osteogénicos en células UMR-106 tratadas con altos niveles de calcio. Se adicionó cloruro cálcico (0,1 M) hasta alcanzar niveles correspondientes a una situación de hipercalcemia (1,8 mM) y se com-pararon con niveles normales (1,25 mM). La exposición a los distintos niveles de calcio extracelular fue de 48h. Las barras representan media ± error estándar
Discusión
En este estudio la dieta rica en Ca durante 21 días no promovió diferencias significativas en los niveles plasmáticos de Ca ó P a costa de incrementar la calciuria y disminuir la fosfaturia. Esto tuvo una repercusión directa sobre los niveles de PTH y calcitriol en plasma. Este efecto podría ser debido a una hipercalcemia transitoria al inicio del experimento resultando en una posterior disminución de la producción de PTH, hipercalciuria y de la síntesis de calcitriol, ya que parece consistente con una activación del receptor de calcio (CaSR) en las glándulas paratiroides y en el riñón, lo cual se ha descrito ampliamente que resulta en la disminución de PTH y un incremento de la excreción urinaria de calcio11,12. Los niveles de calcio en plasma, que permanecieron similares en ambos grupos, también podrían deberse a esta excesiva calciuria o a una adaptación del organismo al elevado aporte de calcio en la dieta de manera prolongada. Con respecto al hueso, los animales alimentados con dieta de alto contenido en calcio mostrsaron una reducción de la actividad osteoblástica asociada con la disminución de PTH y una tendencia a disminuir el volumen óseo trabecular.
Es interesante destacar que en animales alimentados con dieta deficiente en vitamina D se produce osteosclerosis a nivel trabecular y la infusión de calcio y fósforo resulta en una disminución de la actividad osteoblástica13. Estas observaciones apoyan nuestros resultados que sugieren que un incremento de la carga de calcio reduce los osteoblastos en la superficie ósea. Además, en nuestro estudio la actividad osteoclástica no mostró diferencias significativas en comparación con el grupo alimentado con dieta de contenido normal en calcio a pesar de la disminución de PTH sugiriendo que otros mecanismos deben estar implicados.
Una limitación de este estudio in vivo es que no se realizó un marcaje con fluorocromos específicos tipo calceína en estos animales por lo que no se pudieron determinar parámetros cinéticos de formación y mineralización.
En este estudio la ingesta de una dieta rica en calcio durante 3 semanas no produjo cambios significativos en varios parametros de histomorfometría ósea (volumen oseo trabecular, volumen de osteoide, separación trabecular y número de trabeculas) a pesar de una disminución significativa de la actividad osteoblástica y una actividad osteoclástica similar.
In vitro, células UMR-106 que fueron tratadas con altos niveles de calcio no mostraron cambios en la expresión génica de Runx2, Osterix y Osteocalcina, lo que sugiere que la disminución de la actividad osteoblástica observada en el hueso no está directamente influenciada por una alta concentración de calcio, sino que podría estar más bien relacionada con la disminución de la concentración de PTH. La línea celular de osteosarcoma de rata UMR-106 es un modelo con fenotipo osteoblástico ampliamente usado en el que la respuesta a calcio extracelular y PTH ha sido bien caracterizada14,15. Previamente, nuestro grupo ha publicado que la activación del CaSR por un calcimimético aumenta la osteogénesis y el remodelado óseo, por lo que, presumiblemente, sus activadores naturales como el calcio iónico y otros deberían tener un efecto similar16. En este estudio previo se examinó el efecto del calcimimético en UMR-106 con una concentración muy baja de calcio (0,5 mM), por lo que el tratamiento con la droga producía una respuesta más significativa. Por lo tanto, en este experimento in vitro con UMR-106 con una concentración de calcio normal (1,25 mM), en la que el CaSR estaría en un alto grado de activación en base a lo descrito en glándulas paratiroides17, un calcio alto (1,8 mM) no debería producir una activación adicional importante y por ello no se observaría un incremento significativo de la expresión de genes osteogénicos. Probablemente 1,8 mM de calcio provoca sólo un ligero incremento en la activación del CaSR con respecto a 1,25 mM de calcio, la cual sólo produce tendencias a incrementar Osterix y Osteocalcina como se observa en este estudio.
En un estudio con voluntarios jóvenes y sanos, se evaluaron los efectos de la administración aguda de 400 mg de calcio oral y después de 10 horas se observó que la concentración de PTH sérica disminuyó, acompañada por un descenso de los niveles séricos de telopéptidos de colágeno tipo I, sin embargo no mostraron datos relativos a la formación de hueso18. Este estudio apoya nuestras observaciones de que el suplemento de calcio en la dieta reduce los niveles de PTH, resultando en cambios a nivel óseo. En este estudio de manera aguda la disminución de PTH produjo un descenso de la actividad osteoclástica que no hemos observado en nuestro estudio con ratas y que probablemente se deba al tratamiento prolongado con dieta rica en calcio. Es importante destacar que la expresión de 25(OH)D-1α-hidroxilasa está directamente regulada por la PTH19, y que por lo tanto un incremento de la ingesta de calcio resultaría en una disminución de la síntesis de calcitriol, lo cual sería consistente con los resultados obtenidos en nuestro estudio.
En conclusión, una dieta rica en calcio podría conducir a una reducción de la actividad osteoblástica debido a una disminución de la producción de PTH que además resultaría en una bajada de la vitamina D activa.











 texto en
texto en