INTRODUCCIÓN
Tras una lesión medular (LM) se produce una marcada pérdida de masa ósea y un aumento del remodelado que conlleva al desarrollo de osteoporosis y fracturas esqueléticas, especialmente bajo el nivel de la lesión1-3. Así, más del 50% de los pacientes con LM completa desarrollan una osteoporosis densitométrica al año de la LM1, que puede alcanzar el 81% de los pacientes tras más de 5 años de la LM4. Sin embargo, a pesar de la elevada incidencia de osteoporosis y fracturas, el abordaje terapéutico de estos pacientes es claramente deficiente, ya que menos del 10-20% de ellos recibe tratamiento antiosteoporótico2,5.
Existen pocos estudios que analicen el efecto del tratamiento antiosteoporótico en la osteoporosis asociada a la LM. En este sentido, el tratamiento con bisfosfonatos, orales o endovenosos, especialmente el zoledronato, ha demostrado disminuir la pérdida de densidad mineral ósea (DMO) en este proceso. Sin embargo, en pacientes con LM reciente, en los que existe una rápida y marcada pérdida de DMO asociada a un incremento del recambio óseo, su eficacia es menor, especialmente a nivel infralesional, en extremidades inferiores6-9, que es donde tienen lugar la mayoría de fracturas por fragilidad en estos pacientes2. En la misma línea, el tratamiento con teriparatida, un fármaco osteoformador, tampoco ha demostrado eficacia en la prevención de la pérdida ósea en este proceso10. Todo ello indica la necesidad de mejorar el abordaje terapéutico de esos pacientes, no sólo en los periodos avanzados de la enfermedad, sino también de forma precoz tras la LM, cuando la magnitud de la pérdida ósea es mayor, con el fin de prevenir las complicaciones asociadas a largo plazo.
El denosumab, un anticuerpo monoclonal dirigido contra el RANK-ligando, es un mediador esencial para la diferenciación y supervivencia del osteoclasto, con un marcado efecto antirresortivo y eficacia demostrada en el tratamiento de la osteoporosis posmenopáusica y del varón11, con un notable efecto positivo en el hueso cortical, como en el fémur proximal o en el antebrazo distal11. Por ello, el uso de denosumab podría estar especialmente indicado en el tratamiento de pacientes con LM y osteoporosis. De hecho, en un modelo animal de ratones con LM se observó un aumento de la expresión de RANKL12, lo que sugería un potencial papel terapéutico de denosumab en esta situación clínica. Asimismo, recientemente un estudio exploratorio que incluía un reducido número de pacientes con LM observó un efecto preventivo del denosumab en la pérdida de masa ósea a los pocos meses de la LM13, y nosotros reportamos de forma preliminar un efecto positivo de este tipo de tratamiento en pacientes con LM y osteoporosis durante un periodo de seguimiento de 12 meses14.
En este estudio se reporta nuestra experiencia en pacientes con LM reciente motora completa tratados con denosumab durante 24 meses.
PACIENTES Y MÉTODOS
Diseño del estudio y selección de pacientes
Este estudio forma parte de un estudio observacional prospectivo con el objetivo principal de analizar el efecto de la LM reciente (<6 meses) en la pérdida de masa ósea y el metabolismo óseo en estos pacientes1. Los pacientes fueron reclutados de forma consecutiva en el Instituto de Neurohabilitación Guttmann, y remitidos posteriormente a la Unidad de Patología Metabólica Ósea del Servicio de Reumatología del Hospital Clínic de Barcelona. Se indicó tratamiento antiosteoporótico en aquellos pacientes que presentaban una OP densitométrica durante el seguimiento. En pacientes con déficit de 25-OH-vitamina D ([25-OHD] <20 ng/ml) se indicaron suplementos de vitamina D. El estudio fue aprobado por el comité ético del Hospital Clínic de Barcelona y del Instituto de Neurorehabilitación Guttmann. Todos los pacientes firmaron el consentimiento informado previo a su inclusión.
En este estudio presentamos los datos sobre el efecto del tratamiento antiosteoporótico con denosumab en la DMO evolución de los marcadores de remodelado óseo (MRO) en individuos con LM que desarrollaron osteoporosis durante el seguimiento y completaron los 24 meses de tratamiento con denosumab. Se incluyeron 13 pacientes.
MÉTODOS
A todos los pacientes se les realizó una valoración clínica, analítica con cuantificación de MRO y una densitometría ósea en el momento basal y a los 12 y 24 meses de seguimiento.
Se recogieron los factores de riesgo de osteoporosis, el índice de masa corporal (IMC) y las características de la lesión incluyendo el nivel de la LM (tetraplejia/paraplejia), la presencia de espasticidad y la severidad de la LM de acuerdo con la escala de AIS15 que clasifica en función de la afectación motora y sensitiva en 5 categorías:
A: LM motora y sensitiva completa; B: LM motora completa y sensitiva parcial; C y D: motora y sensitiva parcial; E: sin lesión motora ni sensitiva. También se recogieron la incidencia de fracturas esqueléticas y los potenciales efectos adversos durante el seguimiento.
Determinaciones analíticas
Las determinaciones analíticas incluyeron: creatinina, calcio y fosfato por métodos automatizados. Se cuantificaron los valores de 25-OHD (Liason DiaSorin) y de los siguientes MRO: fosfatasa alcalina ósea (FA ósea por IDS, Vitro), propéptido aminoterminal del procolágeno tipo I (PINP por Cobas e411, Roche) y telopéptido carboxiterminal del colágeno tipo I (CTX por el método automatizado Cobas e411, Roche).
Densidad mineral ósea
La DMO de columna lumbar y fémur proximal (cuello de fémur y fémur total) fue cuantificada mediante absorciometría dual de rayos X (DXA; Lunar Prodigy, Radiation Corporation Madison, WI) en el momento basal, y a los 12 y 24 meses de seguimiento. Las categorías densitométricas fueron definidas según los criterios de la OMS (DMO normal, osteopenia y osteoporosis)16.
Análisis estadístico
Los resultados se han expresado mediante la media ± desviación estándar de la media (DE). Las diferencias entre medias de las variables continuas se analizaron mediante la T student y las diferencias entre proporciones mediante la Chi-cuadrado. Para la comparación entre variables apareadas (basal y 12 meses; 12 meses y 24 meses; basal y 24 meses) se utilizó la prueba no paramétrica de Wilcoxon. Para valorar asociación entre variables analíticas y densitométricas se utilizó el coeficiente de correlación de Pearson. El valor p<0,05 fue considerado estadísticamente significativo.
RESULTADOS
Las características clínicas de los individuos incluidos en el estudio se muestran en la tabla 1.
Tabla 1 Características clínicas, analíticas y densitométricas de los pacientes con LM en el momento basal
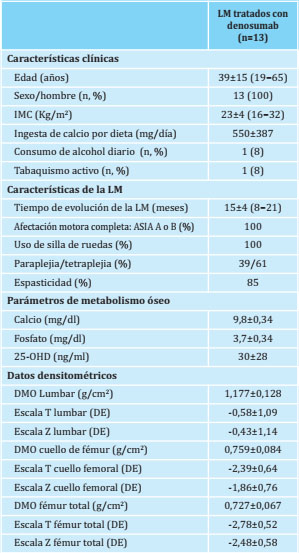
Resultados expresados en media ± DE, n y %.LM: lesión medular; IMC: Índice de masa corporal; 25‐OHD: 25‐OH‐vitamina D; DE: desviación estándar
Se incluyeron 13 varones, con una edad media de 39±15 años a los 15±4 meses de haber presentado la LM. Todos los pacientes tenían una LM severa (ASIA A o B) y el 61% tenía una tetraplejia. La mayoría presentaba una LM de tipo espástico (85%) y todos ellos requerían silla de ruedas para desplazarse. La principal causa de la LM fue por accidente de tráfico (85%). Un paciente presentó una LM por precipitación y otro por accidente deportivo. Todos los pacientes incluidos en el estudio habían desarrollado una osteoporosis durante el periodo inicial de seguimiento (previo al inicio del tratamiento antiosteoporótico con denosumab).
A los 12 meses del inicio del tratamiento con denosumab, se observó un incremento significativo de la DMO en todas las localizaciones analizadas: columna lumbar (+7,47 ± 3,67%, p=0,001) y cuello de fémur (+3,03 ± 3,73, p=0,019) (tabla 2 y figura 1). Asimismo, a los 12 meses se observó un descenso significativo en todos los MRO: FA ósea (-41 ± 22%, p=0,003); PINP (-53 ± 26%, p=0,001) y CTX (-59 ± 29%, p=0,002) (figura 2).
Tabla 2 Evolución de la DMO y de los marcadores de remodelado óseo a los 12 y 24 meses de tratamiento con denosumab
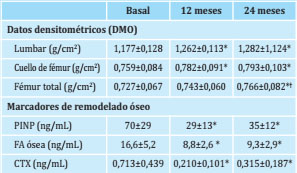
Resultados expresados en media ± DE.* p<0,05 comparado con valores basales.† p<0,05 comparado con los valores a los 12 meses.DMO: densidad mineral ósea; P1NP: propéptido amino-terminal del procolágeno tipo I; FA ósea: fosfatasa alcalina ósea; CTX: telopéptido carboxi-terminal del colágeno tipo I.
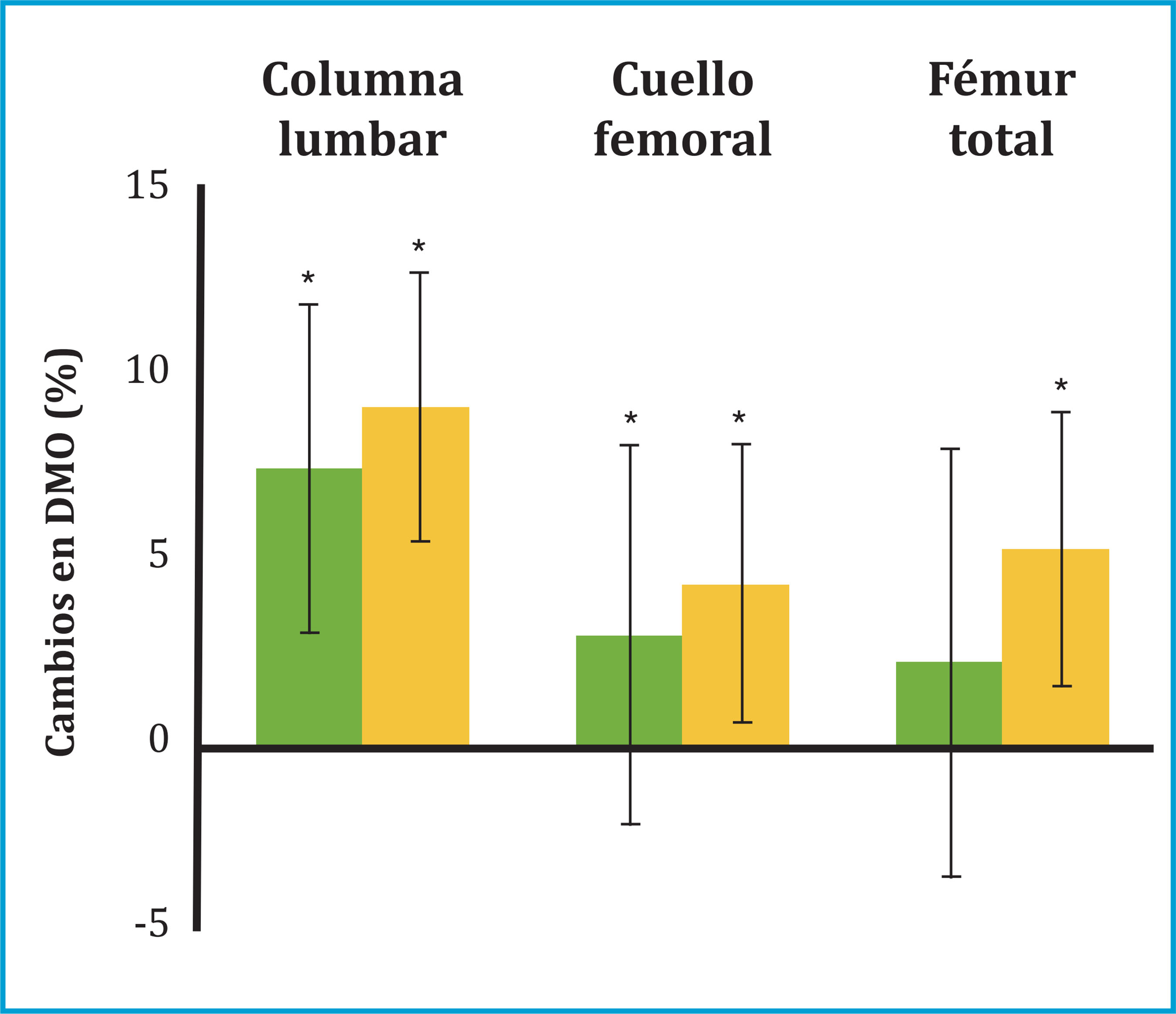
* p<0,05 comparado con valores basales.
Figura 1 Cambio porcentual de la DMO (± desviación estándar) en columna lumbar, fémur total y cuello defémur a los 12 (barras verdes) y 24 meses (barras naranjas) de iniciar el tratamiento con denosumab
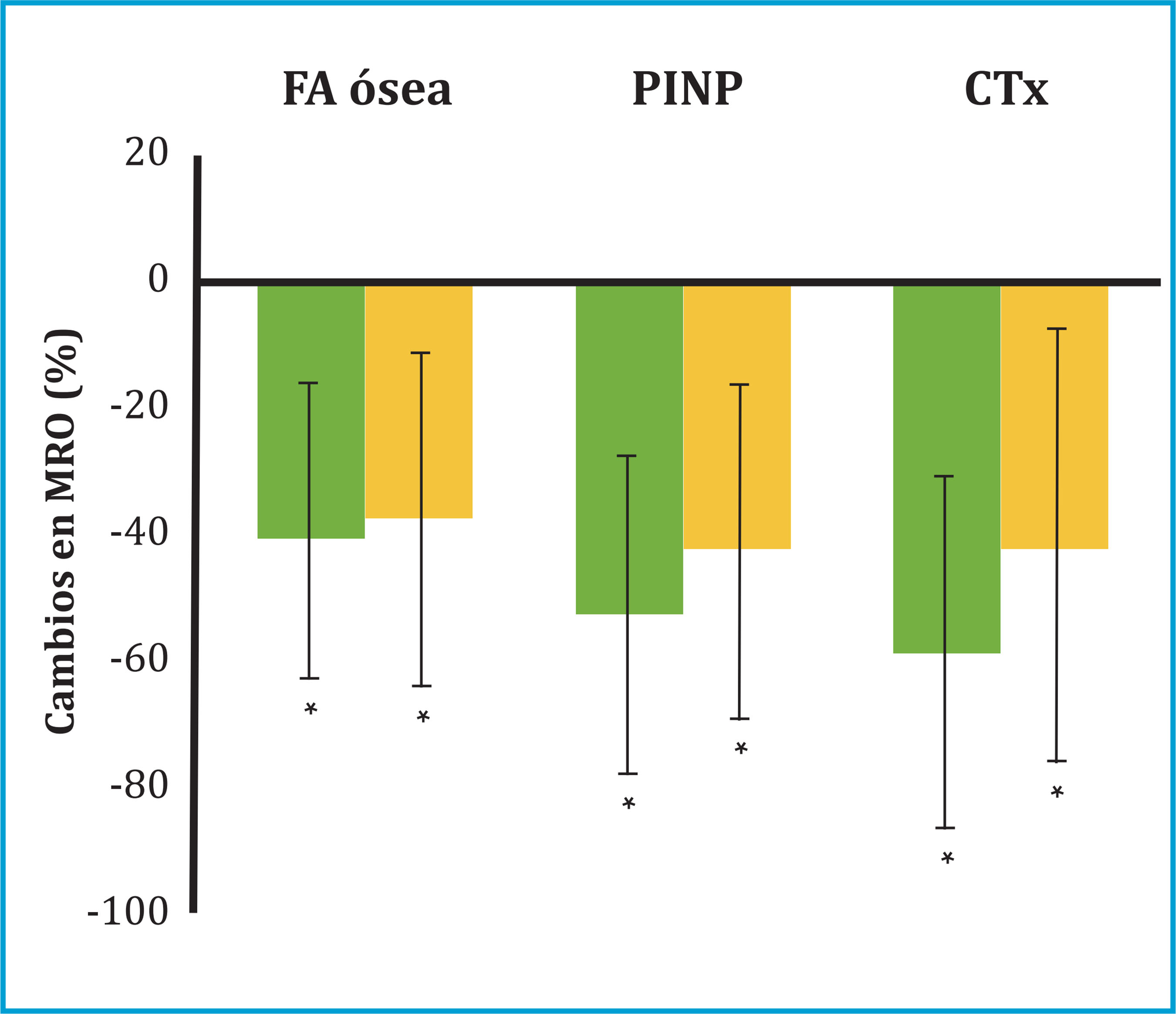
* p<0,05 comparado con valores basales.
Figura 2 Cambio porcentual en los MRO (± desviación estándar) a los 12 (barras verdes) y 24 meses (barras naranjas) de iniciar el tratamiento con denosumab
A los 24 meses de tratamiento se observó un incremento adicional de la DMO en todas las localizaciones. Así, los pacientes alcanzaron un incremento total de DMO a los 24 meses del +9,1 ± 4,4% en columna lumbar (p=0,002); +4,4 ± 5,1% en cuello de fémur (p=0,033) y +5,3 ± 5,7% en fémur total (p=0,011) (tabla 2 y figura 1). Los MRO persistieron disminuidos a los 24 meses con un descenso global de FA ósea (-38 ± 27%, p=0,003); PINP (-43 ± 27%, p=0,001) y CTX (-42 ± 35%, p=0,005) (tabla 2 y figura 2).
La evolución de la DMO no se relacionó con los cambios en los MRO ni con los valores de 25-OHD. Ningún paciente presentó fracturas esqueléticas por fragilidad durante el seguimiento ni efectos adversos asociados al tratamiento.
DISCUSIÓN
Los resultados de este estudio confirman la eficacia del denosumab en el tratamiento de la osteoporosis asociada a la LM de reciente instauración, no solo en la prevención de la pérdida ósea sino en el incremento mantenido de la DMO tras 24 meses de tratamiento. Así, el tratamiento con denosumab durante 24 meses se asoció a un incremento progresivo y significativo de la masa ósea en todas las localizaciones esqueléticas, tanto en columna lumbar como a nivel sublesional, en fémur proximal, y a una disminución mantenida de los MRO durante los 24 meses del tratamiento.
Los resultados presentados indican que el tratamiento con denosumab en pacientes con osteoporosis asociada a LM, no solo previene la pérdida de masa ósea, sino que incluso revierte parcialmente dicha pérdida, observándose un aumento del orden del +7,47% en columna lumbar y del +3% en cuello femoral a los 12 meses de tratamiento. Además, y tal como cabría esperar, los pacientes alcanzaron un mayor incremento de masa ósea a tras el segundo año de tratamiento con denosumab, de hasta el +9% en columna lumbar y +5% en fémur proximal. Mientras que los pacientes no tratados, según la literatura, presentan pérdidas mantenidas de DMO entre el 2% y 21%1,17-20, dependiendo de la localización evaluada (columna y/o fémur proximal o distal), y del tiempo de evolución de la LM, observándose las mayores pérdidas de DMO durante los primeros 1-2 años tras la instauración de la misma19-20.
Aunque se trata de un estudio observacional que incluye un reducido número de pacientes, es importante señalar que el denosumab produjo un aumento de la DMO, no solo en columna lumbar, sino también a nivel sublesional, en cuello de fémur y fémur total, y que fue del orden del 9,1% en columna lumbar, 4,4% en cuello de fémur y 5,3% en fémur total tras dos años de tratamiento, siendo hasta la fecha el único tratamiento antiosteoporótico que se ha asociado a un aumento de la DMO en pacientes con OP asociada a una LM reciente. Nuestros pacientes tenían una LM motora completa con un tiempo medio de instauración de 15 meses, que suele coincidir con el periodo de mayor pérdida ósea3,19,20, en el que, con excepción del denosumab13, no parece existir un tratamiento antiosteoporótico eficaz, particularmente para prevenir la pérdida infralesional en extremidades inferiores. En este sentido, el tratamiento con fármacos antirresortivos, como los bisfosfonatos orales y/o endovenosos (incluyendo alendronato, pamidronato o zoledronato), u osteoformadores, como la teriparatida, tan solo han demostrado atenuar la pérdida de masa ósea en las extremidades inferiores tras una LM reciente6-10,21,22. Sin embargo, en pacientes con LM de larga evolución, en los que la magnitud de pérdida ósea y del recambio óseo han disminuido, los bisfosfonatos parecen tener un efecto preventivo6,7. Si bien, se ha indicado la necesidad de realizar nuevos estudios que incluyan un mayor número de pacientes con mayor tiempo de seguimiento que evalúen el tratamiento de estos pacientes23.
Asimismo, el tratamiento con denosumab se asoció con una disminución de los valores de todos los MRO analizados en este estudio (FA ósea, PINP y CTX), con un descenso del orden del ~40% tras 24 meses de tratamiento, un hallazgo que no hemos observado en pacientes con LM con similar tiempo de evolución que no realizaron dicho tratamiento, en los que persiste un aumento de los MRO24. Esta disminución en los MRO fue de magnitud similar a la reportada en el tratamiento de la osteoporosis posmenopáusica y del varón con este tipo de terapia11,25.
Por otro lado, si bien se trata de un estudio observacional que incluye un reducido número de pacientes, no se observaron efectos secundarios relacionados con el tratamiento con denosumab ni el desarrollo de nuevas fracturas esqueléticas durante los 24 meses de seguimiento.
Existen pocos estudios que evalúen el efecto del tratamiento antiosteoporótico a medio plazo en individuos con LM. La mayoría de estudios publicados hasta la fecha incluyen solo 6-24 meses de tratamiento con teriparatida, bisfosfonatos o denosumab6-10,13-14,18, 21-22. Este es el primer estudio observacional que valora el efecto del tratamiento antiresortivo con denosumab durante 2 años en individuos con OP asociada a una LM.
Si bien, el número reducido de pacientes y la ausencia de un grupo control constituyen limitaciones del estudio, es importante resaltar que se trata de una cohorte de pacientes homogénea, que incluye varones con LM completa traumática de reciente instauración con seguimiento semestral, y en la que todos los pacientes experimentaron una marcada y rápida pérdida de DMO infralesional tras la LM1. Por ello, a pesar de las características del estudio, consideramos que estos resultados aportan información útil en el manejo de la osteoporosis asociada a esta entidad.
En conclusión, los pacientes con OP asociada a una LM de instauración reciente tratados con denosumab durante 24 meses presentan un incremento significativo de la DMO a nivel lumbar y femoral. Por ello, denosumab podría ser una opción terapéutica prometedora en esta situación clínica. Son necesarios estudios que incluyan un mayor número de pacientes y con mayor tiempo de seguimiento que analicen el efecto a largo plazo de este tratamiento en esta entidad.











 texto en
texto en 


