INTRODUCCIÓN
El hueso es un tejido dinámico que se remodela constantemente en respuesta a una gran variedad de estímulos, entre los que destacan hormonas, factores de crecimiento y carga mecánica (1). El control preciso y coordinado de la remodelación ósea requiere de la interacción y comunicación entre osteoblastos (células formadoras de hueso), osteocitos (principales células mecanosensoras del hueso) y osteoclastos (células encargadas de la resorción ósea); y tiene lugar, entre otros mecanismos, gracias a la formación de las uniones comunicantes (UC) entre dichas células óseas (2).
Los osteocitos son capaces de detectar los estímulos mecánicos debido a que presentan diferentes estructuras mecanosensoras: integrinas, UC, hemicanales de conexina 43 (Cx43), cilio primario y/o receptores acoplados a proteínas G (GPCR), como PTH1R (3). Posteriormente, estas células transducen los estímulos mecánicos en respuestas biológicas, que desencadenan la activación de diferentes vías de señalización, induciendo cambios en la expresión génica y en el metabolismo celular. Esto provoca la secreción de factores capaces de regular la proliferación y la viabilidad de las células efectoras óseas (osteoblastos y osteoclastos). Debido a la complejidad del entorno extracelular del hueso es muy probable que los diferentes mecanosensores interactúen entre sí, integrando las múltiples señales extracelulares en una señal cohesiva (4).
La comunicación celular juega un papel importante en el tejido óseo, al encontrarse embebidos en el interior de una matriz mineralizada (5). Las conexinas (Cx) son unas proteínas que constituyen algunos de los canales esenciales para que pueda tener lugar la comunicación entre las células óseas.
Los osteocitos también son capaces de promover la formación ósea, gracias a las acciones endocrinas de la PTH y su análogo local en el hueso, la PTHrP, a través de la activación de su receptor común, PTH1R (6). PTH1R es un GPCR que puede desencadenar varias vías de señalización intracelular en los huesos (7).
El cilio primario es una estructura mecanosensora capaz de crear un microdominio distinto del citoplasma celular, que permite la localización y concentración específica de receptores como GPCR, canales iónicos y proteínas efectoras, mejorando así la cinética de las vías de señalización (8).
Diversos estudios han demostrado que defectos en la función o estructura sensorial del cilio primario están asociados con diferentes enfermedades, denominadas generalmente como ciliopatías (9). Asimismo, cuando se interrumpe la formación de los cilios primarios o su longitud disminuye, las células presentan una mecanosensibilidad alterada y una respuesta disminuida a la estimulación mecánica (10).
Las integrinas son complejos de proteínas que permiten que la célula interaccione con el medio extracelular (11). Investigaciones anteriores han constatado que en las células MLO-Y4 las integrinas β1 y α2 están implicadas en la activación de quinasas reguladas por señales extracelulares (ERK 1/2), inducida por estímulos mecánicos, lo que desemboca en la activación de vías de señalización que modulan la adhesión de los osteocitos a la matriz mineralizada e inhiben la respuesta apoptótica de estas células (12).
En el presente estudio hipotetizamos la posible relación entre conexinas, cilio primario, PTH1R e integrinas como reguladores de procesos biológicos que serían clave para la función de los osteocitos.
MATERIALES Y MÉTODOS
CULTIVO CELULAR
Se utilizaron tres tipos de células MLO-Y4 Cx43+/+ (presentan un vector vacío como control negativo para poder evaluar los efectos del no silenciamiento) y Cx43-/- (células deficientes en conexina 43, transfectadas con un ARNi), que fueron amablemente cedidas por la Dra. L. I. Plotkin, y células Cx43+/+ a la que se silenció la integrina α2 mediante un ARNi. Dichas células se sembraron a una concentración de 24.000 células/cm2 y se cultivaron con el medio ɑ-Modified Eagle´s Medium (ɑ-MEM) (Gibco, ThermoFisher Scientific, ES) suplementado con 2,5 % de suero de ternero (Calf Serum; CS), 2,5 % de suero fetal bovino (Fetal Bovine Serum; FBS), 1 % de L-glutamina, 1 % de penicilina/estreptomicina y puromicina de Streptomyces alboniger (Sigma Aldrich, ES) a una concentración 10 µg/ml.
Todas las superficies sobre las que se sembraron estas células debían estar previamente colagenizadas con colágeno tipo I al 0,01 % de ácido acético (13). Las células se mantuvieron a 37 °C y 5 % de CO2.
SILENCIAMIENTO DE LA INTEGRINA α2
Las células MLO-Y4 Cx43+/+ se transfectaron con tres silenciadores (ARNi) de α2 diferentes (5 nM) (ThermoFisher Scientific, ES), que presentaban una diana para la secuencia de la integrina α2, usando lipofectamine ARNiMax (Life Technologies, Carlsbad, CA, EE. UU.). Los ARNi se añadieron en medio sin suero durante 24 h. La secuencia scrambled (SCR) (control ARNi, Santa Cruz Tecnhology, TX, EE. UU.) se empleó como control negativo para evaluar los efectos no dirigidos de silenciamiento (ARNi off-targeted”).
PCR
La extracción de ARN se realizó con TRIZOL® (Ambion, FosterCity, CA, EE. UU.). Para la retrotranscripción de ARN (RT-PCR, reacción en cadena de la polimerasa con transcriptasa inversa) se utilizó el kit (Applied Byosistems, Grand Island, NY, EE. UU.) y el termociclador (Eppendorf, Hamburgo, Alemania).
Para analizar la expresión de la integrina α2 (Fw 5´CCATGATGGGTCGAAGCTGA3´; Rv 5´CTTCGTCGGCCACATTGAAA3´) se empleó SYBR Green (Sybr promix ex Taq, Takara, Otsu, Japón). El nivel de expresión integrina α2 se analizó utilizando como gen control β-actina (Fw 5´GAACCCTAAGGCCAACCGTG3´; Rv 5´ACCAGAGGCATACAGGGACAG3´). Se realizaron triplicados de todas las condiciones (Cx43+/+ y Cx43-/-). El cambio de expresión de los genes se calculó basándose en el valor de 2-∆∆Ct.
INMUNOFLUORESCENCIA
Se sembraron 30.000 células/pocillo de las placas multipocillo (Falcon, ES). Las células fueron cultivadas hasta que alcanzaron una confluencia del 80 % y posteriormente se añadió medio sin suero durante 24 h para inducir la formación del cilio primario. Después, las células se fijaron con paraformaldehído (PFA) al 4 % y se permeabilizaron con Tritón X-100b al 0,5 %. A continuación, se añadió la solución de bloqueo compuesta por albúmina de suero bovino (BSA) al 10 %, suplementado con suero goat al 5 %, durante 1 h. Posteriormente, se mantuvieron toda la noche a 4 °C en agitación los siguientes anticuerpos primarios: anti-Cx43 policlonal producido en conejo (Sigma, ST. Louis, MO, EE. UU.) (dilución 1:1000 en BSA al 10 % y suero goat al 5%); y anti-α tubulina acetilada monoclonal producido en ratón (Sigma) (dilución 1:1000 en BSA al 10 % y suero goat al 5 %), para observar así el cilio primario. Posteriormente, se añadieron los anticuerpos secundarios: para cilio primario Alexa fluor® 488 de cabra anti-ratón (Invitrogen Molecular probes, Thermo Fisher ScientificTM, ES) (dilución 1:1000 en BSA al 10 % y suero goat al 5 %), para Cx43 Alexa fluor® 568 anti-conejo IgG (Live technologies, Thermo ScientificTM, ES) (dilución 1:1000 en BSA al 10 % y suero goat al 5 %). Tras 1 h de incubación se añadió 4´-6-diamidino2-fenilindol (DAPI) (dilución 1:10,000). Los núcleos, el cilio primario y la Cx43 se visualizaron con el microscopio de epifluorescencia (Leica CTR 6000). Se realizaron imágenes de los triplicados y se analizaron un total de 100 células de cada condición (Cx43+/+ SCR y α2 y Cx43-/-). La fusión (merged) de las imágenes individuales del cilio primario, la Cx43 y núcleos celulares en una sola se realizó con el programa ImageJ, que permite procesar las imágenes digitales, es capaz de calcular el área y las estadísticas del valor del pixel seleccionado por el usuario y de medir distancias.
ESTIMULACIÓN POR AGONISTAS DE PTH1R (PTH Y PTHRP)
Para realizar la estimulación mediante PTHrP y PTH las células se sembraron en placas a una densidad de 25.000 células/cm2 y ambos ligandos se añadieron a una concentración de 10-7 molar (M), durante 10 min.
ENSAYO DE MUERTE Y ADHESIÓN CELULAR
La viabilidad celular se determinó mediante la exclusión de azul de tripano, método que tiñe las células muertas de azul, permitiendo calcular el porcentaje de células vivas y muertas respecto al total empleando una cámara de Neubauer y un microscopio óptico de campo claro (Leica DM5500B) para hacer los contajes.
Tras tripsinizar las células y transcurridos 30 minutos tras la resiembra, se realizó el contaje de las células no adherentes con la cámara de Neubauer. A continuación, se tomaron imágenes de diferentes campos de las células adheridas a la placa de Petri, mediante un microscopio invertido de campo claro (Leica DM5500B), para calcular los porcentajes de células adheridas respecto al total. Se analizaron un total de 9 campos de cada condición por triplicado (Cx43+/+ SCR y α2 y Cx43-/-).
ANÁLISIS MEDIANTE WESTERN BLOT
Se realizó una extracción de proteínas de cada condición por duplicado (Cx43+/+ SCR y α2 y Cx43-/-), empleando RIPA Buffer (150 mM NaCl, 1,0 % IGEPAL® CA-630, 0,1 % SDS (dodecilsulfato sódico), 50 mM Tris, pH 8, Sigma-Aldrich, St Louis, MO, EE. UU.), inhibidor de proteasa (IP) (dilución 1:100, Calbiochem®, ES) e inhibidor de fosfatasa (IF) (dilución 1:100, Calbiochem®, ES). Se cuantificaron las proteínas mediante el ensayo de ácido bicinconínico (BCA) (PierceTM BCA Protein Assay Kit, Thermo Fisher Scientific, ES). Para realizar la lectura se utilizó el lector de placas Varioskan Flash (Thermo Fisher Scientific, ES) y se hicieron tres lecturas a 562 nm mediante el programa SkanIt Software 2.4.3 RE.
Los extractos de proteína se separaron mediante un gel de poliacrilamida. Posteriormente se transfirieron las proteínas a una membrana de nitrocelulosa (Bio-Rad, Hercules, CA, EE. UU.). El bloqueo se realizó con leche en polvo al 5 % en tampón Tris salino con Tween20 (TTBS) al 0,05 %, durante 1 h en agitación a temperatura ambiente. A continuación, se incubaron durante 24 horas a 4 °C y en agitación los siguientes anticuerpos primarios: anti-fosfo-p44/42 MAPK (Erk 1/2) (Cell Signaling, Beverly, MA, EE. UU.), anti-p44/42 MAPK (Erk 1/2), y anti-α-tubulina (Sigma Aldrich, ES). Posteriormente, se añadieron los anticuerpos secundarios. El revelado mediante quimioluminiscencia se realizó con el sustrato ClarityTM Western ECL (Bio-Rad). La intensidad de las bandas se cuantificó por densitometría, usando Dnr Bio Imaging System MF ChemiBIS3.2 y los programas Gelcapture y QuantityOneTM (Bio-Rad).
ANÁLISIS ESTADÍSTICO
El límite de confianza establecido en todos los test estadísticos realizados fue del 95 %. Por tanto, se consideran estadísticamente significativos los resultados que tengan un valor p (p) p < 0,05.
Para la comparación de medias ± desviación estándar (DE) se usó el programa GraphPad Prism 8. Para comparar medias de más de dos grupos se empleó el test ANOVA de un solo factor y el test ANOVA Welch. No se consideró igualdad de varianzas. Para los análisis múltiples se utilizó el test de Dunnett, el test de Tukey y el test de Kruskal Wallis no paramétrico, siendo t el estadístico que analiza si las medidas de las dos condiciones son iguales o no y gl que serían los grados de libertad que indican el número de valores que pueden ser asignados de forma arbitraria.
RESULTADOS
LA EXPRESIÓN GÉNICA DE INTEGRINAS SE ENCUENTRA MODULADA POR CONEXINA 43 EN CÉLULAS OSTEOCÍTICAS
Se analizó la expresión del ARN de las integrinas α2, α6, β1, β3 y β6 y la Cx43 mediante PCR cuantitativa, para estudiar la posible relación en la expresión de estas dos familias de proteínas.
En la figura 1 se observa cómo la integrina α2 disminuye significativamente su nivel de expresión en células de la línea Cx43 -/- frente a las células Cx43 +/+ (t = 13,93, gl = 4, p = 0,0002). Por el contrario, las integrinas α6, β1 y β3 aumentan su expresión significativamente, en la línea celular Cx43 -/- en comparación con Cx43 +/+ (t = 3,646, gl = 4, p = 0,0219; t = 5,501, gl = 4, p = 0,0053; t = 26,18, gl = 4, p < 0,0001; respectivamente). En el caso de la β6 no se observaron diferencias significativas entre las dos líneas celulares (t = 0,99, gl = 4, p = 0,378).
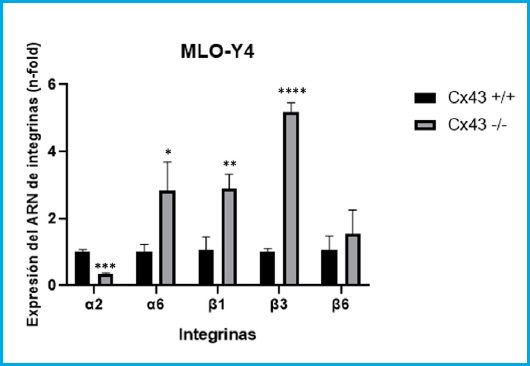
Figura 1. Expresión del ARN de las integrinas α2, α6, β1, β3 y β6 en células Cx43 +/+ y Cx43 -/-. Los resultados se expresan como media ± DE de un experimento realizando triplicados de cada condición experimental *p < 0,05; **p < 0,01; ***p < 0,001; ****p < 0,0001.
Estos resultados indican que la expresión de conexina 43 condiciona el patrón de expresión de diversas integrinas en células osteocíticas.
CONEXINA 43 E INTEGRINA α2 REGULAN LA LONGITUD DEL CILIO PRIMARIO EN CÉLULAS OSTEOCÍTICAS
Se realizaron inmunofluorescencia para observar la posible relación e interacción entre el cilio primario, la Cx43 y la integrina α2, tres conocidos mecanosensores de los osteocitos, y determinar si el desarrollo y la longitud del cilio primario podría depender de la presencia de Cx43 e integrina α2 (Fig. 2).
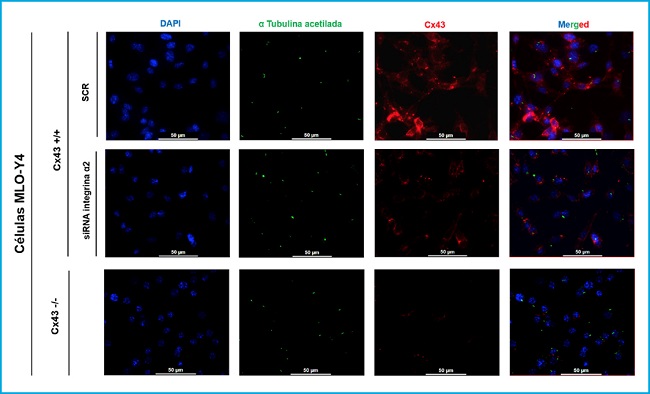
Figura 2. Inmunofluorescencia de las células MLO-Y4 Cx43+/+ (SCR y si RNA α2) y Cx43 -/-. El núcleo celular se visualizó con DAPI (azul), el cilio primario con el anticuerpo anti-α-tubulina acetilada (verde) y la Cx43 con el anticuerpo anti-Cx43 (rojo). Las imágenes fueron capturadas con un microscopio de fluorescencia confocal (40X). Barra de escala = 50 μm.
Se compararon las células MLO-Y4 Cx43+/+, MLO-Y4 Cx43+/+ a las que se silenció la integrina α2 (ARNi α2) y MLO-Y4 Cx43-/-. En los resultados mostrados en la figura 3 se observó que todas las líneas celulares son capaces de desarrollar cilio primario y que este orgánulo se origina en la superficie celular. Además, se observó que la Cx43 presenta una distribución diferente en las células Cx43+/+ y ARNi α2, ya que en las células en las que no se silenció la integrina α2 predomina la presencia de Cx43 en la membrana celular, localización esperada, pues es donde forma hemicanales y UC. Mientras que en las condiciones en las que las células no presentan integrina α2 la Cx43 se encuentra distribuida en el citoplasma celular y no tan focalizada en la membrana plasmática. Las imágenes de la inmunofluorescencia también permitieron observar que la Cx43 y el cilio primario no colocalizan.
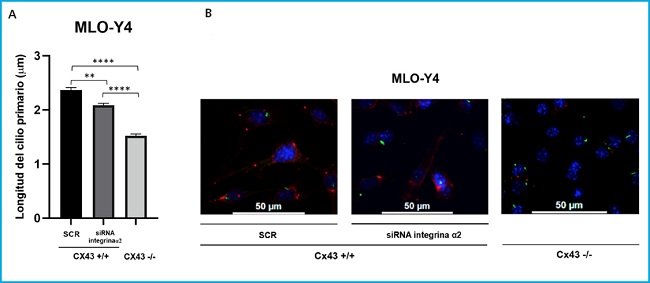
Figura 3. Comparación de la longitud del cilio primaRio (μm) entre las líneas Cx43+/+ (SCR y ARNi α2) y Cx43 -/-. A. Los resultados muestran el valor medio ± DE de la longitud del cilio primario en μm medio a partir de las imágenes realizadas a diferentes campos. *p < 0,05; **p < 0,01; ***p < 0,001; ****p < 0,0001. B. Imágenes representativas en las que se puede visualizar el núcleo por DAPI (azul) y el cilio primario por el anticuerpo anti-α-tubulina acetilada (verde). Las imágenes se capturaron con microscopio de fluorescencia confocal (40X). Bara de escala = 50 μm.
Para poder comparar cuantitativamente el desarrollo del cilio primario y su longitud se analizaron imágenes de cada tipo celular (Cx43+/+ SCR, Cx43+/+ ARNi α2 y Cx43-/-). Estas imágenes fueron tomadas a partir de diferentes campos mediante microscopía de fluorescencia (40X).
Los análisis estadísticos se realizaron comparando las medias ± DE de la longitud en μm de todos los cilios analizados en las células Cx43+/+ SCR (2,37), Cx43+/+ ARNi α2 (2,08) y Cx43-/- (1,52). Los resultados obtenidos indican que la longitud del cilio primario en las células en las que se silenció la integrina α2 y en las células deficientes en Cx43 era significativamente menor que en las células scrambled. El valor p fue: p = 0,0017 para la comparación de SCR vs. ARNi α2, p < 0,0001 SCR vs. Cx43-/- y p < 0,0001 ARNi α2 vs. Cx43-/- (Fig. 3).
Podemos sugerir en base a estas observaciones que conexina 43 e integrina α2 se encuentran implicadas en la elongación de cilio primario en células osteocíticas.
REGULACIÓN DE LA FOSFORILACIÓN DE QUINASA ERK 1/2 POR CONEXINA 43 EN CÉLULAS OSTEOCÍTICAS
Para caracterizar la respuesta de las células MLO-Y4 (Cx43+/+ y Cx43-/-) al estímulo por agonistas se añadieron al medio de cultivo los ligandos del receptor PTH1R, PTH y PTHrP (1-37), a una concentración de 10-7 M, durante 10 min. Inmediatamente después se realizó la extracción de proteínas para analizar la expresión de P-ERK mediante Western blot. El propósito de este experimento fue determinar si la deficiencia en Cx43 influía en la activación del receptor PTH1R tras estimularlo con sus respectivos ligandos (PTH y PTHrP) y analizar las vías de señalización intracelulares que activa dicho estímulo y la respuesta celular que desencadena, concretamente la fosforilación de ERK 1/2.
Los resultados obtenidos muestran que en las células Cx43+/+ la estimulación con PTH y PTHrP aumenta la fosforilación de ERK 1/2 (media ± DE de los duplicados realizados) con respecto a las células que no fueron estimuladas con ningún ligando (CE). En el caso de las células Cx43-/-, la estimulación con PTH disminuye la fosforilación de ERK con respecto a las células Cx43+/+ que fueron estimuladas con PTH y el péptido agonista PTHrP no produjo estímulo en las células Cx43-/-. No se obtuvieron variaciones significativas en los niveles de P-ERK entre las diferentes condiciones experimentales (Fig. 4).
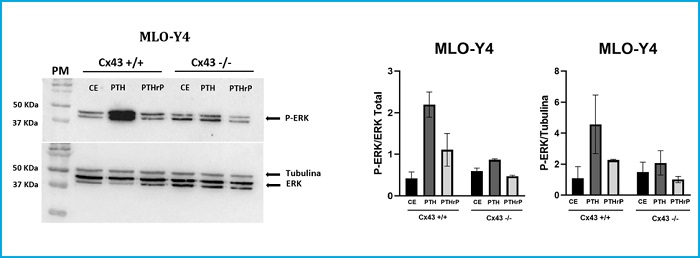
Figura 4. Análisis de P-ERK tras estimular con PTH y PTHrP células MLO-Y4 Cx43+/+ y Cx43-/-. En las células Cx43+/+ la estimulación con PTH y PTHrP aumenta la fosforilación de ERK 1/2 vs. células que no fueron estimuladas con ningún ligando (CE) (2,200 ± 0,696 frente a 0,4240 ± 0,150 y 1,11 ± 0,554 frente a 0,4240 ± 0,150, respectivamente). En las células Cx43-/-, la estimulación con PTH disminuye la fosforilación de ERK con respecto a las células Cx43+/+ que fueron estimuladas con PTH (0,865 ± 0,003 frente a 2,20 ± 0,696). Se utilizaron los valores de ERK total y tubulina para normalizar los valores de P-ERK. Los resultados se expresan como media ± DE de un experimento por duplicado de cada condición experimental vs. CE.
Nuestras observaciones sugieren que conexina 43 regula la fosforilación de ERK 1/2 dependiente de PTH1R activado por ligando.
LA EXPRESIÓN DE LA CX43 REGULA LA VIABILIDAD Y LA ADHESIÓN DE LAS CÉLULAS OSTEOCÍTICAS
Se realizó un ensayo de muerte celular con las células Cx43+/+ SCR, ARNi α2 y Cx43-/- para poder determinar si la falta de expresión de la integrina α2 y la Cx43 modificaría las rutas de señalización que intervienen en la respuesta de la célula, provocando su apoptosis. En la figura 5A se observa cómo el número de células Cx43-/- vivas disminuye significativamente respecto a las células Cx43+/+ SCR (p = 0,0035). En el caso del análisis de las células muertas vemos que aumenta su número significativamente en las células Cx43-/- respecto a Cx43+/+ SCR (p = 0,0074).
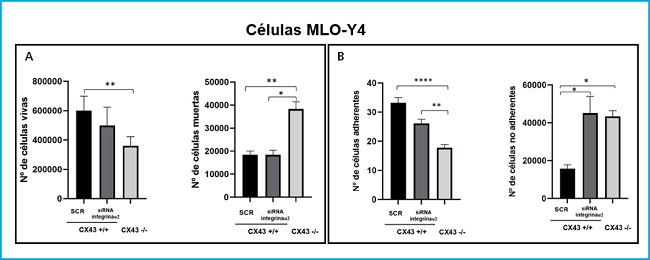
Figura 5. Análisis de la muerte (A) y adhesión (B) celular en células Cx43+/+ (SCR y ARNi α2) y Cx43-/-. Los resultados muestran el valor medio ± DE de los contajes del número de células vivas y muertas de un único experimento con seis réplicas para cada condición y los contajes del número de células adheridas y no adheridas en la placa *p < 0,05; **p < 0,01; ***p < 0,001; ****p < 0,0001.
En cuanto a la línea celular Cx43+/+ ARNi α2 al no haber diferencias significativas en el número de células vivas (aunque si una ligera tendencia a una disminución en el número de estas) y presentar un número muy similar de células muertas respecto a las células Cx43+/+ SCR, se sugiere que el silenciamiento de la integrina α2 influye en la proliferación de los osteocitos y no en la muerte de estos.
Por otro lado, también se realizó un ensayo de adhesión en las células Cx43+/+ SCR, ARNi α2 y Cx43-/-. En la figura 5B se muestra que el número de células Cx43-/- adheridas a la placa de colágeno disminuye significativamente con respecto a las células Cx43+/+ SCR y ARNi α2 (p <0,001 y p = 0,0039, respectivamente). En el caso del contaje de las células no adherentes el número de estas aumenta significativamente tanto en las células Cx43+/+ ARNi α2 como en Cx43-/- respecto a Cx43+/+ SCR (p = 0,0146 y p = 0,0134, respectivamente).
La adhesión celular se cuantificó mediante imágenes realizadas en campo claro, también permitieron analizar la morfología de los diferentes tipos celulares, y se observó que las células Cx43+/+ SCR presentaban una forma más alargada y un mayor número de prolongaciones dendríticas lo que les permitiría potencialmente tener una mayor capacidad de adhesión. Por el contrario, las células Cx43+/+ ARNi α2 y Cx43-/- mostraron una estructura más redondeada debido probablemente a la ausencia tanto de integrinas como de conexinas, ambas proteínas transmembrana que favorecen la adhesión celular (4).
Estos resultados están relacionados con los obtenidos en el ensayo de muerte celular, pues observábamos un mayor número de células muertas en las Cx43-/-, debido a que al carecer de Cx43 se dificultaría la adhesión a la superficie de cultivo, lo que podría provocar que las células se despeguen y mueran por falta de unión a sustrato.
DISCUSIÓN
Las integrinas y las conexinas presentan un papel esencial en las funciones celulares (14). Sin embargo, no se ha esclarecido si es necesaria la interacción de ambas familias de proteínas para el correcto funcionamiento de los osteocitos. La disminución de la expresión de la integrina α2 en las células Cx43-/-, nos llevó a plantearnos si esta integrina pudiese ejercer como mediador en los procesos dependientes de Cx43 en los osteocitos.
Además de las Cx y las integrinas, el cilio primario también es considerado un mecanosensor de los osteocitos (4).
En las imágenes de inmunofluorescencia se pudo observar cómo la deficiencia en Cx43 y el silenciamiento de la integrina α2 influyen en la longitud del cilio primario. Diversos estudios indican que la longitud del cilio primario es un factor determinante para su correcta actuación como mecanosensor (4), dado que si la longitud del cilio es muy pequeña disminuiría el espacio de la membrana ciliar donde podrían localizarse canales iónicos y receptores como el PTH1R que median la respuesta extracelular detectada por el cilio y permiten la transducción de diferentes señales intracelulares (15). Además, el cilio primario genera un compartimento intracelular específico en el que es necesario el transporte intraflagelar de diferentes proteínas, tanto para el desarrollo de este orgánulo como para la transducción de las señales (16). Por tanto, si este espacio se ve disminuido estos procesos podrían verse alterados, provocando que los osteocitos no generen las respuestas adecuadas a los estímulos extracelulares (10).
En las imágenes de la inmunofluorescencia también parece observarse una distribución diferente de la Cx43 entre las células Cx43+/+ SCR y Cx43+/+ ARNi α2. Aunque en ambas condiciones los niveles de expresión de Cx43 son similares, es decir, el silenciamiento de la integrina α2 no influyó en la expresión de Cx43, sí podría influir en la localización celular de esta proteína, pues en las células Cx43+/+ la Cx43 se encontraba principalmente en la membrana celular. Estos resultados podrían indicar que la integrina α2 y la Cx43 interaccionan en la membrana de la célula y que su expresión desencadena una retroalimentación positiva favoreciendo el transporte de estas proteínas desde el retículo endoplasmático hacia la membrana celular.
Los osteocitos, embebidos en la matriz mineralizada, son capaces de detectar diferentes señales, traducirlas en respuestas biológicas y trasmitirlas al resto de células óseas, fundamentalmente, osteoblastos y osteoclastos, para permitir el mantenimiento de la homeostasis ósea (17). Una de estas señales es el estímulo mediante agonistas del PTH1R (PTHrP y PTH) (18).
En los resultados obtenidos en el presente trabajo se observa que en las células Cx43+/+ aumenta la fosforilación de ERK 1/2 cuando son estimuladas con PTH y PTHrP. En el caso de las células Cx43-/-, la estimulación con PTH y PTHrP parece inhibirse pues los niveles de fosfo-ERK 1/2 disminuyen con respecto a las células Cx43+/+. Esto puede ser debido a que los osteocitos Cx43-/- sean menos sensibles a los estímulos, dado que son deficientes en la proteína Cx43 que actúa como mecanosensor y además presentan un cilio primario de menor longitud. Todo ello provocaría que el PTH1R tenga menos espacio para localizarse en la membrana ciliar y generase respuestas intracelulares como la fosforilación de ERK 1/2. Otro de los resultados observados en este experimento es que parece que el aumento de la fosforilación de ERK 1/2 es mayor cuando estimulamos con PTH que con PTHrP, al tiempo estudiado (10 min), lo que indicaría que ambos agonistas activan a PTH1R de forma diferente y que es probable que en dicho mecanismo de activación medie la Cx43. No obstante, serían necesarios más experimentos para confirmar que dicha estimulación es capaz de generar una modificación en la fosforilación de ERK y por tanto una respuesta biológica en la célula.
Otras de las características analizadas en estas células fueron su morfología, capacidad de adhesión y muerte celular. Se observó que las células Cx43+/+ SCR presentaban una forma más alargada y un mayor número de prolongaciones dendríticas lo que aumentaba su capacidad de adhesión. Por el contrario, las células Cx43+/+ ARNiα2 y Cx43-/- presentan una morfología más redondeada y una menor capacidad de adhesión en comparación con las células Cx43+/+ SCR. También se observó que las células Cx43-/- presentan una mayor mortalidad respecto a los otros dos tipos celulares. En función de estos resultados se sugiere que la ausencia de Cx43 e integrina α2 impiden la correcta adhesión de las células a la placa colagenizada lo que comprometería a su vez el desarrollo de prolongaciones dendríticas (19). La reducción en el número de prolongaciones dendríticas provocaría que la comunicación entre células se vea alterada, y como dicha comunicación es imprescindible para la supervivencia celular podría ser una de las razones por las que se observa una mayor mortalidad en las células Cx43-/-. Los resultados obtenidos concuerdan con investigaciones anteriores en las que se demuestra que las conexinas y las integrinas son proteínas que intervienen en la adhesión celular (20). Además, también se ha determinado que la Cx43 regula diferentes vías de señalización que desembocan en la expresión de genes pro-supervivencia (21) lo que es congruente con los resultados observados. En el caso de las células Cx43+/+ ARNi α2 las alteraciones en la adhesividad celular podrían ocasionar efectos celulares menos acusados, ya que no se observaron alteraciones en la supervivencia celular en estas condiciones. No obstante, la disminución en la adhesividad podría explicar la tendencia de estas células a proliferar menos que las Cx43+/+ SCR.
CONCLUSIÓN
Nuestro estudio indica que la deficiencia en Cx43 modifica el patrón de expresión de integrinas en los osteocitos MLO-Y4, inhibiendo la expresión de la integrina α2 y aumentando la de integrinas α6, β1 y β3, lo que parece modificar su capacidad de adhesión. Además, la ausencia de la integrina α2 y de la Cx43 altera la longitud del cilio primario.











 texto en
texto en 


