INTRODUCCIÓN
El esqueleto es un órgano metabólicamente activo que se remodela continuamente a lo largo de nuestra vida. El proceso de remodelado óseo, en el que se acoplan resorción y formación de matriz de hueso, sirve para ajustar la arquitectura ósea a las necesidades mecánicas del hueso. Además, ayuda a reparar daños en la matriz ósea y evitar la acumulación de hueso envejecido que puede haber perdido sus propiedades mecánicas (1).
Muchos son los factores que modulan la formación y el mantenimiento de nuestro esqueleto. Entre estos, la carga mecánica representa el principal factor extrínseco con efectos directos sobre el tejido óseo (2). La carga sobre nuestros huesos se traduce en tensiones mecánicas que son recibidas por las células óseas y transformadas en señales biológicas, lo que se conoce como mecanotransducción (2).
Osteoblastos y osteoclastos son las células que llevan a cabo la formación y la resorción ósea, respectivamente (3). Los osteocitos, las células más abundantes del tejido óseo, son los principales receptores de la estimulación mecánica y son capaces de comunicarse con osteoblastos y osteoclastos modulando su actividad (4).
Las células óseas se encuentran en íntimo contacto con las células presentes en la médula ósea. En ella encontramos una población celular muy heterogénea donde conviven células hematopoyéticas que darán lugar a las diferentes poblaciones sanguíneas, con células no hematopoyéticas del microambiente de la médula, como células perivasculares y mesenquimales (MSC) entre otras (5).
Las MSC presentes en la médula constituyen la fuente de células osteoprogenitoras que hacen posible la reparación de fracturas y la formación de nuevo hueso (5).
La diferenciación de las células madre mesenquimales es un proceso que conforma 2 etapas; compromiso a un linaje celular (de las MSC a un progenitor de linaje específico) y maduración (de los progenitores a un tipo celular específico). Un gran número de vías de señalización se encuentran implicadas en la regulación del compromiso de linaje de las MSC, entre las que se incluyen la familia TGF-beta, BMP (proteínas morfogénicas de hueso), Wnt, hedgehogs (Hh), Notch y factores de crecimiento de fibroblastos (FGF) (6,7).
En el presente trabajo estudiamos la comunicación entre los osteocitos y las células mesenquimales, y cómo la estimulación mecánica modifica la proliferación, adhesión y la expresión génica de las células mesenquimales a través de los osteocitos.
Hipotetizamos que el secretoma de osteocitos estimulados mecánicamente induce procesos biológicos relacionados con la potenciación de las capacidades de regeneración ósea de células mesenquimales, para lo que se ha estudiado el efecto del medio condicionado por osteocitos MLO-Y4 estimulados mecánicamente (por flujo de fluido) o no (control estático) sobre distintos procesos biológicos de células mesenquimales C3H/10T1/2 y preosteoblásticas MC3T3-E1.
MATERIAL Y MÉTODOS
CULTIVOS CELULARES
Para los ensayos del presente trabajo se utilizaron las siguientes líneas celulares: células mesenquimales de ratón no comprometidas a linaje osteoblástico (C3H/10T1/2 subclón 8, ATTC, CCL-226). Estas células se cultivaron con medio BME (“basal eagle medium”, Thermofisher, 21010046) + 10 % sueron fetal bovino (FBS) (Thermofisher, 10500064) + 1 % L-glutamina (Thermofisher, 25030024) + 1 % penicilina/estreptomicina (Thermofisher, 15140122) a 37 °C con 5 % de CO2. Células mesenquimales preosteoblásticas de ratón (MC3T3-E1 subclón 4, ATTC, CRL-2593). Estas células fueron cultivadas con medio MEM alfa (“minimum essential medium”, Thermofisher, A1049001) + 10 % FBS + 1 % L-glutamina y 1 % de estreptomicina/penicilina a 37 °C con 5 % de CO2. Células osteocíticas murinas MLO-Y4 (Kerafast, EKC002). Estas células se cultivaron con medio MEM alfa sin ácido ascórbico (Thermofisher, 22571038) + 2,5 % FBS + 2,5 % de suero de ternero (“calf serum” [CS], Thermofisher, 16010159) y 1 % de estreptomicina/ penicilina a 37 °C con 5 % de CO2.
ESTIMULACIÓN MECÁNICA POR FLUJO DE FLUIDO (“FLUID FLOW”)
Se sembraron 250 000 células MLO-Y4 en portaobjetos de cristal delimitados con teflón, en un área de 15 cm2 previamente recubierto con matriz de colágeno (Sigma Aldrich, 000010C8919). Después de 48 horas, las células fueron sometidas a un estímulo mecánico (FF) mediante el dispositivo FlexcellStreamer de tensión de corte medio que produce una tensión de 10 dinas/cm2 durante 10 minutos (Flexcell Internacional Corporation, Hillsborough, Carolina del Norte, EE. UU.). Como control (control estático o SC), se usaron células MLO-Y4 sembradas en portaobjetos de cristal delimitados con teflón sin ser sometidas a ningún estímulo mecánico. A continuación, las células se incubaron, durante 18 horas, con medio MEM alfa sin rojo fenol (Gibco) suplementado con 0,5 % de CS, 0,5 % de FBS y 1 % de penicilina-estreptomicina para obtener medios condicionados (CM) de los diferentes grupos experimentales: células mecanoestimuladas (FF) y células control.
ENSAYO DE PROLIFERACIÓN
Para realizar los ensayos de proliferación, ambas líneas celulares MC3T3-E1 y C3H/10T1/2 fueron sembradas a una densidad de 20.000 células/pocillo en placas de cultivo de 24 pocillos (VWR,734-2325). Al día siguiente se cambió el medio por un medio con 250 µl de medio condicionado (control estático o fluid flow) y 750 µl de su medio de cultivo correspondiente. Como control se usaron células MC3T3-E1 y C3H/10T1/2 incubadas con 250 µL de MEM alfa sin rojo fenol (Gibco) suplementado con 0,5 % de CS, 0,5 % de FBS y 1 % de penicilina-estreptomicina y 750 µl de su medio de cultivo correspondiente. Pasadas las 24 h de incubación las células se despegaron con Tripsina-EDTA (Thermofisher, 25300062) y se hizo un recuento celular con azul de Tripán (Thermofisher, 15250061) en cámara de Neubauer. Se repitió el mismo proceso a las 48, 72 y 96 horas obteniéndose así una valoración de la proliferación.
ADHESIÓN CELULAR
La adhesión de las células preosteoblásticas MC3T3-E1 y células mesenquimales C3H/10T1/2 se evaluó mediante la cuantificación de células marcadas con el tinte vital fluorescente cytopainter (Abcam, ab176735). Para ello, se sembraron células MC3T3-E1 o C3H/10T1/2 en placas P6 durante 24 horas. Al día siguiente se cambió el medio por un medio con 250 µl de medio condicionado (control estático o fluid flow) y 750 µl de su medio de cultivo correspondiente. Como control del experimento se usaron células MC3T3-E1 y C3H/10T1/2 incubadas con 250 µL de MEM alfa sin rojo fenol (Gibco) suplementado con 0,5 % de CS, 0,5 % de FBS y 1 % de penicilina-estreptomicina y 750 µl de su medio de cultivo correspondiente. Finalizadas las 24 horas, se incubaron con cytopainter durante 30 minutos y, tras la incubación, se levantaron las células, se contaron y sembraron 20 000 células/cm2 sobre un nuevo pocillo de P6 durante 30 minutos. Finalmente, se recogió el sobrenadante y se contaron las células no adheridas en una cámara de Neubauer mediante el método por exclusión con azul tripán. Por otro lado, se obtuvieron imágenes de las células adheridas a la superficie de los pocillos mediante microscopio PAULA (“Personal automated lab assistant, Leica microsystems”). El número de células marcadas con fluorescencia se contó en 3 campos diferentes y aleatorios.
REACCIÓN EN CADENA DE LA POLIMERASA A TIEMPO REAL (RT-PCR)
Se sembraron en placas de cultivo de 6 pocillos 300 000 cé- lulas por pocillo en el caso de las células preosteoblásticas MC3T3-E1 y 450 000 en el de las células mesenquimales C3H/10T1/2. Pasadas 24 horas de incubación, se lavaron las células con PBS y se sustituyó el PBS por 250 µl de MEM alfa en los controles y 250 µl del medio condicionado correspondiente en los otros pocillos. Además, a cada pocillo se añadieron 750 µl de su medio correspondiente. Tras 24 horas de incubación se retiró el medio de cultivo, se recogieron cada uno de los pocillos en tubos de 1,5 ml mediante trizol y se almacenaron a -80 °C.
Al día siguiente se descongelaron las muestras, se mantuvieron en hielo para mantener una baja temperatura y se procedió a seguir el protocolo de extracción de ARN. La transcripción reversa para la obtención de cDNA se realizó mediante el uso de el kit de transcripción reversa de cDNA (“High capacity RNA to cDNA Kit”, Thermofisher, 4387406) siguiendo las instrucciones. Tras la obtención del cDNA se realizó una PCR en una placa P384 mediante el uso de “Sybergreen” (TB Green, Condalab RR420A) para estudiar los siguientes genes: RUNX2, fosfatasa alcalina (ALP), PPARγ y osteocalcina. Además se usó la beta actina (actina citoesquelética) como gen de expresión constitutiva. Para ello, se utilizó un termociclador ABI PRISM 7500 (Applied Biosystems).
ANÁLISIS ESTADÍSTICO
Los datos se encuentran expresados como medias ± error estándar. Se analizó la distribución de los datos y dado que no se ajustaban a una distribución normal, las diferencias entre los grupos experimentales se evaluaron mediante análisis de la varianza no paramétrico (Kruskal-Wallis). La determinación de las posibles diferencias entre los grupos experimentales se realizó mediante los test de Dunn o de Mann-Whitney. Para realizar los análisis estadísticos se utilizó el programa GraphPad Prism. Se consideró p < 0,05 como valor estadísticamente significativo.
RESULTADOS
EFECTOS DE LOS MEDIOS CONDICIONADOS DE LOS OSTEOCITOS ESTIMULADOS O NO MECÁNICAMENTE SOBRE LA PROLIFERACIÓN DE CÉLULAS MESENQUIMALES Y PREOSTEOBLASTOS
Se realizó un estudio de proliferación de células preosteoblásticas de ratón MC3T3-E1 y de células mesenquimales (C3H/10T1/2) con 25 % de medios condicionados de células osteocíticas de ratón MLO-Y4 mecánicamente estimuladas (FF) o no (SC) (Fig. 1).

Figura 1. Proliferación y muerte celular de células preosteoblásticas MC3T3-E1 (A y B, respectivamente) y células mesenquimales embrionarias C3H/10T1/2 (C y D, respectivamente) en presencia o ausencia de medios condicionados de osteocitos MLO-Y4 tras estímulo mecánico (flujo de fluido: MC FF) o no (control estático: MC SC). Los controles representan células sin estímulo de medios condicionados de osteocitos. Los valores son la media ± error estándar de 3 experimentos realizados por triplicado. *p < 0,05 vs. control; **p < 0,01 vs. control; ap < 0,05 vs. MC SC; bp < 0,01 vs. MC SC.
Observamos que en ambas líneas celulares el secretoma de los osteocitos muestra efectos significativos en la proliferación. Mientras que el secretoma de los osteocitos estimulado mecánicamente (FF) promueve una mayor proliferación, el secretoma de osteocitos no estimulados (SC) induce una menor proliferación frente al control (Figs. 1 A y C). No se observaron diferencias en la viabilidad celular en ninguna de las tres condiciones experimentales durante los 4 días analizados (Figs. 1 B y D).
EFECTOS DE LOS MEDIOS CONDICIONADOS DE LOS OSTEOCITOS ESTIMULADOS O NO MECÁNICAMENTE SOBRE LA ADHESIÓN DE CÉLULAS MESENQUIMALES Y PREOSTEOBLASTOS
A continuación, se realizó un estudio de adhesión de células preosteoblásticas de ratón MC3T3-E1 y de células mesenquimales (C3H/10T1/2) en presencia de secretoma de células osteocíticas de ratón MLO-Y4 tras estimulación (FF) o ausencia (SC) de estímulo mecánico por paso de fluido.
No se apreciaron diferencias significativas en la adhesión de células MC3T3-E1 en las distintas condiciones experimentales (Fig. 2). En cuanto a la cantidad de células no adheridas, observamos que estimulación con medio condicionado (FF y SC) apenas disminuyó la adhesión con respecto al control (Fig. 2).
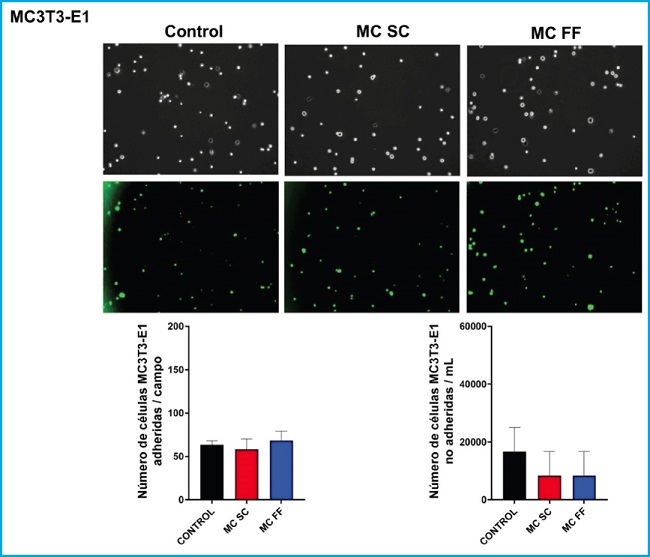
Figura 2. Adhesión de células preosteoblásticas MC3T3-E1 en presencia o ausencia de medios condicionados de osteocitos MLO-Y4 tras estímulo mecánico (flujo de fluido: MC FF) o no (control estático: MC SC). Los controles representan células sin estímulo de medios condicionados de osteocitos. Los valores son la media ± error estándar de 3 experimentos realizados por triplicado. Se muestran imágenes representativas en obtenidas por microscopía de campo claro (panel superior) o por microscopía de epifluorescencia (panel inferior). Los resultados se expresan como número de células adheridas/campo (inferior izquierda) y como células no adheridas/mL (inferior derecha). Los valores son la media ± error estándar de 3 experimentos realizados por triplicado.
Sin embargo, sí se observó una diferencia clara entre las diferentes condiciones experimentales en la adhesión de células C3H/10T1/2. El medio condicionado por los osteocitos estimulados mecánicamente aumentó la adhesión de esta línea celular (Fig. 3).

Figura 3. Adhesión de células mesenquimales embrionarias C3H/10T1/2 en presencia o ausencia de medios condicionados de osteocitos MLO-Y4 tras estímulo mecánico (flujo de fluido: MC FF) o no (control estático: MC SC). Los controles representan células sin estímulo de medios condicionados de osteocitos. Los valores son la media ± error estándar de 3 experimentos realizados por triplicado. Se muestran imágenes representativas en obtenidas por microscopía de campo claro (panel superior) o por microscopía de epifluorescencia (panel inferior). Los resultados se expresan como número de células adheridas/campo (inferior izquierda) y como células no adheridas/mL (inferior derecha). Los valores son la media ± error estándar de 3 experimentos realizados por triplicado. *p < 0,05 vs. control.
ANÁLISIS DE LA EXPRESIÓN DE GENES EN CÉLULAS MESENQUIMALES Y PREOSTEOBLÁSTICAS TRATADAS CON MEDIOS CONDICIONADOS DE OSTEOCITOS ESTIMULADOS O NO MECÁNICAMENTE
Se realizó un estudio de marcadores de diferenciación y formación ósea (Runx2, osteocalcina y fosfatasa alcalina) y de diferenciación adipogénica (PPARᵞ) en células preosteoblásticas de ratón MC3T3-E1 y de células mesenquimales (C3H/10T1/2) estimulados con 25 % de medios condicionados de células osteocíticas de ratón MLO-Y4 en presencia (FF) y ausencia (SC) de estímulo mecánico por paso de fluido. Como podemos observar en las figuras 4 y 5, no se observaron cambios significativos sobre la expresión de Runx2, osteocalcina, ni fosfatasa alcalina en ninguna de las dos líneas estudiadas.
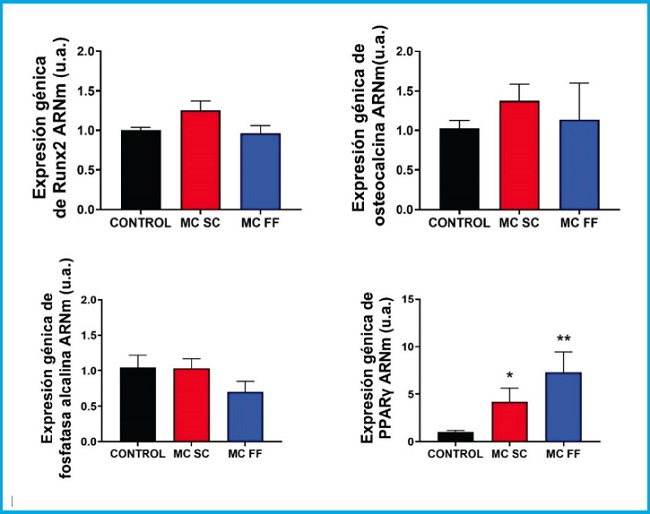
Figura 4. Análisis de expresión génica de marcadores de diferenciación y formación ósea (Runx2, osteocalcina y fosfatasa alcalina) y de diferenciación adipogénica (PPARᵞ) en células preosteoblásticas MC3T3-E1 en presencia o ausencia de medios condicionados de osteocitos MLO-Y4 tras estímulo mecánico (flujo de fluido: MC FF) o no (control estático: MC SC). Los controles representan células sin estímulo de medios condicionados de osteocitos. Los valores son la media ± error estándar de 3 experimentos realizados por triplicado. *p < 0,05 vs. control; **p < 0,01 vs. control.
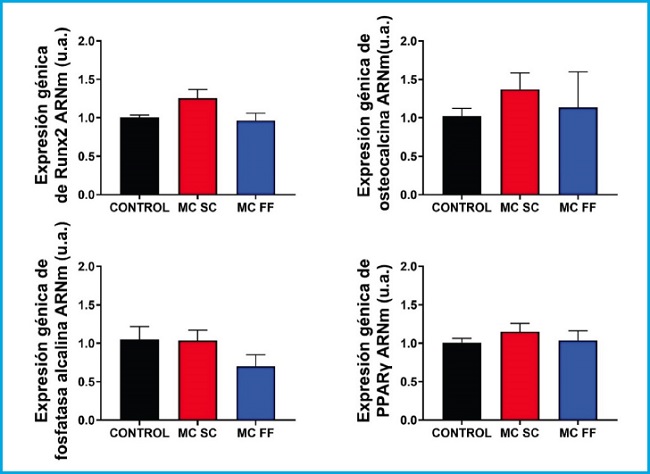
Figura 5. Análisis de expresión génica de marcadores de diferenciación y formación ósea (Runx2, osteocalcina y fosfatasa alcalina) y de diferenciación adipogénica (PPARᵞ) en células preosteoblásticas C3H/10T1/2 en presencia o ausencia de medios condicionados de osteocitos MLO-Y4 tras estímulo mecánico (flujo de fluido: MC FF) o no (control estático: MC SC). Los controles representan células sin estímulo de medios condicionados de osteocitos. Los valores son la media ± error estándar de 3 experimentos realizados por triplicado.
Sin embargo, la expresión de PPARγ aumentó tras la estimulación con medios condicionados de osteocitos SC y FF en las células preosteoblásticas MC3T3-E1 (Fig. 4), mientras que en las células C3H/10T1/2, los niveles de expresión de PPARγ, permanecieron prácticamente inalterados en todas las condiciones experimentales (Fig. 5).
DISCUSIÓN
El envejecimiento y ciertas enfermedades óseas como la osteoporosis provocan la alteración del remodelado óseo y con ello la pérdida de masa ósea. Esto se debe a la acumulación de osteocitos apoptóticos y al reclutamiento de precursores osteoclásticos que fomentan el proceso de resorción ósea. Esta situación puede ser evitada mediante el estímulo mecánico, que ya se aplica de manera natural a los osteocitos cuando hacemos ejercicio (8).
Estudios anteriores ya evidenciaron que el medio condicionado de los osteocitos estimulados mecánicamente es capaz de reclutar osteoprogenitores (células mesenquimales y osteoblastos) y promover el compromiso del linaje osteogénico de estas células para reponer los osteoblastos agotados, mejorar la formación ósea y fortalecer el tejido (9). Además, la estimulación mecánica tiene un papel fundamental a la hora de modular ciertos procesos celulares. En nuestros resultados, encontramos que la exposición de las células preosteoblásticas MC3T3-E1 y de las mesenquimales C3H/10T1/2 a medios condicionados que contienen secretoma de células osteocíticas MLO-Y4 estimuladas mecánicamente afecta a su proliferación y adhesión, así como a la expresión génica de uno d ellos marcadores estudiados. Algunas discrepancias en los resultados obtenidos entre las dos líneas celulares utilizadas en el presente trabajo pueden ser debidas a la distinta naturaleza de cada tipo celular. La línea celular preosteoblástica MC3T3-E1 se encuentra en un mayor grado de diferenciación y compromiso hacia un fenotipo osteoblástico comparado con las C3H/10T1/2. Estas últimas al ser de origen embrionario, se encuentran más indiferenciadas y posiblemente por ello y por su carácter de célula madre embrionaria, puedan presentar mayor proliferación respecto a líneas más diferenciadas, como las MC3T3-E1 (10).
En cuanto a las diferencias de las células control respecto a las expuestas a medios condicionados, los resultados podrían indicar que los osteocitos estimulados mecánicamente in vivo mantienen los niveles de masa ósea al inducir, mediante la secreción de moléculas, la proliferación de células mesenquimales que posteriormente se pueden diferenciar a osteoblastos que formarán la matriz ósea. Sin embargo, los osteocitos no estimulados mecánicamente presentan un secretoma modificado que probablemente implica la disminución de secreción de factores proliferantes que actúan sobre las mesenquimales, o el aumento de la secreción de factores inhibidores de la proliferación. En cualquiera de las dos situaciones, el resultado conllevaría una menor proliferación de células mesenquimales y posiblemente una menor diferenciación osteoblástica para generar matriz ósea.
Las células mesenquimales C3H/10T1/2 al ser células menos diferenciadas podría pensarse que presenten una menor expresión de proteínas que suelen estar presentes en células más especializadas. Por tanto, sería posible que, al no haberse comprometido a un fenotipo celular concreto, puedan ser modificadas más fácilmente por el secretoma de los osteocitos mecanoestimulados comparadas con células más diferenciadas como las MC3T3-E1 que se encuentran ya comprometidas a la expresión de proteínas de linaje osteoblástico. Sin embargo, los efectos de expresión génica más significativos observados en este trabajo tras estimulación con secretoma de osteocitos, corresponden a un aumento de expresión de PPARγ en células MC3T3-E1. Este cambio se podría asociar a un aumento de la adipogénesis asociado al envejecimiento, pérdida de masa ósea y retraso en la regeneración (11), proceso contrario a la osteoblastogénesis (12) y al resto de resultados obtenidos en el presente estudio. Sin embargo, algunos trabajos indican que, en algunas fases de la diferenciación a osteoblastos, la expresión de PPARγ puede tener un papel importante (13,14). Por ello, será necesario realizar más experimentos que puedan comprobar de manera más directa el potencial adipogénico y osteogénico del secretoma de osteocitos sobre los distintos tipos de células mesenquimales usados en este trabajo.
Respecto a la adhesión celular, para que se produzca un aumento en la adhesión suele ser necesario un incremento en la expresión de proteínas de unión a matriz, como las integrinas (15). Es posible que, gracias a la sobreexpresión de estas proteínas de unión a matriz, las células mesenquimales se adhieran con mayor facilidad tras ser estimuladas con el secretoma de osteocitos mecanoestimulados. La capacidad adhesiva de las células mesenquimales es un requisito necesario para que se produzca la terapia de regeneración (16) dado que, al ser células dependientes de unión a sustrato, necesitan primero unirse a las zonas dañadas para poder comenzar procesos de proliferación o diferenciación.
Por tanto, en base a nuestros resultados se puede asumir que ciertos factores del secretoma de osteocitos favorecen la adhesión de las células mesenquimales, y puede que indirectamente de este modo potencien los procesos de regeneración a partir de estas células.











 texto en
texto en 


