Introducción
El término alucinógeno proviene de la palabra en latín alucinari, con el significado de "vagar por la mente", así como también encontramos "psicodélico" como sinónimo, derivado de las palabras griegas psyche (mente) y delos (visible) (McGeeney, 2013). Bajo su definición recoge a un grupo de sustancias susceptibles de producir cambios significativos en la percepción sensorial (visual, auditiva, táctil y/u olfatoria) y en el pensamiento, sin reducir el nivel de conciencia, simplemente alterándola a través de la percepción de sensaciones, cogniciones y afectos anómalos (Whelan & Johnson, 2018).
El uso histórico de setas alucinógenas nos remonta a cientos de años atrás, introduciéndonos en la cultura Maya y Azteca de México, así como en la cultura de los indios mazatecos del sur mexicano. Este primer uso de las plantas psicodélicas tenía diversos propósitos, incluyendo el religioso, el cultural, recreacional y, el más relevante para nosotros, el medicinal (Yamin‐Pasternak, 2010). Otro aspecto histórico destacable está relacionado con su acción en la psicoterapia, empleándose como afianzamiento de la relación terapéutica y como asistencia en la exploración de la "experiencia interior" durante la sesión (Whelan & Johnson, 2018). De modo que los psicodélicos se usaron en entornos clínicos y de investigación con resultados alentadores en cuanto al tratamiento de enfermedades mentales y al de los trastornos por consumo de sustancias. Sin embargo, al mismo tiempo surgieron preocupaciones sobre el posible abuso y efectos adversos, además de la asociación de los psicodélicos con el movimiento de la contracultura. Así, comenzó la fiscalización de los psicodélicos, prohibiéndose en gran medida en Estados Unidos en 1970, e impidiendo la investigación sobre su potencial terapéutico. Tras décadas en las que la investigación en esta línea permaneció congelada, recientemente ha habido un resurgimiento en el interés por estas sustancias, aunque limitando el acceso a algunos grupos de investigadores (Barnett & Greer, 2021).
Las investigaciones que han podido realizarse con los alucinógenos se han centrado en diferentes ámbitos, entre ellos, encontramos su posible utilidad clínica en el tratamiento de las cefaleas. Concretamente, la migraña es uno de los problemas de dolor de cabeza más comunes, aproximadamente con una prevalencia del 15% y situado entre los tres trastornos más discapacitantes en el mundo. Existen numerosos tratamientos que se usan hoy en día, aunque aún se necesitan avances que permitan incrementar la eficacia y disminuir los efectos secundarios. La investigación reciente sugiere que ciertos alucinógenos como el LSD o la psilocibina pueden tener un impacto positivo para la migraña, además de una reducción en la latencia de eficacia, de modo que resultarían necesarias un menor número de dosis (Schindler et al., 2020).
Otro tipo de cefalea reconocida por su gravedad es la cefalea en racimos, a veces considerada como la más dolorosa de todos los tipos de dolor de cabeza (Sewell et al., 2006) y conocida por el nombre de "dolor de cabeza del suicidio" (Robbins, 2013). Tiene una prevalencia baja en la población mundial, representando el 1,5% del total de pacientes con dolor de cabeza, predominando especialmente en el sexo masculino y con un comienzo habitual entre los 20 y los 40 años. (Sewell et al., 2006; Sempere et al., 2006). La cefalea en racimos se clasifica normalmente en dos categorías: episódica, con periodos de remisión de más de un mes y crónica, cuando dura más de un año y tiene periodos de remisión inferiores a un mes (Sempere et al., 2006). Se manifiesta en forma de severos ataques de dolor durante un tiempo que se estima entre los 15 y los 180 minutos, y se acompaña de síntomas autonómicos ipsilaterales craneales (Headache Classification Committee of the International Headache Society [IHS], 2013).
Aunque no hay cura conocida para la cefalea en racimos, en ocasiones se pueden prevenir los ataques, así como provocar su interrupción con una relativa eficacia. Los principales tratamientos que se usan para abortar el ataque son el oxígeno y el sumatriptán, mientras que el verapamilo, las sales de litio y los corticoides son las principales recomendaciones a nivel preventivo (Preedy, 2016; Sewell et al., 2006). Sin embargo, estos tratamientos son ineficaces en algunos casos y, por lo general, no hay medicación para terminar eficazmente un periodo de cefalea en racimos, así como para prolongar el periodo de remisión. El tratamiento quirúrgico puede ser una de las opciones para los pacientes que no responden a este tratamiento estandarizado, incluyendo también la estimulación cerebral profunda o la estimulación del nervio occipital. No obstante, este tratamiento de cirugía cerebral puede tener complicaciones especialmente graves (Leone et al., 2006). De este modo, algunos pacientes han optado por el LSD o por la psilocibina para paliar este grave dolor de cabeza (Sewell et al., 2006). Algunos estudios de carácter epidemiológico han ido enfocados en esta línea, investigando el uso de las drogas ilegales en pacientes afectados de cefalea en racimos (Donnet et al., 2007). Por lo general se ha observado una mayor frecuencia en el uso de la población que sufre dicho dolor de cabeza, aunque sigue sin establecerse si es debido a una mejoría real de los síntomas, a una respuesta placebo, a la convicción del paciente o a antecedentes fisiopatológicos comunes entre la cefalea en racimos y las conductas adictivas como el consumo de drogas (De Coo et al., 2019).
Por último, debemos mencionar a la ketamina, un derivado de la fenciclidina y uno de los fármacos que se utilizan como anestésico general, siendo de los pocos fármacos anestésicos intravenosos que muestran un efecto analgésico. Dicho efecto tiene lugar a dosis bajas y consigue inhibir la transferencia del dolor al SNC, lo que puede ser relevante ante determinadas circunstancias médicas que provoquen cefalea (Han et al., 2013). Por otro lado, también se ha examinado el efecto de la ketamina sobre la interrupción de la migraña, centrándose los primeros estudios en un contexto ambulatorio en el cual evaluaron la ketamina a través de diversas vías de administración y para diferentes causas de migraña, con resultados variables (Bilhimer et al., 2020).
Mecanismo de acción del LSD
El LSD es un agonista serotoninérgico (perteneciente al grupo de las indolaminas) que fue sintetizado por primera vez por Albert Hofmann en 1938, pasando inadvertido hasta 1943, cuando el investigador descubrió sus propiedades alucinógenas (McGeeney, 2013). Se ha hipotetizado que actúa inhibiendo el disparo de las células de serotonina, al mismo tiempo que evita que sus receptores postsinápticos sean regulados al alza o a la baja. Passie et al. (2008) han señalado que el LSD actúa como un agonista de los autorreceptores de serotonina en los receptores 5-HT1A del locus coeruleus, de los núcleos del rafe y de la corteza. También actúa como agonista parcial en el receptor postsináptico 5-HT1A, además de exhibir una afinidad elevada por otros subtipos de este receptor (5-HT1B, 5-HT1D y 5-HT1E). Sin embargo, sus efectos alucinógenos se han ligado a su actividad como agonista sobre el receptor 5-HT2 (característica compartida por otros alucinógenos pertenecientes al grupo de las indolaminas), de manera que la dosis del alucinógeno correlaciona con su respectiva acción sobre dicho receptor. La mayoría de los datos señalan específicamente al receptor 5-HT2A, aunque no podemos descartar un efecto sobre el 5-HT2C. La activación de los receptores 5-HT2A tiene lugar principalmente en las células piramidales neocorticales, produciendo un aumento en los niveles de glutamato corticales e influyendo indirectamente en los receptores NMDA, lo que puede conducir a una alteración entre la transmisión de la zona cortical con zonas subcorticales.
Mecanismo de acción de la psilocibina
La psilocibina se obtiene a partir de diferentes hongos, habiéndose descrito más de 100 especies de hongos que la contienen, muchos de ellos pertenecientes al género Psilocybe. Al igual que el LSD, tiene como diana farmacológica a los receptores serotoninérgicos, por lo que también es una sustancia alucinógena perteneciente al grupo de las indolaminas. Es considerado un profármaco, ya que tras su administración se metaboliza a través de una desfosforilación, dando lugar a la psilocina, siendo así farmacológicamente activa. Se caracteriza principalmente por su actividad como agonista del receptor postsináptico 5-HT2 y, aunque no parece explicar completamente todos sus efectos (Winter et al., 2007), se considera el mecanismo responsable de las alucinaciones visuales cuando la activación tiene lugar en la capa V de la corteza prefrontal medial (mPFC). Específicamente, un estudio encontró que la administración de la psilocibina disminuyó los valores de la onda alfa en la exploración electroencefalográfica (EEG), además de disminuir los potenciales evocados visuales N170, asociados a la aparición de las alucinaciones (Kometer et al., 2013).
Por otra parte, al igual que el LSD, la psilocibina no muestra afinidad específica por los receptores de glutamato, sin embargo, son modulados indirectamente por su actividad serotoninérgica. Los trabajos realizados con tomografía por emisión de positrones (PET) han demostrado que, tras la administración aguda de psilocibina, se produce un hipermetabolismo de glutamato a nivel de la corteza medial frontolateral y frontal (Carhart-Harris et al., 2013).
Mecanismo de acción de la ketamina
La ketamina es un anestésico que pertenece al grupo de las arilhexilaminas. Esta sustancia, cuando es consumida a altas dosis, actúa antagonizando a los receptores de NMDA de manera no competitiva, lo que se ha relacionado con sus efectos psicodislépticos (Tyler et al., 2007). Concretamente, antagoniza los receptores NMDA de las interneuronas de GABA inhibitorias en la corteza prefrontal medial, desinhibiendo a las neuronas piramidales y, en última instancia, aumentando el glutamato extracelular. (De Gregorio et al., 2018).
Además de este mecanismo de acción, la ketamina muestra afinidad por los receptores opioides, de serotonina (especialmente a los receptores 5-HT1 y 5-HT2), muscarínicos (Tiger et al., 2020), así como también interactúa con la dopamina (D2) y con los bloqueadores de los canales de sodio (Peltoniemi et al., 2016). Es importante destacar que la ketamina también actúa liberando catecolaminas e inhibiendo su recaptación cuando se administra a dosis bajas (Bakhsh & Greer, 2021).
El objetivo de este trabajo es revisar la evidencia disponible en relación con la posible utilidad de sustancias con propiedades psicodélicas (LSD, psilocibina, ketamina) en el tratamiento de las cefaleas.
Metodología
Para la realización de esta revisión teórica se utilizaron las bases de datos de Web of Sciences, Scopus y Pubmed, sin límite temporal, utilizando los siguientes descriptores: «psilocybin», «LSD», «ketamine», «migraine», «cluster», «headache» y «hallucinogens», los cuales fueron aplicados al título, resumen y palabras clave. La búsqueda se completó con la revisión manual de las referencias de artículos, con objeto de identificar trabajos pertinentes para esta revisión que no se hubieran detectado.
Resultados
Psilocibina y LSD
En la Tabla 1 se recogen los estudios que han examinado el potencial terapéutico de la psilocibina y el LSD en el tratamiento de las cefaleas. A continuación, se detallan los aspectos más relevantes de cada uno de ellos.
Uno de los primeros trabajos al respecto fue realizado veinte años después del descubrimiento del LSD. Sicuteri (1963) realizó un estudio preliminar en el que usó LSD y derivados, como el 2-Bromo-LSD, observando cierta eficacia para las cefaleas tras su administración.
En el resurgimiento de las investigaciones con alucinógenos, Sewell et al. (2006) entrevistaron a 53 pacientes con cefalea en racimos, quienes analizaron el tratamiento utilizado y su valoración acerca de la eficacia. Para abortar el ataque de cefalea la psilocibina fue efectiva en un 85% de los participantes; solo dos personas usaron LSD, siendo efectivo en un 50%. En cuanto al tratamiento profiláctico, la psilocibina se catalogó de eficaz en un 52% y de parcialmente efectivo en un 18%; ocho tomaron LSD con una eficacia del 88%. Por último, se recogió la extensión del periodo de remisión, lo que resultó eficaz en el 91% de pacientes que consumieron psilocibina y en un 80% de los que consumieron LSD. Además, se observó que una sola dosis de LSD era suficiente para inducir de un periodo de remisión y raramente se necesitaron tres dosis de psilocibina. Cabe destacar que todas las dosis fueron subalucinógenas.
En un estudio posterior (Karst et al., 2010), el interés se volvió a centrar en el 2-Bromo-LSD y, partiendo del estudio preliminar de Sicuteri (1963), usaron el mismo rango de dosis. La sustancia se les administró a cinco pacientes con cefaleas en racimos (uno de ellos episódica y el resto crónica), una vez cada cinco días hasta un total de tres dosis. El paciente con cefalea en racimos episódica se mantuvo en remisión hasta la fecha de publicación de dicho estudio. Dos de los pacientes que sufrían cefalea en racimos crónica afirmaron experimentar una reducción relevante en cuanto a la frecuencia de sus ataques, incluyendo una remisión durante más de un mes (pasando así al subtipo de cefalea en racimos episódica). En cuanto a otro de los pacientes, se produjo una disminución de la frecuencia de los ataques dejando de usar el tratamiento estandarizado, no obstante, no pasó un mes completo de remisión y se produjo un aumento en la frecuencia de los ataques unos seis meses después del tratamiento. Esta reducción tan relevante de los síntomas no se produjo en el último paciente, aunque sí indicó una disminución de la intensidad de los ataques de aproximadamente un 30% en los primeros cuatro meses. Probablemente también pudo haber influido que el paciente siguiera consumiendo alcohol, puesto que es un desencadenante conocido y común de estos ataques.
Pese a estos alentadores resultados, en varios estudios (Griffiths et al., 2006; Griffiths et al., 2008), aunque no se evaluó el dolor de la cabeza de manera específica, algunos de los participantes informaron de manera espontánea un aumento en el dolor de cabeza tras la administración de psilocibina. Por este motivo, Johnson et al. (2012) decidieron analizar el efecto de la psilocibina en voluntarios sanos, con diferentes dosis en un estudio a doble ciego y con un diseño cruzado. La cefalea tuvo lugar, significativamente, en un número mayor de participantes en cada dosis de psilocibina en comparación con el placebo. La gravedad de las cefaleas entre los que informaron de la misma estuvo relacionada con la dosis, aunque todos los dolores de cabeza fueron calificados como leves o moderados, de manera que ningún participante consideró que el dolor fuera severo con ninguna de las dosis.
La siguiente investigación relevante (Schindler et al., 2015) se realizó en forma de encuesta a pacientes que sufrían cefalea en racimos. En cuanto a la interrupción del ataque encontraron que la psilocibina se catalogó como más eficaz que los triptanes usados, el triptán intranasal y el oxígeno, pero no más que la inyección de un triptán. Con respecto a la prevención, describieron a la psilocibina y al LSD como más efectivos de manera significativa que el verapamilo, la prednisona y la metisergida, mientras que la eficacia de la psilocibina y el LSD no fue estadísticamente diferente, al igual que no se diferenciaron del 2-Bromo-LSD, pero sí resultaron más eficaces que el LSA y el DMT. Cabe subrayar que las dosis no fueron alucinógenas, lo cual no restó eficacia.
Por otra parte, ante la existencia de asociaciones y foros online sobre cefaleas, Andersson et al. (2017) analizaron 13 temas acerca de la migraña y 19 acerca de la cefalea en racimos. Los autores concluyen que los pacientes se suelen encontrar desesperados y vulnerables, considerando las sustancias ilegales como último recurso para su dolor. Por lo general, hay poco o ningún interés por los efectos psicodislépticos de estas sustancias, de manera que dichos efectos son tolerados o evitados usando dosis subalucinógenas. Principalmente, la psilocibina, el LSD y las triptaminas psicodélicas (como DMT) resultaron eficaces como profilaxis y tratamiento abortivo tanto de la cefalea en racimos como de las migrañas, de manera que informaron de un descenso significativo en la frecuencia y en la intensidad de los ataques en ambos casos, mientras que algunos pacientes experimentaron una remisión completa. Sin embargo, los pacientes solían seguir manteniendo el consumo de alucinógenos algunas veces al año a fin de seguir en ese estado.
Recientemente, Schindler et al. (2020) han explorado los efectos de la psilocibina en un estudio a doble ciego realizado en pacientes con migraña. En la primera sesión experimental todos los sujetos recibieron placebo, y en la segunda psilocibina. La frecuencia de las migrañas disminuyó con la psilocibina significativamente en comparación con el placebo, además de reducir la gravedad del dolor y el deterioro funcional, aunque no se encontraron diferencias significativas en cuanto a la duración de los ataques. Corroborando lo observado por Johnson et al. (2012), el segundo ataque de migraña se produjo en un tiempo significativamente menor tras la psilocibina. Conviene destacar que en las dos semanas evaluadas se produjo la mejoría tras una única administración de una dosis baja de psilocibina.
En la Tabla 2 se describen los aspectos principales de los estudios de caso único realizados, recogiendo las características del caso, la sustancia usada, así como su administración y los resultados obtenidos por el paciente.
Uno de los primeros estudios al respecto (Ling & Buckman, 1960), cuando el LSD era usado en psicoterapia, relataba el caso de una mujer de 51 años que padecía migraña severa desde los 9. Tras la toma de LSD durante seis sesiones se observó un cese de los ataques que duró, al menos, hasta la publicación del estudio. Años más tarde, Snow (2003) describe su propia experiencia al sufrir migraña de tipo hemiparésica desde los 15 años, para la cual no existe cura. Comenzó a usar LSD con la esperanza de aliviar su dolor, con buen resultado, de modo que a lo largo de los años siguió consumiéndolo cada medio año a modo preventivo.
Sewell et al. (2006) mantuvieron contacto con un paciente de cefalea en racimos episódica antes de desarrollar su estudio. Se trataba de un hombre de 34 años que sufría esta cefalea desde los 16, pero a los 22 años encontró mejoría al usar LSD recreativamente; basándose en su experiencia decidió tratarse con esta sustancia y, posteriormente, con psilocibina. Con las administraciones de psilocibina cada tres meses consiguió una remisión duradera. Por otra parte, Sempere (2006) describió el caso de un varón de 47 años con cefalea en racimos episódica, la cual pasó al subtipo crónico. No apreció eficacia con el tratamiento estandarizado, hasta que en un foro descubrió la psilocibina, que probó en uno de sus ataques, remitiendo totalmente en 20 minutos. Tras ingerir tres dosis a lo largo de dos semanas cesaron los ataques, permaneciendo asintomático en los seis últimos meses. De manera preventiva optó por una infusión una vez al mes.
Un caso reciente (Johnson & Black, 2020) describe a una mujer de 48 años que sufría cefalea en racimos crónica (además de trastorno depresivo mayor, osteoartritis y dolor de espalda). El tratamiento usado para la cefalea tenía una eficacia limitada y, desesperada, durante un fuerte ataque tomó Argyreia nervosa, una planta que contiene LSA (análogo químico del LSD). El resultado fue positivo durante dos semanas, tanto para la cefalea como para los síntomas depresivos y el dolor de espalda.
Ketamina
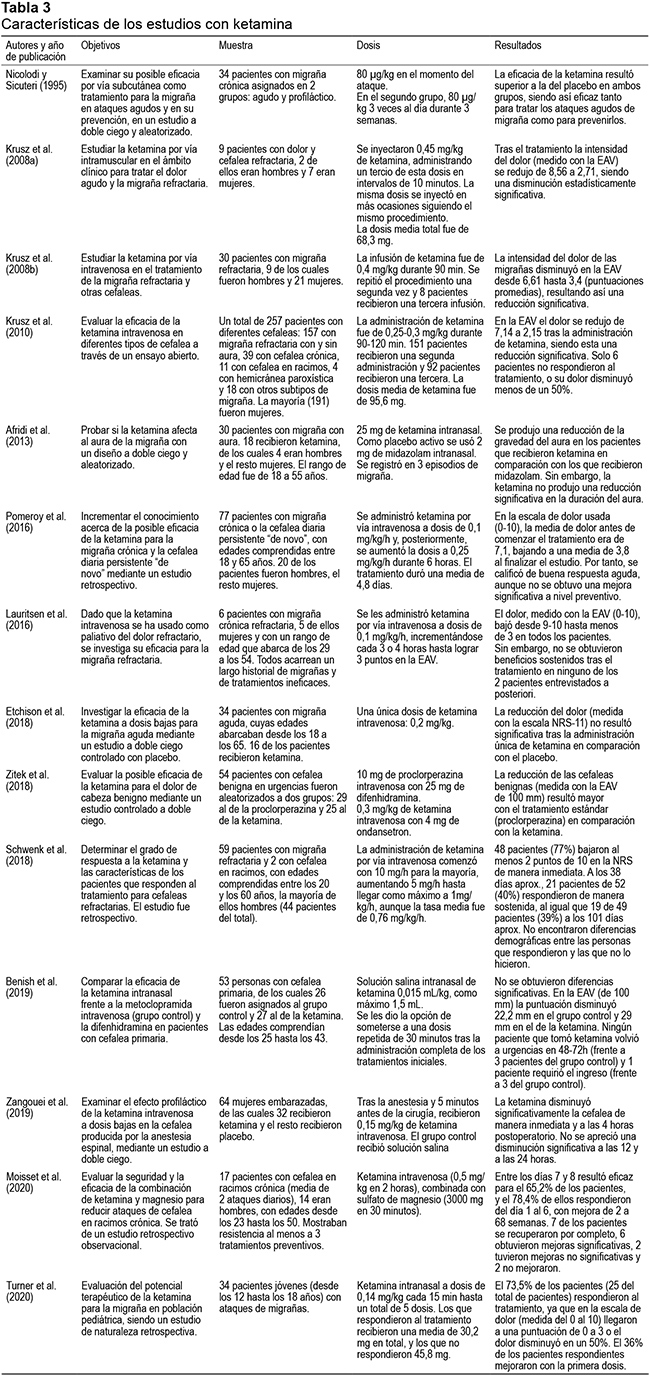
Una serie de estudios han analizado el potencial terapéutico de la ketamina administrada por diferentes vías para el tratamiento de diferentes tipos de cefaleas. En la Tabla 3 se recogen sus principales características.
Una de las primeras investigaciones al respecto (Nicolodi & Sicuteri, 1995) trató de comparar la intensidad del dolor antes y después de administrar ketamina por vía subcutánea en un grupo de 17 pacientes con migraña, comprobando así su posible efecto en una intervención aguda. Por otra parte, en otros 17 pacientes con migraña y refractarios al tratamiento preventivo estandarizado, se administró ketamina a fin de examinar un posible efecto profiláctico. El estudio fue aleatorizado y a doble ciego en ambos grupos de pacientes. La eficacia de la ketamina resultó superior a la del placebo, tanto para tratar los ataques agudos como para prevenirlos.
Krusz et al. (2008a) examinaron el papel de la ketamina, administrada por vía intramuscular, para el abordaje del dolor agudo y las migrañas refractarias. La intensidad del dolor inicial se redujo de manera significativa tras el tratamiento en los 9 pacientes evaluados, que recibieron varias dosis de ketamina y valoraron su dolor en la EAV. Asimismo, Krusz et al. (2008b) estudiaron la eficacia de la ketamina administrada por vía intravenosa para la migraña y otras cefaleas. Para ello, 30 pacientes fueron tratados con un total de 48 infusiones tras las que se obtuvo una reducción significativa del dolor, medido con la EAV.
La utilidad de la ketamina intravenosa también fue explorada en un ensayo abierto en 247 pacientes con diferentes tipos de cefalea: migraña refractaria con y sin aura, cefalea crónica, cefalea en racimos, hemicránea paroxística y otros subtipos de migraña (Krusz et al., 2010). La intensidad del dolor se midió con la EAV antes y después del tratamiento, observándose una disminución estadísticamente significativa, a pesar de que en 6 pacientes no resultó eficaz (o respondieron en menor medida).
Con posterioridad, Afridi et al. (2013) profundizaron en el estudio acerca de la acción de la ketamina intranasal sobre el aura de la migraña, usando un diseño doble ciego, y empleando midazolam como placebo activo. De los 30 pacientes que participaron, 18 recibieron ketamina, apreciándose en ellos una reducción de la gravedad del aura, aunque no redujo su duración.
Pomeroy et al. (2016) se centraron, principalmente, en el posible potencial terapéutico de la ketamina por vía intravenosa para aliviar la migraña crónica y la cefalea diaria persistente "de novo". Se les aplicó por vía intravenosa a 77 pacientes que fueron resistentes a todos los tratamientos previamente utilizados. La mayoría de los pacientes bajaron su puntuación en la escala de dolor; además fueron clasificados como respondedores agudos, puesto que redujeron al menos dos puntos en dicha escala a la hora del alta. Sin embargo, los efectos no se mantuvieron en el tiempo de manera significativa.
La ketamina por vía intravenosa ha sido evaluada para la migraña refractaria en un estudio realizado en el ámbito hospitalario (Lauritsen et al., 2016). La ketamina fue aplicada en seis pacientes ingresados y con la escala analógica visual (EVA) se registró el dolor de los pacientes en el momento del ingreso, antes de la infusión de ketamina y después. Cabe destacar que todos los pacientes llevaban un largo recorrido con la migraña (entre 12 y 46 años), además habían probado numerosos tratamientos para los ataques agudos (entre 14 y 26 medicamentos) y de modo preventivo (más de 7), todos ellos fallidos. Tras la administración de ketamina los 6 pacientes obtuvieron una puntuación inferior a 3 sobre 10 (al inicio todos puntuaban de 9 a 10) al menos durante 8 horas. Se hizo el seguimiento de dos de los pacientes, y ninguno de ellos informó beneficios sostenidos tras este tratamiento.
En otra investigación reciente (Etchison et al., 2018) se evaluó la eficacia de la ketamina en dosis bajas y por vía intravenosa como paliativo de la migraña aguda en el servicio de urgencias, en un estudio doble ciego controlado con placebo en 34 pacientes. En la escala de calificación numérica (NRS-11) midieron la reducción del dolor a los 30 minutos tras la aplicación, donde no se produjeron disminuciones significativas en las puntuaciones.
Asimismo, se analizó la ketamina para el tratamiento de cefaleas benignas en un departamento de emergencias (Zitek et al., 2018). Para ello, se diseñó un estudio doble ciego donde se comparó la eficacia de la ketamina por vía intravenosa con el tratamiento estándar (proclorperazina) en un total de 54 pacientes. La severidad de las cefaleas, medida con la EAV, disminuyó en mayor medida con el tratamiento estándar en comparación con la ketamina cuando fue medida a los 60 minutos, a los 45 minutos y en el seguimiento de 24 a 48 horas. De esta manera, el tratamiento estándar resultó superior a la ketamina en el abordaje de las cefaleas benignas.
Schwenk et al. (2018) realizaron un estudio retrospectivo a lo largo de tres años tras la administración durante cinco días de ketamina intravenosa con el fin de determinar la tasa de respuesta y las características de los pacientes que responden al tratamiento. Del total de pacientes (59 con migraña refractaria y 2 con cefalea en racimos) el 77% respondieron inmediatamente ya que bajaron al menos 2 puntos de 10 en la NRS, mientras que el 40% mantuvo una respuesta sostenida en la primera visita (tras 38 días aproximadamente) y el 39% en la segunda (tras 101 días aproximadamente).
Por su parte, Benish et al. (2019) compararon la ketamina con metoclopramida intravenosa y difenhidramina (siendo este el grupo control) en 53 adultos con cefalea primaria. Para ello se evaluó el dolor en la EAV al inicio del estudio y 30 minutos tras la administración; sin embargo, la ketamina por vía intranasal no produjo una disminución significativa del dolor.
Por otro lado, algunos estudios han analizado el efecto analgésico de la ketamina tras intervenciones quirúrgicas como la cesárea. Concretamente, Zangouei et al. (2019) se centran en la cefalea como efecto secundario de la anestesia espinal, examinando la posible acción profiláctica de la ketamina intravenosa. En un estudio controlado con placebo en 64 mujeres embarazadas, observaron que la ketamina disminuía significativamente la cefalea de manera inmediata y a las 4 horas postoperatorio; en cambio, la disminución no fue estadísticamente significativa tras las 12 y 24 horas después de la cirugía.
En cuanto a la relación entre ketamina y cefalea en racimos podemos señalar una investigación reciente, realizada por Moisset et al. (2020), en la cual evaluaron su eficacia en un grupo de 17 pacientes con cefalea en racimos crónica, todos ellos resistentes al menos a tres tratamientos preventivos y con una media de dos ataques diarios. La ketamina fue administrada por vía intravenosa combinada con magnesio y se valoró la disminución de los ataques entre los días 7 y 8 después de la administración única de ketamina, siendo significativa en el 65,2% del total de pacientes. El 78,4% de los pacientes respondedores al tratamiento experimentaron los efectos analgésicos entre los días 1 y 6 y duraron de 2 a 68 semanas. Siete de los pacientes obtuvieron una resolución completa de las cefaleas, seis experimentaron reducciones significativas, dos experimentaron una reducción no significativa y los dos últimos pacientes no mejoraron.
Por último, podemos mencionar un trabajo reciente que examina el tratamiento de la migraña pediátrica con ketamina (Turner et al., 2020). Se describe una serie de pacientes que acudieron al departamento de urgencias de un centro médico pediátrico con ataques de migraña, recibiendo ketamina intranasal cada 15 minutos hasta llegar a 5 dosis y registrándose las puntuaciones de dolor en una escala al inicio y tras la aplicación de la dosis. El 73,5% de los pacientes respondieron al tratamiento, y de ellos el 36% obtuvieron alivio significativo en la primera dosis.
Discusión
En el presente trabajo se ha realizado una revisión narrativa sobre el potencial terapéutico de alucinógenos como el LSD, la psilocibina y la ketamina en el tratamiento de diferentes tipos de cefaleas.
El LSD es calificado por los pacientes con migraña y cefalea en racimos como eficaz en diferentes trabajos, tanto en los estudios cualitativos a través de las entrevistas a una muestra afectada, como en estudios de caso único, sin olvidar la primera investigación al respecto (Sicuteri, 1963), donde se empezó a sospechar de cierta eficacia de la sustancia en pacientes con cefalea. Generalmente, esta sustancia suele administrarse con la finalidad de obtener una remisión en los periodos de migraña y de cefalea en racimos, obteniendo resultados satisfactorios, y en ocasiones solo ha sido necesaria una única dosis para inducir un periodo de remisión (Sewell et al., 2006; Schindler et al., 2015; Andersson et al., 2017; Ling & Buckman, 1960; Snow, 2003). También se ha administrado con la finalidad de detener los ataques agudos, aunque en este sentido existe una menor evidencia (Snow, 2003; Sewell et al., 2006; Andersson et al., 2017). Cabe destacar que las dosis usadas a nivel profiláctico (en torno a los 100 µg) son más elevadas que las que se suelen usar a modo abortivo (50 µg aproximadamente o dosis subalucinógenas).
Algunos autores han incluido en sus estudios a derivados del LSD. Es el caso del 2-Bromo-LSD, que ha demostrado su eficacia en varios trabajos aun siendo un análogo no alucinógeno (Sicuteri, 1963; Karst et al., 2010; Schindler et al., 2015). En todas las investigaciones el 2-Bromo-LSD se ha usado con fines preventivos y en aquellos que permitieron comparar su eficacia con el LSD, se obtuvieron resultados contradictorios, con una menor utilidad que el LSD (Sicuteri, 1963), o resultando igual de efectivos (Schindler et al., 2015). Un estudio reciente contempló otro derivado, el LSA, mostrando cierta eficacia en la profilaxis de un caso único (Johnson & Black, 2020), aunque fue catalogada como menos eficaz que el LSD y la psilocibina en un estudio anterior (Schindler et al., 2015).
Con respecto a la psilocibina, los pacientes con migraña y con cefalea en racimos la han considerado eficaz a través de encuestas (Sewell et al., 2006; Schindler et al., 2015; Andersson et al., 2017) y en los estudios de caso único (Sewell et al., 2006; Sempere, 2016), así como también demostró eficacia en una reciente investigación controlada con placebo (Schindler et al., 2020). Habitualmente, se ha administrado eficazmente tanto para abortar el ataque como para prevenirlo. Estos alentadores resultados contrastan con algunas investigaciones en las que el dolor de cabeza apareció como efecto secundario en voluntarios sanos tras la administración de psilocibina (Griffiths et al., 2006; Griffiths et al., 2008; Johnson et al. 2012), aunque la cefalea se calificó como leve o moderada y de carácter transitorio, al igual que ocurrió en un estudio con pacientes con migraña (Schindler et al., 2020).
En cuanto a la ketamina, uno de los primeros estudios mostró una eficacia superior al placebo en la detención de los ataques y prevención de los mismos siendo, que tengamos conocimiento, el único trabajo realizado a través de la vía subcutánea (Nicolodi & Sicuteri, 1995). Algunos autores examinaron la acción de la ketamina por vía intranasal, aunque contemplaron diferentes aspectos como el aura de la migraña, la cefalea primaria y la migraña en jóvenes, lo cual dificulta la comparación de los resultados obtenidos. Aun así, cabe mencionar que produjo una reducción en la intensidad del aura, aunque no en su duración (Afridi et al., 2013), y no se mostró superior al tratamiento estándar en la cefalea primaria (Benish et al., 2019); mientras que en la migraña de la población pediátrica careció de eficacia en la mayoría de los pacientes de la muestra del estudio (Turner et al., 2020). En esta revisión bibliográfica, solo una investigación incluyó la vía intramuscular en la administración de la ketamina (Krusz et al., 2008a), resultando ser eficaz para la disminución del dolor agudo y la migraña refractaria. Cabe resaltar que la mayoría de los estudios se han centrado en la actuación de la ketamina por vía intravenosa en diferentes tipos de cefaleas. De todas estas investigaciones, solo una se centra en la cefalea benigna, resultando inferior al tratamiento estándar en cuanto a eficacia (Zitek et al., 2018). Gran parte de los estudios restantes se han centrado principalmente en el posible efecto terapéutico de la ketamina intravenosa en la migraña, aunque de manera complementaria y, en algunos estudios puntuales también se ha examinado su acción en otras cefaleas como la hemicránea paroxística, la cefalea en racimos y la cefalea diaria persistente "de novo", entre otras. Por lo general, los resultados manifiestan la eficacia de la ketamina intravenosa en la reducción del dolor agudo, no siendo tan buena la respuesta a nivel preventivo (Lauritsen et al., 2016; Krusz et al., 2008b; Krusz et al., 2010; Pomeroy et al., 2017; Schwenk et al., 2018). Es importante hacer referencia al número de dosis administradas, ya que en todos estos estudios se administraron varias dosis a la mayoría de los pacientes, y solo una investigación analizó la administración de la ketamina en una única dosis, la cual no consiguió reducir el dolor migrañoso, en comparación con el placebo (Etchison et al., 2018). Una investigación reciente se centró específicamente en la cefalea en racimos crónica, constatando la eficacia de la ketamina con una única dosis en poco más de la mitad de los pacientes (Moisset et al., 2020). Por último, podemos mencionar un estudio en pacientes con cefalea producida por la anestesia espinal en embarazadas, donde la ketamina se muestra eficaz inmediatamente y a las pocas horas tras la cirugía, sin embargo, su eficacia desaparece conforme pasa el tiempo (Zangouei et al. 2019).
En el presente trabajo de revisión solo se han incluido los alucinógenos descritos dada la carencia de trabajos en este ámbito con otras sustancias psicodélicas. No obstante, se ha observado la cefalea como efecto secundario tras el consumo de ibogaina (Mash et al., 2018) y de escopolamina (Peatfield & Villalón, 2013). También existen datos anecdóticos sobre la salvia divinorum, usada por los mazatecos para aliviar el dolor de cabeza (Prisinzano, 2009); y sobre la mescalina o cactus del peyote, con la cual se experimentó en 1894, antes de la síntesis del LSD, y posteriormente algunos consumidores sanos informaron sobre cefalea tras su administración (McGeeney, 2013). El agonista serotoninérgico DMT se ha contemplado en algunos estudios, con una eficacia comparable (Andersson et al., 2017) o un tanto inferior (Schindler et al., 2015) a la obtenida por el LSD y la psilocibina, según algunos pacientes.
Por otra parte, el mecanismo de acción responsable de la eficacia de las sustancias mencionadas no está claro. En cuanto a las indolaminas consideradas (psilocibina y LSD), se ha planteado que su acción agonista a los receptores 5-HT2A podría estar mediando los efectos clínicos sobre la migraña (Sewell, 2020), en consonancia con los resultados obtenidos en estudios con modelos animales, donde se ha constatado que la activación de dichos receptores provoca efectos antiinflamatorios (Flanagan & Nichols, 2018). Las alteraciones en el sueño se encuentran bajo investigación, pero puede formar parte de la fisiopatología de las cefaleas, donde los receptores 5-HT2A también muestran su implicación, por lo que podría estar relacionado con el potencial terapéutico de estas sustancias (Schindler et al., 2018). No obstante, debemos tener en cuenta que el 2-Bromo-LSD (análogo no alucinógeno del LSD) ha mostrado cierta eficacia en algunos estudios, lo que sugiere que el mecanismo de acción implicado en las alucinaciones no está asociado (o solo parcialmente) con el potencial terapéutico para las cefaleas (Karst et al., 2010). Algunos estudios documentaron cefalea leve o moderada como efecto secundario de la psilocibina, lo que puede deberse a diferentes mecanismos, como por ejemplo la liberación retardada de óxido nítrico (NO), el agonismo de los receptores 5-HT2B o la vasodilatación meníngea de rebote, entre otras hipótesis (Johnson et al., 2012). Igualmente, mediante técnicas de neuroimagen se ha observado una disminución del flujo sanguíneo en el hipotálamo tras la administración de psilocibina y, a su vez, se apreció un aumento del mismo durante los episodios agudos de cefalea en pacientes con cefalea en racimos (Carhart-Harris et al., 2012).
Asimismo, es incierto el mecanismo de acción de la ketamina que subyace a sus efectos en las cefaleas, aunque se cree que el dolor es modulado mediante el antagonismo de los receptores NMDA (Guirimand et al, 2000). La fisiopatología de la migraña es compleja, pero uno de sus componentes postulados es el fenómeno "wind-up" (o suma temporal del dolor), que se refiere a un aumento de la excitabilidad de las neuronas nociceptivas, de manera que se incrementa la percepción de dolor. En modelos animales se demostró que este fenómeno permite a las neuronas del trigémino una mayor capacidad para procesar los estímulos dolorosos (Coste et al., 2008), donde los receptores NMDA parecen estar implicados (Muir, 2010), de modo que la respuesta a los estímulos dolorosos se ve disminuida por la ketamina (Price et al., 2002). Por otra parte, se postula que esta sustancia puede reducir el dolor al inhibir la neurotoxicidad provocada por el glutamato, lo que a su vez inhibiría la depresión propagada cortical (Sarchielli et al., 2007), una onda de actividad que se propaga paulatinamente y que parece ser uno de los componentes fisiopatológicos de la migraña (Charles y Baca, 2013), que activa a los canales de NMDA con la consiguiente liberación glutamatérgica (Hoffman y Charles, 2018). Es importante destacar que nos hemos centrado en la actuación de la ketamina a altas dosis (Tyler et al., 2007) debido a la escasa investigación con dosis bajas en el tratamiento de la cefalea (Etchison et al., 2018).
A pesar de que los resultados obtenidos en diversos estudios señalan cierta eficacia de las sustancias analizadas, debemos tener en cuenta las limitaciones que presentan. Atendiendo a las limitaciones metodológicas en el caso del LSD y de la psilocibina, es importante subrayar la insuficiencia de estudios aleatorizados y a doble ciego, especialmente en el LSD y sus derivados. Este hecho dificulta que las conclusiones sean firmes. También es importante considerar que los estudios suelen contar con una muestra pequeña que puede ser no representativa de la población, de modo que los resultados son difícilmente extrapolables. Por otra parte, la información recogida de forma retrospectiva a través de las entrevistas puede haber aumentado el riesgo de sesgos, y además en estas entrevistas o en los foros puede haber cierto sesgo en la selección de los pacientes, ya que solo participaron aquellos que contaban con acceso a internet y a ciertos sitios web. Otra limitación es el desconocimiento de las dosis usadas y de la pureza de las sustancias consumidas por algunos pacientes. Por último, cabe mencionar la limitación de la validez diagnóstica, puesto que algunos diagnósticos de cefalea en racimos son controvertidos y realmente podrían sufrir otro trastorno similar como es el caso de la hemicránea paroxística; de igual modo algunos pacientes padecían varios tipos de cefaleas.
Respecto a la ketamina, también nos encontramos con ensayos abiertos y con algún estudio retrospectivo, no obstante, existe un mayor número de trabajos en los que se usa un diseño doble ciego. Encontramos ciertas limitaciones que impiden generalizar los resultados dada la variabilidad en los estudios puesto que, además de diferir en el diseño, para medir la reducción del dolor se ha hecho uso de diferentes instrumentos (escala NRS-11, EAV de 10 o de 100mm, simplemente la valoración de 0 a 10 o la cuantificación de ataques diarios) que permitían la valoración subjetiva de los pacientes, lo que puede suponer un sesgo en sí mismo. Además, la ketamina se ha administrado por diferentes vías, en diferentes dosis y para diversos problemas de cefalea, sin olvidar un posible sesgo en la validez del diagnóstico de los pacientes. Asimismo, en los trabajos que contaron con un grupo placebo existía la posibilidad de desenmascaramiento debido a los efectos característicos que produce la ketamina; solo un estudio utilizó un placebo activo que permitía no descubrir la sustancia administrada en caso de que los pacientes no hubiesen consumido esta droga con anterioridad, dadas ciertas características particulares asociadas a esta sustancia como, por ejemplo, el nistagmo.
Este es el primer trabajo de revisión bibliográfica que abarca el posible potencial terapéutico de las sustancias con propiedades psicodélicas en el tratamiento de diversas cefaleas, aunando información acerca de los estudios realizados hasta la fecha. Esta revisión puede ser de interés para los investigadores y clínicos, de cara a futuros trabajos en este ámbito. Para poder confirmar la eficacia de los alucinógenos mencionados en el tratamiento de las diferentes cefaleas, se necesitan futuros trabajos que permitan solventar las limitaciones anteriores. El interés general gira en torno a la necesidad de estudios controlados, especialmente utilizando placebos activos que dificulten el desenmascaramiento. Asimismo, sería importante caracterizar más cuidadosamente la actuación de dichos psicodélicos en los ataques agudos y en el periodo de remisión, sin interferencia de otros fármacos y utilizando escalas de dolor detalladas, además de definir el tipo de pacientes que puede verse beneficiado. Lejos de apoyar el consumo de sustancias ilegales, se trata de determinar la verdadera eficacia en las diferentes cefaleas, siendo el foco de atención una población que, en ocasiones, es resistente al tratamiento estándar y puede verse motivada por la desesperación hacia conductas de riesgo o incluso hacia el suicidio.
En conclusión, ante el resurgimiento del interés por los alucinógenos un creciente número de estudios sugiere su potencial terapéutico para diversos trastornos. En este trabajo nos hemos centrado en el posible uso de las sustancias psicodélicas para las cefaleas. Principalmente, la evidencia disponible hasta la fecha confirma que el LSD es especialmente eficaz para la profilaxis de las cefaleas, siendo minoritario su uso como abortivo; se constata además la posible utilidad de la ketamina en la detención de los ataques, administrada por vía intravenosa en la mayoría de los estudios, aunque no demuestra tal eficacia para prevenir los ataques; mientras que la psilocibina resulta eficaz tanto a nivel abortivo como profiláctico. Secundariamente, estudios puntuales señalan la eficacia de derivados del LSD, concretamente 2-Bromo-LSD y LSA, y del agonista serotoninérgico DMT. La mayoría de los resultados se han obtenido de una muestra de pacientes con migraña y cefalea en racimos, aunque minoritariamente también se han tratado otras cefaleas como, por ejemplo, la cefalea diaria persistente "de novo" o la hemicránea paroxística. Se deben considerar las múltiples limitaciones metodológicas que presentan muchos de estos estudios, así como la escasez de los mismos, por lo cual se requieren futuras investigaciones que permitan solventar las dificultades encontradas para la generalización de los resultados.