Introducción
El desarrollo acelerado del mundo ha producido cambios significativos en los hábitos alimentarios de las personas, generando un aumento en la ingesta de azúcares y grasas, que conlleva a una creciente incidencia de la obesidad y enfermedades no transmisibles asociadas1. Algunos de los factores de riesgo para su desarrollo incluyen el desbalance energético, la oferta masiva de productos ultraprocesados en el mercado2, procesos de aculturación alimentaria3, un consumo excesivo de alimentos altamente palatables1, entre otros. El análisis de este tipo de ingesta caracterizada por la pérdida del control, ha identificado que factores como la ansiedad, la depresión y el estrés postraumático son potenciales desencadenantes de hábitos de alimentación compulsiva4-6. A nivel de la literatura, el consumo compulsivo y crónico de alimentos palatables (alimentos ricos en grasas y/o azúcares, por lo cual se asocian a un alto estímulo placentero) se ha asociado a un término controvertido, la “adicción a la comida” que fue mencionada por primera vez en el año 1956 por Theron Randolph7, ésta ha evolucionado a través de los años hasta llegar a la creación de un instrumento de medición psicométrica en donde se clasifica y diagnostica8. Sin embargo, dicho constructo no es completamente aceptado por parte de la comunidad científica9, debido a que actualmente se desconoce el o los compuestos cuyo consumo/uso pueda explicar los cambios neurobiológicos y conductuales que se presentan en individuos con este tipo de adicción.
Partiendo de que en una adicción se exhiben cambios conductuales frente al consumo de ciertas sustancias a pesar de los efectos negativos que dicho consumo pueda generar en los individuos10. En la escala YFAS se teoriza que individuos con adicción a la comida presenten criterios de adicción a sustancias psicoactivas11, los cuales incluyen la pérdida del control, deseo persistente, tolerancia, abstinencia, alteraciones en la esfera social de la conducta, malestar clínicamente significativo frente al consumo y demás, criterios validados en el Manual Diagnóstico y Estadístico de Desórdenes Mentales (DSM) de la Asociación Americana de Psiquiatría12. Producto de lo cual, se ha reforzado un estudio formal de la adicción a la comida, en el que se ha identificado que el consumo de alimentos palatables genera una activación del circuito de recompensa, que induce cambios a corto plazo, relacionados a la percepción del placer producto del aumento en la liberación de dopamina en estructuras como el núcleo accumbens, la amígdala y la corteza prefrontal12,13. En adición, los cambios a largo plazo que se relacionan a la sobre estimulación de este sistema indican una disminución en la densidad de receptores dopaminérgicos tipo 2, así como en la proyección dopaminérgica en las mismas estructuras cerebrales; estos cambios neurobiológicos se han asociado a las alteraciones en la conducta como la tolerancia, abstinencia, compulsividad y demás, frente al consumo crónico de los alimentos palatables13, en el artículo de Leigh & Morris se presenta evidencia que soporta el modelo de la adicción de la comida como constructo diagnóstico según los criterios de adicción validados por el DSM-IV.
Dentro de este panorama, se ha descrito que individuos con una activación crónica del circuito de respuesta al estrés14,15 e hijos de madres que presentaron hiperfagia de alimentos palatables durante la gestación16, pueden tener una mayor susceptibilidad a desarrollar este tipo de conductas alimentarias adictivas. Teniendo en cuenta dichos antecedentes, el presente artículo pretende analizar la evidencia actual, con el fin de comprender la relación entre el sistema endocannabinoide y la adicción a la comida, bajo el marco de los cambios neurobiológicos y conductuales de la adicción a sustancias psicoactivas.
Material y métodos
Se realizó una revisión exploratoria de la literatura implementando una búsqueda bibliográfica en las principales bases de datos: Cochrane, PubMed, y Google Scholar. Los términos DeCS (Descriptores en Ciencias de la Salud) utilizados en la búsqueda fueron: adicción a la comida, endocannabinoides, nutrición, núcleo accumbens, hipotálamo, CB1 y conducta alimentaria. Por su parte, los términos MeSH empleados fueron: food addiction, endocannabinoids, nucleus accumbens, hypothalamus, CB1 y feeding behavior. Es importante mencionar que la búsqueda que se realizó fue de carácter extensivo a partir de las estrategias que se presentan en la Tabla 1, otorgando mayor profundidad y extensión a la revisión a medida que se encontraban nuevos artículos bien sea en la búsqueda inicial o a partir de la bibliografía de aquéllos ya incluidos.
Tabla 1. Estrategias de búsqueda utilizadas para la identificación de artículos en bases de datos.
| Base de datos | Estrategia de búsqueda | Resultados obtenidos |
|---|---|---|
| PubMed | Endocannabinoids AND “food addiction” AND hypothalamus AND CB1 OR Endocannabinoids AND “feeding behavior” AND CB1 OR Endocannabinoids AND “nucleus accumbens” | 250 |
| Endocannabinoids AND “feeding behavior” OR Endocannabinoids AND “food addiction” OR Endocannabinoids | 97 | |
| Endocannabinoids AND food addiction AND hypothalamus AND CB1 OR Endocannabinoids AND feeding behavior AND CB1 | 143 | |
| Endocannabinoids AND "food addiction" AND hypothalamus AND CB1 OR Endocannabinoids AND "feeding behavior" AND CB1 | 93 | |
| Cochrane | Endocannabinoids AND “food addiction” AND hypothalamus AND CB1 OR Endocannabinoids AND “feeding behavior” AND CB1 OR Endocannabinoids AND “nucleus accumbens” | 2 |
| Endocannabinoids AND “feeding behavior” OR Endocannabinoids AND “food addiction” OR Endocannabinoids AND food | 47 | |
| Endocannabinoids AND food addiction AND hypothalamus AND CB1 OR Endocannabinoids AND feeding behavior AND CB1 | 0 | |
| Endocannabinoids AND "food addiction" AND hypothalamus AND CB1 OR Endocannabinoids AND "feeding behavior" AND CB1 | 0 | |
| Google Scholar | Endocannabinoids AND “food addiction” AND hypothalamus AND CB1 OR Endocannabinoids AND “feeding behavior” AND CB1 OR Endocannabinoids AND “nucleus accumbens” | 127 |
| Endocannabinoids AND “feeding behavior” OR Endocannabinoids AND “food addiction” | 191 | |
| Endocannabinoides AND adicción a la comida AND hipotálamo AND conducta alimentaria | 118 |
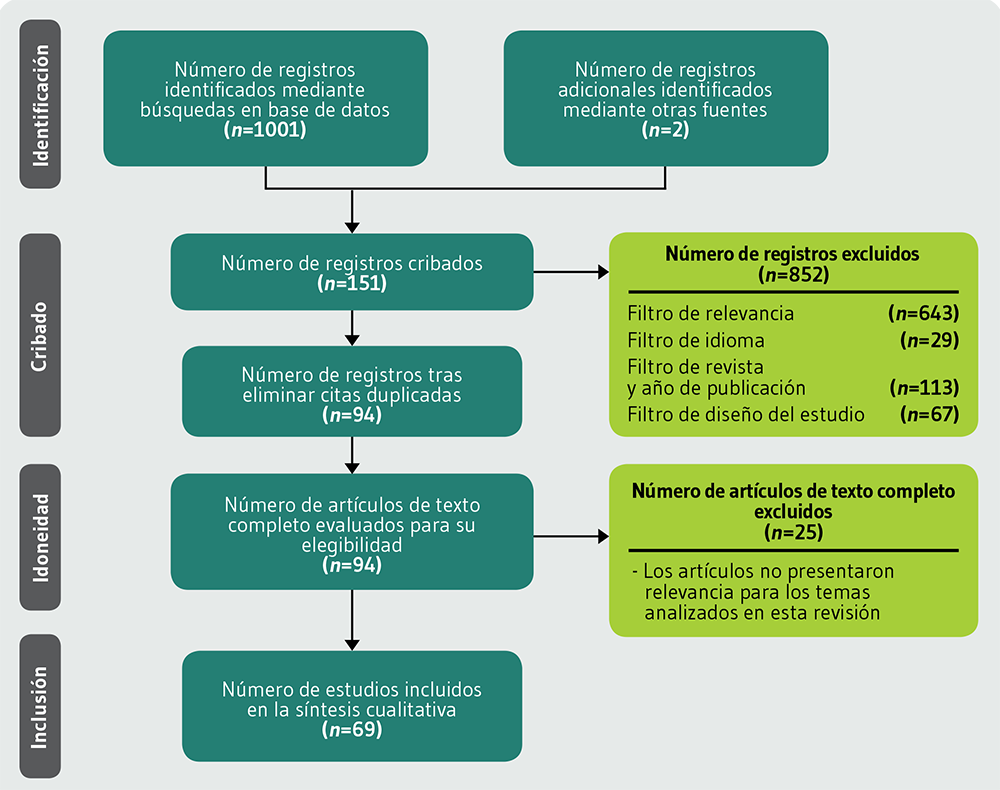
De los 1121 registros identificados, 120 no pudieron ser recuperados para su posterior lectura, lo que dió lugar a un análisis preliminar a partir de 1001 registros, durante el cual se procedió a la lectura del título y resumen, en donde se aplicaron los siguientes filtros:
relevancia: artículos que desarrollaran temáticas como la adicción a la comida y/o el sistema endocannabinoide, en humanos o en modelos de roedores;
idioma: en idioma inglés y/o español;
revista y año de publicación: artículos publicados entre el 2009 y el 2019 en revistas indexadas según el sistema de Scopus y Scimago;
diseño del estudio: se tuvo en cuenta que el diseño correspondiera a artículos originales, revisiones de la literatura y revisiones sistemáticas, teniendo en cuenta el objetivo y naturaleza de la revisión exploratoria.
El modelo visual del proceso efectuado fue adaptado a partir de las directrices recomendadas por PRISMA para revisiones exploratorias (PRISMA-ScR: Preferred Reporting Items for Systematic reviews and Meta-Analyses extension for Scoping Reviews).
Resultados
Dentro del proceso de selección de registros se incluyeron 5 artículos que no cumplieron con el criterio de año de publicación en el apartado de introducción debido a su relevancia en la temática abordada. Como resultado de los filtros principales de la búsqueda, se incluyeron 69 registros bibliográficos cuya descripción se presenta en la Tabla MA1, disponible en los Materiales Adicionales (http://www.renhyd.org/index.php/renhyd/article/view/1153/737) de este artículo. La Figura 1 muestra el diagrama de flujo de proceso de selección de artículos.
Sistema Cannabinoide
En el cuerpo humano, el sistema endocannabinoide se compone por moléculas lipídicas conocidas como cannabinoides y receptores cannabinoides; a continuación, se presentarán los mismos:
Cannabinoides: Los cannabinoides son un grupo de sustancias que de acuerdo a su naturaleza se pueden caracterizar y clasificar en tres grupos: 1) los fitocannabinoides, derivados de la planta Cannabis sativa L. conocidos como los cannabinoides clásicos. 2) los endocannabinoides, producidos al interior del cuerpo humano y 3) los exocannabinoides, obtenidos de forma artificial y son capaces de mimetizar a los fitocannabinoides17-19.
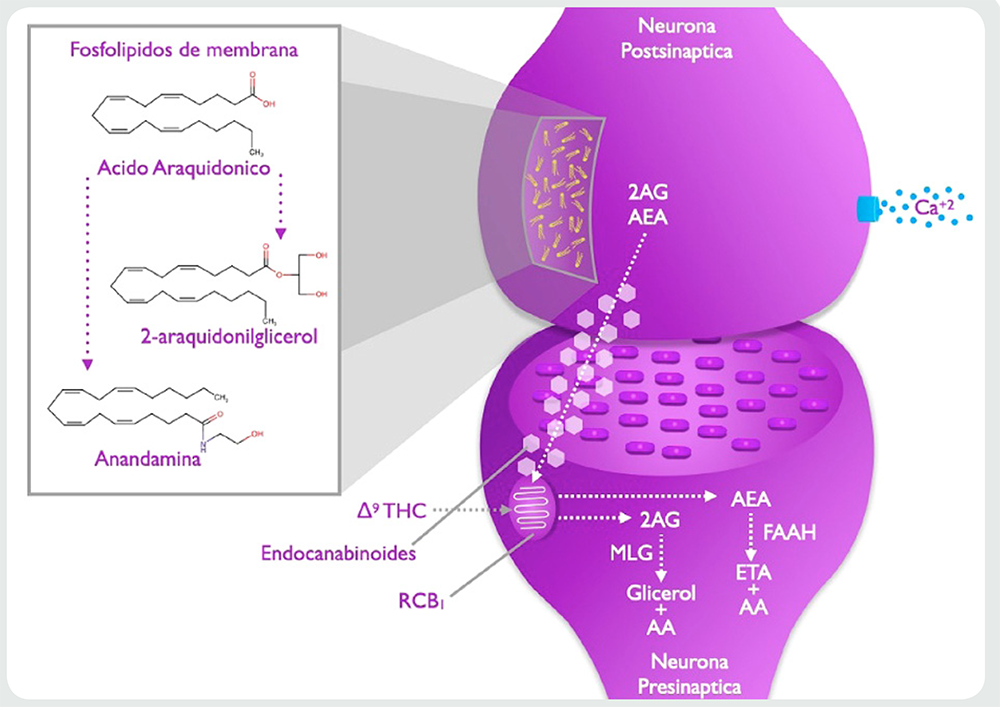
Los endocannabinoides son sustancias que se pueden producir al interior del cuerpo humano a partir de sustancias lipídicas, dentro de los cuales se encuentran los agonistas de los receptores CB1 que son derivados del ácido araquidónico, tales como anandamida (araquidonoil etanolamida o AEA), 2-araquidonoil-glicerol (2-AG), 2-araquidonil-glicerileter (noladín, 2-AGE), O-araquidoniletanolamina (virodhamina), y N-araquidonil-dopamina (NADA)18, estas sustancias no pueden ser almacenadas ya que se degradan rápidamente por acción de la enzima FAAH (Fat acid amide hydrolase, en inglés). Por lo cual, la obtención de los endocannabinoides se lleva a cabo a demanda a partir de membrana que contienen ácido araquidónico almacenados en las membranas neuronales20. Los endocannabinoides más estudiados son AEA y el 2-AG18,21.
Receptores Cannabinoides: Los receptores cannabinoides son compuestos pertenecientes a la familia de los receptores unidos a proteínas G22,23 y están compuestos por tres subunidades: alfa, beta y gamma. Cuando un agonista se une a su receptor, éste cambia su conformación, permitiéndole interactuar con la proteína G a la cual está ligado, hasta ahora inactiva. Al activarse la proteína G, su subunidad alfa se hace menos afín a las subunidades beta y gamma, por lo que se separa de ellas. A su vez, el complejo beta-gamma se hace menos afín al receptor y se separa de él. Una vez libre en la matriz intracelular el complejo beta-gamma es capaz de llevar a cabo múltiples funciones que caracterizan a la activación de los receptores cannabinoides24,25. En este grupo se han identificado los receptores cannabinoides tipo 1 (CB1) y tipo 2 (CB2); para esta revisión se analizará a profundidad los CB1, debido a que están ampliamente distribuidos en el cuerpo humano, los efectos de su activación sobre el tracto gastrointestinal y sistema nervioso central se asocian a una alteración de las vías homeostática y hedónica de la ingesta, además de relacionarse con los cambios neurobiológicos de la adicción al cannabis mediada por el tetrahidrocannabinol.
Los receptores CB1 son compuestos de naturaleza proteica cuya cadena está compuesta por 472 aminoácidos, con 7 dominios hidrofóbicos transmembrana típicos de los receptores acoplados a proteínas G, que se extienden a través de la membrana plasmática, con bucles extra e intracelulares26. Este receptor es capaz de establecer enlaces con los tres tipos de cannabinoides en diferentes áreas del cuerpo humano de acuerdo a su localización, entre las cuales resaltan el estómago, el páncreas, el intestino delgado, el hígado, el tejido adiposo, los órganos reproductores y el sistema nervioso central27.
En este último, la literatura ha descrito a profundidad los fenómenos de señalización frente a la activación del sistema endocannabinoide, estructuras como el cerebelo, hipocampo, córtex prefrontal, ganglios basales y otras, cuentan con un mecanismo en común, presentado en la Figura 2, en donde se ve que estímulos como el cambio del gradiente de concentración por la entrada de iones de calcio a la neurona postsináptica promueven la liberación de fosfolípidos membranales que contienen ácido araquidónico, a partir del cual se producen endocannabinoides (AEA o 2-AG en el ejemplo), una vez liberados, viajan a través del espacio extracelular y se unen a los receptores CB1 de la neurona presináptica.
Las uniones entre los cannabinoides y los receptores CB1 se dan mediante la asociación de un grupo polar hidroxilo fenólico y el grupo carboxílico del receptor por puentes de hidrógeno, además de la interacción de extremo alquilo altamente hidrofóbico de las moléculas con la zona hidrofóbica del receptor CB1 (entre las hélices 3-6-7)28,29. Tales uniones tienen una variada intensidad a nivel de sus efectos, lo cual está relacionado con el grado de afinidad presente entre el receptor y el cannabinoide.
Efectos del sistema cannabinoide con relación a la ingesta
La ingesta o el consumo de alimentos tiene en cuenta una sofisticada red de señalización en el cuerpo humano que comprende estructuras pertenecientes al sistema nervioso central y el tracto gastrointestinal30; a continuación, se presentarán las dos vías de la ingesta, la vía homeostática y la vía hedónica:
Vía homeostática: La regulación homeostática de la ingesta se da principalmente a nivel del hipotálamo, esta área cerebral compleja cuenta con múltiples estructuras conocidas como núcleos, mismos que le otorgan un rol principal en funciones tales como la regulación endocrina, el metabolismo a través de las señales de apetito y saciedad, ciclos del sueño, termorregulación, entre otras30. Como es de esperar, los receptores CB1 se expresan en más de uno de los núcleos celulares del hipotálamo, en este artículo se profundizará la evidencia de la activación de estos receptores sobre el núcleo arcuato, éste es el encargado de recibir la información de los depósitos energéticos en el cuerpo a través de hormonas periféricas como la grelina, la insulina y la leptina31.
La activación de los receptores CB1, en tejidos como el estómago y el páncreas, repercute en la producción y liberación de grelina31-35 y de insulina36-38, respectivamente. Cuando la grelina se asocia a los receptores GHS en aferentes vagales, se genera un estímulo que atraviesa el nervio vago hasta llegar al núcleo del tracto solitario, alcanzando posteriormente el núcleo arcuato, donde por un lado estimula la liberación de neuropéptidos orexigénicos como el neuropéptido Y (NPY) y la proteína asociada a Agouti (AgRP), y por otro lado provoca una disminución en la liberación de neuropéptidos anorexigénicos como pro opiomelanocortina (POMC) y transcrito regulado por cocaína-anfetamina (CART), ocasionando así un aumento en el apetito y, por consiguiente, da lugar a un mayor consumo de alimentos en los seres humanos, especialmente de aquellos que cuentan con propiedades gratificantes, los cuales se asocian también a una mayor liberación de dopamina39,40.
El papel de la insulina en la regulación de apetito y saciedad puede tener diferentes efectos a nivel del sistema nervioso central. Por un lado, el aumento de los niveles plasmáticos de insulina podría relacionarse con la disminución de la alimentación por la vía homeostática debido a sus efectos en el núcleo arcuato asociados a una menor liberación de los neuropéptidos orexigénicos NPY y AgRP37. De forma paralela, según el estudio de Figlewicz y Col.41, en el cual se administró una dosis de insulina en varios sitios receptores del sistema nervioso central de ratas tales como el núcleo arcuato, el núcleo accumbens y el área tegmental ventral, encontrando que su infusión en el núcleo accumbens incrementó la autoadministración de sacarosa. Adicionalmente, otro estudio efectuado en ratas realizado por Woods y Col.42, evidenció a partir de diferentes experimentos que tras el consumo de glucosa se estimula rápidamente la activación del receptor de insulina en el núcleo accumbens. Teniendo en cuenta esto, los autores proponen que es posible que esta hormona tenga la capacidad de informar al núcleo accumbens sobre el valor nutritivo de diferentes comidas promoviendo la ingesta hedónica, a través del mecanismo fisiológico descrito41,42.
La relación entre los cannabinoides y la leptina presenta un comportamiento distinto20,43, la literatura reporta que un aumento en los niveles plasmáticos de esta hormona se asocia a la disminución en la síntesis endógena de los cannabinoides, sin embargo, esta asociación ha sido descrita únicamente en personas con un peso corporal adecuado. Esta hormona es producida en los adipocitos y liberada al torrente sanguíneo por donde se transporta para luego cruzar la barrera hematoencefálica44, cuando actúa a nivel del núcleo arcuato, inhibe la actividad de las neuronas que coexpresan el neuropéptido Y (NPY) y la proteína asociada a Agouti (AgRP), de manera que disminuyen las señales de apetito a nivel hipotalámico. Por otro lado, la activación de los receptores de leptina en las neuronas que coexpresan pro opiomelanocorticona (POMC) y el transcriptor regulador por cocaína y anfetamina (CART), resulta en un aumento de la expresión de estos neuropéptidos y por ende en un efecto de saciedad. Así mismo, algunos estudios realizados en ratas obesas afirman que la leptina podría actuar como mediadora en la regulación del sistema endocannabinoide por medio de un mecanismo no identificado pero que se sugiere podría darse por una inhibición en el proceso de liberación de dichas sustancias actuando como un modulador negativo del sistema endocannabinoide antagonista del receptor CB145. La representación de los efectos del sistema endocannabinoide sobre la regulación de apetito y saciedad se presenta en la Figura 3.
Adicional a los efectos previamente presentados sobre la activación del sistema endocannabinoide que inciden en la actividad del núcleo arcuato, según los cuales se propone que podría darse una mayor ingesta, estudios adicionales podrían demostrar otras vías de acción de este sistema sobre la ingesta por la vía homeostática.
Un estudio realizado por Lage y Cols. en modelos animales mostró que la ingesta de alimentos bajo un estado de ablación del receptor CB1 podría estar asociado a un fallo en la activación de los neuropéptidos anorexigénicos transcriptasa relacionada con la cocaína-anfetamina (CART) y la pro opiomelanocortina (POMC); este efecto podría ocasionar que se dé un consumo de alimentos más prolongado en ratones cuando se da una escisión de los receptores CB1 en el núcleo paraventricular permanente46.
Los resultados del estudio realizado por Merroun y Cols. realizado en modelos animales, proponen que el sistema cannabinoide interacciona de manera importante con las neuronas productoras de orexina en el hipotálamo, ya que al aplicar medicamentos inhibidores del receptor CB1 se presenta una disminución significativa en el número de neuronas que expresan orexina A ocasionando que se dé una hipofagia mediada por la inhibición de los receptores CB1, la producción de NPY y orexina A47.
Vía hedónica: La ingesta hedónica hace alusión a los procesos motivacionales de la ingesta impulsados por el placer mediado por el circuito de recompensa en el cual la vía dopaminérgica mesolímbica tiene un rol principal. A nivel anatómico, el circuito de recompensa incluye las vías dopaminérgicas mesolímbica y mesocortical, la estimulación de cada una de estas vías tiene unos efectos específicos a nivel del comportamiento de los individuos frente a los estímulos placenteros que serán estudiados más adelante. Es necesario partir del hecho de que este circuito da lugar a una respuesta fisiológica a diferentes estímulos que habitualmente generan placer, tales como el sexo, realizar actividad física, consumir alimentos palatables e incluso el consumo de sustancias psicoactivas48,49. Una vez el individuo es expuesto a estos estímulos, se genera una activación de las neuronas del hipotálamo lateral que genera una liberación de orexinas, la cual estimula a las neuronas dopaminérgicas del área ventral tegmental (VTA)50, con lo que se produce una liberación de dopamina en las proyecciones que llegan al núcleo accumbens y amígdala (Vía Mesolímbica) y al córtex prefrontal (Vía Mesocortical).
La activación de las neuronas dopaminérgicas que proyectan al núcleo accumbens en la vía dopaminérgica da lugar a la sensación de placer característica de los diferentes estímulos, la exposición a cada uno de éstos produce una liberación de dopamina que varía de acuerdo al tiempo de exposición, tipo de estímulo, y magnitud del mismo50. Múltiples autores señalan que la actividad del sistema endocannabinoide sobre esta estructura potencia la percepción placentera frente al consumo de alimentos palatables, así como aumenta la sensibilidad a sus características organolépticas, resultando en un refuerzo positivo de su ingesta y modela las preferencias alimentarias51-55.
Siguiendo en la vía dopaminérgica mesolímbica, se ha propuesto que la liberación de este neurotransmisor a nivel de la amígdala se relaciona con la generación de recuerdos positivos asociados a la exposición al estímulo56,57 debido a que la amígdala es el centro emocional del Sistema Nervioso Central (SNC). De esta manera la sensación placentera producida en el núcleo accumbens tras la exposición al estímulo se ve reforzada por la asociación entre tal exposición y un mayor valor emocional que le brinda un espacio en la memoria de los individuos, efecto que se ha descrito en individuos con una exposición prolongada a los endocannabinoides49.
En la vía dopaminérgica mesocortical, la liberación de dopamina en el córtex prefrontal ha sido asociada con un efecto sobre la cognición, el comportamiento relacionado a las emociones de los individuos, de manera que los estímulos positivos podrían modular el comportamiento de las personas, así como sus habilidades cognitivas en general (atención, memoria, razonamiento)49,56. Por otro lado, Cortés-Salazar y Cols. afirman que la activación del sistema endocannabinoide podría tener un efecto locomotor estimulante asociado con una inducción a la búsqueda de alimentos, que en estudios realizados por dichos autores en modelos roedores a los que se administró un agonista del receptor CB1, se asoció con un aumento en la actividad de los animales de prueba en momentos comunes de reposo52. Este efecto es de gran importancia en los individuos ya que puede generar un impacto sobre la conducta alimentaria al presentar una pobre toma de decisiones, un mayor reflejo de búsqueda y comportamientos impulsivos51.
Sistema endocannabinoide y adicción a la comida
Los efectos a corto plazo de la activación del sistema endocannabinoide a nivel del circuito de recompensa se caracterizan por el aumento del flujo de dopamina al núcleo accumbens49,58, lo que genera los efectos placenteros característicos de la fase aguda del consumo de sustancias psicoactivas. De otro lado, los efectos del consumo crónico de sustancias psicoactivas resultan en una disminución de los niveles de transmisión dopaminérgica en el núcleo accumbens como regulación secundaria a la sobreactivación de este sistema59, fenómeno que desencadena una serie de cambios fisiológicos en los individuos como la tolerancia a las sustancias, el síndrome de abstinencia, el deseo constante por el consumo de la sustancia psicoactiva y demás cambios que denotan la presencia de conductas adictivas.
El análisis por tomografía de emisión positrones en el sistema nervioso central de individuos adictos a sustancias psicoactivas y en personas con obesidad como el realizado por Volkow y Col.60 encontró similitudes al estudiar la densidad de los receptores dopaminérgicos tipo 2 en el cuerpo estriado (incluido el núcleo accumbens). Como resultado concluyeron que los dos grupos estudiados presentaban una disminución en la densidad de estos receptores, los cuales guardan una relación con el control de los impulsos a nivel de la corteza prefrontal, de manera que los autores relacionan estos hallazgos en el sistema nervioso central con conductas características de los individuos que cursan con adicciones tales como la impulsividad y compulsividad frente al consumo de la sustancia60. Por tanto, la disminución de los niveles de transmisión dopaminérgica en el núcleo accumbens y la expresión de receptores dopaminérgicos tipo 2 en el núcleo accumbens son un punto en común entre los individuos con uso crónico de sustancias de abuso y aquellos quienes han tenido una exposición prolongada a alimentos palatables13.
Estudios realizados en modelos animales mostraron que tras una exposición prolongada a una dieta alta en alimentos palatables se evidenciaron cambios conductuales en los sujetos observados, asociados a una disminución en la actividad de marcadores dopaminérgicos en el núcleo accumbens y el cuerpo estriado61,62. Dichos cambios a nivel del circuito de recompensa podrían inducir alteraciones en los individuos que llevan a la expresión de conductas propias de la adicción49, como la pérdida del control frente al consumo de estos alimentos, el deseo persistente por su consumo, tolerancia, abstinencia, gran cantidad de tiempo utilizado en el consumo, reducción o abandono de actividades sociales, consumo a pesar de consecuencias adversas, consumo a pesar de consecuencias sociales o interpersonales, incumplimiento de la obligación del rol principal (colegio, trabajo, etc...), consumo en situaciones físicamente peligrosas y la presencia de deterioro o malestar clínicamente significativo como resultado de la ingesta11. Se ha podido evidenciar que la susceptibilidad a adquirir dichos comportamientos puede variar de acuerdo con el curso de vida del individuo, estudios realizados con modelos roedores, mostraron que aquellos sujetos expuestos a una estimulación de la vía hedónica en la adolescencia, tenían más probabilidades de perpetuar la conducta de impulsividad en la búsqueda de alimentos en la edad adulta61,62.
Estos criterios son incluidos en la escala de la adicción a la comida de Yale (YFAS 2.0), herramienta de medición psicométrica que analiza la presencia de cambios conductuales en el consumo de alimentos desde el espectro de la adicción a sustancias psicoactivas, enmarcada en el Manual Diagnóstico de Desórdenes Mentales (DSM)12. La escala fue desarrollada en el año 2009 por la psicóloga Ashley Gearhardt y Col.8, actualizada en el año 2016 con apoyo de la doctora Erika Schulte y Col., a partir de dicho análisis se determina si los individuos pueden presentar algún grado de dependencia hacia la comida, cuyo grado se define según la presencia de los diferentes criterios mencionados previamente11.
Autores como Ahmed y Cols. asocian la adicción a los alimentos al efecto de los azúcares a nivel del circuito de recompensa63, a partir de observaciones de cambios en el SNC de ratas tras el consumo de soluciones ricas en glucosa, sin embargo, no hay evidencia fuerte que vincule el consumo de algún componente dietario a la presencia de la adicción a la comida9.
A partir de la evidencia literaria analizada en esta revisión, se considera que el mecanismo fisiológico por medio del cual se desarrolla la adicción a la comida podría estar relacionado a la acción de los endocannabinoides, cuyo precursor es uno de los derivados del ácido linoleico, el ácido araquidónico; esta hipótesis se apoya parcialmente en estudios piloto como el de Naughton y Cols.64, quienes sugieren que el consumo de ácido linoleico puede promover una ingesta excesiva de energía, causada por un aumento en los niveles plasmáticos de grelina.
Consumo de alimentos y niveles plasmáticos de endocannabinoides
El estudio de Monteleone y Cols. encontró que, en individuos sanos, el consumo de una comida “palatable”, como una torta italiana con chocolate o nutella, se relacionaba directamente con un aumento en la síntesis del endocannabinoide 2-AG, cuyos niveles plasmáticos eran considerablemente mayores que en el grupo control, el cual había consumido alimentos poco palatables como leche o mantequilla (con el mismo aporte energético de la preparación palatable). Por otro lado, el consumo de los dos grupos de alimentos se relacionó con una disminución en los niveles plasmáticos de anandamida32. La base conceptual por la que se piensa que el consumo de ciertos alimentos puede aumentar los niveles de endocannabinoides radica en que la síntesis de los mismos en el cuerpo humano se lleva a cabo a partir del ácido araquidónico, un ácido graso poliinsaturado derivado del Omega 665. Esto se ve intensificado por el alto contenido de Omega 6 en los alimentos palatables (ricos en grasa y/o azúcares), debido a que habitualmente son preparados con aceites vegetales que, según su origen pueden presentar entre el 20 y el 79% de su contenido en forma de Omega 666.
Adicionalmente, el estudio de Bisogno y Col. identificó una relación inversamente proporcional entre los niveles plasmáticos de 2-AG y anandamida frente al consumo de alimentos ricos en Omega 3 (naturales o enriquecidos), en donde, como resultado del aumento del consumo de este ácido graso esencial en seres humanos con obesidad, se encontró una disminución de los niveles en plasma de los endocannabinoides mencionados67. Por lo cual se puede proponer que el consumo de ácidos grasos esenciales tiene una gran relevancia en la síntesis de endocannabinoides y sus diferentes efectos en los seres humanos, con aumento en la síntesis cuando se trata de la ingesta de Omega 6 y reducción en el caso de ingesta de Omega 3.
Discusión
La adicción a la comida, comprendida como una hiperfagia compulsiva en presencia de alimentos palatables, es un fenómeno de gran importancia en la actualidad, la conducta alimentaria en los seres humanos está cambiando y más aún en la población con obesidad, en la que se podrían evidenciar conductas que incluyen la pérdida de control, impulsividad, ansiedad, síntomas de abstinencia, cambios sociales y otros frente al consumo de alimentos60-62; los hallazgos asociados a esto pueden ser de gran utilidad para diversas áreas del conocimiento como la psiquiatría, psicología, nutrición humana y fisiología. Estos cambios que presentan paralelismos entre el consumo de alimentos palatables y las sustancias psicoactivas, frente a lo cual los autores proponen como punto en común los cambios neurobiológicos a nivel de la liberación de dopamina en estructuras cerebrales involucradas en la vía dopaminérgica mesolímbica como el núcleo accumbens y la amígdala, así como la corteza prefrontal en la vía mesocortical60.
La evidencia científica actual no presenta el o los mecanismos que expliquen tales cambios en el sistema nervioso central de las personas con adicción a la comida, sin embargo, hay autores que proponen asociaciones teóricas entre tal mecanismo y los endocannabinoides. Estas sustancias de naturaleza lipídica comparten similitudes estructurales y funcionales con los fitocannabinoides (provenientes de Cannabis sativa L.)17-19 frente a los cuales diferentes estudios han demostrado que tras asociarse a los receptores cannabinoides CB1, pueden generar efectos sobre la vía homeostática de ingesta a nivel de la regulación neuroendocrina de apetito y saciedad.
La activación del sistema endocannabinoide en las células P/D1 a nivel del fondo gástrico estimula la liberación de grelina que aumenta las señales de apetito a partir de los efectos de su estímulo sobre los grupos neuronales que expresan neuropéptidos orexigénicos en el núcleo arcuato39,40, la investigación asociada a ello ha sido proyectada como una alternativa terapéutica para el tratamiento de la obesidad, siendo la evidencia encontrada una base fundamental para el desarrollo de fármacos que puedan interferir en esta vía, y por ende, contribuir a la reducción de peso. Por otro lado, los efectos del sistema endocannabinoide sobre las células beta pancreáticas, se relacionan con el aumento en los niveles de insulina que se produce a partir del estímulo de la glucosa y de la expansión de la masa de estas células (ambos procesos modulados por endocannabinoides, tal como lo sugieren Bermudez-Silva y Cols.37); la cual incide en una disminución de la liberación de neuropéptidos orexigénicos, lo que puede resultar en una menor expresión de señales de apetito.
De esta manera los endocannabinoides pueden incentivar el consumo de alimentos. Este planteamiento coincide con los resultados de un estudio interdisciplinar que contó con la partición de dietistas y fisiólogos, liderado por Naughton y Cols.64, quienes realizaron un trabajo experimental en el cual se ofrecieron 3 tipos de desayunos con un aporte calórico semejante y diferentes perfiles de ácidos grasos esenciales a 3 grupos experimentales, la única diferencia de los desayunos fue el tipo de aceite ofrecido a los individuos, siendo uno alto en Omega 6 (aceite de cártamo), otro en Omega 9 (aceite de oliva extra virgen) y otro bajo en Omegas 6 y 3 o control (aceite de coco). Los autores encontraron que el grupo que consumió el desayuno con adición de aceite alto en Omega 6 tuvo un consumo de alimentos más prolongado frente a los demás grupos64, por lo que se asocia un mayor consumo de este ácido graso esencial al incremento de los niveles plasmáticos de endocannabinoides y al aumento en la liberación de grelina, por ende, se producían más neuropéptidos de apetito, dando lugar a un consumo mayor de alimentos en comparación al observado condiciones fisiológicas.
Adicionalmente, cabe destacar que los efectos descritos del sistema endocannabinoide sobre las hormonas que participan en la regulación de la ingesta homeostática también pueden tener un efecto directo sobre la ingesta hedónica. Se ha evidenciado que hormonas con un papel en la regulación de la vía homeostática de la ingesta como la leptina y la grelina podrían regular la vía hedónica a partir de la estimulación de la señalización de dopamina mesolímbica. Algunos estudios han mostrado que la administración de leptina inhibe la activación de las neuronas productoras de dopamina en VTA, mientras que la grelina podría actuar como un regulador de la señalización mesolímbica de dopamina, ya que se ha comprobado que su administración aumenta la actividad en dicha zona del cerebro, estimulando así la secreción de dopamina y, por ende, la motivación hacia el consumo de alimentos50. Se ha comprobado que la insulina también tendría un papel importante en la vía hedónica de la ingesta, ya que dicha hormona podría informar sobre la carga glicémica de diferentes comidas al Núcleo Accumbens, estimulando así la ingesta de alimentos ricos en carbohidratos41,42. Dichos estudios pueden considerarse como un insumo fundamental para la realización de ensayos clínicos en humanos, de interés para las áreas de fisiología, neurobiología y nutrición humana; buscando que éstos permitan dilucidar de manera más específica la interacción entre las vías homeostática y hedónica, así mismo, derivar de ello opciones terapéuticas que regulen la producción de las hormonas antes mencionadas, y permitan mejorar el estado nutricional de las personas con exceso de peso.
Lo anterior coincide con los resultados hallados por diversos autores53-57, quienes plantean que la actividad del sistema endocannabinoide en el núcleo accumbens puede verse asociada al aumento de la percepción de las propiedades hedónicas de los alimentos y propiciar el consumo de alimentos palatables, los cuales a su vez aumentan los niveles plasmáticos de endocannabinoides como el 2-AG 31. Si se tiene en cuenta que el núcleo accumbens hace parte del circuito de recompensa, se puede afirmar que los cambios en esta estructura derivados de la actividad del sistema están profundamente relacionados a la conducta alimentaria en respuesta al consumo de los alimentos palatables que a su vez aumenten los niveles plasmáticos de precursores de los endocannabinoides (anandamida y 2 araquidonoil glicerol) como el ácido araquidónico. El mecanismo fisiológico del circuito de recompensa se ve alterado en el curso de la adicción a sustancias psicoactivas, así como tras el consumo crónico de alimentos palatables, dicha alteración se caracteriza por la disminución en la liberación dopaminérgica y la pérdida de receptores dopaminérgicos tipo 2 en estructuras cerebrales como el núcleo accumbens, la amígdala y el córtex prefrontal, cambios neurobiológicos que se asocian a cambios conductuales como la impulsividad frente al consumo, ansiedad, tolerancia, cambios en la conducta social y deterioro clínicamente significativo, entre otros11.
Frente a esto, en el artículo de Tallima y Col., se propone que la hiperactividad del sistema endocannabinoide asociada a la producción de los derivados del ácido araquidónico como AEA y 2-AG, puede estar relacionada a un deterioro en la esfera social de la conducta en los seres humanos68.
El aumento en el consumo de alimentos palatables en el artículo de Monteleone y Cols.32, se asocia a un incremento de los niveles plasmáticos del endocannabinoide 2-araquidonil glicerol (2-AG), lo cual permitiría pensar en una relevancia del Omega 6 en este fenómeno, ya que los alimentos palatables pueden ser ricos en este ácido graso esencial, el cual mediante diferentes transformaciones en el cuerpo humano puede dar lugar a la obtención del ácido araquidónico y posteriormente de los endocannabinoides agonistas de los receptores CB1.
Por otro lado, a nivel de la literatura recientemente se ha descrito una serie de endocannabinoides agonistas inversos de los receptores CB1 que son derivados del EPA, DHA y el ácido oleico, dentro de los cuales se encuentran el eicosapentanoil etanolamida (EPEA), el docosahexanoil etanolamida (DHEA) y la oleil etanolamida (OEA), los cuales pueden tener efectos inversos a la activación de los receptores CB1 por los demás cannabinoides64. Encontrando un efecto potencial de los mismos a nivel de la modulación del metabolismo de los lípidos; regulación de adipoquinas, como adiponectina y leptina; reducción de los depósitos grasos y de la inflamación del tejido adiposo, esta última asociada a efectos supresores del apetito.
Autores como Cortés y Cols. proponen el desarrollo de una terapia nutricional que contemple el aumento del consumo de Omega 3, junto a la disminución del consumo de Omega 6, con el fin de reducir los niveles centrales y periféricos de endocannabinoides69. Lo que sugiere que el consumo de Omega 6 y Omega 3 podría tener un impacto en la actividad del sistema endocannabinoide y de esta manera incidir sobre la conducta alimentaria de las personas, así como modular sus alteraciones dentro de las cuales se encuentra la adicción a la comida.
Conclusiones
Tras la revisión efectuada, se encontró que la activación del sistema endocannabinoide en el cuerpo humano puede estimular el consumo de alimentos palatables a nivel de la regulación neuroendocrina de apetito y saciedad, así como aumentar la percepción de las características sensoriales de estos alimentos y estimular el circuito de recompensa a largo plazo. Lo anterior produce cambios neurobiológicos en estructuras como el núcleo accumbens, la amígdala y el córtex prefrontal asociados a una disminución en la transmisión dopaminérgica ocasionando que se generen cambios conductuales propios de la adicción a sustancias psicoactivas caracterizados por una pérdida del control, alteraciones en la esfera social de la conducta, tolerancia, abstinencia y malestar físico frente a su consumo. De manera que el consumo de alimentos palatables con un alto aporte de Omega 6 podría incrementar la síntesis de endocannabinoides, con lo cual aumentan los estímulos de apetito y disminuyen los de saciedad, promoviendo el consumo de alimentos a nivel hipotalámico, especialmente los de características palatables. En este proceso se potencia la percepción de las características sensoriales y la sensación placentera frente al consumo debido a la estimulación del núcleo accumbens, tal así que se genera un círculo vicioso entre el consumo de alimentos palatables y sus efectos en el circuito de recompensa que a largo plazo podría dar lugar a la adicción a la comida y al aumento de peso. Por otro lado, un mayor aporte de Omega 3 puede estar relacionado con un efecto contrario en cuanto a la síntesis de endocannabinoides agonistas inversos de los CB1 y en consecuencia a una reducción del apetito, siendo en este caso una medida a estudiar como alternativa para contribuir a reducir comportamientos adictivos hacia la comida y su ulterior impacto en el peso corporal. Todo lo anterior constituye una serie de hallazgos fundamentales para el desarrollo de ensayos clínicos en investigaciones en diversas áreas del conocimiento como la psiquiatría y psicología, neurobiología, fisiología, endocrinología, farmacología y nutrición humana; así como estudios interdisciplinares que permitan crear alternativas estructurales, integrales y multicéntricas para la intervención, tratamiento y prevención de la adicción a la comida y la obesidad como problemas de salud pública que afectan a una parte importante de la población en la época actual.
Mensajes clave
1. La exposición prolongada a alimentos ricos en grasa puede alterar el metabolismo de los endocannabinoides en el cuerpo humano.
2. El exceso de endocannabinoides como anandamida o 2 araquidonoil glicerol a nivel plasmático asociado a un alto consumo de alimentos ricos en Omega 6, conlleva a una sobre activación en el sistema endocannabinoide que se relaciona con cambios neurobiológicos a nivel de rutas dopaminérgicas del sistema nervioso central como la vía mesolímbica y mesocortical, relacionadas con el placer y la conducta.
3. Los cambios neurobiológicos producidos por la sobre activación crónica del sistema endocannabinoide conllevan a la aparición de diferentes alteraciones conductuales como la impulsividad, tolerancia, búsqueda constante por el consumo y otras, las cuales se hacen manifiestas en individuos con adicción a la comida.