INTRODUCCIÓN
Los carcinomas del paladar blando representan el 5-15% de los tumores de orofaringe [1]. La incidencia de estos últimos ha aumentado en los últimos años a expensas de la infección por el virus del papiloma humano (VPH) [2].
Sin embargo, los carcinomas de paladar blando son mayoritariamente P16 negativos [3]. El diagnóstico de los tumores suele ser tardío, ya que, en fases iniciales, son asintomáticos [4]. El tratamiento de elección en los tumores de paladar blando durante años ha sido la radioterapia sola o combinada a quimioterapia [5]. El empleo del abordaje transoral en este tipo de tumores y su menor morbilidad, han promovido el tratamiento quirúrgico. Una resección del paladar blando mayor del 50% en los carcinomas de esta localización exige una reconstrucción minuciosa para conseguir un buen resultado funcional [6].
DESCRIPCIÓN
Durante los años 2018 y 2019 diagnosticamos y tratamos en nuestro servicio 6 pacientes con carcinoma de paladar blando.
Caso 1. Mujer de 90 años con antecedentes de mastectomía más quimioterapia por neoplasia de mama en 2002 y carcinoma escamoso de cuero cabelludo intervenido en 2010. Se diagnosticó de carcinoma escamoso infiltrante bien diferenciado localmente avanzado de paladar duro y blando (T4aN0M0) por el servicio de Odontoestomatología. Tras valorar el caso en el comité de tumores, se realizó radioterapia tridimensional sobre tumor en paladar con intención paliativa. Se administró dosis de 20 Gy en 5 fracciones de 4Gy cada una de ellas, con buena tolerancia. En la tomografía computarizada (TC) de control al año, no se vió tumor en cavidad oral ni extensión cervical ni pulmonar. En seguimiento en consultas externas, ha disminuido mucho el tamaño del tumor y la paciente se encuentra estable.
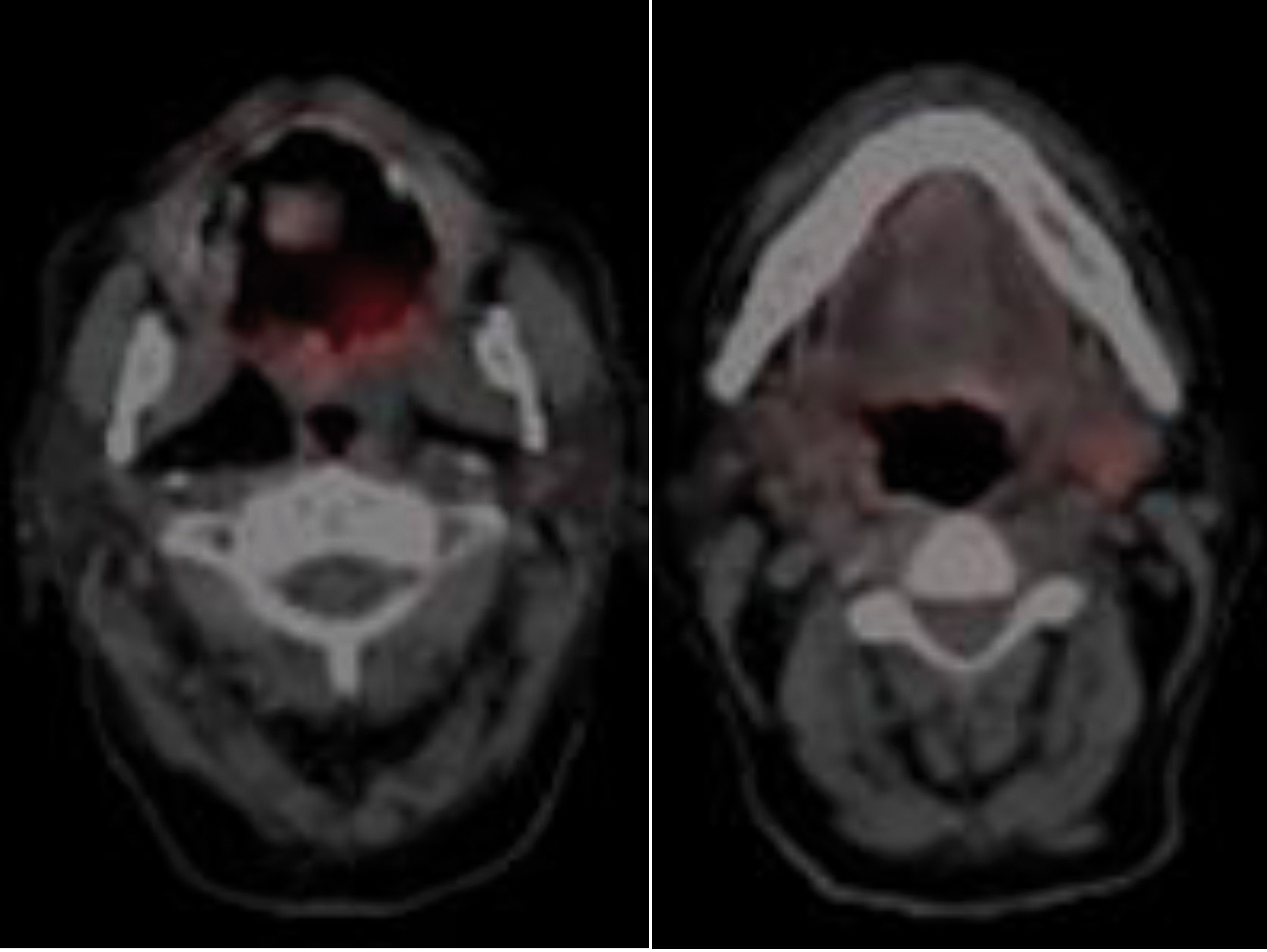
Caso 2. Paciente de 71 años que presentó carcinoma escamoso ulcerado, focalmente queratinizante y moderadamente diferenciado (G2) de paladar blando pT2pN1Mx (Figura 1) que se trató mediante exéresis con reconstrucción con colgajo miomucoso de arteria facial (FAMM) y bola de Bichat y vaciamiento ganglionar bilateral en septiembre de 2018. El paciente no ha seguido revisiones por traslado a otra comunidad.
Caso 3. Paciente de 64 años fumadora activa, con carcinoma escamoso de maxilar superior localmente avanzado, con nódulos pulmonares milimétricos (sospechosos de metástasis, pero no confirmados histopatológicamente) T4aN1M1. Tratada con 5 ciclos de cisplatino y 5-Fluorouracilo con cetuximab y posteriormente, radioterapia más quimioterapia con cisplatino (6 ciclos), finalizando la radioterapia en noviembre 2018. En la última TC se apreciaron cambios postratamiento con remisión local completa y estabilidad de lesiones pulmonares. Falleció a los 26 meses por infección respiratoria.
Caso 4. Paciente de 64 años diagnosticado de carcinoma adenoide quístico pT3 pN0 M0 (Figura 2) tratado con maxilectomía y reconstrucción con colgajo temporal, colocación de prótesis de temporal y vaciamiento ganglionar en noviembre de 2019. Tres semanas después se extrajo la prótesis por infección de esta por Klebsiella pneumoniae. El paciente recibió radioterapia y tanto en la exploración como en la TC de control, está libre de enfermedad.
Caso 5. Varón de 80 años que consultó por lesión en paladar duro y blando derechos de un año de evolución. Se realizó una exéresis de esta con cierre simple en diciembre de 2019 y el estudio histopatológico confirmó que se trataba de un adenocarcinoma polimorfo de paladar blando y duro de bajo grado pT1 N0 Mx con positividad para CK-7, S-100, BCL2 en forma débil para SOX. CD-117 y P-63 negativas. Por el momento, el paciente se encuentra libre de enfermedad.
Caso 6. Varón de 78 años con carcinoma escamoso de paladar blando que contactaba con paladar duro izquierdo que se intervino en agosto de 2019. Se realizó una exéresis la lesión y reconstrucción con bola de Bichat más vaciamiento ganglionar de las áreas I-V izquierdas (pT1-2 N0 M0). El paciente está libre de enfermedad en el momento actual.
DISCUSIÓN
Se trata de cuatro varones y dos mujeres, de edad avanzada (media 74,5 años). El número total de pacientes con carcinomas de cabeza y cuello en 2018 y 2019 en nuestro servicio ha sido de 159 de los que aproximadamente el 10% correspondían a tumores de orofaringe. En nuestra serie, los carcinomas de paladar blando representan 35% de los tumores de orofaringe. Cuatro de ellos son carcinomas escamosos, un carcinoma adenoide quístico y otro de ellos, un adenocarcinoma polimorfo de bajo grado.
La mitad de los casos son tumores localmente avanzados en el momento del diagnóstico. El seguimiento es muy breve al tratarse de casos recientes. A pesar de ello, uno de los casos ha fallecido por causas no relacionadas con su enfermedad oncológica.
Los factores predisponentes más conocidos de los tumores de orofaringe son el tabaco, el consumo de alcohol y el VPH, que cada vez adquiere más relevancia. La asociación del alcohol y el tabaco tiene un efecto sinérgico [7]. La prevalencia de infección por VPH en el carcinoma de orofaringe varía desde el 4% al 93%. El biomarcador más utilizado para detectar presencia de VPH es el P16 y tinciones >70% se consideran positivas y muestran actividad del VPH [8]. La prevalencia media en el sur de Europa es del 17% aunque en España es discretamente inferior [9]. Sin embargo, siendo el paladar blando una sublocalización de la orofaringe, los carcinomas suelen ser VPH negativos [3]. Se desconoce la razón por la que esto es así y algunos autores suponen que se debe a la ausencia de tejido linfoide en el paladar blando [10].
En nuestra serie, los tumores de paladar blando representaban el 35% de los tumores de orofaringe. La mayoría de los estudios incluyen los carcinomas de paladar blando dentro de los de orofaringe o, menos frecuentemente, cavidad oral [1,11]. Sin embargo, algunos autores [1] postulan que los carcinomas de paladar blando tienen una etiología y patogénesis diferente a los de orofaringe, ya que, no dependen del anillo linfático de Waldeyer.
El 85% al 90% de los tumores malignos del paladar blando derivan de células epiteliales y corresponden a carcinomas escamosos. En segundo lugar, se encuentran los tumores que se originan a partir del epitelio de las glándulas salivares (en el paladar blando se localiza el 50% de las glándulas salivares accesorias) siendo los tipos histológicos más frecuentes el carcinoma adenoide quístico y el carcinoma mucoepidermoide. Nuestros casos fueron mayoritariamente carcinomas escamosos, aunque hubo un caso de carcinoma adenoide quístico y otro adenocarcinoma polimorfo de bajo grado.
Los tumores del paladar blando son asintomáticos en fases iniciales. Cuando aumentan de tamaño pueden provocar dolor, halitosis, sangrado, rinolalia y trismus por infiltración de las estructuras vecinas como la musculatura pterigoidea [12]. Distintos autores [1,13] ponen de manifiesto que los tumores de paladar blando se diagnostican en fases precoces por la facilidad diagnóstica por la localización. En nuestro caso, el 50% eran localmente avanzados, de acuerdo con otros autores [2, 9]. Si bien su localización es fácilmente accesible a la exploración básica por parte de los médicos de atención primaria y odontoestomatólogos, inicialmente son asintomáticos y esto puede retrasar el diagnóstico de los pacientes.
La exploración endoscópica es de gran ayuda para la adecuada valoración de la extensión local del tumor y detección de segundos tumores primarios. La imagen de banda estrecha (narrow band imaging, NBI) es una herramienta muy útil en cuanto a sensibilidad y precisión, para realizar biopsias dirigidas bajo esta óptica en las lesiones del paladar [14].
En el caso de tumores localizados, la resonancia magnética nuclear (RMN) en el plano coronal con gadolinio es la prueba de elección [15,16] por la mejor definición de los tejido blandos. Sin embargo, habitualmente es necesario realizar también una TC del cuello y tórax para el estudio de extensión [15]. Casi la totalidad de nuestros pacientes (5/6) el tumor contactaba o afectaba también al paladar duro y la TC resulta necesaria [17].
Es importante saber que, aproximadamente, un 25% de los pacientes con un carcinoma de paladar blando tendrá un segundo tumor primario y la localización más habitual es el suelo de la boca [18].
El tratamiento de los tumores de paladar blando es controvertido. Hasta la última década, el tratamiento de elección ha sido la radioterapia asociada a quimioterapia. En una publicación de Amy Y. Chen (2013) [5] se describe la evolución de los tratamientos del cáncer de orofaringe entre los años 1998 y 2009. Los pacientes que se trataron con quimio-radioterapia aumentaron del 22% en 1998 a 61% en 2009. La cirugía pasó de 41% a 31% en 2009.
El avance en las nuevas técnicas quirúrgicas mediante abordaje transoral ha permitido que se aumente el número de tumores del paladar tratados quirúrgicamente. El incremento en su incidencia causado por el VPH, junto con el mejor pronóstico pese a la extensión ganglionar y la presentación en una población más joven ha impulsado el tratamiento quirúrgico.
Hasta la fecha, no hay evidencia que compare el resultado del tratamiento quirúrgico frente a la quimiorradioterapia en carcinomas de orofaringe [19,20] ni tampoco estudios a largo plazo que demuestren la superioridad de la quimiorradioterapia frente a la cirugía [1].
El tratamiento quirúrgico tiene varias ventajas con respecto a la radioterapia sola o asociada a quimioterapia:
Mejor estadificación del tumor. Sabemos que hasta en un 40% de los casos, la estadificación clínica es diferente a la quirúrgica [21].
Se evita o se precisa una menor dosis de tratamiento complementario con radioterapia y se evita el tratamiento con quimioterapia y, por ende, las toxicidades de ambos [21,22,23,24].
Una menor morbilidad y afectación de la deglución postoperatoria que a largo plazo es normal en la mayoría de los casos.
En los tumores del paladar blando la probabilidad de metástasis cervicales ocultas es aproximadamente del 20%, por lo que está indicado el vaciamiento cervical ipsilateral de las áreas II-IV [25]. En los tumores de línea media o próximos a ella, el vaciamiento debe ser bilateral. En pacientes con evidencia radiológica de afectación de los ganglios retrofaríngeos, se debe realizar un vaciamiento de dicha área o administrar radioterapia postoperatoria.
Nuestros casos diagnosticados en estadios avanzados se trataron con quimiorradioterapia o radioterapia paliativa. Los T1-T2 se trataron quirúrgicamente, y en el caso del T3 se realizó la exéresis quirúrgica con reconstrucción y se administró radioterapia postoperatoria. En todos ellos se realizó un vaciamiento cervical ganglionar unilateral o bilateral.
La resección de los tumores del paladar blando puede tener como secuela una insuficiencia velopalatina, fundamentalmente por la sección del elevador del velo del paladar y también por una disfunción de la trompa de Eustaquio (por una lesión del tensor del velo del paladar). En éstos casos está indicada una reconstrucción cuyos objetivos deben [26]:
Mantener la separación de la orofaringe y nasofaringe.
Conservar la permeabilidad nasal.
Respetar la inteligibilidad y resonancia del habla adecuadas.
Asegurar una deglución correcta.
Permitir la vigilancia del tumor y ser coste efectiva.
La mayoría de los autores cree que la reconstrucción funcional del paladar está indicada en defectos que representen más del 50% (Tabla 1). Para defectos pequeños (<50%), existen como opciones la bola de Bichat o el colgajo de músculo buccinador. El primero va a cubrir defectos pequeños o medianos de forma rápida y sencilla, confiriendo poca morbilidad a la cirugía y epitelizándose en 3 a 4 semanas. El segundo tiene diferentes variantes como el colgajo de base posterior (o de Bozola) o el colgajo miomucoso de arteria facial (FAMM) (Figura 3). Ambos son rápidos y sencillos de realizar, permitiendo un cierre primario del defecto de la zona donante. En el caso del FAMM se debe de tener en cuenta, si es necesario un vaciamiento ganglionar, la preservación de la arteria facial [27].
Tabla 1. Características de los colgajos para la reconstrucción del paladar blando [22-25].
| Tipo de colgajo | Ventajas | Desventajas | Características | |
| Bola de Bichat |
Rápido y sencillo. Puede realizarse bajo anestesia local. Poca morbilidad. Puede asociarse a otros colgajos pediculados. |
Solo puede cubrir pequeños o medianos defectos. | Epitelización en 3-4 semanas. | |
| Músculo bucinador | De base posterior (o de Bozola) |
Rápido y sencillo. Cierre primario del defecto. La radiación previa no se considera contraindicación. |
Puede producir trismus. |
Arteria a bucal o facial. Reconstrucción en pacientes edéntulos. También, reconstrucción de pared faríngea lateral. |
| FAMM |
Rápido y sencillo. Cierre primario del defecto. |
Defectos pequeños. No se puede realizar si N+ |
Se puede pedicular superior o anteriormente. Defectos de hasta 2cm. | |
| De Zhao |
Se puede utilizar en pacientes no edéntulos. No se necesita una sección del pedículo en un segundo tiempo |
Limitado por la comisura labial. No se puede realizar si N+ | ||
Para aquellos defectos mayores del 50% también se dispone de distintas opciones como son el colgajo miomucoso infrahioideo, el colgajo de músculo temporal, el colgajo en isla de la arteria facial tunelizada, el colgajo en isla junto con el colgajo de pared faríngea lateral y el colgajo microvascular de arteria radial [28]. El colgajo de músculo temporal es fácil, seguro y rápido de realizar, aunque puede llegar a ser bastante voluminoso. El colgajo microvascular de arteria radial tiene la ventaja de poder combinarse con otros tipos de colgajos para reconstruir defectos mayores o para la reconstrucción tras la radiación [29], pero requiere experiencia con la microcirugía. Finalmente, los dos colgajos en isla están indicados cuando se precisa de una reconstrucción total del paladar [30].
CONCLUSIONES
Los carcinomas del paladar blando son poco sintomáticos en fases iniciales, por lo que se requiere un alto índice de sospecha para evitar que sean diagnosticados en fases avanzadas. Los médicos de atención primaria y los odontoestomatólogos son piezas claves en la sospecha diagnóstica de estos tumores.
El tratamiento óptimo de estos tumores no está bien definido, si bien, el desarrollo de la cirugía transoral, con una menor morbilidad, ha dado un impulso al tratamiento quirúrgico.
El tratamiento quirúrgico del cáncer de paladar mediante los abordajes transorales permiten reducir la necesidad de tratamiento complementario hasta en un 40% de los casos.
La reconstrucción se hace necesaria en resecciones mayores del 50%.