INTRODUCCIÓN
Se podría definir la ototoxicidad medicamentosa, como la disfunción auditiva, temporal o permanente, causada por un fármaco, que produce hipoacusia neurosensorial, acúfeno y/o desequilibrio [1]. Aunque uno de los principios básicos que dicta la medicina hipocrática es primum non nocere (lo primero es no hacer daño), nos enfrentamos con el reto de sopesar el beneficio de combatir una enfermedad que pone en riesgo la vida del paciente, mediante un fármaco que puede traer consecuencias tóxicas [2].
El cisplatino o cis-diaminodicloroplatino es uno de los quimioterápicos más utilizados actualmente, por su extraordinaria efectividad, pero también es de los medicamentos de uso clínico más ototóxico [3]. La hipoacusia deriva del daño en las células ciliadas externas del órgano de Corti, estría vascular y ganglio espiral [4-5]. Aunque todavía están en discusión los mecanismos fisiopatológicos que inducen la ototoxicidad por cisplatino, la activación de la apoptosis [6] y la producción de radicales libres de oxígeno en la cóclea [7], serían algunos de los factores implicados. La muerte celular típicamente progresa desde la base hasta el ápex, manifestándose por una sordera neurosensorial permanente, progresiva, bilateral y con afectación inicial de las frecuencias agudas [5, 8].
La hipoacusia por cisplatino puede desarrollarse sin que exista ningún síntoma subjetivo [9]. Puede no ser simétrica [10,11] y hay quien considera que afecta más a los hombres que a las mujeres [11-13]. Tiene mayor repercusión en la edad infantil, por el impacto que supone en el desarrollo [5, 7, 12-14].
El daño ototóxico depende de múltiples factores de riesgo, estando directamente en relación con la dosis total acumulada [12, 15]. No se ha establecido un umbral por debajo del cual el efecto ototóxico esté ausente siendo muy variable el rango de vulnerabilidad [14].
Las secuelas pueden aumentar por efecto del ruido intenso [16] o la toma de otros ototóxicos [15, 17]. La radioterapia de la cabeza también puede incrementar este daño, si el oído se encuentra dentro del campo de exposición [18-19]. Diferentes polimorfismos genéticos pueden influir en la incidencia de la ototoxicidad, determinando parte de esa susceptibilidad individual [20] y finalmente la edad, sería otro factor fisiológico destacado. El daño es más prevalente en los niños [21], sobre todo en los más pequeños [12] y en los adultos mayores de 46 años [22]. Las tasas de ototoxicidad en el niño varían de un 13 a un 96% [7, 12, 14, 16, 22-25], pero los menores de 5 años tienen una posibilidad 20 veces mayor de desarrollar hipoacusia que los de 15-20 años [14].
Aunque el daño ototóxico pudiera considerarse de menor importancia, frente a lo que significa la curación de un tumor maligno, dado el incremento de la supervivencia, el intento de minimizar los déficits funcionales es hoy en día una preocupación oncológica [26].
Al comenzar el daño ototóxico por los tonos agudos, la hipoacusia que se genera pasa desapercibida hasta que, al alterarse la inteligibilidad del habla, se pone en evidencia un problema de comunicación [27]. Presagiar qué pacientes experimentarán este daño, no es posible sin evaluar directamente la función auditiva [28]. La monitorización audiológica es el único procedimiento que detecta la ototoxicidad antes de hacerse sintomática [13-14, 29], permitiendo anteponerse a peores circunstancias.
Mediante la aplicación de un protocolo de monitorización auditiva en el paciente tratado con cisplatino [30], evaluaremos la incidencia y severidad de la hipoacusia en nuestro medio, identificando los principales predictores clínicos.
MATERIAL Y MÉTODO
Este trabajo ha sido aprobado por el Comité Ético de Investigación Clínica de nuestra Área de Salud. Se trata de un estudio observacional y prospectivo de los 100 primeros pacientes remitidos desde el Servicio de Oncología de un hospital de tercer nivel, que aceptaron la evaluación del daño ototóxico por cisplatino, durante un periodo de 4 años (2013-2016), como único grupo de control.
La instrumentación, seguimiento y criterios diagnósticos fueron expuestos en un trabajo previo [30] y disponemos de personal experto para realizar las pruebas auditivas. Los tratamientos con cisplatino siguen la terapia protocolizada de nuestra institución.
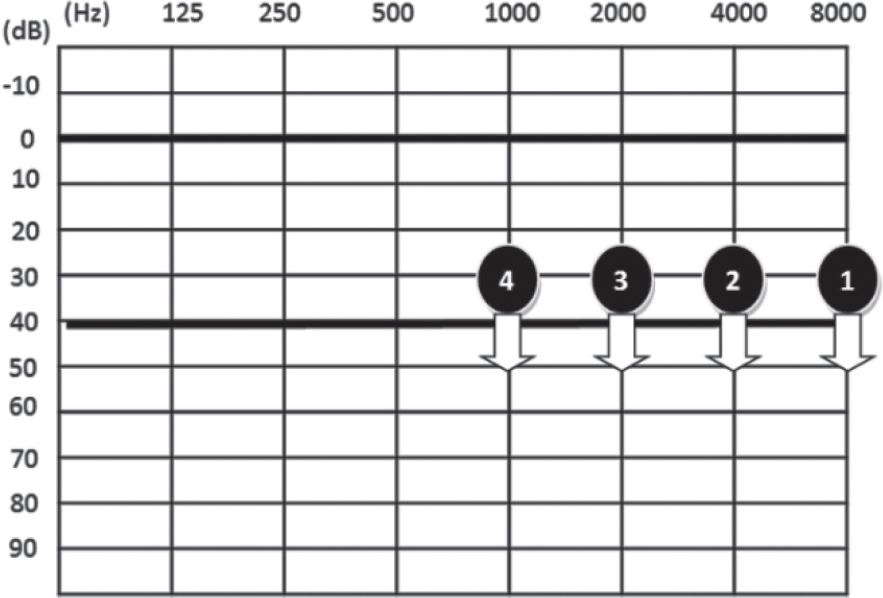
El programa para monitorizar la ototoxicidad por cisplatino cumple las directrices de la American Association of Speech-Language-Hearing Association (ASHA) [31], ratificadas por la American Academy os Audiology (AAA) [32]. Se basa en la información que damos al paciente sobre el objetivo propuesto y en las fases de evaluación (estudio basal, pruebas de monitorización y control postratamiento), resaltándose la importancia de protección frente al ruido y evitación de otros ototóxicos [30]. Para establecer el vínculo entre la hipoacusia y el cisplatino, realizamos una evaluación basal antes del tratamiento y dado el perfil del daño ototóxico, aplicamos como medios de exploración la audiometría de elevada frecuencia (AEF) y las otoemisiones acústicas (OEA) [32]. El control posterior se efectúa 24 horas antes de cada ciclo, a fin de que cualquier descenso temporal de la audición tenga tiempo suficiente de recuperación. Finalmente, una vez terminado el tratamiento, se continúa reevaluando la audición del paciente durante un periodo variable de años, en función de la edad y de la evolución clínica. La significación del menoscabo auditivo la clasificamos siguiendo los criterios de Brock [18] en 4 grados (Tabla 1).
Tabla 1: En la tabla se expresa el significado de cada grado de Brock, indicando en el audiograma el incremento de grado a medida que se supera la intensidad de 40 dB HL desde 8 kHz hacia frecuencias progresivamente inferiores (4 - 2 y 1 kHz).
|
HIPOACUSIA NEUROSENSORIAL |
GRADOS DE BROCK |
|---|---|
|
< 40 dB en todas las frecuencias. |
0 |
|
≥ 40 dB a 8.000 Hz sólo. |
1 |
|
≥ 40 dB a 4.000 Hz y por encima. |
2 (Borden-line) |
|
≥ 40 dB a 2.000 Hz y por encima. |
3 (> grado tolerable de toxicidad) |
|
≥ 40 dB a 1.000 Hz y por encima. |
4 |
Los datos se introdujeron en una base de Microsoft Access, elaborada para su explotación estadística, recogiéndose las características demográficas de cada paciente, los antecedentes de hipoacusia u otros otológicos, las pruebas efectuadas durante la evaluación basal, el tratamiento oncológico recibido y el grado de pérdida auditiva de cada oído antes y después del mismo.
Se presenta un análisis descriptivo de las variables de estudio. Las cuantitativas se representan con la media y la desviación típica y las cualitativas según su distribución en frecuencias. Mediante el test Chi-cuadrado de Pearson, se ha estudiado la asociación de las variables cualitativas. La comparación de los valores cuantitativos se ha realizado mediante la prueba T de Student o la alternativa no paramétrica U de Mann Whitney, según el caso. El grado de Brock inicial vs. el final, se ha examinado mediante la prueba de McNemar-Bowker. Los datos han sido desarrollados con el programa estadístico IBM SPSS Statistics versión 20.0 para Windows. Aquellos valores de p<0,05 son considerados estadísticamente significativos.
RESULTADOS
Características de los pacientes (Tabla 2)
Tabla 2: Características generales de los pacientes estudiados.
|
FACTORES DEMOGRÁFICOS (100 pacientes) | ||||
|---|---|---|---|---|
|
VARIABLE |
NÚMERO DE CASOS |
PORCENTAJE |
||
|
Adultos |
96 |
96% |
||
|
Niños (0 a 16 años) |
4 |
4% |
||
|
Rangos de edad de adultos: |
|
|
||
|
17 a 30 años |
3 |
3% |
||
|
31 a 40 años |
7 |
7% |
||
|
41 a 50 años |
22 |
23% |
||
|
51 a 60 años |
27 |
28% |
||
|
61 a 70años |
31 |
32% |
||
|
> 70 años |
6 |
6% |
||
|
EDAD MEDIA |
59 años |
|
||
|
Género: |
|
|
||
|
Masculino |
73 |
73% |
||
|
Femenino |
27 |
27% |
||
|
Distribución de pacientes por años: |
Inicio de tto. |
Fin de tto. |
|
|
|
Antes de 2013 2013 2014 2015 2016 2017 |
11 27 33 20 9 |
5 18 32 31 12 2 |
11% 33% 20% 9% |
5% 18% 32% 31% 12% 2% |
|
DURACIÓN MEDIA DEL TTO. |
163,57 días |
DS: 278 días |
||
|
Lugar de origen: |
|
|
||
|
Valladolid ciudad |
68 |
68% |
||
|
Valladolid provincia |
32 |
32% |
||
|
Hipoacusia previa al tratamiento: |
|
|
||
|
Con hipoacusia |
58 |
58% |
||
|
Sin hipoacusia |
42 |
42% |
||
|
Edad media con hipo |
61 años |
p<0,001 |
||
|
Edad media sin hipo |
42 años |
|||
|
Seguimiento postratamiento (octubre 2018) |
|
|
||
|
Éxitus |
33 |
33% |
||
|
Control audiométrico > 3 años postratamiento: |
17 |
17% (25% de supervivientes) |
||
En la Tabla 2 se muestran las particularidades demográficas de los 100 pacientes estudiados. Un total de 96 adultos y 4 niños, con predominio del número de varones (73%), donde el uso del cisplatino es más frecuente por la localización y mayor incidencia tumoral. El 80% de la población está comprendida entre 41 y 70 años, siendo la edad media de 59 años. Un tercio procede del medio rural.
Análisis audiométrico (Tabla 3)
Tabla 3: Exploración auditiva. Se especifica el tipo y número de exploraciones realizadas durante la evaluación basal y el seguimiento de los 100 pacientes evaluados.
|
PRUEBAS AUDITIVAS (100 pacientes) | ||
|---|---|---|
|
VARIABLE |
NÚMERO DE CASOS |
PORCENTAJE |
|
Evaluación Basal: |
|
95% |
|
Otoscopia |
98 |
98 % |
|
Timpanograma |
98 |
98 % |
|
Reflejos ipsilaterales estribo |
73 |
73 % |
|
Otoemisiones Transitorias |
62 |
62 % |
|
Productos de distorsión |
71 |
71% |
|
Audiometría alta frecuencia |
94 |
94 % |
|
Audiometría convencional |
1 |
1 % |
|
Pruebas en el seguimiento: |
|
TOTAL |
|
Audiometría tonal convencional: |
|
|
|
1 audio |
23 |
23 |
|
2 audios |
17 |
34 |
|
3 audios |
18 |
54 |
|
4 audios |
9 |
36 |
|
5 audios |
9 |
45 |
|
6 audios |
8 |
48 |
|
7 audios |
7 |
49 |
|
8 audios |
5 |
40 |
|
9 audios |
3 |
27 |
|
10 audios |
1 |
10 |
|
TOTAL |
100 pacientes |
366 audios. |
|
Otoemisiones acústicas (OEA): |
|
|
|
0 OEA |
20 |
0 |
|
1 OEA |
53 |
53 |
|
2 OEA |
11 |
22 |
|
3 OEA |
6 |
18 |
|
4 OEA |
2 |
8 |
|
5 OEA |
2 |
10 |
|
6 OEA |
3 |
18 |
|
7 OEA |
2 |
14 |
|
8 OEA |
0 |
0 |
|
9 OEA |
1 |
9 |
|
TOTAL |
100 pacientes |
152 OEA. |
Dieciséis pacientes iniciaron la evaluación una vez comenzado el tratamiento (control tardío), de los que 5 presentaban hipoacusia, de manera que la valoración basal pudo hacerse en el 95% del total. La distribución y el número de pruebas efectuadas, se refleja en la Tabla 3. En casi todos los casos realizamos un estudio basal auditivo con audiometría de elevada frecuencia (AEF) y a más de la mitad les hicimos también otoemisiones acústicas (OEA), transitorias o fundamentalmente productos de distorsión en forma de DPgrama. Durante el seguimiento, realizado antes de cada nuevo ciclo, utilizábamos la audiometría convencional y las OEA. De media y sin contar la exploración inicial, efectuamos unas 3,7 audiometrías y 1,5 OEA, a cada paciente.
Evaluación del efecto ototóxico (Tabla 4)
Tabla 4: Evaluación del efecto ototóxico del cisplatino y su significación estadística.
|
VARIABLE |
NÚMERO DE CASOS |
MODIFICA (35/100) |
SIGNIFICACIÓN ESTADÍSTICA |
||||
|---|---|---|---|---|---|---|---|
|
Tratamiento: |
|
|
|
||||
|
Cisplatino |
70 |
19/70 (27%) |
p 0.025 |
||||
|
Cisplatino + RT |
30 |
16/30 (53%) |
|||||
|
Globalmente |
100 |
35/100 (35%) |
|
||||
|
- Hombres |
73 |
28/73 (38%) |
No significativo (p 0,247) |
||||
|
- Mujeres |
27 |
7/27 (26%) |
|||||
|
Afectación tardía (3- 5 años post-QT) |
17 |
5/17 (29%) |
|
||||
|
Cisplatino |
9 |
3/9 (17/51)= 36/70 (51%) |
|
||||
|
Cisplatino + RT |
8 |
2/8 (3,5/14)= 19,5/30 (65%) |
|||||
|
Globalmente |
17 |
5/17 (19/65)= 54/100 (54%) |
|||||
|
MODIFICA audición: |
|
Dosis media modifica |
|
||||
|
Cisplatino |
19/100 (19%) |
438 mg/m2 |
p 0.025 |
||||
|
Cisplatino + RT |
16/100 (16%) |
321 mg/m2 |
|||||
|
Globalmente |
35/100 (35%) |
385 mg/m2 |
|
||||
|
NO MODIFICA audición : |
65/100 (65%) |
Dosis media NO modifica |
|||||
|
319 mg/m2 | |||||||
|
Sin hipoacusia previa (42/100): |
Nº oídos |
Oídos modifica |
Dosis media modifica |
Brock previo |
Brock final |
Diferencia |
P<0,001 |
|
Global |
84 |
24 (28%) |
413 mg/m2 |
0 |
2 |
2 |
|
|
Cisplatino |
62 |
13 (21%) |
458 mg/m2 |
0 |
1,7 |
1,7 |
|
|
Cisplatino + RT |
22 |
11 (50%) |
359 mg/m2 |
0 |
2,3 |
2,3 |
|
|
Con hipoacusia previa (58/100): |
|
|
|
|
|
|
|
|
Global |
108 |
33 (31%) |
368 mg/m2 |
1,45 |
2,3 |
0,85 |
|
|
Cisplatino |
78 |
18 (15%) |
426 mg/m2 |
1,3 |
2.2 |
0,9 |
|
|
Cisplatino + RT |
38 |
15 (39%) |
298 mg/m2 |
1,6 |
2,45 |
0,85 |
|
|
Dosis total acumulada: |
|
|
p 0.003 |
||||
|
≥ 400 mg/m2 |
29 |
16/29 (55%) |
|||||
|
Cisplatino |
24 |
12/24 (50%) |
|||||
|
Cisplatino + RT |
5 |
4/5 (80%) |
|||||
|
< 400 mg/m2 |
71 |
19/71 (27%) |
|||||
|
Cisplatino |
46 |
7/46 (15%) |
|||||
|
Cisplatino + RT |
25 |
12/25 (48%) |
|||||
|
Dosis máxima acumulada: |
1125 mg/m2 |
753 mg/m2 |
|
||||
|
Dosis mínima acumulada: |
70 mg/m2 |
200 mg/m2 |
|||||
|
Dosis media acumulada: |
319 mg/m2 |
385 mg/m2 |
|||||
|
Dosis mediana acumulada: |
280 mg/m2 |
329 mg/m2 |
p 0.003 |
||||
|
Simetría oídos (mismo grado de Brock) con audición normal que modifican: |
|
||||||
|
Modificación simétrica |
|
9/13 (69%) |
|||||
|
Modificación asimétrica |
|
4/13 (31%) sin predominio de oído |
|||||
|
Simetría de todos los que modifican: |
|
23/35 (66%) |
|||||
La mayoría de los pacientes (66%) recibió de 3 a 6 ciclos de cisplatino (5,8 de media por paciente), con una dosis total acumulada que osciló entre 70 mg/m2 (dosis mínima) y 1125 mg/m2 (dosis máxima). Sin embargo, las dosis mínima y máxima que produjeron un cambio auditivo mensurable con la graduación de Brock, fueron de 200 mg/m2 (la mínima) y de 753 mg/m2 (la máxima). La dosis global media acumulada que modifica la audición es de 385 mg/m2 y la que no modifica de 319 mg/m2. La diferencia de sus medianas resulta estadísticamente significativa (p 0.025), (Figura 1).
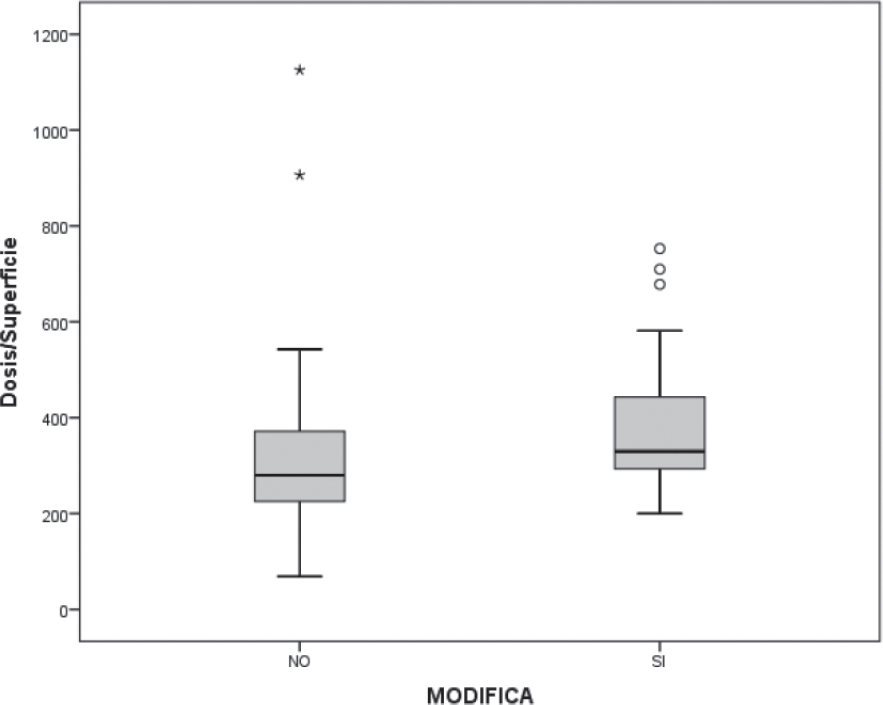
Figura 1: La diferencia entre la mediana de la dosis total acumulada que modifica, con la que no modifica la audición, es estadísticamente significativa (p 0.003).
Al 70% de los pacientes sólo se le administró cisplatino y un 30% recibió además RT en la cabeza. La dosis total acumulada media que modifica la audición solo con cisplatino es de 438 mg/m2 y la de los pacientes que recibieron además RT desciende a 321 mg/m2, siendo esta diferencia estadísticamente significativa (p 0,025), al sumarse la RT al efecto ototóxico (Tabla 4).
En caso de audición normal, la dosis ototóxica media es superior respecto a los que presentan hipoacusia (aunque no es significativa: p 0,372), pero cuando se produce el cambio auditivo, este es significativamente mayor en los oídos normoacúsicos.
Otros factores de riesgo
En la Figura 2 se muestra el cambio de grado que experimentan los 200 oídos de los 100 pacientes evaluados después del tratamiento, observándose un incremento de los grados 2 a 4. La Figura 3 refleja el efecto ototóxico en los oídos con hipoacusia previa.
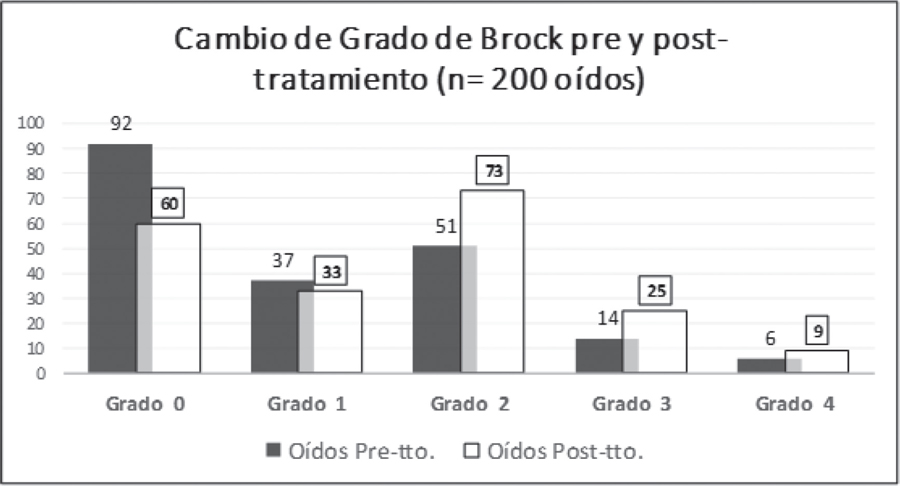
Figura 2: Se observa la modificación del grado de Brock que experimentan los 200 oídos examinados, antes y después del tratamiento ototóxico. Tras el tratamiento (rectángulos blancos), se incrementan los grados 2 a 4, disminuyendo los grados 0 y 1.
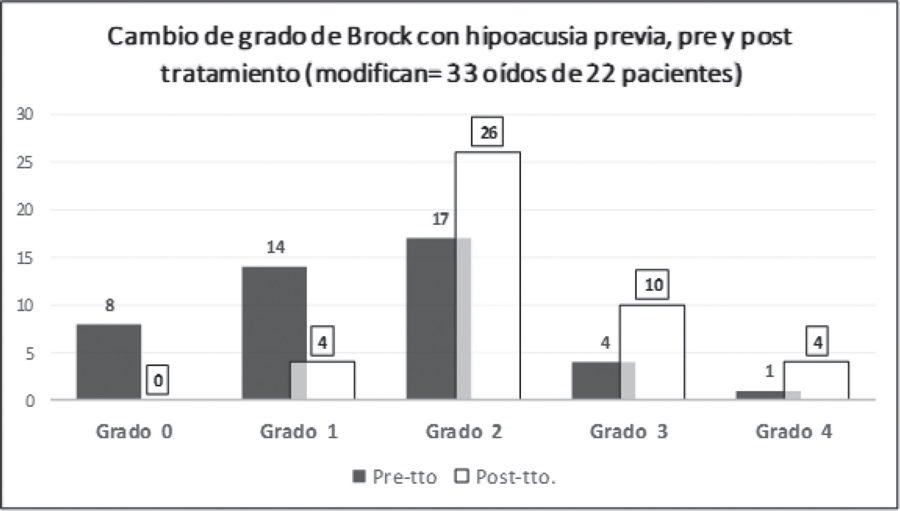
Figura 3: En el 31% de los oídos con hipoacusia previa (33 oídos de 108), se produce un incremento de la misma tras el tratamiento, experimentando una pérdida global de casi 1 grado de Brock, pasando la mayoría, como se ve en la imagen, del grado 1-2 (rectángulos negros) al 2-3 (rectángulos blancos).
Los pacientes afectados, con audición normal (13 pacientes), tienen un menoscabo simétrico en el 69% (mismo grado de Brock en ambos oídos). La distribución asimétrica afecta a uno u otro oído por igual.
En el 77% de los que sufren un incremento de la hipoacusia (27% de la población total), el grado de deterioro es importante (grado de Brock ≥ 2), sobre todo en quienes además del cisplatino recibieron RT; así, en los normoyentes, el grado de Brock ≥ 2 aparece en el 43% de los tratados con cisplatino y en el 83% de quienes, además, reciben RT. Estas diferencias de grado antes y después del tratamiento son estadísticamente significativas (p 0,001).
Edad
El perjuicio auditivo de los pacientes con edades comprendidas entre 11 y 40 años es menor que en niños (< 11 años) y que, en adultos con más de 40 años, sin embargo, las diferencias encontradas, no son significativas (p 0,109), en gran medida porque la población infantil de esta muestra es muy pequeña para poder establecer relaciones.
Género
No sólo hay un predominio de hombres sobre mujeres entre los pacientes tratados con cisplatino, sino que el porcentaje de ototoxicidad relativo es mayor en los hombres que en las mujeres (38/26 %), aunque esta diferencia no resulte significativa (p 0,247).
Audición previa
Evaluando cada oído aisladamente, hemos analizado los que sufrían un cambio en la graduación de Brock.
Un 58% de pacientes tiene hipoacusia antes de iniciar el tratamiento ototóxico (con una edad media de 61 años), unilateral en 8 casos y bilateral en los otros 50. Los que sufren daño ototóxico, pasan tras el tratamiento a un grado de Brock que se incrementa en promedio 0,9 partes de grado independientemente de que reciban o no RT.
A los sujetos afectados de ototoxicidad con audición previa normal (42% de nuestra población, con edad media de 42 años), el cisplatino les provocaba una modificación de 1,7 grados y si recibían RT el cambio promedio era de 2,3 grados.
Es decir, aunque como hemos visto la hipoacusia previa incrementa la vulnerabilidad ototóxica por cisplatino, el grado de afectación, cuando aparece, es mayor si la audición es normal (p <0,001).
Radioterapia en la cabeza
Treinta pacientes recibieron además de la medicación con cisplatino, radioterapia en la cabeza. Si comparamos los que empeoraron su audición tras el tratamiento exclusivo de cisplatino (27%), con quienes la modificaron al recibir además de cisplatino, radioterapia (53%), encontramos que esta diferencia es significativa (p 0,025) (Tabla 4).
Además, la dosis total acumulada media a la que se modifica la audición con cisplatino es de 438 mg/m2 y de 321 mg/m2 si además del cisplatino se usa RT en la cabeza.
Efectos a largo plazo (Tabla 2)
En octubre 2018, un año y medio después de terminarse el último tratamiento de quimioterapia (28-3-2017), realizamos un nuevo control de los pacientes estudiados, comprobando un 33% de éxitus. A 17 pacientes (25% de los supervivientes) les pudimos evaluar auditivamente con un margen de entre 3 y 5 años postratamiento. Un 33% de los que no habían modificado su audición, se afectaron durante este periodo (con una edad media de 51 años), incrementándose la hipoacusia en el 20% de los que la habían sufrido al final del tratamiento. Por tanto, la pérdida auditiva podría llegar a alcanzar a lo largo del tiempo a más del 50% de los pacientes tratados.
DISCUSIÓN
Estudiamos la ototoxicidad de 100 pacientes, que recibieron cisplatino como parte del tratamiento de su proceso oncológico, con una edad media de 59 años, similar a la de otros estudios [33], observando una incidencia global de hipoacusia del 35% (que puede ascender por encima del 50% a lo largo de los años), siendo de grado moderado/severo (grado de Brock ≥ 2) en el 83% de los oídos. La variabilidad interindividual al daño ototóxico por cisplatino, su inicio en la zona basal de la cóclea que facilita el pasar desapercibido hasta que ya tiene consecuencias clínicas importantes y su irreversibilidad, justifican la conveniencia de monitorizar la ototoxicidad a fin de asegurar una detección temprana [9].
En la evaluación basal procuramos obtener una audiometría de elevada frecuencia (AEF), pero el seguimiento se realiza fundamentalmente con la audiometría convencional y con las OEA si se trata de pacientes normoyentes. Aunque se supone que la AEF es el procedimiento más sensible para detectar los cambios ototóxicos iniciales [34], es una prueba larga y compleja, que suele resultarle muy pesada al paciente oncológico y donde, al no existir un rango de normalidad, cada individuo debe ser su propio control. Podríamos utilizarla siguiendo los criterios ASHA, 1994 [31], evaluando la pérdida de respuesta en 3 frecuencias consecutivas, donde se obtenían previamente, pero su principal limitación es la falta de un gradiente que refiera la severidad de la hipoacusia adquirida o el impacto clínico sobre el paciente [30]. Por estos motivos, aunque la AEF nos ha resultado útil en la evaluación basal, para obtener nuestros patrones de normalidad, no la hemos aplicado en el control posterior de los pacientes. Sin embargo, la realización de unas OEA sólo demanda unos minutos, no requiere la participación activa del sujeto y la prueba refleja específicamente el estado coclear de las células ciliadas externas [32, 35]. Aplicando las OEA en forma de Productos de Distorsión y obteniendo el DP-grama, los cambios ototóxicos podrían detectarse incluso antes, que con la audiometría convencional y de forma más rápida y cómoda para el paciente [34, 36]. Sin embargo, dada su escasa amplitud acústica, la presencia de cualquier problema concomitante en el oído medio (muy frecuente en la edad infantil), hace que se alteren o desaparezcan. Además, uno de sus mayores inconvenientes es la variabilidad en la interpretación de los resultados, al no existir acuerdo respecto a un criterio que fije la medida del cambio producido por el efecto ototóxico [34, 35], por lo que actualmente su utilidad radica en acompañar a otra prueba audiológica como la audiometría de tonos puros, ofreciendo una evaluación complementaria, cuyos resultados, aún por estudiar, no hemos considerado en este trabajo. Sería deseable estandarizar un protocolo de seguimiento audiológico, aceptado de forma general, rápido y sencillo de aplicar, especialmente en los niños y en aquellos pacientes que tuvieran comprometido su estado general o cognitivo.
Habiéndose propuesto diferentes pautas para determinar cuándo se puede hablar de cambio audiométrico producido por la ototoxicidad, la regla más ampliamente utilizada es la de la Academia Americana [31, 32], si bien este criterio de detección precoz no expresa el grado de deterioro que ha producido el efecto ototóxico, al no ser específico de frecuencia. Una de las causas de variabilidad en la incidencia publicada de ototoxicidad se debe a los diferentes procedimientos de graduación utilizados [37]. Mientras unos la clasifican por el descenso de umbral experimentado, otros lo hacen por el de la pérdida auditiva existente, lo que en función de la línea basal puede dar resultados dispares. Aunque lo ideal es obtener esta línea basal pretratamiento, como referencia de los cambios auditivos observados, en algunas ocasiones resulta muy difícil, por falta de cooperación, retraso cognitivo, etc. [35]. Para expresar la magnitud del daño coclear ototóxico, nosotros hemos aplicado la escala de Brock [18], muy utilizada en los estudios de ototoxicidad por cisplatino [7, 12, 13, 17, 18, 23-25, 29, 34], pues se centra en las frecuencias agudas, que es por donde se inicia la pérdida auditiva. La graduación es muy sencilla en función del audiograma tonal obtenido, con independencia del descenso de umbral que se haya producido respecto a la línea basal (Tabla 1). En los niños, donde una pérdida inferior a 40 dB podría tener repercusiones, se puede aplicar la escala de Chang [38], que categoriza con mayor precisión los distintos grados. Dada la dificultad que representa expresar la pérdida auditiva reflejada en un audiograma, estas escalas ofrecen la posibilidad de clasificarla en función de su severidad, lo que nos permite trasladárselo al oncólogo de manera objetiva y mucho más comprensible; sin embargo, consideramos necesario la estandarización de una fórmula de graduación aceptada de forma general, que facilite la comparación de las diferentes investigaciones.
Factores de riesgo
A la hora de evaluar los resultados, además de la disparidad en la forma de definir la ototoxicidad y graduar el daño, no es infrecuente la falta de correlación de los datos audiométricos pre y postratamiento, la variabilidad en el tiempo de seguimiento y en el polimorfismo de los grupos de estudio, lo que dificulta aún más, poder conocer la relativa importancia de los factores de riesgo añadidos [19].
Mayoritariamente se acepta que la dosis total acumulada es el principal factor de riesgo en la ototoxicidad por cisplatino [7, 12, 17, 18, 23, 29]. Coincidiendo con nuestros resultados están los de Stavroulaki et al. (2001) [39] y Biro et al. (2006) [40], que expresan un cambio de umbral a partir de una dosis total acumulada media de cisplatino de 350 a 400 mg/m2; aunque de manera general se considera que el umbral en adultos está en 600 mg/m2 [15]. En los niños, el nivel de toxicidad es más bajo, a partir 400 mg/m2 de dosis total acumulada [29].
Cuando se asocia la radioterapia de cabeza al tratamiento con cisplatino, es mayor la vulnerabilidad y severidad de la hipoacusia neurosensorial [19, 41]. Puesto que ambos son ototóxicos, el resultado final dependerá de la dosis del cisplatino y de la intensidad de la RT aplicada. La incidencia de hipoacusia neurosensorial después del tratamiento con RT en la cabeza varía en la literatura del 0 al 43%, incrementándose del 17 al 88% si se combina con cisplatino [19]. En nuestros resultados, el tratamiento conjunto ha producido una tasa general de hipoacusia del 53%, similar a la de otros autores [41], pudiendo incrementarse a lo largo del tiempo hasta en un 65%.
El daño por cisplatino es mucho más intenso en oídos normoyentes que en hipoacúsicos, lo que representa un hallazgo bastante original y claramente significativo de nuestros resultados.
Aun utilizando los datos clínicos más actualizados para desarrollar modelos de regresión que predigan la contingencia de la ototoxicidad por cisplatino en base a diferentes variables, su funcionamiento sólo es útil para calcular el riesgo medio de una población, pero no lo es, para conocer lo que ocurrirá en un paciente concreto [14-15]. Seguramente, la precisión de estos patrones se incrementaría, si se pudieran tener en cuenta los marcadores genéticos [20]. En los últimos años la industria farmacéutica ha puesto además un especial énfasis en el desarrollo de sustancias protectoras del oído interno frente a los efectos ototóxicos del cisplatino. Es posible que en el futuro se pueda aplicar un tratamiento personalizado, quizá basado en la identificación de genotipos de alto riesgo, que permita asegurar la prevención de la ototoxicidad [14].
CONCLUSIONES
Nuestros resultados confirman la importancia del daño auditivo inducido por cisplatino y su incremento en caso de asociar RT en la cabeza, llegando a afectar a un 35% de pacientes y posiblemente a más del 50% a largo plazo. La susceptibilidad al daño ototóxico, el inicio clínicamente insidioso y su irreversibilidad, justifican la conveniencia de monitorizar la ototoxicidad por cisplatino. En general, afecta simétricamente a ambos oídos y de manera más intensa si la audición es normal. En nuestro estudio, ni el género, ni la edad, son responsables de diferencias estadísticamente significativas respecto al daño ototóxico, que depende fundamentalmente de la dosis total acumulada.