INTRODUCCIÓN
El cáncer de tiroides no es uno de los cánceres más frecuentes. Sin embargo, su incidencia ha ido incrementándose a lo largo de las cuatro últimas décadas. Además, su presentación, muy predominante en el sexo femenino y fundamentalmente durante la edad reproductiva [1], hace que este tipo de cáncer adquiera una especial relevancia cuando se lo considera desde el punto de vista de la gestación.
Por una parte, cabe considerar las influencias que, tanto el ambiente hormonal femenino [2], como la presencia de otras enfermedades tiroideas [3] y metabólicas [4], pudieran tener en su etiopatogenia. En este contexto, también se han realizado muchos esfuerzos por dilucidar si los cambios endocrino-metabólicos experimentados durante la gestación podrían generar algún efecto negativo sobre la incidencia y la progresión del cáncer de tiroides [5].
Por otro lado, resulta de especial relevancia valorar la influencia que tanto el propio cáncer de tiroides como su manejo clínico (médico, quirúrgico, radio y quimioterapia) puedan tener tanto en la progresión del propio embarazo y de la lactancia, como en las posibilidades de futuras gestaciones [6].
Es fácil comprender, por lo tanto, que la guía clínica publicada por la American Thyroid Association (ATA) de 2015 [7] tuviera que complementarse con una específica para la gestación en 2017 [8]. También resulta pertinente pensar que, a la luz de los nuevos trabajos publicados a partir de esa fecha, dichas guías deban reconsiderar algunos de sus posicionamientos en un futuro cercano.
EPIDEMIOLOGÍA DE LOS NÓDULOS TIROIDEOS Y DEL CÁNCER DE TIROIDES EN EL PERIODO REPRODUCTIVO
La presencia nódulos tiroideos resulta un hallazgo muy común en las mujeres, dado que pueden estar presentes a la palpación en un 5-6% de los casos y pueden detectarse en hasta un 68% de las mujeres adultas por técnicas de imagen (ecografía, tomografía computarizada o resonancia magnética) [9, 10]. De ahí que no resulte extraño el que su descubrimiento resulte frecuente durante la gestación. La prevalencia de dichos nódulos varía, según las series, entre el 3-21% de las gestaciones y puede incrementarse su número en relación con el número de embarazos hasta afectar a casi el 40% de las gestantes multíparas. La mayoría son únicos y de pequeño tamaño (5-12 mm). Muchos de ellos tienden a crecer (al igual que el resto de la glándula tiroidea) durante la gestación y suele observarse con mucha frecuencia que regresan a su tamaño original tras el parto [8].
Las probabilidades de que estos nódulos sean malignos varían ampliamente según las series estudiadas, aunque la mayor parte apuntan a rangos comprendidos entre el 10-20% de los casos. La gran mayoría están constituidos por carcinomas diferenciados de tiroides (CDT). El tipo histológico más frecuente lo constituye el carcinoma papilar de tiroides (CPT) que comprende entre el 75-80% de los casos, seguido del carcinoma folicular (CFT) en un 15-20% de las ocasiones. Mucho menos frecuente resulta el carcinoma medular de tiroides (CMT) y resulta extremadamente raro el carcinoma indiferenciado o anaplásico en pacientes con edad inferior a los 50 años [8].
Aunque en general el cáncer de tiroides tiene una incidencia baja en relación con otros tipos de cánceres (2,9% de todos los casos nuevos de cáncer en los E.E.U.U.), constituye el carcinoma endocrino más frecuente y uno de los más frecuentes hallados en el contexto de la gestación. Además, su incidencia se ha incrementado de forma muy significativa en las cuatro últimas décadas, desde aproximadamente 3,6 casos por 100.000 habitantes en la década de los 70, hasta los 15,7 casos por 100.000 registrados en 2017. La incidencia es 3-4 veces superior en mujeres que en varones (en todas las etnias y en todos los rangos de edad) y más de un tercio de los casos lo hace en menores de 45 años, durante la edad reproductiva [1]. La prevalencia global del cáncer de tiroides durante la gestación es de 14,4 casos por 100.000 nacimientos, y la mayor parte de ellos son diagnosticados durante el primer año tras el parto (10,8 casos por 100.000 nacimientos) [8]. En otros países como Corea, donde el cáncer de tiroides es la cuarta neoplasia más común, la prevalencia durante la gestación se dispara hasta cifras de 87 casos por 100.000 nacimientos [11]. Estos datos justificarían el tratar de establecer un enlace entre el ambiente hormonal de las mujeres en edad fértil con el desarrollo del CDT y, más concretamente, el intentar discernir si existe alguna relación entre los cambios endocrino-metabólicos que se pueden producir durante la gestación y la progresión y el pronóstico del CDT durante esta etapa.
ETIOPATOGENIA DEL CARCINOMA DIFERENCIADO DE TIROIDES
Factores relacionados con la presencia previa de enfermedades tiroideas y otros problemas endocrino-metabólicos
Hasta la fecha, son varios los trabajos que han relacionado de forma prospectiva el padecimiento de enfermedades tiroideas benignas de diferente índole, con el desarrollo de CDT. Entre los más recientes caben destacar dos estudios, uno prospectivo [3] y un metaanálisis [12] en los que se encuentra relación estadísticamente significativa entre el hipertiroidismo por enfermedad de Graves-Basedow (atribuibles a una posible activación de los protooncogenes RET y TRK por los anticuerpos anti-receptor de TSH y al incremento de estradiol derivado del propio hipertiroidismo), las tiroiditis autoinmunes (reordenamientos en RET/CPT, activación de la vía MAP-Kinasa), adenomas foliculares (mutaciones en los genes RAS y RET) así como con la presencia de bocio simple o nodular. No queda tan claro en ninguno de los dos trabajos la asociación entre hipotiroidismo (fuera del contexto autoinmune) con el desarrollo de CDT (Tabla 1).
Tabla 1. Relación entre enfermedades tiroideas benignas y desarrollo de carcinoma diferenciado de tiroides.
|
Patología Benigna Tiroidea |
Posible mecanismo etiopatogénico / Observaciones |
|---|---|
|
Hipertiroidismo (enfermedad de Graves-Basedow) |
- Activación de los protooncogenes RET y TRK por los anticuerpos antirreceptor de TSH (TRAb) - Incremento de los niveles de estradiol derivado del propio efecto del hipertiroidismo |
|
Tiroiditis autoinmunes |
- Activación de la vía MAP-Kinasa - Inflamación crónica que condiciona formación de cromatina inestable y reordenamientos RET/CPT |
|
Adenoma folicular |
- Mutaciones en genes RAS y RET |
|
Bocio simple y nodular |
- Desconocido |
|
Hipotiroidismo |
- No demostrada asociación con el desarrollo de CDT (fuera del contexto de tiroiditis autoinmune subyacente) |
En cuanto a la relación del CDT con otras patologías endocrino-metabólicas, la cuestión no parece tan clara. Algunos autores encuentran fuertes asociaciones entre la obesidad [13, 14] o la resistencia a la insulina/diabetes mellitus [15] y el desarrollo de nódulos tiroideos y CDT. En estas asociaciones parecen involucrarse mecanismos derivados tanto de la inflamación [4, 16], como de la activación de señales metabólicas aberrantes (leptina-JAK2-STAT3) [17]. También han llamado la atención la presencia de algunos genotipos involucrados en el estrés oxidativo y el metabolismo de las hormonas esteroideas [18] y otros mecanismos como la sobreexpresión de receptores para IGF-1 y algunas adipoquinas, que actuarían estimulando la proliferación celular y suprimiendo la apoptosis [13]. En este sentido, algunos autores han encontrado que los pacientes con CDT diagnosticados antes de los 40 años de edad tenían un riesgo cardiovascular incrementado (hipertensión arterial, miocardiopatía…) cuando se los comparaba con los controles [19], hecho que pudiera estar en relación con los mecanismos subyacentes de inflamación y de resistencia a la insulina.
Factores relacionados con el ambiente hormonal femenino y los cambios endocrino-metabólicos producidos durante la gestación
Los estudios prospectivos [20, 21], los de casos y controles [22] y los metaanálisis de estudios epidemiológicos [23, 24] arrojan resultados tremendamente contradictorios y nada concluyentes en relación con la influencia que pudieran tener aspectos tales como la edad de la menarquía (y de la menopausia), el número de embarazos, la lactancia o el uso de anticonceptivos orales, entre otros factores, con el desarrollo de CDT (Tabla 2).
Tabla 2. Factores relacionados con la reproducción y su posible influencia en el desarrollo de carcinoma diferenciado de tiroides.
|
Factores favorecedores |
- Menarquía precoz ó tardía - Menopausia a edad avanzada (CDT en posmenopausia) - Multiparidad - Historia de abortos |
|
Factores neutros |
- Uso de anticonceptivos hormonales orales (algunos estudios) |
|
Factores protectores |
- Edad avanzada en la primera gestación - Lactancia prolongada - Anticonceptivos hormonales orales (algunos estudios) |
Basado en [20-24]. Los factores relacionados en esta tabla proceden de estudios epidemiológicos en los que los resultados no son concluyentes y en ocasiones resultan discordantes. Ver texto para más información.
Sin embargo, están bien documentados ciertos aspectos del CDT que parecen involucrar el desarrollo de este tipo de cáncer con el ambiente hormonal femenino, fundamentalmente a expensas de los estrógenos. Por una parte, el dimorfismo sexual tan claro con el que se presenta, dado que es entre 3-4 veces más frecuente en las mujeres que en los varones [1]. En segundo lugar, entre las mujeres, el riesgo de padecer CDT se incrementa al inicio de la pubertad y disminuye mucho tras la menopausia [25]. En tercer lugar, existe evidencia de la presencia de receptores para estrógenos en el tejido epitelial tiroideo sano y en el de las células tumorales de CDT. Los estrógenos constituyen en sí mismos un potente factor de crecimiento, tanto para las células tiroideas normales, como para las de las neoplasias diferenciadas de tiroides. Además, los estrógenos parecen estar involucrados en mecanismos de óxido-reducción en los que parecen favorecer la producción de H2O2, la cual es un potente agente inductor de mutaciones al originar inestabilidad genómica mediante daños oxidativos en el ADN [2]. Tomados todos estos mecanismos en conjunto, algunos autores proponen teorías que explicarían, al menos en parte, la mayor incidencia del CDT durante la etapa reproductiva en las mujeres e, incluso, podrían establecer un nexo de unión entre el exceso de asociación del CDT con el carcinoma de mama [26].
En lo referente a la gestación propiamente dicha, es una condición en la que se producen cambios tanto funcionales como morfológicos a nivel de la glándula tiroidea [8, 27, 28]. En primer lugar, se produce un marcado incremento en los niveles de estrógenos, los cuales dan lugar a elevaciones significativas en las cifras de proteína transportadora de tiroxina (TBG) durante el primer trimestre, tanto por aumento de su producción hepática, como por la disminución de su catabolismo. Esto origina un descenso relativo en la concentración de hormona tiroidea libre. En segundo lugar, se produce un incremento fisiológico progresivo de los niveles de gonadotropina coriónica (hCG) secretada por la placenta, que alcanza su pico sobre la semana 10-12 de gestación. La hCG exhibe una subunidad α idéntica a la de la hormona estimulante del tiroides (TSH) y tiene afinidad por el receptor de la TSH a nivel tiroideo. Esto hace que estimule la síntesis y liberación de hormonas tiroideas, dando lugar a un descenso significativo en las cifras de TSH (más evidente entre las semanas 8-14 de gestación) por el feed-back negativo que producen a nivel hipotálamo-hipofisario T4 y T3. Por último, durante el segundo y tercer trimestres de la gestación, se incrementa el metabolismo de las hormonas tiroideas, por la mayor actividad de las desyodinasas placentarias tipo II y tipo III. Durante el embarazo, la producción de hormona tiroidea necesita incrementarse hasta en un 40% y lo hace de forma lineal hasta las semanas 16-20 de gestación, donde se suelen identificar los máximos requerimientos. A partir de la segunda mitad de la gestación, las necesidades suelen estabilizarse, para volver a los requerimientos iniciales tras el parto [10]. Todos estos cambios incrementan la dificultad que entraña la valoración de los niveles circulantes hormonales durante la gestación, motivo por el que se han propuesto puntos de corte específicos por trimestre, modificados a su vez por la presencia o ausencia de patologías tiroideas concomitantes. También la carencia o el exceso de suplementación de yodo podrían dar lugar a incrementos en las cifras de anticuerpos antitiroideos, lo que se traduce en mayor dificultad en el seguimiento de los CDT durante el embarazo [8]. Por otra parte, y debido a la influencia conjunta de los niveles incrementados de estrógenos y de hCG, durante la gestación se han descrito tanto incrementos globales del volumen tiroideo (más significativo en regiones con deficiencia de yodo) [28] como aparición de nuevos nódulos e incrementos significativos en el volumen de los nódulos tiroideos ya presentes antes de la gestación, si bien es cierto que, la mayor parte de estos regresan a su volumen pregestacional hacia el tercer mes posparto [8].
MANEJO DE LOS NÓDULOS TIROIDEOS DURANTE LA GESTACIÓN
Como ya se ha comentado con anterioridad, la prevalencia de los nódulos tiroideos durante la gestación es elevada, aunque variable según las series. Los cambios fisiológicos y hormonales que ocurren durante el embarazo parecen incrementar el riesgo tanto de crecimiento como de aparición de nuevos nódulos en el tiroides, aunque con un mínimo impacto en la práctica. Los análisis inmunohistoquímicos realizados durante la gestación e inmediatamente posparto demuestran una mayor proporción de receptores estrogénicos de tipo α (REα), y sugieren que dichos hallazgos pudieran explicar, al menos en parte, la razón de este crecimiento [10].
La probabilidad de que un nódulo descubierto durante la gestación corresponda con un carcinoma de tiroides oscila según las series entre el 10-20%, con una incidencia aproximada de unos 14,4 casos por 100.000 gestaciones. Por tanto, es mandatorio establecer una correcta estrategia de diagnóstico y manejo de los nódulos tiroideos descubiertos durante la gestación [8].
Historia clínica y exploración física
Resulta fundamental realizar una historia adecuada, encaminada fundamentalmente a descartar exposición a radiaciones ionizantes antes de los 18 años, así como a investigar historia de carcinoma de tiroides familiar o de enfermedades familiares que puedan asociarse a carcinoma de tiroides. Es indispensable recoger datos sobre cambios de tamaño, sintomatología compresiva local y clínica de disfunción tiroidea. También resulta imprescindible realizar una palpación cuidadosa del cuello, centrada tanto en la región tiroidea como en las cadenas ganglionares [8].
Determinaciones de laboratorio
La determinación de los niveles de TSH (y de T4 libre) resulta obligada durante la gestación. Hay que tener en cuenta, sin embargo, que no orientarán hacia la posibilidad de tener un cáncer de tiroides, sino que servirán para valorar el estado funcional de dicha glándula en relación al momento de la gestación en que se determinen [8].
Más controvertida resulta la determinación de anticuerpos antitiroideos durante el embarazo (máxime si no se dispone de alguna determinación previa pregestacional). Por una parte, existe escasa evidencia científica entre la asociación de nódulos tiroideos y autoinmunidad durante la gestación. Por otra, durante el embarazo los títulos tienden a descender por la especial situación inmunológica inherente a la gestación [29]. Como ya se ha comentado con anterioridad, una ingesta inadecuada de yodo (por exceso o defecto) podría dar lugar a un incremento en el título de autoanticuerpos antitiroideos [8].
La determinación de tiroglobulina en un tiroides nodular pero intacto está desaconsejada, dado que no nos aportará información sobre el carácter benigno o maligno de los nódulos [8].
Por último, la determinación de calcitonina debe reservarse para aquellas pacientes con historia familiar de CMT, neoplasia endocrina múltiple de tipo 2 (MEN2) o mutaciones ya conocidas en el oncogén RET [8].
Ecografía de cuello
La ecografía tiroidea resulta la mejor herramienta para la detección de los nódulos tiroideos y la determinación del tamaño de estos. Resulta imprescindible para evaluar la sospecha de malignidad en función de las características ecográficas que presenten, monitorizar su crecimiento y descartar la presencia de adenopatías loco-regionales sugerentes de malignidad [8].
En este sentido, para caracterizar los nódulos tiroideos en relación con aspectos o patrones que sugieran malignidad, podemos seguir las recomendaciones de 2015 de la ATA [7] o las más conservadoras pero bien validadas del TI-RADS [30]. Además, la ecografía resulta obligatoria para poder llevar a cabo una punción-aspiración con aguja fina (PAAF) guiada en aquellos nódulos y adenopatías sospechosos de malignidad.
Punción aspiración con aguja fina guiada por ecografía (paaf)
La PAAF ecodirigida es una herramienta diagnóstica muy segura durante la gestación y puede realizarse en cualquier momento del embarazo. Además, la gestación no parece alterar los patrones histológicos obtenidos mediante esta prueba. La necesidad de llevar a cabo una PAAF durante la gestación deberá establecerse no sólo en relación al tamaño del nódulo. Antes bien, debería estar basada en una franca sospecha de malignidad establecida por las características ecográficas del nódulo, la presencia de adenopatías cervicales potencialmente metastásicas, un crecimiento muy rápido del mismo o la presencia de otros factores de riesgo (historia de radiación previa, antecedentes familiares de neoplasia tiroidea o enfermedades que cursan con cáncer de tiroides) [8]. En caso de llevarse a cabo, los resultados de la citología nos permitirán clasificar a los nódulos según el sistema de Bethesda (Tabla 3) en seis categorías diagnósticas [31], de las cuales, serán candidatas para realizar cirugía (durante la gestación o, preferiblemente, posparto) las tres últimas, quedando la categoría 3 (atipia de significado incierto) sometida a las mismas consideraciones que las recomendadas fuera de la gestación.
Tabla 3. Sistema de Bethesda para la clasificación de hallazgos en la citopatología tiroidea: Categorías diagnósticas, riesgo de malignidad y recomendaciones de manejo para las pacientes gestantes.
|
Categoría diagnóstica |
Diagnóstico citológico |
Riesgo estimado de malignidad por el sistema Bethesda (%) |
Riesgo real de malignidad en nódulos extirpados (media en %) |
Recomendaciones de manejo |
|---|---|---|---|---|
|
I |
No diagnóstico / Insatisfactorio |
1 - 4 |
20 |
Monitorización ecográfica trimestral (en función de características ecográficas) Repetir PAAF (antes o después del parto en función de las características ecográficas) |
|
II |
Benigno |
0 - 3 |
2,5 |
Ecografía tiroidea anual |
|
III |
Atipia de Significado Incierto / Lesión Folicular de significado incierto |
5 - 15 |
14 |
Monitorización ecográfica trimestral Repetir PAAF tras el parto / Considerar estudio genético |
|
IV |
Neoplasia Folicular o Sospecha de Neoplasia Folicular |
15 - 30 |
25 |
Diferir cirugía tras el parto vs Lobectomía (preferiblemente 2º Trimestre) |
|
V |
Sospechoso de Malignidad |
60 - 75 |
70 |
Diferir cirugía tras el parto vs Tiroidectomía total (preferiblemente 2º Trimestre) |
|
VI |
Maligno |
97 - 99 |
99 |
Diferir cirugía tras el parto vs Tiroidectomía total (preferiblemente 2º Trimestre) |
Gammagrafía tiroidea diagnóstica (tc99m o i-123)
Fuera de la gestación, la gammagrafía tiroidea estaría indicada para evaluar la funcionalidad de los nódulos tiroideos en situaciones en las que la TSH se encuentre suprimida de forma persistente.
Sin embargo, las exploraciones con radionúclidos están contraindicadas formalmente durante toda la gestación, por el riesgo de exposición fetal a la radiación y por la posibilidad de provocar un hipotiroidismo congénito si se realiza a partir de la semana 12-14 de gestación, dado que, a partir del segundo trimestre, el tiroides fetal es capaz de captar iodo y sintetizar hormonas tiroideas. No obstante, parece que la exposición involuntaria a una gammagrafía antes de la semana 12 no parece lesionar el tiroides del feto [8]. Por otra parte, los estudios de seguimiento realizados en pacientes que sufrieron radiación en periodo fetal durante el accidente de Chernobyl (con exposiciones calculadas al I-131 similares a las que se pueden utilizar para el diagnóstico), han demostrado un incremento no significativo del riesgo de CDT y una mayor incidencia significativa en la aparición de nódulos tiroideos, en general > 10 mm [32].
Tampoco estarían recomendadas de entrada otras técnicas de imagen como la tomografía computarizada o la resonancia magnética, por los posibles efectos nocivos sobre el feto.
SEGUIMIENTO Y MANEJO DE LOS NÓDULOS TIROIDEOS DURANTE LA GESTACIÓN
Nódulos con citología benigna
En general, no está recomendado el tratamiento supresor con levotiroxina para los nódulos tiroideos benignos, dada su ineficacia. El tratamiento con levotiroxina se debe instaurar en caso de que los niveles de TSH estén por encima del rango recomendado para la edad gestacional y/o si existiera patología subyacente (tiroiditis u otras enfermedades autoinmunes, abortos de repetición…) que hicieran recomendable controlar más estrechamente los valores de TSH. La ecografía debería repetirse durante la gestación en caso de crecimiento rápido y significativo o cuando los criterios ecográficos de benignidad no hayan quedado suficientemente claros en la primera prueba y haya que considerar repetir la PAAF para reclasificarlos. En caso de citología benigna y ausencia de crecimiento, no se requieren medidas especiales durante la gestación [8].
Nódulos con citología indeterminada
No se han realizado estudios prospectivos durante la gestación para evaluar la evolución de este tipo de nódulos durante la misma. Conviene recordar que las tasas de malignidad asociadas a este tipo de nódulos son muy variables, dado que existen diferentes subcategorías diagnósticas dentro de la clasificación de Bethesda [9] (Tabla 3).
Aunque fuera de la gestación cada vez se promueve más la realización de test moleculares (genéticos) en busca de mutaciones (BRAF, TERT y otras) que puedan orientar hacia la malignidad y/o agresividad de estas lesiones, durante la gestación no existen estudios validados. En caso de utilizarlos, se recomienda realizar test que detecten mutaciones en el ADN, dado que, teóricamente, los cambios inducidos por el embarazo podrían alterar los resultados de las expresiones de ARN y llevar a confusión [8].
En aquellas pacientes en las que se hubiera obtenido un resultado de citología indeterminada, en el caso de que se indicara tratamiento quirúrgico, se recomienda esperar a realizar la tiroidectomía tras el parto. Sólo en aquellas situaciones en que se evidencie un crecimiento agresivo o la presencia imágenes sospechosas de metástasis ganglionares o a distancia, debe plantearse el tratamiento quirúrgico durante la gestación. En la Figura 1 se sintetiza el manejo adecuado de los nódulos tiroideos descubiertos durante la gestación [33].
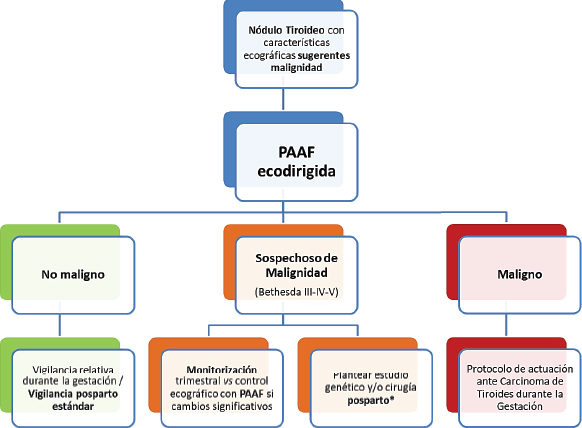
*La cirugía podría plantearse antes del parto si existen datos de agresividad (tamaño tumoral, sospecha de invasión, metástasis ganglionares locales o metástasis a distancia).
Modificado de [33].
Figura 1. Algoritmo de manejo de los nódulos tiroideos descubiertos durante la gestación.
CARCINOMA DE TIROIDES DURANTE LA GESTACIÓN
Las principales cuestiones que tanto médicos como pacientes deben tener en cuenta en la planificación familiar dentro del contexto de un carcinoma de tiroides, incluyen el riesgo de progresión del carcinoma con el embarazo, el momento óptimo para el tratamiento del mismo y los riesgos que puede entrañar dicho tratamiento tanto para la madre como para el feto [34]. Por otra parte, dado que más del 90% de los carcinomas de tiroides detectados durante la gestación son diferenciados (y más concretamente se corresponden con CPT), incidiremos en esta revisión de forma especial en tres escenarios clínicos diferentes: los CDT de nuevo diagnóstico durante la gestación, los microcarcinomas papilares de tiroides (MCPT) sometidos a vigilancia activa antes de la gestación y, por último, los CDT previamente diagnosticados y tratados [5]. Para el resto de los cánceres de tiroides (medular, carcinoma indiferenciado / anaplásico) existe muy poca evidencia científica y las decisiones sobre el tratamiento más adecuado (quirúrgico, radio y quimioterapia) deben individualizarse y basarse tanto en las opinión de los comités multidisciplinares como en de la del propio paciente. Además, deben tener en cuenta por igual tanto los aspectos clínicos como los éticos, teniendo estos últimos una especial trascendencia durante la gestación [8].
¿CONSTITUYE LA GESTACIÓN UN RIESGO REAL PARA EMPEORAR EL PRONÓSTICO DE LOS CDT?
Carcinomas de tiroides diagnosticados durante el periodo perigestacional
Desde hace años se ha tratado de relacionar tanto las elevaciones de hCG como de estrógenos que acontecen durante la gestación con un riesgo elevado en el desarrollo y/o empeoramiento del CDT en el embarazo. Sin embargo han sido muy pocos los trabajos capaces establecer relaciones estadísticamente significativas entre gestación y empeoramiento del pronóstico del CDT. Entre los más recientes e importantes cabe destacar dos estudios llevados a cabo en Italia. En el primero, Vannucchi et al. objetivaron unas elevadas tasas de persistencia / recurrencia del CDT entre las pacientes cuyo diagnóstico se produjo durante el embarazo o durante el primer año posparto, cuando se las comparaba con las mujeres nulíparas y con las que los carcinomas se habían diagnosticado más de un año después del parto. Además, pudo relacionar dichos hallazgos con una expresión incrementada de los REα en el tejido tumoral tiroideo de dichas pacientes [35]. Pocos años después, Messuti et al., aunque no encontraron relaciones con los receptores de estrógenos, volvieron a evidenciar en el análisis multivariante una relación estrecha entre la gestación y la peor evolución del CDT [36]. Sin embargo, fuera de estos dos trabajos, ni antes ni después se ha logrado establecer una relación causal entre el pronóstico del CDT y la gestación. En las guías de la ATA de 2017 referentes a enfermedad tiroidea y gestación, Alexander et al. realizan una excelente labor de revisión sin encontrar diferencias en el pronóstico del CDT entre pacientes gestantes y no gestantes, ni en lo referente a mortalidad ni en tasas de recurrencia o persistencia de la enfermedad [8]. Trabajos posteriores a la publicación de estas guías [37, 38] ratifican con sus resultados los postulados de la ATA de 2017. Incidiendo en este tema, Oh et al. no objetivaron cambios significativos en el tamaño de los CDT durante la gestación, cuando revisaron los datos ecográficos trimestrales realizados durante el embarazo y los compararon con los controles ecográficos previos a la gestación. Hay que apuntar, sin embargo, que el trabajo de Oh et al. estaba condicionado por una elevada presencia de MCPT (68%) [39]. Por tanto, a fecha de hoy, no existen datos que sustenten un potencial impacto negativo de la gestación sobre el CDT.
Tampoco existe una explicación adecuada que arroje luz sobre el por qué un ambiente endocrino-metabólico como el de la gestación, tan desfavorable «a priori» para el devenir del CDT, carezca, en la práctica de efectos deletéreos sobre el mismo. Cabe especular con la hipótesis de que, al ser el CDT una patología con una evolución lenta y relativamente indolente, los cambios hormonales que se manifiestan a lo largo de la gestación no constituyan un estímulo lo suficientemente intenso ni prolongado como para influir en la historia natural de la enfermedad. Esta línea de pensamiento entroncaría con los datos objetivados por algunos autores, en los que la multiparidad parece asociarse a mayor incidencia de CDT [22], si bien es verdad que dicha asociación no ha logrado verificarse en otros muchos trabajos. Quizá un trasfondo de susceptibilidad genética podría explicar en parte esta cuestión, sobre todo en pacientes con afectación tiroidea autoinmune de base [40]. Por el contrario, otras hipótesis contemplan que el embarazo podría comportarse como un factor protector frente al CDT. Esta interesante línea de pensamiento se basa en el microquimerismo fetomaternal, mecanismo por el que las células del feto pasan a través de la placenta y establecen una estirpe de células fetales en el interior de la madre donde conviven sin aparente rechazo. Dichas células fetales (microquimeras) podrían desarrollar un papel protector tanto frente al desarrollo como a la progresión del CDT [41, 42].
Microcarcinomas papilares tiroideos diagnosticados antes de la gestación y sometidos a vigilancia (antes, durante la gestación y posparto)
En una pequeña serie de 9 pacientes embarazadas bajo seguimiento activo por MCPT, Shindo et al. objetivaron crecimiento de los microcarcinomas en 4 de ellas (44,4%), muy significativo frente a lo acontecido en el grupo control, en el que se produjo incremento del tamaño en sólo el 11,1%. No se encontraron correlaciones con el tamaño tumoral, ni con las cifras de TSH, ni con las de tiroglobulina. Tampoco se detectaron sobreexpresiones de los REα en los 3 tumores resecados tras el parto. Los autores concluyeron que el riesgo de crecimiento del MCPT podría incrementarse durante la gestación [43].
Dos años después, en la mayor serie de seguimiento realizada hasta la fecha, llevada a cabo en el hospital de Kuma de Japón, se evaluó la progresión de los MCPT sometidos a seguimiento en las mujeres que quedaron embarazadas. El embarazo y el parto se asociaron con un aumento en el tamaño (≥ 3 mm) de los MCPT en solo el 8% de los 51 embarazos / casos de parto. Ninguna de las pacientes desarrolló metástasis ganglionares durante la gestación [44]. Además, los estudios prospectivos realizados con anterioridad en el mismo hospital apuntaban claramente a que la progresión de los MCPT parecía tener una relación muy estrecha con la edad de las pacientes. Las pacientes más jóvenes(<40 años) tenían un riesgo de progresión a enfermedad clínica del 9,5% a los 5 años, y este riesgo disminuía hasta el 2,2% a partir de los 60 años. Es decir, parece que el riesgo de progresión de los MCPT está más ligado a la edad que a la gestación. En este trabajo los autores concluyen que los MCPT de bajo riesgo pueden ser sometidos a vigilancia (más estrecha en pacientes más jóvenes) sin necesidad de tener que recurrir a la cirugía de entrada, dado que se puede realizar tratamiento quirúrgico de rescate sin empeoramiento del pronóstico si se comprueba evolución en la enfermedad [45].
Carcinomas diferenciados de tiroides sometidos a tratamiento antes de la gestación. utilidad de la estratificación dinámica del riesgo (respuesta al tratamiento)
Aunque existe suficiente evidencia de que la gestación no parece influir de forma significativa en el devenir de los CDT, algunos de los primeros estudios parecían indicar que el embarazo podría tener un pequeño impacto sobre la progresión y/o la recurrencia de algunos CDT previamente tratados y considerados libres de enfermedad [5]. Con el objetivo de dilucidar el impacto real de la gestación sobre los CDT previamente sometidos a tratamiento, Rakhlin et al. llevaron a cabo un estudio retrospectivo sobre 235 pacientes, con una edad media de 34 años, en las que el embarazo tuvo lugar unos 3 años de media después de haber recibido el primer tratamiento para su CDT. El 89% de las pacientes había sido sometida a tiroidectomía total y el 61% de éstas había recibido terapia ablativa con radioyodo. En función de la respuesta al tratamiento, fueron catalogadas preconcepcionalmente según la respuesta al tratamiento en: excelente, indeterminada, bioquímica incompleta y estructural incompleta [7, 46] (Tabla 4). Un 27% de las pacientes presentaban un riesgo intermedio de recurrencia según las características iniciales de su CDT. En los resultados obtenidos se pudo evidenciar que, durante los 3-12 meses tras el parto, las pacientes catalogadas como de respuesta excelente, indeterminada o bioquímica incompleta antes de la gestación, continuaron sin evidencia de enfermedad estructural tras el parto. Por el contrario, entre las pacientes catalogadas como de respuesta estructural incompleta antes del embarazo, se pudo identificar progresión de la lesión estructural en un 29% de los casos (incremento en el tamaño inicial ≥ 3 mm o aparición de nuevos focos metastásicos). Sin embargo, tan solo un 8% requirieron tratamiento adicional tras el parto [47]. Estos datos permiten concluir que el riesgo de progresión del CDT durante la gestación se circunscribe a las pacientes con respuesta estructural incompleta y que dicho riesgo es muy bajo. Por otro lado la clasificación dinámica de riesgo (situación de respuesta al tratamiento) antes de la gestación, ha demostrado ser un excelente predictor del comportamiento del CDT durante la gestación [47].
Tabla 4. Categorías de riesgo actualizadas en función de la respuesta a los 2 años del tratamiento inicial del carcinoma diferenciado de tiroides (estratificación dinámica del riesgo). Objetivos de supresión de TSH para cada categoría. Tiroidectomía total con AR.
|
|
Tiroidectomía total sin AR |
Lobectomía |
TSH mU/L |
Excelente |
|---|---|---|---|---|
|
Tg no estimulada <0,2 ng/mL Tg estimulada <1 ng/mL Ac. Anti-Tg indetectables Pruebas de imagen negativas |
Tg no estimulada <0,2 ng/mL Ac. Anti-Tg indetectables Pruebas de imagen negativas |
Tg no estimulada estable <30 ng/mL Ac. Anti-Tg indetectables Pruebas de imagen negativas |
0,5-2,0 |
Indeterminada |
|
Tg no estimulada 0,2 - 1 ng/mL Tg estimulada 1 - 10 ng/mL Ac. Anti-Tg positivos estables o en descenso Estudios de imagen no concluyentes (hallazgos inespecíficos) |
Tg no estimulada 0,2 - 5 ng/mL Ac. Anti-Tg positivos estables o en descenso Estudios de imagen no concluyentes (hallazgos inespecíficos) |
Ac. Anti-Tg positivos estables o en descenso Estudios de imagen no concluyentes (hallazgos inespecíficos) |
0,5-1,0 |
Bioquímica incompleta |
|
Tg no estimulada >1 ng/mL Tg estimulada >10 ng/mL Ac. Anti-Tg positivos en aumento Pruebas de imagen negativas |
Tg no estimulada >5 ng/mL Ac. Anti-Tg positivos en aumento Pruebas de imagen negativas |
Tg no estimulada >30 ng/mL Niveles de Tg no estimulada en aumento Ac. Anti-Tg positivos Pruebas de imagen negativas |
0,5-1,0 |
Estructural incompleta |
|
Evidencia de enfermedad estructural o funcional |
< 0,1 |
|
|
|
Abreviaturas - AR: ablación con radioyodo; Tg: tiroglobulina; Ac. Anti-Tg: anticuerpos antitiroglobulina Modificado de [46]. La tabla original de las guías ATA de 2015 [7] sólo incluye como modalidad de tratamiento la Tiroidectomía total con AR.
A modo de resumen, puede concluirse de los resultados obtenidos en los estudios que relacionan el CDT con la gestación, que el pronóstico es muy bueno para la mayor parte de las pacientes con edad < 45 años, incluso en presencia de enfermedad residual. En general, la tasa de supervivencia libre de enfermedad a los 10 años en estas pacientes se sitúa entre el 97-100% [34].
SEGUIMIENTO Y MANEJO DEL CARCINOMA DIFERENCIADO DE TIROIDES EN EL PERIODO PERIGESTACIONAL
Aunque en lo fundamental el manejo de los pacientes con CDT durante el embarazo no difiere demasiado del manejo fuera del periodo gestacional, existen condiciones inherentes a la propia gestación y a la lactancia que conciernen a la seguridad tanto de la madre como a la del feto o del recién nacido y que deben ser tenidas en cuenta.
Cribado de pacientes antes de la gestación
Las guías ATA para el manejo de las enfermedades tiroideas durante la gestación recomiendan como norma general realizar determinaciones pregestacionales siempre que sea posible de la función (TSH) y de la autoinmunidad tiroideas. Sin embargo, no hacen referencia a realizar un screening específico en busca de CDT previo a la gestación [8]. En una extensa revisión, Lin et al. valoran la hipotética rentabilidad de realizar un screening masivo en pacientes asintomáticos, utilizando ecografía y PAAF ecodirigida para realizar un diagnóstico y tratamiento precoz de los CDT. Concluyen que no queda nada claro si el diagnóstico y tratamiento precoz en pacientes asintomáticos contribuyen a disminuir las tasas de mortalidad o benefician de alguna manera al estado de salud de los afectados, mientras que sí que podrían dar lugar a realizar un sobrediagnóstico y llevar a cabo un sobretratamiento de una patología relativamente indolente, el cual podría implicar más riesgo de daños colaterales para los afectados que la propia enfermedad en sí misma [48].
Manejo del carcinoma de tiroides diagnosticado justo antes de la gestación o durante el embarazo
De acuerdo con las guías de la ATA 2017 [8] y las revisiones publicadas de forma más reciente [10], los CDT descubiertos antes del segundo trimestre deben ser monitorizados ecográficamente para evaluar un posible comportamiento agresivo antes de la semana 24-26 de gestación: crecimiento significativo (con incremento mayor o igual al 50% del volumen o al 20% en dos diámetros), invasión traqueal o vascular o presencia de metástasis ganglionares. En estos casos, la cirugía debe ser considerada como una alternativa razonable. Algunos autores sugieren que dicha cirugía puede ser llevada a cabo con total seguridad en cualquier fase de la gestación, siempre que sea realizada por equipos expertos, sin que entrañe peligro ni para la madre ni para el feto [37, 49]. Sin embargo, la mayor parte de los autores, en caso de no poder postergar la cirugía, se decantan por realizarla durante el segundo trimestre del embarazo, dado que es el momento más seguro tanto para la madre como para el feto [8].
Para aquellos CDT que no exhiban criterios de agresividad o que sean descubiertos tarde durante la gestación, se aconseja diferir la cirugía hasta después del parto, dado que dicha actitud no cambia el pronóstico del CDT [8].
En cuanto al tratamiento con levotiroxina, resulta mandatorio si se lleva a cabo la cirugía, dado que las pacientes quedarán hipotiroideas y los niveles de TSH deben monitorizarse cada 4-6 semanas aproximadamente para intentar llevarlos a los rangos adecuados según el riesgo inicial de recurrencia [7]. En aquellas pacientes en las que se haya decidido observación, aun asumiendo que no existe evidencia científica hasta la fecha, parece razonable intentar conseguir niveles de TSH < 2,0 mU/L, por lo que se aconseja iniciar tratamiento con levotiroxina si las cifras son superiores a estas cifras [8, 10].
En cuanto al tratamiento ablativo o adyuvante con I-131, si éste estuviera indicado, debe posponerse hasta que hayan finalizado tanto el embarazo como la lactancia, dado el riesgo que puede suponer dicho tratamiento en términos de teratogenicidad e hipotiroidismo (fetal y en el recién nacido) [8, 10].
Pacientes en seguimiento activo por microcarcinoma papilar de tiroides
Las guías de la ATA de 2017 [8] recomiendan monitorizar el seguimiento de los MCPT con estudios ecográficos seriados a lo largo de toda la gestación. Sin embargo, estas recomendaciones estaban basadas en los estudios previos a la publicación de los datos del hospital de Kuma [44]. A la vista del comportamiento indolente de los MCPT durante la gestación, algunos autores consideran que el seguimiento durante el embarazo de estas pacientes podría ser más individualizado y flexible [5, 44].
Pacientes diagnosticadas y tratadas de carcinoma diferenciado de tiroides previamente a la gestación
En las últimas guías de la ATA referentes al manejo de la enfermedad tiroidea durante la gestación, se recomienda no monitorizar ni con niveles de tiroglobulina ni con ecografía de cuello a aquellas pacientes que tuvieran niveles indetectables de tiroglobulina previos a la gestación (en ausencia de positividad para anticuerpos antitiroglobulina). Por el contrario, recomiendan la monitorización tanto con determinaciones de tiroglobulina como con ecografía de cuello en el resto de los casos [8]. El trabajo publicado por Rakhlin et al. confirmó la indolencia con la que progresan los CDT tratados antes de la gestación, clasificados como respuesta excelente, indeterminada o bioquímica incompleta. Por esta razón estas categorías de riesgo podrían ser excluidas de la monitorización tras una evaluación individualizada del riesgo. Aunque el pronóstico para la categoría de respuesta estructural incompleta no es malo, el propio autor se muestra de acuerdo con las recomendaciones de las guías en cuanto a la monitorización estrecha con tiroglobulina y ecografía de cuello en aquellas pacientes gestantes con respuesta estructural incompleta, con vistas a identificar los pocos casos que podrían exhibir progresión de la enfermedad durante el embarazo [5, 47].
Como ya se ha mencionado con anterioridad, la monitorización de los anticuerpos antitiroideos durante la gestación resulta más controvertida, dadas las características especiales de la inmunidad durante esta etapa [29], y las guías de la ATA no hacen ninguna mención especial al respecto.
Respecto al tratamiento con levotiroxina en estas pacientes, cumple la doble función de asegurar unos niveles adecuados para la edad gestacional y la de suprimir los niveles de TSH hasta los valores óptimos en función de las necesidades determinadas por la estratificación dinámica de riesgo [46] (tabla 4). Hay que adecuar la dosis la hormona en función de los requisitos para cada trimestre, teniendo en cuenta que dichas necesidades se pueden ver incrementadas en un 40% o más, fundamentalmente hasta la semana 20 de gestación, y esto no es diferente para las gestantes tratadas de CDT. De cualquier forma, toda paciente sometida a tratamiento por CDT, independientemente de su grado de respuesta al mismo, tendrá unos objetivos de supresión de TSH que siempre van a ser más estrictos que los recomendados para edad gestacional. Por tanto, si cumplimos los objetivos de supresión de TSH, vamos a tener suficientemente cubiertas las necesidades gestacionales de levotiroxina durante el embarazo [8].
En la Figura 2 se muestra un algoritmo de manejo de los CDT durante el periodo gestacional adaptado a las recomendaciones más actualizadas.

Figura 2. Algoritmo de manejo del carcinoma de tiroides durante la gestación. Abreviaturas - CT: carcinoma de tiroides; CDT: carcinoma diferenciado de tiroides; TSH: hormona estimulante del tiroides; Tg: tiroglobulina; ECO: ecografía; 2ºT: segundo trimestre Para una explicación más pormenorizada, consultar detalles en el texto.
CONSIDERACIONES ESPECIALES SOBRE LA SALUD MATERNO-FETAL EN RELACIÓN CON EL CARCINOMA DIFERENCIADO DE TIROIDES Y CON SU TRATAMIENTO
Tratamiento supresor con levotiroxina
Como hemos comentado en varias ocasiones, resulta imprescindible mantener unos niveles adecuados de TSH durante toda la gestación, que garanticen una maduración embriológica y fetal adecuada. Sin embargo, en carcinomas tratados antes de la gestación, fundamentalmente en aquellos con respuesta estructural incompleta, deberíamos garantizar niveles de TSH por debajo de lo que se podría considerar fisiológico. Existe muy poca evidencia sobre las repercusiones que el hipertiroidismo subclínico mantenido pueda tener sobre la salud materno-fetal. El hipertiroidismo subclínico puede resultar una situación común durante parte de la gestación, sobre todo durante el primer trimestre por efecto de hCG. En general, se considera menos perjudicial que el hipotiroidismo para el devenir de la gestación [8]. Sin embargo, algunos autores han encontrado que el hipertiroidismo subclínico durante las semanas 4-8 de la gestación, si bien parece proteger contra el riesgo de aborto, se asocia negativamente con un mayor riesgo de preeclampsia y de desprendimiento de placenta [50]. En un estudio previo, Zamperini et al. realizaron un seguimiento exhaustivo de pacientes previamente tratadas de CDT y sometidas a tratamiento supresor o de reemplazo con levotiroxina. Como aspecto novedoso se incluyó la realización de ecografías tiroideas fetales seriadas durante el seguimiento. Los autores encontraron que el crecimiento tiroideo fetal fue normal en todos los casos (tanto los sometidos a tratamiento supresor como los de reemplazo hormonal con levotiroxina), la función tiroidea neonatal fue también normal al parto y no se produjo mayor incidencia de morbi-mortalidad materna, aunque sí se registraron mayor número de abortos debidos a problemas no oncológicos [51].
Cirugía tiroidea durante la gestación
La mayor parte de los autores encuentran que la cirugía tiroidea durante la gestación no presenta ningún impacto negativo para el devenir del embarazo. Algunos estudios señalan que cualquier momento de la gestación puede resultar adecuado, siempre que se utilicen técnicas óptimas y la tiroidectomía sea realizada por un equipo experimentado [37, 49]. Las guías de la ATA, de acuerdo con la opinión de la mayoría de los expertos, abogan por realizar la intervención durante el segundo trimestre de la gestación, siempre que esta práctica resulte imprescindible. Dado que el pronóstico en cuanto a la progresión del CDT es idéntico, tanto si se realiza la cirugía durante la gestación como si se realiza tras el parto, la mayor parte de los autores respaldan esperar a que concluya la gestación para llevarla a cabo [8].
Influencia del cáncer de tiroides sobre la gestación y las complicaciones ginecológicas
En general, los estudios demuestran que las complicaciones materno-fetales durante la gestación en pacientes con CDT no intervenido resultan comparables con las observadas en la población general. En algunos trabajos se objetivan mayores tasas de tromboembolismos venosos, mayores requerimientos transfusionales y estancias hospitalarias más prolongadas [6].
En cuanto a las complicaciones observadas entre las mujeres ya sometidas a tratamiento para su CDT antes de la gestación, Blackburn et al. encuentran tasas más elevadas de complicaciones en relación con problemas ginecológicos (cervicitis y endocervicitis), complicaciones en relación con la gestación (mayor tasa de hemorragias, abortos, diabetes gestacional) así como otras patologías ginecológicas (alteraciones menstruales y menopaúsicas, mayor incidencia de quistes ováricos). La incidencia de dichas complicaciones es mayor en los primeros 5 años tras el tratamiento y varía ligeramente en función del estadio tumoral y de la técnica empleada para el tratamiento del CDT [52].
Consideraciones sobre el tratamiento con i-131 y sus efectos sobre la reproducción
Como se ha comentado con anterioridad, tanto el diagnóstico con radionúclidos como el tratamiento con I-131 están formalmente contraindicados durante la gestación y la lactancia, en aras de prevenir daños provocados por la radiación fetal en general y más específicamente el daño tiroideo tanto en el feto (a partir del segundo trimestre) como en el neonato [8].
Desde hace décadas, son muchos los trabajos que han puesto de manifiesto la ausencia de complicaciones importantes relacionadas con la administración de radioyodo como tratamiento complementario del CDT. En una revisión exhaustiva de las publicaciones registradas desde la primera década del 2000, Sioka et al. solo encuentran mayor incidencia de amenorrea o irregularidades menstruales transitorias, que habitualmente se resuelven en el primer año y que pueden llegar a afectar hasta al 30% de las pacientes que han recibido I-131. No parece existir mayor incidencia de abortos, nacimientos pretérmino o con bajo peso, malformaciones congénitas ni tasas incrementadas de mortalidad. Tampoco parece incrementar la tasa de carcinomas tiroideos y no tiroideos entre los niños nacidos de madres previamente tratadas con I-131 [53].
Dos trabajos más recientes, además de coincidir con lo expuesto por Sioka et al., ponen de manifiesto una disminución significativa en la tasa de gestaciones entre las mujeres sometidas a tratamiento con I-131. Sin embargo, esto no parece ser consecuencia de un efecto directo del radioyodo sobre el aparato reproductivo femenino [54, 55]. Más bien parece secundario a un seguimiento de las recomendaciones de las guías de retrasar la gestación entre 6-12 meses tras el radioyodo, con vistas a evitar los posibles efectos secundarios del I-131 sobre la nueva gestación y el lograr estabilizar los niveles de hormonas tiroideas previamente al embarazo [8, 54, 55].
CONCLUSIONES
El CDT es una patología relativamente usual entre las mujeres en edad fértil y es el segundo cáncer en frecuencia durante la gestación. La forma más habitual de presentación es como un nódulo tiroideo (alrededor de un 10-20% de los nódulos descubiertos durante el embarazo pueden ser malignos), por lo que es necesario realizar un correcto diagnóstico y seguimiento de los mismos, en los cuales resulta fundamental la realización de ecografía tiroidea y PAAF ecodirigida cuando los hallazgos en la ecografía indiquen elevada sospecha de carcinoma tiroideo. La PAAF guiada por ultrasonidos es la herramienta de mayor valor diagnóstico para descartar un carcinoma tiroideo y resulta seguro realizarla en cualquier momento de la gestación.
La gestación no parece afectar de forma significativa a la progresión de los CDT. Esto es válido para los casos de nueva aparición, los MCPT que se encuentran en seguimiento previo al embarazo, y para la mayor parte de los casos de CDT tratados previamente a la gestación. Sólo un pequeño porcentaje de los CDT catalogados como de respuesta estructural incompleta al tratamiento, presentan un ligero riesgo de progresión durante el embarazo, pero sin que se modifique su pronóstico.
El tratamiento de elección para el carcinoma tiroideo es la cirugía. Si el carcinoma no presenta signos de agresividad, lo más adecuado es diferirla hasta después del parto, dado que esta actitud no modifica el pronóstico sobre el CDT. En caso de tener que realizarla durante la gestación, se puede indicar sin problemas, dado que no suele complicar el embarazo, aunque resulta preferible llevarla a cabo durante el segundo trimestre, dado que es el momento más seguro tanto para la madre como para el feto.
En caso de optar por una actitud conservadora durante el embarazo, nuevamente la ecografía debe jugar un papel fundamental para realizar el seguimiento de los cánceres de reciente descubrimiento. En los MCPT parece que no resultaría tan necesario realizar una monitorización ecográfica, dada su indolencia. Para los CDT previamente tratados, el seguimiento debe individualizarse en función del grado de respuesta al tratamiento previo a la gestación. Los niveles de tiroglobulina son el mejor indicador de evolución de la enfermedad aunque podría ser necesario complementarlos con ecografía en algunos casos de respuesta estructural incompleta o sospecha de progresión del CDT.
La presencia de un CDT durante la gestación tampoco parece influir en el incremento de la morbi-mortalidad materno-fetal de la gestación en curso. Sin embargo, sí parece tener influencia sobre el desarrollo de otras patologías ginecológicas y relacionadas con la reproducción en los siguientes años a su diagnóstico y tratamiento, independientemente del tratamiento recibido.
La monitorización de la TSH durante toda la gestación y el reemplazo adecuado con levotiroxina son elementos clave, tanto para el correcto desarrollo del feto como para intentar frenar la progresión del CDT. En este sentido, hay que intentar lograr mantener los niveles de TSH dentro de los objetivos recomendados para cada categoría de riesgo en los casos de CDT tratados antes de la gestación y se recomienda conseguir valores < 2,0 mU/L para aquellos casos de diagnóstico durante la gestación en los que se decida posponer la intervención hasta después del parto.
El tratamiento con I-131, cuando esté indicado por el riesgo de recurrencia o persistencia del CDT, deberá diferirse hasta después del parto y una vez terminada la lactancia, por el riesgo de exposición fetal y neonatal a este radionúclido y, fundamentalmente, por el riesgo de hipotiroidismo congénito o neonatal. El tratamiento con radioyodo ha demostrado ser seguro y no se asocia con problemas materno-fetales en las siguientes gestaciones ni afecta a la capacidad reproductora de la madre. Se recomienda esperar al menos 6-12 meses tras su administración, para evitar exposición radiactiva residual al feto y para garantizar la estabilidad en los niveles de hormonas tiroideas y de TSH circulantes previos a la gestación.














